组织灌注的改善是脓毒性休克复苏的关键,直接影响患者预后[1]。相对于重要组织器官,作为外周组织的皮肤是人体最大的器官,在循环衰竭中最先被牺牲而最后被恢复,为组织灌注的评估提供了新的思路[2-4]。外周灌注指数(PI)可无创、快捷、量化地反应外周组织灌注,是一个简单而强大的指标。氧输送与氧消耗的平衡是组织灌注和器官功能障碍之间相互作用的支柱,在休克状态下,氧输送低于临界阈值,器官灌注受到严重损害,会由需氧代谢转变为无氧代谢。中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差比值(Pv-aCO2/Ca-vO2)是反映无氧代谢的敏感指标[5],较乳酸具有更快的治疗反应性[6],亦成为一个有前景的指标。本研究的目的在于分析脓毒性休克初始复苏后PI联合Pv-aCO2/Ca-vO2对预后的预测价值, 从而探寻有价值的监测指标以期改善预后。
1 资料与方法 1.1 一般资料本研究为前瞻性观察性研究。选取2019年1月至2021年1月河北医科大学哈励逊国际和平医院急诊重症监护病房(EICU)收治的明确诊断为脓毒性休克并留置中心静脉导管的患者76例。纳入标准:符合2016年美国重症医学会(SCCM)与欧洲重症医学会(ESICM)制定的脓毒性休克诊断标准[1]。排除标准:年龄 < 18岁或>80岁;妊娠;心房颤动;严重贫血和高铁血红蛋白血症患者;雷诺综合征;肿瘤晚期;心肺复苏术后;治疗不积极中途放弃者。本研究经河北医科大学哈励逊国际和平医院伦理委员会审查批准(批件号2019-1-022),所有检测均获得患者家属知情同意。
1.2 治疗方法所有入选患者均按照2016年脓毒症与脓毒性休克处理国际指南[7]进行救治;入EICU后第一时间启动抢救性液体复苏,3 h内输注至少30 mL/kg的晶体液进行初始复苏,完成初始复苏后继续根据容量反应性进行容量管理,以乳酸正常化作为复苏目标。1 h内使用抗生素并进行必要的病灶引流,及时应用血管活性药物,并给予脏器支持。
1.3 PI监测与Pv-aCO2/Ca-vO2测算均应用飞利浦IntelliVue MP30监护仪(飞利浦,美国)进行生命体征监测,当患者完成3 h初始复苏时记录监护仪显示的外周灌注指数(PI),测量前确保指套部位合适,指端局部无颤抖,待波形稳定后连续记录PI监测值3次,取3次平均值。于同一时刻抽取中心静脉、动脉血进行血气分析,数值计算: Pv-aCO2/Ca-vO2= [中心静脉血二氧化碳分压(mmHg)-动脉血二氧化碳分压(mmHg)]/[1.34×动脉血氧饱和度(%)×血红蛋白(g/L)+0.003×动脉血氧分压(mmHg)-(1.34×中心静脉血氧饱和度(%)×血红蛋白(g/L)+0.003×静脉血氧分压(mmHg)]。1 mmHg=0.133 kPa。
1.4 临床资料收集记录收集患者性别、年龄、身高、体重、感染部位、基础疾病,降钙素原(PCT)、白细胞计数(WBC),急性生理与慢性健康状况评分Ⅱ(APACHEⅡ)、序贯器官衰竭评分(SOFA),机械通气及通气参数,完成初始复苏时血流动力学参数包括平均动脉压(MAP)、中心静脉压(CVP)、心率(HR)、PI,氧代谢指标包括中心静脉氧饱和度(ScvO2)、动脉血乳酸(Lac)、Pv-aCO2/Ca-vO2,3 h乳酸清除率[3 h乳酸清除率(LCR3 h)=[入院乳酸(T0 Lac)-初始复苏时乳酸(T3h Lac)]/入院乳酸(T0 Lac),去甲肾上腺素用量、初始复苏液体量,28 d预后。
1.5 患者分组根据28 d预后情况分为存活组和死亡组;根据PI临界值分为PI≥1.4组与PI < 1.4组;根据Pv-aCO2/Ca-vO2临界值,分为Pv-aCO2/Ca-vO2>1.6与Pv-aCO2/Ca-vO2≤1.6组。
1.6 统计学方法数据统计分析软件采用SPSS19.0,全部定量数据行Kolmogorov-Smimov检验判断是否正态分布,符合正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验;不符合正态分布用中位数[M(Q1,Q3)]表示,两组间比较用秩和检验;计数资料以率(%)表示,两组间比较采用χ2检验;Kaplan-Meier法绘制根据两指标临界值分组患者的生存曲线,Log-rank法检验组间差别,Cox回归分析筛选28 d病死率的预测因素,受试者工作特征(ROC)曲线评估两指标对预后的预测价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者一般资料比较共纳入76例患者,其中男性41例,女性35例,年龄41-78岁,年龄(65.14±8.57)岁,原发感染部位包括肺部感染33例,腹腔感染26例,泌尿系感染7例,血流感染6例,其他及感染部位不明确4例。APACHEⅡ为(20.41±3.50)分,SOFA为(9.80±2.27)分。存活组37例,死亡组39例,28d总病死率51.32%。两组患者年龄、性别、感染部位、机械通气比例及通气参数、降钙素原、白细胞计数、初步复苏液体量、去甲肾上腺素用量比较差异无统计学意义(P>0.05),死亡组比生存组具有更高的APACHEⅡ和SOFA(P < 0.05)。见表 1。
| 指标 | 存活组(n=37) | 死亡组(n=39) | t/χ2值 | P值 |
| 年龄(岁) | 64.39±8.06 | 67.33±6.97 | 1.410 | 0.163 |
| 男性(n, %) | 21(56.76) | 20(51.28) | 0.000 | 0.985 |
| 感染部位(n, %) | 2.635 | 0.451 | ||
| 肺部 | 14(37.84) | 19(48.72) | ||
| 腹腔 | 15(40.54) | 11(28.21) | ||
| 尿路 | 5(13.51) | 2(5.13) | ||
| 血流 | 2(5.41) | 4(10.26) | ||
| 其他 | 1(2.70) | 3(7.69) | ||
| APACHEⅡ | 18.76±2.82 | 21.97±3.39 | 4.505 | 0.000 |
| SOFA | 8.32±1.75 | 11.21±1.78 | 7.116 | 0.000 |
| 机械通气[例(%)] | 19(51.35) | 23(58.97) | 0.047 | 0.828 |
| 机械通气参数 | ||||
| 吸入氧体积分数(%) | 46.22±4.63 | 47.25±5.31 | 0.183 | 1.036 |
| 潮气量(mL/kg) | 6.83±1.57 | 6.49±1.53 | 0.298 | 0.778 |
| 呼气末正压(mmHg) | 6.64±1.92 | 6.81±2.06 | 0.207 | 0.832 |
| 降钙素原(ng/mL) | 12.91±9.27 | 13.69±6.37 | 0.428 | 0.670 |
| 白细胞(×1012/L) | 14.06±3.72 | 14.05±3.70 | 0.012 | 0.991 |
| 去甲肾上腺素[μg/(kg·min)] | 0.51±0.10 | 0.54±0.14 | 1.362 | 0.186 |
| 初步复苏液量(mL/kg) | 32.08±1.36 | 31.77±1.09 | 1.100 | 0.275 |
| 注:APACHEⅡ; 急性生理与慢性健康状况评分Ⅱ;SOFA:序贯器官衰竭评分 | ||||
存活组ScvO2、PI高于死亡组,Pv-aCO2/Ca-vO2、HR低于死亡组(P < 0.05)。存活组3 h Lac低于死亡组,LCR高于死亡组,两组患者0 h、3 h Lac组内比较亦差异有统计学意义,存活组3 h Lac较0h下降,死亡组3 h Lac较0 h上升(P < 0.05)。两组间MAP、CVP、0h Lac差异无统计学意义(P>0.05)。见表 2。
| 参数 | 存活组(n=37) | 死亡组(n=39) | t值 | P值 |
| MAP (mmHg) | 76.97±7.04 | 75.87±6.56 | 0.705 | 0.483 |
| CVP (mmHg) | 8.15±2.25 | 7.86±1.96 | 1.326 | 0.213 |
| HR (次/min) | 94.08±9.50 | 100.79±12.50 | 2.626 | 0.010 |
| ScvO2 (%) | 69.86±3.37 | 67.33±3.34 | 3.291 | 0.002 |
| Lac (mmol/L) | ||||
| T0 h | 4.60±1.19 | 5.14±1.91 | 1.513 | 0.121 |
| T3h | 3.64±1.00a | 5.60±1.42a | 7.323 | < 0.001 |
| LCR (%) | 18.63±11.33 | -7.06±11.46 | 9.823 | < 0.001 |
| PI | 1.77±0.63 | 0.89±0.69 | 5.495 | < 0.001 |
| P(v-a)CO2/C(a—v)O2 | 1.52±0.52 | 2.57±0.86 | 4.914 | < 0.001 |
| 注:MAP:平均动脉压;CVP:中心静脉压;HR:心率;ScvO2:中心静脉血氧饱和度;Lac:乳酸;LCR:乳酸清除率;与T0时刻相比,aP < 0.05 | ||||
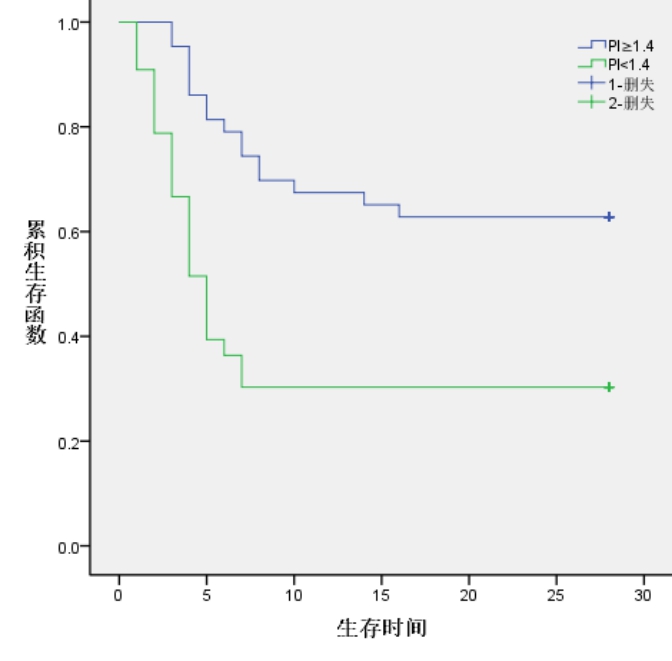
高PI(PI≥1.4)组43例,生存27例,中位生存时间20.09 d(95%CI: 16.95~23.24)。低PI(PI < 1.4)组33例,生存10例, 中位生存时间11.00 d(95%CI: 7.14~14.86)。Kaplan-Meier生存曲线分析显示,高PI组中位生存时间显著高于低PI组(χ2=12.424,P < 0.001)。见图 1。
|
| 图 1 PI≥1.4与PI < 1.4患者28 d生存率比较 Fig 1 Comparison of 28 d survival rate between groups with PI≥1.4 and PI < 1.4 |
|
|
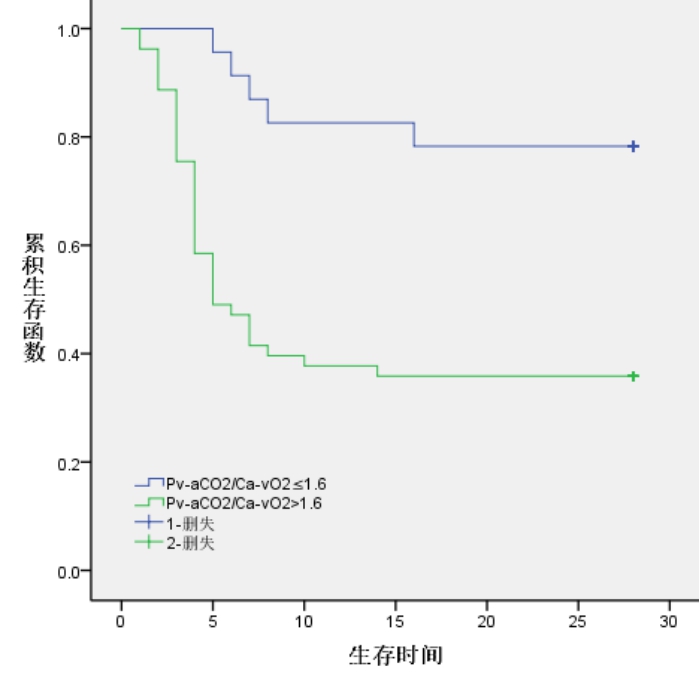
高Pv-aCO2/Ca-vO2(Pv-aCO2/Ca-vO2>1.6)组53例,生存19例,中位生存时间12.85 d(95%CI: 9.75~15.95)。低Pv-aCO2/Ca-vO2(Pv-aCO2/Ca-vO2≤1.6)组23例,生存18例, 中位生存时间23.74 d(95%CI: 20.35~27.13)。Kaplan-Meier生存曲线分析显示,低Pv-aCO2/Ca-vO2组中位生存时间显著高于Pv-aCO2/Ca-vO2组(χ2=12.200,P < 0.001)。见图 2。
|
| 图 2 Pv-aCO2/Ca-vO2≤1.6与Pv-aCO2/Ca-vO2>1.6患者28 d生存率比较 Fig 2 Comparison of 28 d survival rate between groups with Pv-aCO2/Ca-vO2≤1.6 and Pv-aCO2/Ca-vO2>1.6 |
|
|
对年龄、APACHEⅡ评分、SOFA评分、去甲肾上腺素用量、MAP、CVP、PCT、ScvO2、T0 Lac、T3h Lac、LCR、PI、Pv-aCO2/Ca-vO2进行多因素cox回归分析显示PI(RR=0.397,95%CI: 0.230~0.687,P=0.001), Pv-aCO2/Ca-vO2(RR=1.878,95%CI: 1.169~3.019,P=0.009)、SOFA评分(RR=1.232,95%CI: 1.006~1.508,P=0.044)、LCR(RR=0.924,95%CI: 0.896~0.953,P=0.000)是脓毒性休克患者28 d死亡的预测因子。见表 3。
| 因素 | B值 | S.E | Wald | P值 | RR值 | 95%CI | |
| PI | -0.923 | 0.280 | 10.902 | 0.001 | 0.397 | 0.230~0.687 | |
| Pv-aCO2/Ca-vO2 | 0.630 | 0.242 | 6.778 | 0.009 | 1.878 | 1.169~3.019 | |
| SOFA | 0.208 | 0.103 | 4.062 | 0.044 | 1.232 | 1.006~1.508 | |
| LCR | -0.079 | 0.016 | 25.327 | < 0.001 | 0.924 | 0.896~0.953 | |
| 注:PI:外周灌注指数;Pv-aCO2/Ca-vO2:中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差比值;SOFA:序贯器官衰竭评分;LCR:乳酸清除率;RR:相对危险度;95%CI: 95%可信区间 | |||||||
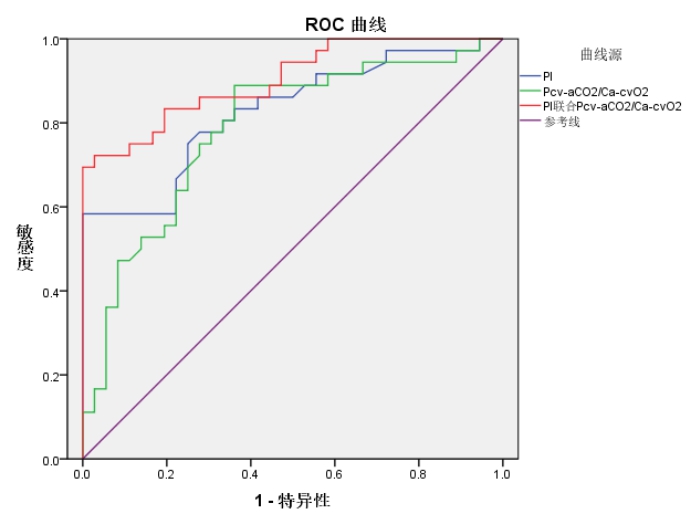
经ROC分析显示,PI、Pv-aCO2/Ca-vO2预测脓毒性休克患者28 d死亡的AUC分别为0.828(95%CI: 0.732~0.923)、0.785(95%CI: 0.677~0.893),二者联合预测的AUC为0.903(95%CI: 0.835~0.971)。见表 4,图 3。
| 指标 | AUC | 约登指数 | 95%CI | P值 | 最佳临界值 | 敏感度(%) | 特异度(%) |
| PI | 0.828 | 0.527 | 0.732~0.923 | < 0.001 | 0.52 | 58.3 | 94.4 |
| Pv-aCO2/Ca-vO2 | 0.785 | 0.528 | 0.677~0.893 | < 0.001 | 2.35 | 88.9 | 63.9 |
| 联合诊断 | 0.903 | 0.694 | 0.835~0.971 | < 0.001 | —— | 72.2 | 97.2 |
| 注:PI:外周灌注指数;Pv-aCO2/Ca-vO2:中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差比值;AUC:ROC曲线下面积;95%CI: 95%可信区间 | |||||||
|
| 图 3 始复苏3 h的PI、Pv-aCO2/Ca-vO2、PI联合Pv-aCO2/Ca-vO2预测患者28 d死亡的ROC曲线 Fig 3 ROC curves of PI, Pv-aCO2/Ca-vO2, PI combined with Pv-aCO2/Ca-vO2 at 3h of initial resuscitation for predicting 28 d mortality |
|
|
脓毒性休克早期液体复苏是治疗的重要手段及关键措施,直接影响这种高病死率疾病患者的预后[1, 8-9]。而液体复苏的核心目的是恢复有效循环血容量,维持组织灌注,改善微循环。有研究[10-11]表明,当血压维持正常时,仍存在微循环灌注的巨大差异以及脏器功能的损害;在临床实际中亦不乏应用血管活性药物等措施维持血压等大循环指标正常而后出现肢端坏死的病例。由于大循环和微循环间监测的不一致性,需要联合外周组织灌注识别大循环-微循环偶联的关系[12]。外周灌注指数(PI)代表外周小动脉的搏动强度,是脉搏氧饱和度(SpO2)监测的内建指标,可敏感反应末梢血流量变化,可以评价外周组织灌注情况[13],并可提示微循环功能[14]。其监测简便、易行、无创。PI < 1.4是识别重症患者灌注不良的敏感指标[15]。He等[3]对46例脓毒性休克患者的研究发现,复苏后PI是感染性休克患者死亡的独立危险因素。本研究表明,PI预测脓毒性休克28 d死亡的AUC为0.828,截断值为0.52时,敏感度58.3%,特异度94.4%,这与He等[3]的研究当PI截断值为0.2时,预测复苏后ICU病死率的敏感性65%,特异性92%在截断值方面存在差异,分析原因,一方面包括入组病例选择性偏移即入院率偏移,另一方面为研究节点不同,He的研究节点为经过EGDT,ScvO2≥70%,而本研究节点为随SSC指南变迁不再强调ScvO2达标,而是经3 h初始液体复苏MAP≥65 mmHg,本研究较He的研究具有较低的ScvO2和较少的复苏液体量。但两项研究均表明PI预测脓毒性休克28 d死亡结局的特异度良好,但敏感度偏低。
休克复苏终点是恢复细胞氧代谢和器官功能[11]。中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差(Pv-aCO2/Ca-vO2)作为识别无氧代谢的指标近年受到广泛关注。Pv-aCO2/Ca-vO2本是呼吸商(VCO2/VO2)的替代指标,有氧代谢条件下该比值小于1.0,在细胞缺氧时,启动无氧代谢,无氧代谢时没有O2消耗利用,此时呼吸商趋向无限大,加之无氧代谢产生酸性代谢产物通过HCO3- 缓冲进一步产生CO2,总效应导致Pv-aCO2/Ca-vO2异常升高[16]。Pv-aCO2/Ca-vO2异常升高>1.6提示存在无氧代谢,即存在细胞缺氧[12, 17]。既往研究发现复苏后Pv-aCO2/Ca-vO2异常升高与乳酸未清除相关[14, 18], 而该指标相较于乳酸又具有更快的治疗反应性的优势[6]。本研究结果表明初始液体复苏3 h Pv-aCO2/Ca-vO2是脓毒性休克28 d死亡的独立预测因素,Pv-aCO2/Ca-vO2预测脓毒性休克28 d死亡的AUC为0.785,截断值为2.35时,敏感度88.9%,特异度63.9%。
本研究即在脓毒性休克高病死率的背景下,立足于脓毒性休克初始液体复苏完成时刻,从组织灌注及氧代谢的角度评估患者预后,以期探寻早期评估脓毒性休克患者预后的有价值指标并进而指导及评估治疗从而降低病死率、改善预后。本研究之所以选择PI和Pv-aCO2/Ca-vO2两个指标的联合,从另外一个角度讲,从“流量为核心”[12]的复苏策略出发,Pv-aCO2/Ca-vO2关注的是氧流量,PI关注的是血流量,故二者结合可更全面反应治疗效果及评估预后。本研究结果表明脓毒性休克患者生存组与死亡组PI和Pv-aCO2/Ca-vO2差异有统计学意义,Kaplan-Meier生存曲线分析显示高PI与低PI患者、低Pv-aCO2/Ca-vO2与高Pv-aCO2/Ca-vO2患者的中位生存时间及28 d生存率存在显著差异,多因素cox回归分析证实这两项指标均是脓毒性休克28 d死亡的独立预测因素,经ROC曲线分析,PI联合Pv-aCO2/Ca-vO2预测脓毒性休克死亡的AUC为0.903,敏感性72.2%,特异性97.2%,优于两指标单独应用。
本研究的局限性在于:⑴本研究仅是单中心小样本研究,⑵本研究为单一时间点的检测,未行动态检测以反应变化趋势。可能导致结果一定程度上的局限性。
利益冲突 所有作者声明无利益冲突
作者贡献声明:刘倩:研究设计、筛选病例,研究实施,撰写论文;王啸、袁会敏:数据收集及整理,统计学分析;王维展、王璞:研究设计、论文修改、工作支持
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The thirdinternational consensus definitions for sepsis and septic shock(Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | 何怀武, 刘大为. 休克复苏中外周组织灌注应用进展[J]. 中华医学杂志, 2018, 98(1): 72-74. DOI:10.3760/cma.j.issn.0376-2491.2018.01.019 |
| [3] | He HW, Liu DW, Long Y, et al. The peripheral perfusion index and transcutaneous oxygen challenge test are predictive of mortality in septic patients after resuscitation[J]. Crit Care, 2013, 17(3): R116. DOI:10.1186/cc12788 |
| [4] | 董亮, 李朗, 梁锋鸣, 等. 经皮氧分压监测用于评估感染性休克患者预后的临床研究[J]. 中华急诊医学杂志, 2018, 27(3): 265-271. DOI:10.3760/cma.j.issn.1671-0282.2018.03.008 |
| [5] | Su LX, Tang B, Liu YL, et al. P(v-a)CO2/C(a-v)O2-directed resuscitation does not improve prognosis compared with SvO2 in severe Sepsis and septic shock: a prospective multicenter randomized controlled clinical study[J]. J Crit Care, 2018, 48: 314-320. DOI:10.1016/j.jcrc.2018.09.009 |
| [6] | Mallat J, Lemyze M, Meddour M, et al. Ratios of central venous-to-arterial carbon dioxide content or tension to arteriovenous oxygen content are better markers of global anaerobic metabolism than lactate in septic shock patients[J]. Ann Intensive Care, 2016, 6(1): 10. DOI:10.1186/s13613-016-0110-3 |
| [7] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Crit Care Med, 2017, 45(3): 486-552. DOI:10.1097/CCM.0000000000002255 |
| [8] | 江利冰, 李瑞杰, 张斌, 等. 2016年脓毒症与脓毒性休克处理国际指南[J]. 中华急诊医学杂志, 2017, 26(3): 263-266. DOI:10.3760/cma.j.issn.1671-0282.2017.03.004 |
| [9] | 季兵, 朱建良, 马丽梅, 等. 早期集束化治疗对脓毒症及脓毒性休克患者预后的影响[J]. 中华急诊医学杂志, 2019, 28(2): 170-174. DOI:10.3760/cma.j.issn.1671-0282.2019.02.008 |
| [10] | Marik PE. Fluid responsiveness and the six guiding principles of fluid resuscitation[J]. Crit Care Med, 2016, 44(10): 1920-1922. DOI:10.1097/CCM.0000000000001483 |
| [11] | 李玉婷, 李洪祥, 郭健杏, 等. 平均动脉压对脓毒性休克患者发生急性肾损伤的影响[J]. 中华急诊医学杂志, 2019, 28(9): 1088-1092. DOI:10.3760/cma.j.issn.1671-0282.2019.09.006 |
| [12] | 何怀武, 刘大为, 隆云. 休克复苏: "大循环-微循环"偶联的提出与内涵[J]. 中华医学杂志, 2018, 98(35): 2781-2784. DOI:10.3760/cma.j.issn.0376-2491.2018.35.002 |
| [13] | Lima AP, Beelen P, Bakker J. Use of a peripheral perfusion index derived from the pulse oximetry signal as a noninvasive indicator of perfusion[J]. Crit Care Med, 2002, 30(6): 1210-1213. DOI:10.1097/00003246-200206000-00006 |
| [14] | 何怀武, 刘大为, 隆云, 等. 外周灌注指数和静-动脉血二氧化碳分压差/动-静脉血氧含量差比值评估脓毒症复苏后乳酸清除的研究[J]. 中华内科杂志, 2018, 57(12): 917-921. DOI:10.3760/cma.j.issn.0578-1426.2018.12.008 |
| [15] | Lima AP, Beelen P, Bakker J. Use of a peripheral perfusion index derived from the pulse oximetry signal as a noninvasive indicator of perfusion[J]. Crit Care Med, 2002, 30(6): 1210-1213. DOI:10.1097/00003246-200206000-00006 |
| [16] | Mesquida J, Saludes P, Gruartmoner G, et al. Central venous-to-arterial carbon dioxide difference combined with arterial-to-venous oxygen content difference is associated with lactate evolution in the hemodynamic resuscitation process in early septic shock[J]. Crit Care, 2015, 19: 126. DOI:10.1186/s13054-015-0858-0 |
| [17] | Du W, Long Y, Wang XT, et al. The use of the ratio between the veno-arterial carbon dioxide difference and the arterial-venous oxygen difference to guide resuscitation in cardiac surgery patients with hyperlactatemia and normal central venous oxygen saturation[J]. Chin Med J (Engl), 2015, 128(10): 1306-1313. DOI:10.4103/0366-6999.156770 |
| [18] | He HW, Liu DW, Long Y, et al. High central venous-to-arterial CO2 difference/arterial-central venous O2 difference ratio is associated with poor lactate clearance in septic patients after resuscitation[J]. J Crit Care, 2016, 31(1): 76-81. DOI:10.1016/j.jcrc.2015.10.017 |
 2022, Vol. 31
2022, Vol. 31




