2. 宁夏医科大学公共卫生管理学院, 银川 750004
2. School of Public Health Administration, Ningxia Medical University, Yingchuan 750004, China
自从1950年提出急性肺损伤(acute lung injury, ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的概念后,如何管理ARDS患者降低病死率一直是临床上关注的热点。ARDS是各种病因导致肺泡上皮细胞损伤,肺毛细血管内皮细胞通透性的改变,引起肺间质及肺泡的水肿,一种非心源性肺水肿,临床上常见以呼吸窘迫及顽固性低氧血症为主要表现,其病死率为35%~45%[1]。根据病因ARDS分型可以分为肺源型及非肺源型,感染是发生ARDS最常见的原因之一约占77.2%,肺炎使ARDS发生风险显著增加[2],尤其在2019年后新型冠状病毒全球传播下,致病菌引起肺实质的炎症改变,导致ARDS的发病率更高[3]。一研究报道感染相关的ARDS发病率为27%~37%[4]。重症肺炎合并ARDS患者常因顽固性性低氧引发多器官损害甚至衰竭,病死率高,治疗难度大,是临床重症呼吸常见疾病之一。
据统计针对ARDS或急诊重症肺炎的预后病死率评分工具较少,柏林定义和一些报道[5]提出氧合指数对ARDS严重程度的分级,甚至提出观察脉搏血氧饱和度(SPO2)数值评估疾病严重程度,但均未对病死率有很好的预测性。研究表明APACHE Ⅱ评分对脓毒症休克的病死率有良好的预测性[6-7]。CURB-65评分是针对社区获得性肺炎常用的评分系统之一,在《中国成人社区获得性肺炎诊断和治疗指南》中推荐[8],在急诊诊疗中能快速判断患者肺炎的严重程度,对评估患者是否需要进一步住院治疗起到指导作用。两种评分各有优点,但针对急诊重症肺炎合并ARDS目前仍无统一评分工具,某研究表明血清miR-122联合APACHE Ⅱ评分对ARDS患者预后有评估价值[9]。也有对重症肺炎严重程度提出一种新的评分模型CLCGH评分(包含5项内容:Cr≥ 259.5 μmol/L, WBC≥ 17.35 ×109 /L, CRP≥ 189.4 μg/mL, GCS≤ 9分和HCO3-≤ 17.65 mmol/L)[10],当评分大于3分时重症肺炎病死率高。本研究拟通过预测模型的建立,评价APACHHEⅡ评分和CURB-65评分对重症肺炎合并ARDS患者预后的预测价值,探寻更适用于急诊重症肺炎合并ARDS患者预后评估系统。
1 资料与方法 1.1 一般资料采用回顾性队列研究方法,收集2017年1月至2021年12月本院急诊重症监护室住院治疗的108例急诊入院的重症肺炎合并ARDS患者临床资料。
1.1.1 纳入标准(1)年龄≥18岁;(2)重症肺炎的诊断符合中国医师协会急诊分会在2016年制定的诊断标准;ARDS的诊断符合“柏林定义”;(3)急诊入院患者。
1.1.2 排除标准(1)数据记录不完整患者;(2)住院时间 < 24 h患者;(3)存在免疫缺陷、肿瘤晚期或其他疾病终末状态、妊娠患者;(4)慢性感染1周内疾病加重者。
1.1.3 诊断标准重症肺炎的诊断标准[11]:符合下列1项主要标准或≥3项次要标准者可诊断。
主要标准:①气管插管要呼机械通气治疗;②脓毒症休克液体复苏后仍要血管活性药物治疗。次要标准:①呼吸频率增快≥30次/min;②氧合指数≤250 mmHg;③意识障碍和(或)定向障碍;④多肺叶的浸润;⑤血尿素氮≥7.14 mmol/L;⑥收缩压 < 90 mmHg,要积极的液体复苏。ARDS诊断标准[12]:①从已知临床损伤或新发的或加重呼吸系统症状到符合诊断标准,发病时间在1周以内;②不能用胸腔积液、肺大叶/肺不张或肺部结节完全解释的双肺浸润影;③不能用心力衰竭或液体负荷过量完全解释;④氧和状态分级:轻度:PEEP/CPAP≥5 cmH2O时,200 mmHg < PaO2/FiO2≤300 mmHg,中度:PEEP≥5 cmH2O时,100 mmHg < PaO2/FiO2≤200 mmHg,重度:PEEP≥5 cmH2O时,PaO2/FiO2≤100 mmHg。
1.2 伦理学本研究符合医学伦理学要求,并通过宁夏医科大学总医院伦理委员会审查(伦理编号:KYLL-2-22-0548)。
1.3 资料收集方法收集2017年1月1日至2021年12月31日急诊入院收住急诊重症监护病房诊断为重症肺炎合并ARDS患者的病例相关资料:包括入院时生命体征(HR、RR、BP、SPO2、T),一般情况(年龄、性别)、发病到入院时间(h)、是否有基础疾病(慢性心血管系统疾病、慢性呼吸系统疾病、肝脏疾病、肾脏疾病、免疫功能抑制)统计合并基础疾病的种类数(个)、实验室检查(白细胞总数、中性粒细胞百分比值、血小板计数、血气分析、血清乳酸、尿素氮、肌酐、电解质等)、临床特点(意识状态),记录入院后第1个24 h APACHE Ⅱ评分和CURB-65评分,住院天数,28 d预后情况。
1.4 统计学方法采用R语言(Ver 4.2.0)进行统计分析。非正态分布的计数资料采用中位数(四分位数间距)[M(IQR)]表示,组间比较采非参数检验。计数资料以百分比(%)表示,组间比较采用χ2检验或fisher确切概率法。基于文献及临床经验,本研究主要评价APACHE Ⅱ评分和CURB-65评分对急诊重症肺炎合并ARDS患者预后的预测效能,故在模型开发过程中,本研究以是否存活为因变量,分别以APACHE Ⅱ评分、CURB-65评分以及二者联合为自变量,建立Logistic回归方程。通过重复50次的10折交叉验证评价不同预测模型对急诊重症肺炎合并ARDS患者预后预测的准确性。通过计算不同模型的C统计量、Kendall's tau-a秩相关系数、R2、布里尔分数(Brier评分)评价模型预测的预测能力,通过校准曲线评价模型预测的准确性。通过净重新分类指数(NRI)和综合判别改善指数(IDI)评价不同模型对急诊重症肺炎合并ARDS患者预后预测的效果。通过决策曲线(DCA)评价各模型的获益。
2 结果 2.1 基本情况比较本研究最终纳入108符合纳排标准的患者,其中男性81例,女性27例,年龄(57.92 ± 16.56)岁,最终存活48例,死亡60例,病死率55.56%,在死亡组中年龄、APACHEⅡ评分及CURB-65评分均大于存活组,差异有统计学意义(P < 0.05),年龄、发病至入院时间、合并基础疾病种类数,差异均无统计学意义。见表 1。
| 临床资料 | 存活组(n=48) | 死亡组(n=60) | Estimated Difference(95%CI) | u/χ2值 | P值 |
| 年龄(岁,x±s) | 53.00(23.00) | 65.00(20.75) | -7.00(-14.00, -1.00) | 1070.50 | 0.02 |
| 性别(n,%) | 0.05 | 0.82 | |||
| 男 | 37(77.08) | 44(73.33) | |||
| 女 | 11(22.92) | 16(26.67) | |||
| 发病至入院时间[h,M(IQR)] | 5.00(3.50) | 7.00(6.00) | -2.00(-3.00, 0.00) | 1154.00 | 0.08 |
| APACHE Ⅱ评分[M(IQR)] | 18.00(8.25) | 26.00(7.50) | -6.00(-8.00, -3.00) | 817.50 | < 0.01 |
| CURB-65评分[M(IQR)] | 2.00(1.00) | 2.00(1.00) | -1.00(-1.00, -0.00) | 868.00 | < 0.01 |
| 基础疾病(n,%) | 0.32 | ||||
| 1种 | 16(33.33) | 19(31.68) | |||
| 2种 | 26(54.17) | 25(41.68) | |||
| 3种 | 4(8.33) | 9(15.00) | |||
| 4种 | 2(4.17) | 7(11.67) |
由于APACHE Ⅱ评分和CURB-65评分中已经包含年龄变量,故分别以单独APACHE Ⅱ评分为模型1、单独CURB-65评分为模型2、APCHEⅡ评分联合CURB-65评分为模型3,三种预后预测模型为自变量,是否存活为因变量建立Logistic回归模型,结果显示:模型1进行预测时,APACHE Ⅱ评分每增加1分,重症肺炎合并ARDS患者的死亡危险增加1.12倍;模型2进行预测时,CURB-65评分每增加1分,重症肺炎合并ARDS患者的死亡危险增加2.21倍;模型3进行预测时,APACHE Ⅱ和CURB-65评分每增加1分,重症肺炎合并ARDS患者的死亡危险分别增加1.1和1.95倍。见表 2。
| 模型 | Estimate | Std. Error | OR(95%CI) | P值 |
| 模型1 | ||||
| 截距 | -2.48 | 0.76 | 0.08(0.02, 0.37) | < 0.01 |
| APACHE Ⅱ评分 | 0.12 | 0.03 | 1.12(1.06, 1.20) | < 0.01 |
| 模型2 | ||||
| 截距 | -1.44 | 0.50 | 0.24(0.09, 0.63) | < 0.01 |
| CURB-65评分 | 0.79 | 0.22 | 2.21(1.43, 3.40) | < 0.01 |
| 模型3 | ||||
| 截距 | -3.42 | 0.87 | 0.03(0.01, 0.18) | < 0.01 |
| APACHE Ⅱ评分 | 0.10 | 0.03 | 1.10(1.03, 1.18) | < 0.01 |
| CURB-65评分 | 0.67 | 0.23 | 1.95(1.24, 3.07) | < 0.01 |
| 注:模型1为仅包含APACHE Ⅱ评分的Logistic回归模型;模型2为仅包含CURB-65评分的Logistic回归模型;模型3为APACHE Ⅱ评分联合CURB-65评分的Logistic回归模型 | ||||
重复50次10折交叉验证结果显示,模型1的准确度最高为1,最低为0.23,(0.68±0.14);模型2的准确度最高为1,最低位0.36,(0.66±0.11);模型3的准确度最低0.27,最高为1,(0.72±0.13)。见图 1。

|
| 图A为模型1重复50次10折交叉验证模型准确率的变化;图B为模型2重复50次10折交叉验证模型准确率的变化;图C为模型3重复50次10折交叉验证模型准确率的变化 图 1 不同模型交叉验证模型的准确率 Fig 1 The accuracy of cross -verification of different models |
|
|
通过C统计量、Kendall's tau-a秩相关系数、R2,布里尔分数(Brier评分)评估模型的校准度,模型3的优于模型1和模型2,但三者总体差异不大。模型1、模型2还是模型3,其拟合优度检验值均大于0.05,提示三种模型拟合良好见表 3。诊断实验结果显示,模型3的敏感度、准确率及曲线下面积(C统计量)高于其他2中模型。见表 4、图 2。重抽样500次的校准曲线结果显示,模型3更易低估或高估急诊重症肺炎合并ARDS患者的死亡风险,模型1次之,模型2对重症肺炎合并ARDS患者死亡风险的预测效果优于模型1和模型3。见图 3。
| 名称 | 模型1 | 模型2 | 模型3 |
| C统计量 | 0.716 | 0.699 | 0.768 |
| Kendall's tau-a秩相关系数 | 0.215 | 0.198 | 0.268 |
| R2 | 0.182 | 0.182 | 0.281 |
| 布里尔分数 | 0.212 | 0.214 | 0.191 |
| 拟合优度检验 | 0.599 | 1 | 0.144 |
| 名称 | 敏感度 | 特异度 | 准确率 | 曲线下面积 | P值 |
| 模型1(APACHE Ⅱ评分) | 76.67% | 64.58% | 71.30% | 71.61%(61.69%, 81.54%) | < 0.01 |
| 模型2(CURB-65评分) | 75.00% | 58.33% | 65.74% | 69.86%(60.42%, 79.30%) | < 0.01 |
| 模型3(APACHE Ⅱ评分+ CURB-65评分) | 91.67% | 62.50% | 77.78% | 76.84%(67.44%, 86.24%) | < 0.01 |

|
| 图 2 不同评分的ROC曲线 Fig 2 ROC curve of different models |
|
|

|
| 图A为模型1的校准曲线;图B为模型2的校准曲线;图C为模型3的校准曲线;Apparent为未校正的校准曲线,Bias-corrected为重抽样500次后的校准曲线 图 3 不同模型的校准曲线 Fig 3 Calibration curve of different models |
|
|
与模型1相比,模型2对死亡病例及存活病例正确分类的比例均有所降低,但无论是NRI和IDI,模型1和模型2均差异无统计学意义。模型3较模型1的预测能力有所改善,IDI提高了0.08,差异有统计学意义(P < 0.01),但NRI二者差异无统计学意义(P > 0.01)。与模型2相比,模型3对存活病例的重新分类能力有所改善,综合判别能力有所提高,其差异均具有统计学意义(P < 0.01)。见表 5。
| 名称 | 模型1 vs.模型2 | 模型1 vs.模型3 | 模型2 vs.模型3 | |||||
| 值(95%CI) | P值 | 值(95%CI) | P值 | 值(95%CI) | P值 | |||
| NRI+ | -0.07(-0.29, 0.16) | 0.57 | 0.10(-0.05, 0.24) | 0.18 | 0.16(-0.01, 0.34) | 0.07 | ||
| NRI- | -0.10(-0.48, 0.28) | 0.61 | 0.23(-0.14, 0.61) | 0.22 | 0.57(0.20, 0.93) | < 0.01 | ||
| IDI | -0.003(-0.09, 0.08) | 0.95 | 0.08(0.03, 0.13) | < 0.01 | 0.09(0.04, 0.14) | < 0.01 | ||
| 注:NRI+为死亡组净重新分类指数,NRI-为存活组重新分类指数;IDI为综合判别改善指数。 | ||||||||
不同模型的DCA显示,APACHE Ⅱ评分联合CRUB-65评分在预测概率为25%~55%左右时,净获益较单APACHE Ⅱ评分及CRUB-65评分模型高,而在其他概率预测区间模型1、模型2及模型3均获益基本相当。见图 4。
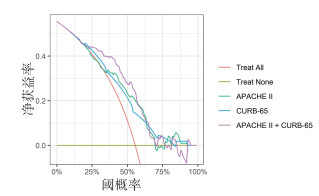
|
| 图 4 不同模型的DCA曲线 Fig 4 DCA curves of different models |
|
|
ARDS病死率较高,而重症肺炎则又是导致ARDS的主要原因[13]。急诊重症肺炎合并ARDS患者往往病情发展迅速,常合并心脏、肾脏、肝脏等多系统损害,病死率高。早期快速评估重症肺炎合并ARDS患者病情严重程度,有益于患者病情的预判,为后续诊疗提供帮助。
年龄为重症患者死亡的独立危险因素之一,APACHE Ⅱ评分也是重症社区获得性肺炎的独立危险因素[14],而本研究的结果显示,死亡组重症肺炎合并ARDS患者无论是在年龄、APACHEⅡ评分还是CUBR-65评分上均高于存活组,表明年龄越大、APACHEⅡ评分和CURB-65评分分值越高死亡风险越大。老年患者由于呼吸道纤维运动减弱,口腔定植菌增多等病理生理改变,且常合并心血管等基础疾病,低氧状态下更容易诱发器官功能的衰竭。
目前对急诊重症肺炎合并ARDS患者死亡预测评分报道较少,但单用于ARDS及重症肺炎预后评估的研究较多。有研究筛选出社区获得性肺炎发生ARDS的多个高风险因素从而建立人工神经网络预测模型对社区获得性肺炎发生ARDS有较好的预测能力[15],还有报道指出年龄、SOFA评分、淋巴细胞/中性粒细胞比值、血管外肺水指数(EVLWI)和肺上皮细胞膜糖蛋白(KL-6)联合检测为重症肺炎或ARDS患者死亡的独立危险因素,对患者预后及疾病严重程度评估有指导意义[16-19]。APACHEⅡ评分和临床肺部感染(LIPS)评分对ARDS患者病情的评估及预后判断有一定指导意义[20],同样与在Bradley研究中提及肺炎评分(PSI)和CURB-65评分可以较好的预测新型冠状病毒引起的社区获得性肺炎的预后[21]和钟明媚等[22]研究中表明CURB-65评分对老年社区获得性肺炎患者死亡风险有良好的预测性。本研究结果显示,三种评分预测模型均对急诊重症肺炎合并ARDS患者的预后良好预测能力和较高的拟合度。除此之外APACHE Ⅱ评分联合CURB-65评分在预测性能高于其他两种模型,但优势并不明显,考虑其中年龄和意识在两个评分系统中都有分值,但重症肺炎合并ARDS患者早期受损靶器官为肺组织,患者急诊入院时主要表现为呼吸窘迫等呼吸衰竭表现,其他器官的损害在第1天评分中未有较高的评分值。由于CURB-65评分参数较少,具有简洁、易操作的临床特点,对急诊重症肺炎合并ARDS患者预后预测获益与APACHEⅡ评分相比基本相当,因此,在急诊对重症肺炎合并ARDS患者预后的评估上,CURB-65评分可能更有一定优势。
本研究还显示模型3可能对急诊重症肺炎合并ARDS患者的病死率有过度的评价,同样在其他研究中也表明CURB-65 > 2分收住重症监护病房进行重症监护管理敏感度低,应根据患者患者再次评估[23]。考虑本研究样本量小,对于病情发展后期因多器官功能衰竭而死亡的诱因未细分化,需要进一步大样本研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李雪:研究设计、数据收集、论文撰写;吴嘉荔:研究设计、统计学分析;马汉宁:数据收集;张亚娟:统计学指导;杨立山:对稿件知识内容进行批判性修改
| [1] | Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788-800. DOI:10.1001/jama.2016.0291 |
| [2] | Reilly JP, Zhao ZG, Shashaty MGS, et al. Low to moderate air pollutant exposure and acute respiratory distress syndrome after severe trauma[J]. Am J Respir Crit Care Med, 2019, 199(1): 62-70. DOI:10.1164/rccm.201803-0435OC |
| [3] | Meyer NJ, Gattinoni L, Calfee CS. Acute respiratory distress syndrome[J]. Lancet, 2021, 398(10300): 622-637. DOI:10.1016/S0140-6736(21)00439-6 |
| [4] | Auriemma CL, Zhuo HJ, Delucchi K, et al. Acute respiratory distress syndrome-attributable mortality in critically ill patients with sepsis[J]. Intensive Care Med, 2020, 46(6): 1222-1231. DOI:10.1007/s00134-020-06010-9 |
| [5] | Kacmarek RM, Berra L. Prediction of ARDS outcome: what tool should I use?[J]. Lancet Respir Med, 2018, 6(4): 253-254. DOI:10.1016/S2213-2600(18)30098-5 |
| [6] | Yu MH, Chen MH, Han F, et al. Prognostic value of the biomarkers serum amyloid A and nitric oxide in patients with sepsis[J]. Int Immunopharmacol, 2018, 62: 287-292. DOI:10.1016/j.intimp.2018.07.024 |
| [7] | Assimakopoulos SF, Akinosoglou K, de Lastic AL, et al. The prognostic value of endotoxemia and intestinal barrier biomarker ZO-1 in bacteremic sepsis[J]. Am J Med Sci, 2020, 359(2): 100-107. DOI:10.1016/j.amjms.2019.10.006 |
| [8] | 中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(4): 253-279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005 |
| [9] | 郝金香, 许俊旭, 梁勇, 等. miR-122联合APACHEⅡ评分对ARDS患者预后的评估价值[J]. 中华危重病急救医学, 2019, 31(6): 694-698. DOI:10.3760/cma.j.issn.2095-4352.2019.06.007 |
| [10] | Wang X, Jiao JL, Wei RW, et al. A new method to predict hospital mortality in severe community acquired pneumonia[J]. Eur J Intern Med, 2017, 40: 56-63. DOI:10.1016/j.ejim.2017.02.013 |
| [11] | 中国医师协会急诊医师分会. 中国急诊重症肺炎临床实践专家共识[J]. 中国急救医学, 2016, 36(2): 97-107. DOI:10.3969/j.issn.1002-1949.2016.02.001 |
| [12] | Definition Task Force ARDS, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [13] | Matthay MA, Zemans RL, Zimmerman GA, et al. Acute respiratory distress syndrome[J]. Nat Rev Dis Primers, 2019, 5(1): 18. DOI:10.1038/s41572-019-0069-0 |
| [14] | Aziz AOA, Fattah MTA, Mohamed AH, et al. Assessment of mortality predictors in patients with severe community-acquired pneumonia requiring icu admission[J]. New Horizons in Medicine and Medical Research Vol.3, 2022, 4: 150-161. DOI:10.9734/bpi/nhmmr/v3/15573D |
| [15] | 莫继朋, 贾中芝, 汤艳, 等. 基于人工神经网络建立社区获得性肺炎并发急性呼吸窘迫综合征的预测模型[J]. 中华危重病急救医学, 2022, 34(4): 367-372. DOI:10.3760/cma.j.cn121430-20210927-01406 |
| [16] | Hendrickson CM, Matthay MA. Endothelial biomarkers in human sepsis: pathogenesis and prognosis for ARDS[J]. Pulm Circ, 2018, 8(2): 2045894018769876. DOI:10.1177/2045894018769876 |
| [17] | Chen CS, Shi L, Li YP, et al. Disease-specific dynamic biomarkers selected by integrating inflammatory mediators with clinical informatics in ARDS patients with severe pneumonia[J]. Cell Biol Toxicol, 2016, 32(3): 169-184. DOI:10.1007/s10565-016-9322-4 |
| [18] | Song M, Liu YJ, Lu ZW, et al. Prognostic factors for ARDS: clinical, physiological and atypical immunodeficiency[J]. BMC Pulm Med, 2020, 20(1): 102. DOI:10.1186/s12890-020-1131-0 |
| [19] | 李双凤, 高延秋, 李晓燕, 等. EVLWI、sICAM-1和KL-6联合检测在重症肺炎ARDS患者预后评估中的价值[J]. 中华急诊医学杂志, 2021, 30(6): 730-736. DOI:10.3760/cma.j.issn.1671-0282.2021.06.016 |
| [20] | 周笳, 王维秀, 谭效锋. APACHEⅡ和LIPS在急性呼吸窘迫综合征病情评估及预后判断中的价值[J]. 中国老年学杂志, 2021, 41(1): 62-65. DOI:10.3969/j.issn.1005-9202.2021.01.018 |
| [21] | Bradley J, Sbaih N, Chandler TR, et al. Pneumonia severity index and CURB-65 score are good predictors of mortality in hospitalized patients with SARS-CoV-2 community-acquired pneumonia[J]. Chest, 2022, 161(4): 927-936. DOI:10.1016/j.chest.2021.10.031 |
| [22] | 钟明媚, 徐康, 丁震, 等. 中性粒细胞/淋巴细胞比值与CURB-65评分在老年社区获得性肺炎预后评价中的作用[J]. 中华急诊医学杂志, 2021, 30(10): 1235-1239. DOI:10.3760/cma.j.issn.1671-0282.2021.10.014 |
| [23] | Ilg A, Moskowitz A, Konanki V, et al. Performance of the CURB-65 score in predicting critical care interventions in patients admitted with community-acquired pneumonia[J]. Ann Emerg Med, 2019, 74(1): 60-68. DOI:10.1016/j.annemergmed.2018.06.017 |
 2023, Vol. 32
2023, Vol. 32




