由脓毒症引起的心功能障碍称为脓毒症心肌病(sepsis induced cardiomyopathy,SIC),是脓毒症多器官功能障碍的重要环节[1],并发SIC使患者脓毒症器官功能障碍复杂化,与患者不良预后和病死率增加密切相关[2]。虽然关于SIC的发病机制尚不完全明晰,但大量研究认为,作为机体能量代谢工厂线粒体在SIC的发生发展起着举足轻重的作用。研究[3-5]显示SIC病患者心脏线粒体基因广泛下调,心肌细胞存在局灶性线粒体膜损伤、线粒体水肿及线粒体嵴结构改变。目前对SIC多为治疗原发病,出现心源性休克时提供支持治疗,并无早期针对SIC的预防治疗[6],因此研究SIC的线粒体相关机制,可为临床早期识别和干预提供重要思路。
线粒体动力学是线粒体在细胞内,通过分裂与融合维持线粒体网络结构稳定的动态变化过程,线粒体融合使线粒体之间基因和产物交换以维持最佳功能,线粒体分裂则是线粒体进行质量控制的重要环节[7-8]。Drp1是介导线粒体分裂的关键蛋白[9],与癌细胞生长及转移[10-11]、神经退行性病变相关通路、神经细胞损伤[12-14]、心肌缺血-再灌注损伤、糖尿病心肌病等密切相关[15-16],但在脓毒症及相关疾病中的作用研究有限。本文拟通过抑制Drp1介导的线粒体分裂,观察脂多糖(lipopolysaccharide,LPS)刺激下,H9C2细胞线粒体动力学情况以及线粒体功能状态,探讨线粒体动力学在SIC的作用机制。
1 材料与方法 1.1 材料H9C2大鼠心肌细胞系(上海中乔新舟);DMEM高糖培养基、胰酶、青霉素/链霉素双抗(Gibco,美国);胎牛血清(上海双洳公司),线粒体分裂抑制剂(mitochondrial division inhibitor 1,Mdivi-1,Selleck,美国);LPS(Sigma,美国);二甲基亚砜(北京鼎国昌盛);CCK-8试剂盒(MCE,美国);乳酸脱氢酶(LDH)检测试剂盒(南京建成);线粒体膜电位检测试剂盒、活性氧(ROS)检测试剂盒(北京索莱宝);细胞凋亡检测试剂盒(BD Pharmingen,美国);RNA提取试剂盒(上海碧云天);引物(上海生工);SYBR(QIANGIN,德国);总蛋白提取试剂盒(上海贝博);BCA蛋白含量检测试剂盒(江苏凯基生物);动态相关蛋白1(dynamin related protein 1,Drp1)、视神经萎缩蛋白1(Optic Atrophy 1,Opa1)、线粒体融合蛋白2 (Mitofusin2,Mfn2)抗体,MitoTracker Green(CST,美国);GAPDH抗体(北京中杉金桥)。
1.2 方法 1.2.1 细胞培养及分组H9C2大鼠心肌细胞用含1 % 双抗和10 % 胎牛血清的DMEM高糖培养基,于95 % CO2,37℃恒温培养箱中培养,细胞融合约80%时1:3传代。利用LPS建立SIC细胞模型[17],Mdivi-1提前30 min预处理抑制线粒体分裂,将H9C2细胞分为4组,对照组(Control);LPS刺激组(LPS)予2 μg/mL LPS;Mdivi-1对照组(Mdivi-1)予1 μmol/L Mdivi-1;LPS+Mdivi-1干预组(LPS+Mdivi-1)予2 μg/mL LPS、1 μmol/L Mdivi-1,其中Mdivi-1以二甲基亚砜溶解,Control组与LPS组加入等量的二甲基亚砜,刺激48 h后收取细胞进行检测。
1.2.2 心肌细胞存活率检测将细胞按4 000个/孔接种于96孔板,建模后,CCK-8与培养基1:9混匀后加入孔中,100 μL/孔,37℃培养箱孵育1.5 h,酶标仪于450 nm处测定吸光度OD值并计算细胞存活率。
1.2.3 心肌损伤标志物检测收集细胞上清液,3 000 r/min 4℃离心10 min,按LDH试剂盒说明,检测450 nm波长处吸光度OD值,计算细胞上清液中LDH活性。
1.2.4 线粒体功能检测细胞处理后,无血清培养基配制ROS探针工作液,工作液处理细胞,37℃培养箱孵育30 min,PBS清洗3次,荧光显微镜下观察荧光强度并分析。
细胞处理后,收集细胞PBS清洗2次,配制JC-1工作液及缓冲液,按说明书处理细胞,37℃培养箱孵育30 min,缓冲液洗涤细胞2次后,重悬并于流式细胞仪检测。
1.2.5 心肌细胞凋亡检测细胞处理后,不含EDTA的胰酶消化收集细胞,PBS洗涤2次,100 μL结合液重悬,分别加入3 μL FITC Annexin V和5 μL PI,室温避光孵育15 min后加入400 μL结合液重悬,流式细胞仪检测。
1.2.6 线粒体形态检测H9C2细胞以2×104个/mL密度种于激光共聚焦培养皿并分组处理,加入400 nmol/L MitoTracker工作液,37℃培养箱孵育30 min,PBS清洗细胞表面3~4次后,加入1 mL培养基,激光共聚焦观察线粒体,Image J软件分析线粒体平均长度。
1.2.7 实时荧光定量PCR检测线粒体分裂与融合蛋白表达细胞分组处理,按试剂盒说明提取细胞RNA并逆转录获取cDNA,cDNA与SYBR、相应引物混合后上机反应,2-∆∆t法计算mRNA表达量。引物见表 1。
| 基因 | Forward(5’→3’) | Reserve(3’→5’) |
| Drp1 | ATGGTGGTCAGGAACCGACA | GCAACTGGAACTGGCACATCT |
| Opa1 | ATGCTCGCTATCACTGCCAACAC | CCTTCTTCTCGCCGTCTTCAGC |
| Mfn2 | TCCACAGCCATTGCCAGTTCAC | CCGCACAGACACAGGAAGAAGG |
细胞分组处理后,试剂盒提取细胞蛋白,BCA法测量蛋白浓度并计算上样量。10%聚丙烯酰胺凝胶电泳、转膜、封闭后,分别用Drp1(1:1 000)、Opa1(1:1 000)、Mfn2(1:1 000)、GAPDH(1:5000)4℃孵育。过夜后回收一抗,TBST清洗膜3次,对应二抗(1:5 000)室温孵育80 min,TBST再次洗涤3次,上机显影。Image J分析各蛋白灰度值,分别与GAPDH灰度值相比进行目的蛋白的相对定量。
1.3 统计学方法采用SPSS24.0软件进行数据处理,正态分布的计量资料计量资料采用均数±标准差(x±s)表示,组间差异比较采用单因素方差分析,组间两两比较采用LSD-t(Least-significant Difference Test)检验,以P < 0.05为差异有统计学意义。
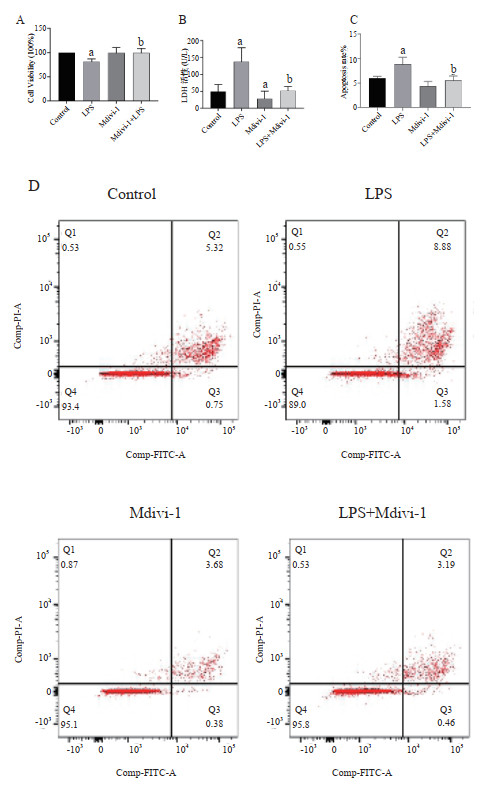
2 结果 2.1 抑制Drp1对心肌细胞存活状态和凋亡的影响LPS刺激可降低细胞存活率(F=9.371,P < 0.05),与LPS组相比LPS+Mdivi-1组细胞存活率升高(P < 0.05),Mdivi-1组与Control组差异无统计学意义(P > 0.05,图 1A)。LDH结果显示,与Control组相比,LPS组LDH活性增高,Mdivi-1组LDH活性降低,与LPS组相比,LPS+Mdivi-1组LDH活性降低,心肌损伤减轻(图 1B,F=13.264,均P < 0.05)。心肌细胞凋亡检测显示(图 1C-D ),与Control组相比LPS组心肌细胞凋亡增加,LPS+Mdivi-1组较LPS组细胞凋亡减少,(F=11.105,P < 0.05),Control组与Mdivi-1组间差异无统计学意义(P > 0.05)。
|
| A:CCK-8检测细胞存活率(n=7);B:微板法检测LDH活性;C-D:流式细胞仪检测细胞凋亡(n=3);与Control组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 1 抑制Drp1对脓毒症心肌细胞存活状态和凋亡的影响 Fig 1 Effect of inhibition of Drp1 on survival and apoptosis of SIC |
|
|
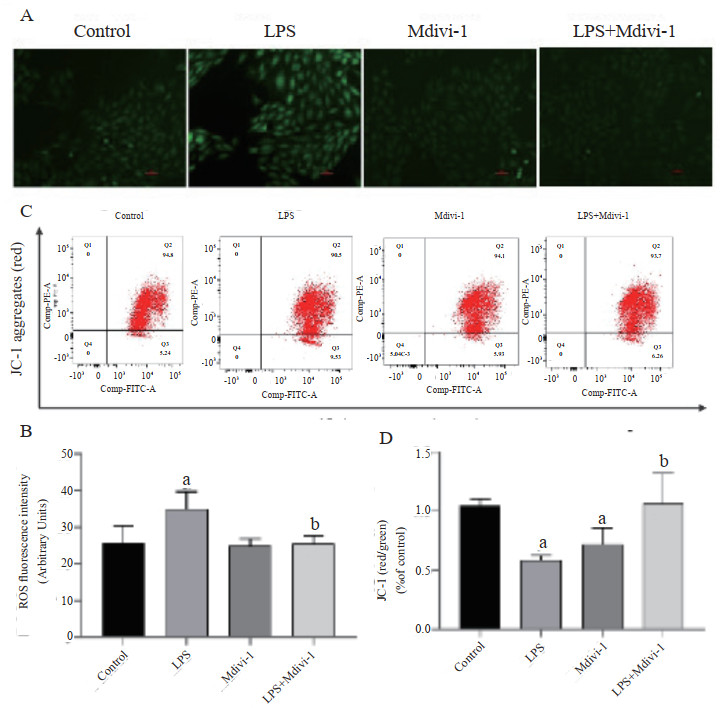
如图 2A-B ,与Control组相比LPS组荧光强度增加,细胞内ROS生成增多(F=14.022,P < 0.05), Mdivi-1组差异无统计学意义(P > 0.05);LPS+Mdivi-1组ROS含量低于LPS组(P < 0.05)。线粒体膜电位检测所示(图 2C-D),与Control组相比,LPS组及Mdivi-1组线粒体膜电位降低(F=7.2295,均P < 0.05),LPS+Mdivi-1组膜电位较LPS组升高(P < 0.05)。
|
| A:荧光显微镜检测细胞ROS含量;B:细胞内ROS荧光强度(n=8);C:流式细胞仪检测线粒体膜电位;D:线粒体膜电位(n=3);与Control组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 2 抑制Drp1对脓毒症心肌细胞线粒体功能的影响 Fig 2 Effect of inhibition of Drp1 on mitochondrial function of SIC |
|
|
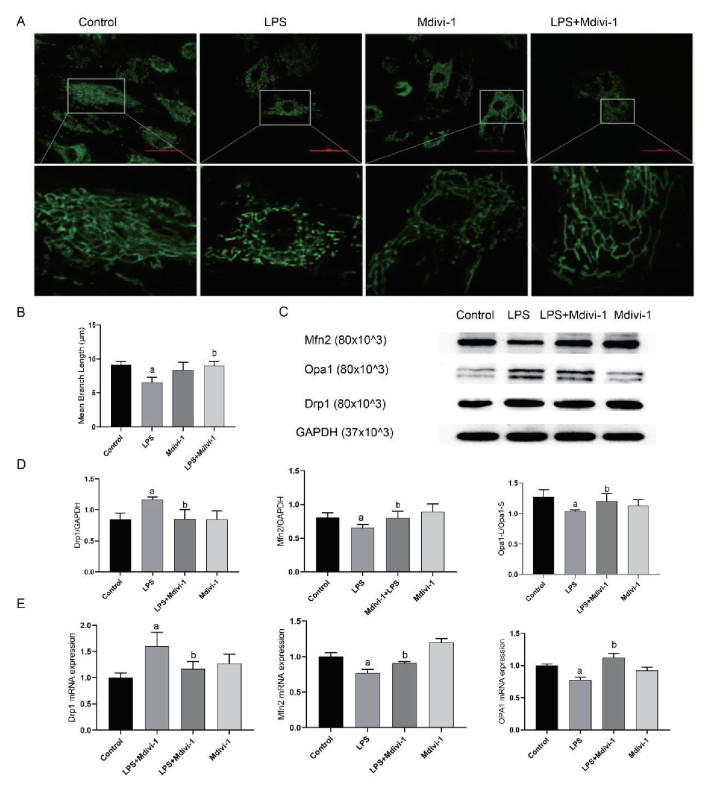
MitoTracker染色显示(见图 3A-B ),与Control组相比LPS组可引起线粒体断裂,平均长度显著缩短(P < 0.05);与LPS组相比,LPS+Mdivi-1组可减少线粒体断裂,线粒体平均长度延长(F=20.742,P < 0.05),Mdivi-1组与Control组间差异无统计学意义(P > 0.05)。Western bolt结果显示(图 3C-D ),与Control组相比LPS组可使线粒体分裂蛋白Drp1表达量上升,融合蛋白Mfn2表达量下降(F=7.386,F=4.266,均P < 0.05);OPA1可水解为L-Opa1与S-Opa1,共同调节粒体融合过程,L-Opa1剪切为S-Opa1时,线粒体融合受抑制[18],与Control组相比LPS组L-Opa1/S-Opa1比值降低(F=3.89,P < 0.05),Mdivi-1组Drp1、Mfn2、Opa1与Control组间均差异无统计学意义(P > 0.05);与LPS组相比Mdivi-1+LPS组分裂蛋白Drp1表达量降低,融合蛋白Mfn2及L-Opa1/S-Opa1表达量上升(均P < 0.05)。实时荧光定量PCR结果显示,与Control组相比,LPS组Drp1 mRNA表达量上升,Mfn2、Opa1 mRNA表达量下降(F=9.956,F=42.692,F=26.53,均P < 0.05),Mdivi-1组Drp1与Opa1mRNA表达量差异无统计学意义(P > 0.05),Mfn2 mRNA表达量上升(P < 0.05),与LPS组相比LPS+Mdivi-1组中Drp1 mRNA表达量下降(P < 0.05),Mfn2、Opa1 mRNA表达量上升(图 3E ,P < 0.05),与Western blot结果一致。
|
| A:MitoTracker染色激光共聚焦检测线粒体形态;B:线粒体平均长度(n=9);C:Western Blot检测线粒体分裂蛋白与融合蛋白表达;D:线粒体动力学相关蛋白Drp1、Mfn2、L-Opa1/S-Opa1蛋白相对表达量(n=4);E. 线粒体动力学相关蛋白Drp1、Mfn2、Opa1 mRNA表达量(n=3);与Control组比较,aP < 0.05;与LPS组比较,bP < 0.05 图 3 抑制Drp1对脓毒症心肌细胞线粒体动力学的影响 Fig 3 Effect of inhibition of Drp1 on mitochondrial dynamics in SIC |
|
|
脓毒症是宿主对感染的免疫失调导致危及生命的器官功能障碍[19]。心功能障碍在脓毒症多器官功能障碍启动和序贯发生中至关重要[6]。基于线粒体机制在SIC发病机制中的主导作用,本研究从线粒体动力学方面着手进行探讨。
研究已发现线粒体动力学在多项疾病的发生发展中占据重要作用[20],Drp1、Opa1、Mfn2是介导线粒体动力学中融合与分裂的关键蛋白,参与调控线粒体内膜及外模的融合与分裂过程。研究发现敲除小鼠Drp1或Mfn2基因调控小鼠线粒体动力学,可加速线粒体衰老及功能障碍[21];另有研究表明Drp1参与缺血-再灌注损伤[15]、急性性肾损伤、癌症、阿尔兹海默症等疾病发展,对以上疾病模型应用不同Drp1抑制剂后,均发现有保护或治疗作用。本研究发现H9C2细胞在LPS刺激下,Drp1 mRNA表达量及蛋白表达量上调,线粒体平均长度降低,呈过度分裂状态;且线粒体融合蛋白Mfn2、OPA1 mRNA及蛋白表达量降低,此时线粒体融合受抑制,细胞处于线粒体动力学失衡状态,提示SIC的发病机制可能与细胞的线粒体动力学失衡相关。
Mdivi-1是Drp1的选择性抑制剂,可选择性调节Drp1活性,从而抑制Drp1介导的线粒体分裂。本研究发现Mdivi-1干预LPS刺激的H9C2细胞后,Drp1 mRNA及蛋白表达量显著降低,Mfn2、Opa1 mRNA及蛋白表达量上调。进一步分析融合与分裂蛋白结果显示,Mdivi-1干预后,LPS刺激引起的线粒体过度分裂现象得到缓解,线粒体融合与分裂趋于平衡,综上结果可以认为Mdivi-1有助于维持线粒体动力学稳定。
线粒体膜电位是三羧酸循环相关氧化还原过程中产生的跨膜电势,是氧化磷酸化能量储存过程的重要部分,功能正常的线粒体通过维持稳定的膜电位以完成细胞氧化呼吸功能过程,ROS是细胞氧化呼吸的正常代谢产物,线粒体是其主要产生部位,当线粒体功能障碍时可异常增高,细胞内ROS含量一定程度上可反应线粒体功能。进一步研究发现LPS刺激H9C2细胞,引起线粒体动力学失衡时,出现线粒体膜电位下降,ROS生成增多的线粒体功能障碍表现,Mdivi-1干预LPS刺激的心肌细胞,使线粒体动力学趋于平衡状态时,细胞ROS生成减少,线粒体膜电位升高,线粒体功能明显改善。表明脓毒症心肌细胞线粒体动力学的平衡,对细胞线粒体功能的维持至关重要。
线粒体功能障碍与多种疾病密切相关,影响细胞稳态与活性,参与细胞凋亡。LDH在心肌梗死、心肌缺血等多种心肌损伤中上升,是心肌损伤的重要标志。本研究发现LPS处理H9C2细胞后,细胞存活率降低,LDH升高,细胞凋亡增加,出现明显细胞损伤,经过Mdivi-1干预LPS处理的心肌细胞,线粒体功能障碍缓解后,细胞存活率提高,细胞凋亡减少,LDH含量降低,证明线粒体功能改善可明显缓解LPS造成的心肌损伤。
致谢: 感谢唐娴老师的统计学相关指导
利益冲突 所有作者声明无利益冲突
作者贡献声明 伏春晓: 直接参与设计实验、实验操作、数据分析、文章撰写等;袁羞、王晗、周亮:实验操作、采集数据;李少军: 统计学分析、后期文章指导、修改;谭利平: 实验设计、工作支持,获取研究经费、指导、支持性贡献。改
| [1] | Hollenberg SM, Singer M. Pathophysiology of sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. DOI:10.1038/s41569-020-00492-2 |
| [2] | Tsolaki V, Makris D, Mantzarlis K, et al. Sepsis-induced cardiomyopathy: oxidative implications in the initiation and resolution of the damage[J]. Oxid Med Cell Longev, 2017, 2017: 7393525. DOI:10.1155/2017/7393525 |
| [3] | Takasu O, Gaut JP, Watanabe E, et al. Mechanisms of cardiac and renal dysfunction in patients dying of sepsis[J]. Am J Respir Crit Care Med, 2013, 187(5): 509-517. DOI:10.1164/rccm.201211-1983OC |
| [4] | Matkovich SJ, Al Khiami B, Efimov IR, et al. Widespread down-regulation of cardiac mitochondrial and sarcomeric genes in patients with sepsis[J]. Crit Care Med, 2017, 45(3): 407-414. DOI:10.1097/CCM.0000000000002207 |
| [5] | Rossi MA, Celes MR, Prado CM, et al. Myocardial structural changes in long-term human severe sepsis/septic shock may be responsible for cardiac dysfunction[J]. Shock, 2007, 27(1): 10-18. DOI:10.1097/01.shk.0000235141.05528.47 |
| [6] | Beesley S J, Weber G, Sarge T, et al. Septic cardiomyopathy[J]. Crit Care Med, 2018, 46(4): 625-634. DOI:10.1097/CCM.0000000000002851 |
| [7] | Adebayo M, Singh S, Singh AP, et al. Mitochondrial fusion and fission: the fine-tune balance for cellular homeostasis[J]. FASEB J, 2021, 35(6): e21620. DOI:10.1096/fj.202100067R |
| [8] | Tahrir FG, Langford D, Amini S, et al. Mitochondrial quality control in cardiac cells: mechanisms and role in cardiac cell injury and disease[J]. J Cell Physiol, 2019, 234(6): 8122-8133. DOI:10.1002/jcp.27597 |
| [9] | Kalia R, Wang RY, Yusuf A, et al. Structural basis of mitochondrial receptor binding and constriction by DRP1[J]. Nature, 2018, 558(7710): 401-405. DOI:10.1038/s41586-018-0211-2 |
| [10] | Liang J, Yang YP, Bai L, et al. DRP1 upregulation promotes pancreatic cancer growth and metastasis through increased aerobic glycolysis[J]. J Gastroenterol Hepatol, 2020, 35(5): 885-895. DOI:10.1111/jgh.14912 |
| [11] | Lee YG, Nam Y, Shin KJ, et al. Androgen-induced expression of DRP1 regulates mitochondrial metabolic reprogramming in prostate cancer[J]. Cancer Lett, 2020, 471: 72-87. DOI:10.1016/j.canlet.2019.12.017 |
| [12] | Rong R, Xia XB, Peng HQ, et al. Cdk5-mediated Drp1 phosphorylation drives mitochondrial defects and neuronal apoptosis in radiation-induced optic neuropathy[J]. Cell Death Dis, 2020, 11(9): 720. DOI:10.1038/s41419-020-02922-y |
| [13] | Grohm J, Kim SW, Mamrak U, et al. Inhibition of Drp1 provides neuroprotection in vitro and in vivo[J]. Cell Death Differ, 2012, 19(9): 1446-1458. DOI:10.1038/cdd.2012.18 |
| [14] | Yu M, Yang JH, Gao X, et al. Lanthanum chloride impairs spatial learning and memory by inducing[J]. Metallomics, 2020, 12(4): 592-606. DOI:10.1039/c9mt00291j |
| [15] | Wu DC, Dasgupta A, Chen KH, et al. Identification of novel dynamin-related protein 1 (Drp1) GTPase inhibitors: therapeutic potential of Drpitor1 and Drpitor1a in cancer and cardiac ischemia-reperfusion injury[J]. FASEB J, 2020, 34(1): 1447-1464. DOI:10.1096/fj.201901467R |
| [16] | Zhou H, Zhang Y, Hu SY, et al. Melatonin protects cardiac microvasculature against ischemia/reperfusion injury via suppression of mitochondrial fission-VDAC1-HK2-mPTP-mitophagy axis[J]. J Pineal Res, 2017, 63(1). DOI:10.1111/jpi.12413 |
| [17] | 曹剑英, 张彦周, 丁显飞, 等. KLF4在LPS诱导的心肌细胞损伤中的作用研究[J]. 中华急诊医学杂志, 2021, 30(6): 704-709. DOI:10.3760/cma.j.issn.1671-0282.2021.06.012 |
| [18] | Zhang DY, Zhang Y, Ma J, et al. Cryo-EM structures of S-OPA1 reveal its interactions with membrane and changes upon nucleotide binding[J]. Elife, 2020, 9: e50294. DOI:10.7554/eLife.50294 |
| [19] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [20] | Archer SL. Mitochondrial dynamics: mitochondrial fission and fusion in human diseases[J]. N Engl J Med, 2013, 369(23): 2236-2251. DOI:10.1056/NEJMra1215233 |
| [21] | Song MS, Franco A, Fleischer JA, et al. Abrogating mitochondrial dynamics in mouse hearts accelerates mitochondrial senescence[J]. Cell Metab, 2017, 26(6): 872-883.e5.. DOI:10.1016/j.cmet.2017.09.023 |
 2022, Vol. 31
2022, Vol. 31




