有机磷农药(organophosphorus pesticides, OP)是一类脂溶性高、疏水性强、易与蛋白结合的有机磷酸酯或硫化磷酸酯化合物,长期接触可明显损伤血管内皮细胞功能,诱发多种血管性疾病,如动脉粥样硬化,糖尿病等[1-3]。氢溴酸山莨菪碱(anisodamine hydrobromide, AniHBr)作为一种胆碱能和α1肾上腺素能受体拮抗剂,具有稳定细胞质膜、抗脂质过氧化、拮抗胆碱能受体、抗凝血与促纤溶等药理作用[4]。最新研究发现AniHBr可作用于内皮细胞改善脂多糖(lipopolysaccharide, LPS)导致的微循环障碍[5]。然而关于AniHBr是否对敌敌畏损伤的内皮细胞具有保护作用鲜有报道。基于此,本研究通过建立敌敌畏损伤的内皮细胞模型,观察AniHBr预处理对细胞活性的影响,探讨不同浓度AniHBr对敌敌畏损伤的内皮细胞的保护作用。
1 材料与方法 1.1 材料细胞株:人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs):购自内蒙古大学细胞库。
实验用主要试剂及仪器:CCK-8试剂盒(北京全式金中国),氢溴酸山莨菪碱(成一制药中国),77.5%敌敌畏(天津华宇中国),胎牛血清(SclenCell美国),ECM培养基(SclenCell美国),CO2细胞培养箱(Thermo美国),酶标检测仪(Molecular Devices SpectraMax i3美国)。
1.2 方法 1.2.1 实验分组实验设置6个分组,分别为空白组(含ECM、细胞和CCK-8溶液)、敌敌畏组(含ECM、细胞、CCK-8溶液和敌敌畏)、敌敌畏+AniHBr组(分别含ECM、细胞、CCK-8溶液、敌敌畏和5 mg/L、100 mg/L、1 600 mg/L、8 000 mg/L浓度的AniHBr),每个小组4个副孔。
1.2.2 实验方法按实验设计将细胞悬液转移至96孔板中(100 μL/孔)并标记组别,放入细胞培养箱中预培养12 h。敌敌畏+AniHBr组按分组每孔加入10 μL不同浓度的AniHBr,细胞培养箱中孵育4 h。敌敌畏组和敌敌畏+AniHBr组分别每孔加入10 μL敌敌畏,继续培养30 min后,各组每孔中加入10μL CCK-8溶液。孵育2~4 h后应用酶联免疫检测仪测450 nm双波长处吸光度(OD值),计算细胞活力并观察颜色变化。
1.2.3 敌敌畏损伤内皮细胞模型的建立用PBS将敌敌畏稀释成分别为1:50、1:70、1:90、1:110(敌敌畏: PBS)浓度组,与细胞孵育30 min后测OD值,并计算细胞活力。
1.2.4 AniHBr对内皮细胞活力的影响用无血清ECM培养基将AniHBr稀释成5 mg/L、100 mg/L、1 600 mg/L、8 000 mg/L浓度组,测不同浓度AniHBr与细胞作用4 h后的OD值,并计算细胞活力。
1.2.5 AniHBr对敌敌畏损伤的内皮细胞活力的影响用无血清ECM培养基将AniHBr稀释成5 mg/L、100 mg/L、1 600 mg/L、8 000 mg/L浓度组,与细胞孵育4 h后测与最佳损伤浓度的敌敌畏作用细胞30 min后的OD值,并计算细胞活力。
细胞活力(%)=[(实验组-空白组)/(阴性对照组-空白组)]×100%
1.3 观察指标① 各组细胞OD值;②加入CCK-8试剂反应后的颜色变化;③细胞活力。
1.4 统计学方法计量资料以均数±标准差(Mean±SD)表示,采用SPSS 26.0软件进行统计分析。多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 敌敌畏损伤内皮细胞模型的建立与空白组相比,敌敌畏组细胞OD值及细胞活力随着敌敌畏浓度降低逐渐升高,差异均有统计学意义(P < 0.05)。根据计算得出,当1:90浓度敌敌畏作用30 min时细胞存活率 > 50%,故选用1:90浓度敌敌畏与细胞作用30 min为最佳造模条件,见表 1。
| 敌敌畏组(敌敌畏: PBS) | |||||
| 指标 | 空白组 | 1:50 | 1:70 | 1:90 | 1:110 |
| OD值[L/(g·cm)] | 0.326±0.024 | 0.115±0.019b | 0.171±0.018b | 0.245±0.010b | 0.281±0.012a |
| 细胞活力(%) | 1 | 0.227±0.081b | 0.439±0.067b | 0.672±0.066b | 0.803±0.130a |
| 与空白组比,aP < 0.05,bP < 0.01 | |||||
与空白组相比,AniHBr (5 mg/L、100 mg/L、1 600 mg/L、8 000 mg/L) 组细胞活力及OD值差异均无统计学意义(P > 0.05)。见表 2。
| AniHBr组(mg/L) | |||||
| 指标 | 空白组 | 5 | 100 | 1600 | 8000 |
| OD值[L/(g•cm)] | 0.394±0.014 | 0.391±0.027 | 0.381±0.014 | 0.374±0.030 | 0.368±0.031 |
| 细胞活力(%) | 1 | 0.990±0.080 | 0.962±0.052 | 0.936±0.084 | 0.921±0.086 |
与空白组相比,敌敌畏组细胞活力及OD值明显降低,差异有统计学意义(P < 0.01);与敌敌畏组相比,敌敌畏+AniHBr 8 000 mg/L浓度组OD值差异有统计学意义(P < 0.05),敌敌畏+AniHBr 1 600 mg/L和8 000 mg/L浓度组细胞活力差异均有统计学意义(P < 0.05或P < 0.01),其余各浓度组细胞活力及OD值差异均无统计学意义(P > 0.05),见表 3。
| 指标 | 空白组 | 敌敌畏组 | 敌敌畏+AniHBr组(mg/L) | |||
| 5 | 100 | 1600 | 8000 | |||
| OD值[L/(g•cm)] | 0.476±0.089 | 0.270±0.043a | 0.287±0.048 | 0.308±0.045 | 0.326±0.050 | 0.378±0.078b |
| 细胞活力(%) | 1 | 0.506±0.061a | 0.545±0.050 | 0.599±0.070 | 0.647±0.118b | 0.687±0.065c |
| 注:与空白组比,aP < 0.01;与敌敌畏组比,bP < 0.05,cP < 0.01 | ||||||
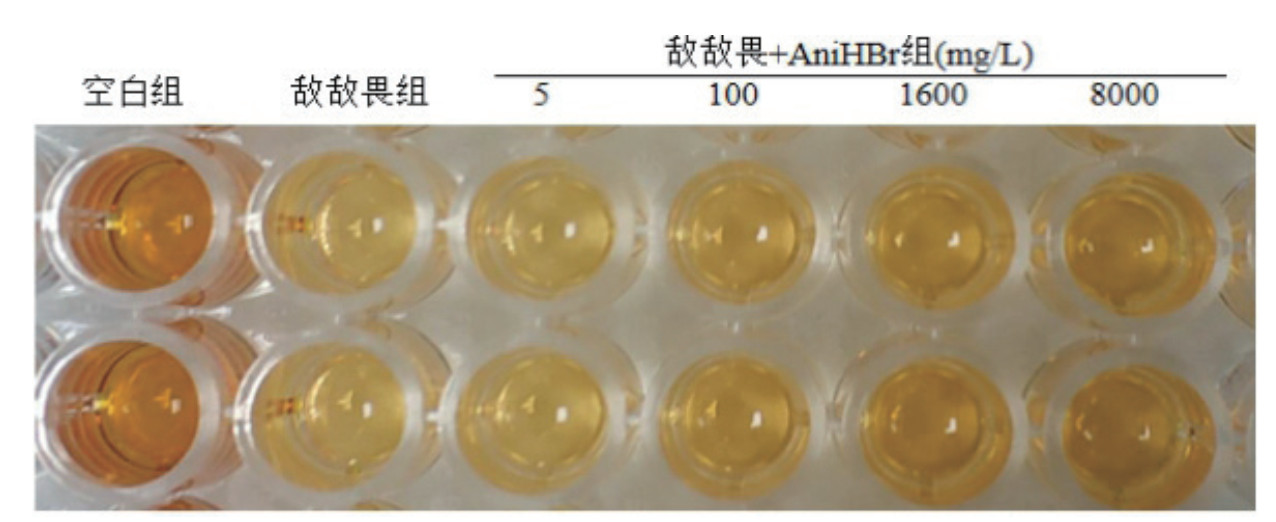
与空白组相比,敌敌畏组和敌敌畏+AniHBr组吸光度降低,细胞活性减弱,反应后颜色变浅;与敌敌畏组相比,敌敌畏+AniHBr组吸光度高,细胞活性高,反应后颜色深,且随着AniHBr浓度的增加,吸光度、细胞活性依次升高,颜色依次变深,见图 1。空白组细胞贴壁生长,呈铺路石样;敌敌畏组细胞漂起、缩小呈圆形,细胞变形严重;敌敌畏+AniHBr组细胞形态学改变明显减轻,见图 2。
|
| 图注:敌敌畏+AniHBr组随着AniHBr浓度增大颜色依次变深 图 1 加入CCK-8溶液温孵2 h后各组颜色变化 |
|
|

|
| 空白组细胞贴壁生长,呈铺路石样;敌敌畏组细胞漂起、缩小呈圆形,细胞变形严重;敌敌畏+AniHBr组随着AniHBr浓度升高,细胞形态学改变明显减轻 图 2 HUVECs的形态学观察图 |
|
|
有机磷农药中毒是机体强烈的应激反应过程,患者发生多器官功能障碍综合征[6]的同时会出现免疫功能低下[7]、炎性因子过度激活[8],导致血管内皮功能损伤,出现微循环障碍和全身炎症反应综合征[9-10],其中炎症反应为当前研究热点,值得注意的是,近年来已有不少研究发现炎症反应通常伴有氧化应激[11-12]。有机磷农药作为一种强氧化剂,可激活机体产生过量的活性氧(reactive oxygen species,ROS),ROS生成上调可以导致钙调节失衡、线粒体功能障碍,激活核因子-κB(nuclear-factor kappaB,NF-κB)信号通路并促进炎性因子(TNF-α、IL-1β和IL-6)的分泌,进而导致凋亡级联激活,促使细胞发生功能障碍[13]。这进一步提示有机磷农药中毒与炎症反应和氧化应激有密切联系。
AniHBr可通过抑制炎症因子释放、保护冠脉内皮糖萼、减少细胞凋亡,发挥保护冠脉内皮功能和改善微循环等作用[14-15]。此外,AniHBr还可减弱LPS诱导的炎症因子升高、线粒体功能障碍和氧化应激,抑制肾小管上皮细胞凋亡[16]。韦义萍等[17]研究也进一步证实,AniHBr对5-氟尿嘧啶损伤的血管内皮细胞具有保护作用。使用AniHBr与细胞共同孵育4 h后OD值和细胞活力无明显变化,说明在一定时间内,不同浓度AniHBr对HUVECs活性无明显抑制作用,可排除实验中AniHBr对细胞活力的影响。同时,笔者在AniHBr对敌敌畏损伤的内皮细胞活力影响的研究中发现,使用AniHBr处理细胞后,细胞活力和OD值随AniHBr浓度增加呈上升趋势,当AniHBr增加到一定浓度时,结果有统计学意义。提示AniHBr与敌敌畏损伤的内皮细胞活力之间存在剂量-反应关系,内皮细胞活力随着AniHBr浓度的增加而升高,表明AniHBr对内皮细胞具有保护作用且呈浓度依赖性。
以往的研究表明,敌百虫及对氧磷可刺激血管内皮细胞发生氧化应激和炎症反应,使细胞膜通透性增加,导致细胞损伤[18-19],而AniHBr作为一种M受体拮抗剂,可使ACh介导的α7烟碱型乙酰胆碱受体(α7nAChR)激活增加,从而激活胆碱能抗炎通路,抑制NF-κB信号通路激活,调节炎症因子的表达水平[20-21]。另有研究也证实山莨菪碱可完全阻断LPS作用下的HUVECs核提取液中NF-κB DNA的结合活性[22]。葛磊等[23]提出AniHBr通过影响NF-κB/IκB等信号通路减少炎性因子及ROS的产生,利于维护细胞氧化-抗氧化及促炎-抗炎细胞因子平衡,减轻细胞损伤。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Pohanka M. Diagnoses of pathological states based on acetylcholinesterase and butyrylcholinesterase[J]. Curr Med Chem, 2020, 27(18): 2994-3011. DOI:10.2174/0929867326666190130161202 |
| [2] | 詹峰, 宋维. 常见除草剂急性中毒: 共性与差异性[J]. 中华急诊医学杂志, 2020, 29(12): 1515-1519. DOI:10.3760/cma.j.issn.1671-0282.2020.12.003 |
| [3] | 李鹏, 刘立英, 周寿红, 等. 对氧磷对血管内皮细胞的损伤作用及机制探讨[J]. 中国动脉硬化杂志, 2007, 15: 666-670. DOI:10.3969/j.issn.1007-3949.2007.09.006 |
| [4] | 郭思宇, 张景媛, 吴嘉瑞, 等. 山莨菪碱治疗感染性休克的临床应用进展[J]. 中国医院用药评价与分析, 2019, 19(4): 389-392. DOI:10.14009/j.issn.1672-2124.2019.04.002 |
| [5] | Du XQ, Liu H, Yue YH, et al. Anisodamine hydrobromide protects glycocalyx and against the lipopolysaccharide-induced increases in microvascular endothelial layer permeability and nitric oxide production[J]. Cardiovasc Eng Technol, 2021, 12(1): 91-100. DOI:10.1007/s13239-020-00486-8 |
| [6] | 高艳霞, 王艺博, 李毅, 等. 急性百草枯中毒导致多器官损伤的临床观察[J]. 中华急诊医学杂志, 2020, 29(11): 1411-1416. DOI:10.3760/cma.j.issn.1671-0282.2020.11.006 |
| [7] | 张炉英, 陆元兰, 岑祥莹, 等. 敌草快免疫毒性研究进展[J]. 中华急诊医学杂志, 2021, 30(5): 646-650. DOI:10.3760/cma.j.issn.1671-0282.2021.05.027 |
| [8] | Ahmed MAE, El Morsy EM, Ahmed AAE. Protective effects of febuxostat against paraquat-induced lung toxicity in rats: Impact on RAGE/PI3K/Akt pathway and downstream inflammatory cascades[J]. Life Sci, 2019, 221: 56-64. DOI:10.1016/j.lfs.2019.02.007 |
| [9] | Vanova N, Pejchal J, Herman D, et al. Oxidative stress in organophosphate poisoning: role of standard antidotal therapy[J]. J Appl Toxicol, 2018, 38(8): 1058-1070. DOI:10.1002/jat.3605 |
| [10] | 急性敌草快中毒诊断与治疗专家共识组. 急性敌草快中毒诊断与治疗专家共识[J]. 中华急诊医学杂志, 2020, 29(10): 1282-1289. DOI:10.3760/cma.j.issn.1671-0282.2020.10.002 |
| [11] | Yang W, Liu W, Yu W, et al. Angptl2 deficiency attenuates paraquat (PQ)-induced lung injury in mice by altering inflammation, oxidative stress and fibrosis through NF-κB pathway[J]. Biochem Biophys Res Commun, 2018, 503(1): 94-101. DOI:10.1016/j.bbrc.2018.05.186 |
| [12] | Liu MW, Su MX, Zhang W, et al. Protective effect of Xuebijing injection on paraquat-induced pulmonary injury via down-regulating the expression of p38 MAPK in rats[J]. BMC Complement Altern Med, 2014, 14: 498. DOI:10.1186/1472-6882-14-498 |
| [13] | Choi SE, Park YS, Koh HC. NF-κB/p53-activated inflammatory response involves in diquat-induced mitochondrial dysfunction and apoptosis[J]. Environ Toxicol, 2018, 33(10): 1005-1018. DOI:10.1002/tox.22552 |
| [14] | 曾烨, 邱艳, 江文丽, 等. 氢溴酸山莨菪碱改善微循环障碍的机制研究进展[J]. 江苏大学学报(医学版), 2021, 31(1): 23-27. DOI:10.13312/j.issn.1671-7783.y200227 |
| [15] | 王福军, 杨军, 张健, 等. 氢溴酸山莨菪碱对心肺复苏术后冠脉内皮功能的保护作用机制[J]. 中国急救医学, 2021, 41: 60-65. DOI:10.3969/j.issn.1002-1949.2021.01.012 |
| [16] | Wan F, Du X, Liu H, et al. Protective effect of anisodamine hydrobromide on lipopolysaccharide-induced acute kidney injury[J]. Biosci Rep, 2020, 40(7): BSR20201812. |
| [17] | 韦义萍, 吴芳园, 高文, 等. 山莨菪碱对5-氟尿嘧啶诱导血管内皮细胞损伤的保护作用[J]. 广西医科大学学报, 2020, 37(8): 1429-1434. DOI:10.16190/j.cnki.45-1211/r.2020.08.006 |
| [18] | 李荣霏, 易高众, 郭鹏程, 等. 有机磷诱导HUVEC-12损伤的实验研究[J]. 中国实用医药, 2008, 3(23): 30-31. DOI:10.3969/j.issn.1673-7555.2008.23.015 |
| [19] | 李鹏, 尹雅玲, 张玉林, 等. 有机磷酸酯类化合物对机体的影响[J]. 安徽农业科学, 2008, 36(31): 13492-13493, 13501. DOI:10.13989/j.cnki.0517-6611.2008.31.151 |
| [20] | Zhao T, Li DJ, Liu C, et al. Beneficial effects of anisodamine in shock involved cholinergic anti-inflammatory pathway[J]. Front Pharmacol, 2011, 2: 23. DOI:10.3389/fphar.2011.00023 |
| [21] | Eisenkraft A, Falk A. Possible role for anisodamine in organophosphate poisoning[J]. Br J Pharmacol, 2016, 173(11): 1719-1727. DOI:10.1111/bph.13486 |
| [22] | Ruan QR, Zhan g WJ, Hufnagl P, et al. Anisodamine counteracts lipopolysaccharide-induced tissue factor and plasminogen activator inhibitor-1 expression in human endothelial cells: contribution of the NF-κB pathway[J]. J Vasc Res, 2001, 38(1): 13-19. DOI:10.1159/000051025 |
| [23] | 葛磊, 尢家騄, 李康华, 等. H2O2致体外培养动脉内皮细胞损伤及山莨菪碱保护[J]. 激光生物学报, 2009, 18(2): 166-171. DOI:10.3969/j.issn.1007-7146.2009.02.005 |
 2021, Vol. 30
2021, Vol. 30




