2. 郑州大学附属郑州中心医院呼吸内科, 郑州 450000
2. Department of Respiratory Medicine, Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou, 450000, Ch
呼吸机相关性肺炎(ventilator-associated pneumonia, VAP)是指原来无肺部感染的呼吸衰竭患者,在气管切开或气管插管行机械通气治疗48 h后,或拔管48 h内发生的肺部感染。VAP的发生与气管插管造成的气道黏膜损伤、气道分泌物增多、病原微生物入侵和增殖密切相关[1-2],患者免疫功能抑制也与VAP的发生密切相关[3]。泛素编辑蛋白A20是也称为肿瘤坏死因子-α诱导蛋白3(tumor necrosis factor-α-induced protein 3, TNFAIP3),通过下调核因子-κB(nuclear factor-κB, NF-κB)表达调控单核细胞功能,发挥免疫抑制作用[4],但有关A20对VAP患者单核细胞活性的调控作用罕见报道。因此,本研究检测VAP患者外周血及支气管肺泡灌洗液(bronchial alveolar lavage fluid, BALF)单核细胞中A20水平,并利用体外培养系统观察A20对VAP患者单核细胞活性的影响。
1 资料与方法 1.1 一般资料选择2019年2月至9月在郑州大学第一附属医院诊断为VAP的患者。VAP的诊断标准参考《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》[5]的标准,所有患者使用呼吸机辅助呼吸超过48 h,肺部影像学显示新出现或进展性的浸润影、实变影或磨玻璃影,加之一下3种临床症候中的2种或以上:(1)发热,体温>38 ℃;(2)脓性气道分泌物;(3)外周血白细胞计数>10×109/L或 < 4×109/L。符合以上标准的患者可进行临床诊断,在临床诊断的基础上,呼吸道分泌物经培养出现新的病原菌,可作为确定病原菌的依据。对于人工气道中培养出的定植菌(如:鲍曼溶血不动杆菌、铜绿假单胞菌等),将标本重新送检,并结合血液或其他体液标本培养结果综合评定其是否为致病菌[6]。排除标准:(1)年龄 < 18岁或>65岁;(2)合并慢性活动性病毒感染;(3)合并恶性肿瘤;(4)合并自身免疫性疾病;(5)正在接受免疫制剂或免疫调节治疗;(6)妊娠期妇女。选择同时期在郑州大学第一附属医院接受健康查体的志愿者作为健康对照。本研究方案已通过郑州大学第一附属医院伦理委员会批准[批准号:ZZUFCC(伦理)20170905-002],入组志愿者或其家属签署知情同意书。最终入组VAP患者24例(VAP组)和健康对照12例(对照组)。
1.2 主要试剂和仪器淋巴细胞分离液购自美国Sigma公司;CD14 MicroBeads和CD4 MicroBeads购自德国美天旎公司;A20小干扰RNA(small interfering RNA, siRNA)和对照siRNA双链体购自美国Santa Cruz公司;细胞活化鸡尾酒、抗CD14-FITC、抗CD4-FITC、抗干扰素-γ(interferon-γ, IFN-γ)-APC、抗白细胞介素-17(interleukin-17, IL-17)-PE和酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)检测试剂盒购自美国eBioscience公司;抗A20-PerCP、抗肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis inducing ligand, TRAIL)-PE、抗Fas配体(Fas ligand, FasL)-APC购自美国Abcam公司;乳酸脱氢酶(lactate dehydrogenase, LDH)细胞毒性检测试剂盒购自武汉碧云天公司。Transwell培养平板购自美国Corning公司;FACS Calibur流式细胞仪为美国BD公司产品;微孔读板仪为美国BioRad公司产品。
1.3 外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)的分离清晨空腹采集抗凝外周血30 mL,使用淋巴细胞分离液、采用密度梯度离心法分离PBMCs,冻存于液氮中备用。
1.4 BALF制备按前述方法制备BALF[6-7]。首先在灌洗肺段经活检孔注入利多卡因进行局部麻醉,将气管镜顶端紧密楔入感染部位亚段支气管开口处,快速注入37℃无菌生理盐水,共灌洗4~5次,每次50 mL。用100 mmHg负压吸引回收灌洗液,回收效率50 %~70 %。双层无菌纱布过滤灌洗液,转入无菌离心管中,4 ℃、1 000 r/min离心10 min,沉淀的细胞成分使用Hank’s液洗涤2次,调整细胞浓度至106个/mL。对所有入组VAP患者的感染部位均进行灌洗,对可耐受灌洗及发生单侧肺部感染的9例VAP患者的未感染部位肺部也进行灌洗,作为对照进行检测。
1.5 CD14+单核细胞和CD4+T细胞的纯化使用CD14 MicroBeads对PBMCs及BALF分选细胞中的CD14+单核细胞进行纯化。每107个细胞使用80 μL缓冲液重悬后加入20 μL CD14 MicroBeads,混匀后4 ℃孵育15 min,加入2 mL缓冲液洗涤,300 r/min离心10 min后弃上清,加入500 μL缓冲液重悬细胞。将分离柱置于MACS磁力分离架上,使用2 mL缓冲液冲洗分离柱,然后加入细胞悬液,收集穿过分离柱的细胞,并使用1 mL缓冲液洗涤2次,为CD14-细胞。将分离柱从磁力分离架上取下,加入2 mL缓冲液,使用注射器活塞快速将细胞推出,即为CD14+单核细胞。使用CD4 MicroBeads对CD14-细胞中的CD4+T细胞进行纯化。每107个细胞使用80 μL缓冲液重悬后加入20 μL CD4 MicroBeads,混匀后4 ℃孵育15 min,加入2 mL缓冲液洗涤,300 r/min离心10 min后弃上清,加入500 μL缓冲液重悬细胞。将分离柱置于MACS磁力分离架上,使用2 mL缓冲液冲洗分离柱,然后加入细胞悬液,使细胞穿过分离柱,使用1 mL缓冲液洗涤2次,将分离柱从磁力分离架上取下,加入2 mL缓冲液,使用注射器活塞快速将细胞推出,即为CD4+T细胞。
1.6 细胞转染将2 μL A20 siRNA或对照siRNA溶于100 μL siRNA转染培养液中,将2 μL siRNA转染试剂溶于100 μL siRNA转染培养液中,将上述两种溶液混合后室温静置30 min。使用siRNA转染培养液洗涤CD14+单核细胞,然后加入800 μL siRNA转染培养液和200 μL混合溶液,37 ℃、5 % CO2条件下培养6 h,洗涤细胞后加入DMEM培养液+20%胎牛血清继续培养42 h。
1.7 细胞培养(1)CD14+单核细胞与CD4+T细胞共培养:取2.5×104个转染后的CD14+单核细胞,与5×104个CD4+T细胞直接接触或间接接触共培养。直接接触共培养:CD14+单核细胞与CD4+T细胞直接混合,并加入1×脂多糖和抗CD3/CD28抗体。间接接触共培养:使用Transwell培养平板,CD14+单核细胞加入上层小室,并加入1×脂多糖,CD4+T细胞加入下层平板,并加入抗CD3/CD28抗体。上下层的细胞被孔径为0.4 μm的半透膜分隔,细胞无法通过,仅可溶性分子能够通过。在培养的最后6 h,向培养液中加入细胞活化鸡尾酒刺激细胞分子分泌,加入莫能霉素抑制高尔基体转运,培养48 h后收集细胞。(2)CD14+单核细胞与NCI-H889细胞共培养:取2.5×104个转染后的CD14+单核细胞,与105个NCI-H889细胞直接接触或间接接触共培养。直接接触共培养:CD14+单核细胞与NCI-H889细胞直接混合,并加入1×脂多糖。间接接触共培养:CD14+单核细胞加入上层小室,并加入1×脂多糖,NCI-H889细胞加入下层平板。培养48 h后收集上清。
1.8 流式细胞术检测CD14+单核细胞中A20、TRAIL、FasL和CD4+T细胞中IFN-γ和IL-17向细胞中加入抗CD14-FITC,室温避光孵育30 min进行表面染色,破膜固定后加入抗A20-PerCP或抗TRAIL-PE、抗FasL-APC,室温避光孵育30 min进行胞内染色。向细胞中加入抗CD4-FITC,破膜固定后加入抗IFN-γ-APC和抗IL-17-PE,室温避光孵育30 min进行胞内染色。FACS Calibur流式细胞仪进行检测,FlowJo V10软件进行分析。
1.9 ELISA法检测细胞因子(IFN-γ、TNF-α、IL-1β、IL-6、IL-8)和颗粒酶B水平抗体包被的平板中加入100 μL标准品或待测样本,贴纸覆盖后室温孵育2 h,洗板5次。加入200 μL结合抗体,贴纸覆盖后室温孵育2 h,洗板5次。加入100 μL底物缓冲液,室温避光孵育30 min,在加入100 μL终止液,室温避光孵育15 min,在450 nm波长读取OD值,绘制标准曲线,计算待测样本中细胞因子和颗粒酶B水平。
1.10 靶细胞死亡检测通过检测培养上清中LDH计算NCI-H889细胞的死亡比例。应用LDH细胞毒性检测试剂盒检测上清中LDH水平,以NCI-H889细胞上清中LDH水平作为“低水平LDH对照”,以Triton X-100处理的NCI-H889细胞上清中LDH水平作为“高水平LDH对照”。按以下公式计算靶细胞死亡比例:(样本LDH水平-低水平LDH对照)/(高水平LDH对照-低水平LDH对照)×100 %[7]。
1.11 统计学方法使用SPSS21.0统计软件进行数据分析。首先进行正态性检测,所有计量资料均符合正态分布,以均数±标准差(Mean±SD)表示,使用成组t检验进行两组间数据比较,使用One-Way ANOVA和SNK-q检验进行多组间数据比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料VAP组男14例,女10例,年龄(51.4±13.9)岁,对照组男7例,女5例,年龄(48.9±14.1)岁,两组差异无统计学意义(P>0.05)。VAP组中,单纯气管插管18例,气管插管后气管切开6例。24例VAP患者的人工气道分泌物中,6例患者未培养出病原菌,18例患者标本中培养出致病病原菌,其中15例为单一病原菌感染(肺炎克雷伯杆菌5例,鲍曼不动溶血杆菌4例,铜绿假单胞菌3例,金黄色葡萄球菌1例,大肠埃希菌1例),3例患者为肺炎克雷伯杆菌和鲍曼不动溶血杆菌混合感染。
2.2 VAP患者CD14+单核细胞中A20水平升高对照组和VAP组外周血CD14+单核细胞中A20阳性细胞比例和A20平均荧光强度(mean fluorescence intensity, MFI)分析的典型流式图见图 1。VAP组外周血CD14+A20+细胞比例高于对照组[(62.61±15.33) % vs (47.13±11.82) %,t=3.064,P=0.004],A20 MFI亦高于对照组[(227.9±64.18) vs (178.2±58.62),t=2.251,P=0.031]。感染部位BALF中CD14+A20+细胞比例高于未感染部位[(66.14±19.62) % vs (52.52±13.71) %,t=1.901,P=0.033],A20 MFI亦高于未感染部位[(268.0±72.56) vs (197.4±60.01),t=2.597,P=0.014]。但CD14+A20+细胞比例和A20 MFI在不同病原菌感染的VAP患者之间的差异无统计学意义(P>0.05)。
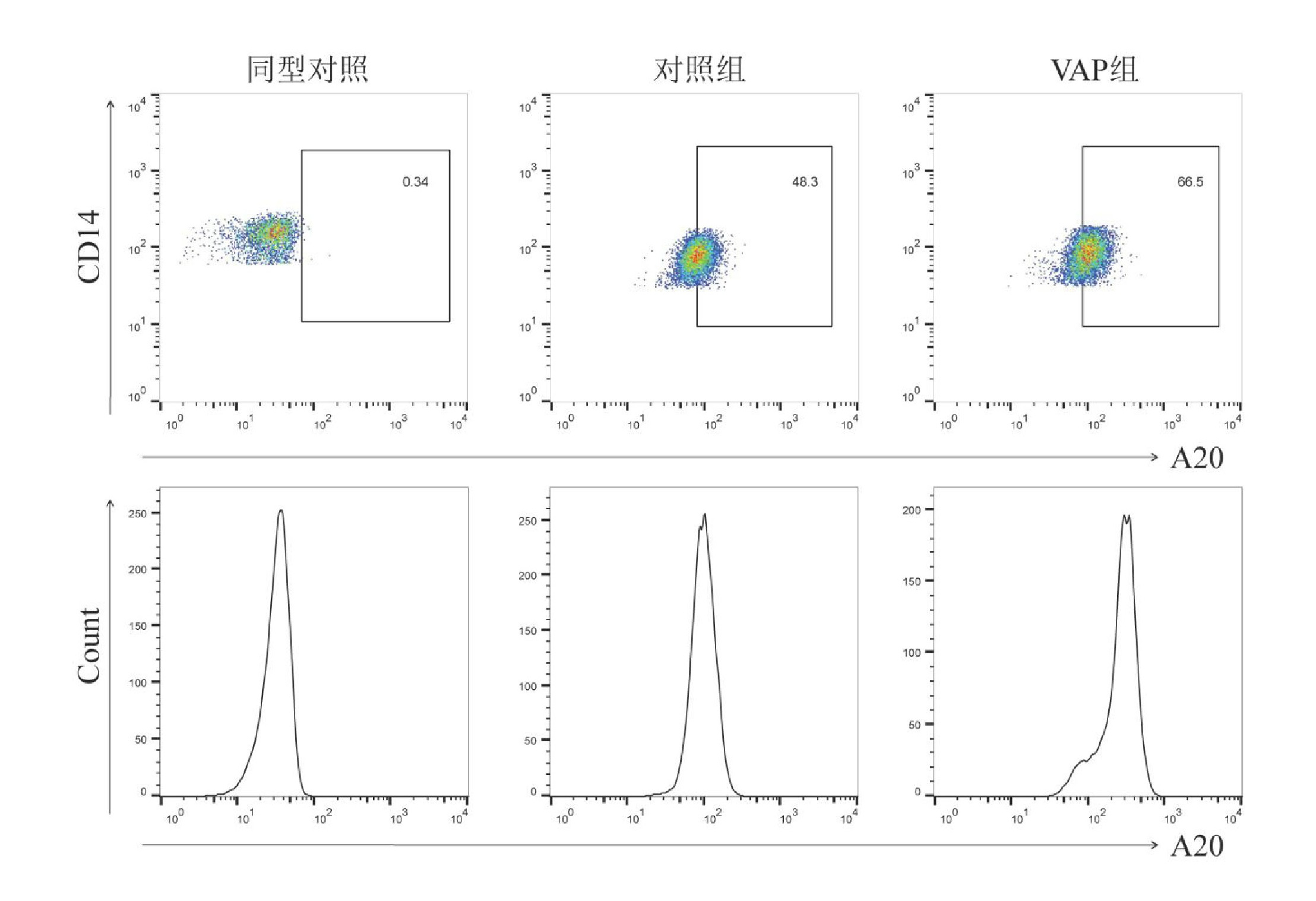
|
| 图 1 对照组和VAP组外周血CD14+单核细胞中A20阳性细胞和A20 MFI分析的典型流式图 Fig 1 Representative flow cytometry analysis for A20 positive cells and A20 mean fluorescence intensity in control group and VAP group |
|
|
未转染、对照siRNA转染及A20 siRNA转染CD14+单核细胞与自体CD4+T细胞间接/直接接触共培养后,CD4+T细胞分泌IFN-γ和IL-17的典型流式图见图 2。在间接接触共培养中,外周血和BALF中纯化的CD14+单核细胞诱导CD4+T细胞分泌IFN-γ的细胞比例和分泌IL-17的细胞比例在未转染、对照siRNA转染及A20 siRNA转染中的差异无统计学意义(P>0.05,表 1)。在直接接触共培养中,A20 siRNA转染的CD14+单核细胞诱导CD4+T细胞分泌IFN-γ的细胞比例和分泌IL-17的细胞比例均高于未转染和对照siRNA转染(P < 0.01,表 1)。
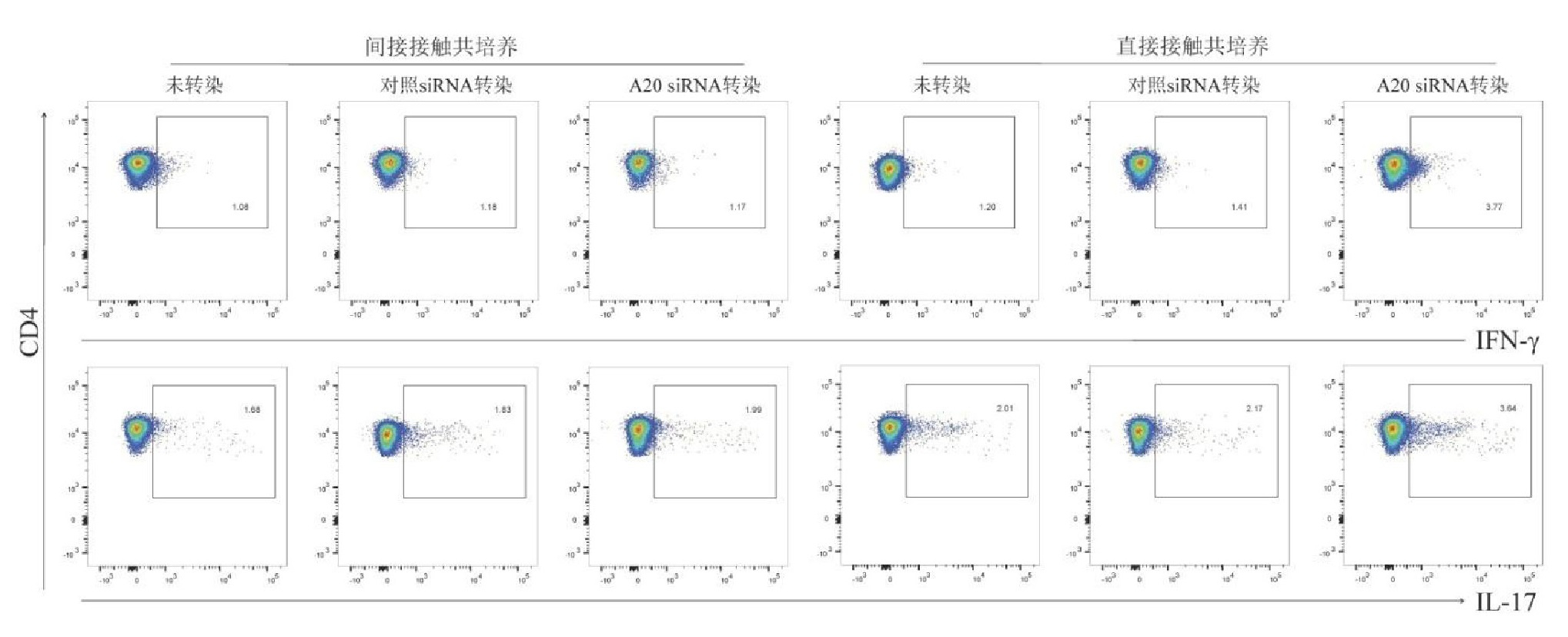
|
| 图 2 未转染、对照siRNA转染及A20 siRNA转染CD14+单核细胞与自体CD4+T细胞间接/直接接触共培养后CD4+T细胞分泌IFN-γ和IL-17的典型流式图 Fig 2 Representative flow cytometry analysis for IFN-γ- and IL-17-secreting CD4+ T cells in direct/indirect contact co-culture system of CD14+ monocytes and autologous CD4+ T cells among untrasnfection, control siRNA transfection, and A20 siRNA transfection |
|
|
| 项目 | 未转染 | 对照siRNA转染 | A20 siRNA转染 | F值 | P值 |
| 间接接触 | |||||
| 外周血CD4+IFN-γ+比例 | 1.18±0.24 | 1.21±0.17 | 1.19±0.20 | 0.133 | 0.876 |
| 外周血CD4+IL-17+比例 | 2.01±0.38 | 1.97±0.29 | 1.99±0.32 | 0.087 | 0.917 |
| BALF中CD4+IFN-γ+比例 | 1.27±0.33 | 1.34±0.29 | 1.36±0.34 | 0.521 | 0.596 |
| BALF中CD4+ IL-17+比例 | 1.88±0.26 | 1.95±0.34 | 2.02±0.41 | 1.004 | 0.371 |
| 直接接触 | |||||
| 外周血CD4+IFN-γ+比例 | 1.44±0.37 | 1.47±0.41 | 3.29±0.77 a | 90.02 | < 0.0001 |
| 外周血CD4+IL-17+比例 | 2.16±0.61 | 2.24±0.58 | 4.01±1.20 a | 36.65 | < 0.0001 |
| BALF中CD4+IFN-γ+比例 | 1.48±0.38 | 1.50±0.53 | 3.31±0.89 a | 65.31 | < 0.0001 |
| BALF中CD4+ IL-17+比例 | 2.01±0.73 | 2.13±0.62 | 3.18±1.05 a | 14.77 | < 0.0001 |
| 注:与未转染、对照siRNA转染比较,a P < 0.05 | |||||
间接接触和直接接触共培养中,A20 siRNA转染VAP患者外周血和BALF中纯化的CD14+单核细胞后,其诱导NCI-H889细胞死亡的比例高于未转染和对照siRNA转染(P < 0.05,表 2和表 3),但靶细胞死亡比例在间接接触共培养和直接接触共培养中的差异无统计学意义(P>0.05,表 2和表 3)。上清中TNF-α、IL-6和颗粒酶B的水平亦高于未转染和对照siRNA转染(P < 0.05,表 2和表 3),而上清中IFN-γ、IL-1β和IL-8的水平在未转染、对照siRNA转染及A20 siRNA转染中的差异无统计学意义(P>0.05,表 2和表 3)。未转染、对照siRNA转染及A20 siRNA转染CD14+单核细胞中TRAIL和FasL MFI分析的典型流式图见图 3。A20 siRNA转染后CD14+单核细胞中TRAIL MFI高于未转染和对照siRNA转染(P < 0.05,表 2和表 3),而FasL MFI在未转染、对照siRNA转染及A20 siRNA转染中的差异无统计学意义(P>0.05,表 2和表 3)。
| 项目 | 未转染 | 对照siRNA转染 | A20 siRNA转染 | F值 | P值 |
| 间接接触 | |||||
| 靶细胞死亡比例(%) | 11.76±3.88 | 10.82±3.04 | 19.29±5.27 a | 29.80 | < 0.0001 |
| IFN-γ (pg/mL) | 23.12±4.88 | 21.22±7.58 | 24.39±9.04 | 1.124 | 0.331 |
| TNF-α (pg/mL) | 108.9±38.20 | 100.3±35.47 | 212.1±78.37 a | 31.46 | < 0.0001 |
| IL-1β (pg/mL) | 71.19±13.94 | 77.63±20.80 | 78.12±13.45 | 1.333 | 0.270 |
| IL-6 (pg/mL) | 84.29±24.68 | 88.35±15.13 | 138.5±17.29 a | 57.74 | < 0.0001 |
| IL-8 (pg/mL) | 92.71±17.67 | 93.17±19.04 | 88.04±19.95 | 0.541 | 0.585 |
| 颗粒酶B (ng/mL) | 2.84±0.49 | 3.17±0.47 | 5.21±0.94 a | 88.24 | < 0.0001 |
| TRAIL MFI | 161.1±24.05 | 164.2±32.55 | 281.1±59.36 a | 65.27 | < 0.0001 |
| FasL MFI | 125.5±30.97 | 126.8±22.54 | 122.2±31.78 | 0.163 | 0.850 |
| 直接接触 | |||||
| 靶细胞死亡比例(%) | 12.32±2.75 | 13.06±3.38 | 20.64±5.89 a | 28.44 | < 0.0001 |
| IFN-γ (pg/mL) | 22.28±7.32 | 19.74±6.67 | 21.01±6.24 | 0.848 | 0.433 |
| TNF-α (pg/mL) | 123.4±44.76 | 129.8±43.66 | 196.3±60.73 a | 15.44 | < 0.0001 |
| IL-1β (pg/mL) | 73.38±29.77 | 73.88±26.74 | 76.43±28.70 | 0.079 | 0.924 |
| IL-6 (pg/mL) | 88.22±18.87 | 94.36±24.57 | 123.1±33.51 a | 11.99 | < 0.0001 |
| IL-8 (pg/mL) | 86.31±23.71 | 86.83±22.68 | 82.33±23.17 | 0.270 | 0.764 |
| 颗粒酶B (ng/mL) | 3.46±0.71 | 3.92±0.82 | 5.15±1.59 a | 14.84 | < 0.0001 |
| TRAIL MFI | 152.3±32.83 | 152.6±27.96 | 298.1±37.18 a | 157.0 | < 0.0001 |
| FasL MFI | 126.7±25.09 | 132.4±38.97 | 123.5±33.93 | 0.444 | 0.644 |
| 注:与未转染、对照siRNA转染比较,a P < 0.05 |
| 项目 | 未转染 | 对照siRNA转染 | A20 siRNA转染 | F值 | P值 |
| 间接接触 | |||||
| 靶细胞死亡比例(%) | 10.08±2.47 | 12.41±2.51 | 18.54±6.62 a | 24.45 | < 0.0001 |
| IFN-γ (pg/mL) | 17.84±6.87 | 20.17±4.57 | 19.11±6.45 | 0.893 | 0.414 |
| TNF-α (pg/mL) | 102.3±45.83 | 107.4±36.72 | 143.9±42.48 a | 7.056 | 0.001 |
| IL-1β (pg/mL) | 65.54±14.19 | 66.43±17.53 | 69.28±17.42 | 0.338 | 0.714 |
| IL-6 (pg/mL) | 96.93±10.51 | 98.79±26.42 | 120.8±38.76 a | 5.492 | 0.006 |
| IL-8 (pg/mL) | 87.67±10.47 | 93.75±19.08 | 91.92±19.70 | 0.813 | 0.448 |
| 颗粒酶B (ng/mL) | 2.88±0.84 | 2.73±0.85 | 5.98±1.12 a | 90.34 | < 0.0001 |
| TRAIL MFI | 191.0±17.23 | 199.9±28.25 | 315.6±32.80 a | 160.3 | < 0.0001 |
| FasL MFI | 118.4±28.25 | 123.2±32.78 | 125.3±22.95 | 0.375 | 0.688 |
| 直接接触 | |||||
| 靶细胞死亡比例(%) | 10.38±1.74 | 11.16±3.54 | 21.39±6.07 a | 51.86 | < 0.0001 |
| IFN-γ (pg/mL) | 21.64±7.18 | 23.97±5.19 | 23.16±4.48 | 1.022 | 0.365 |
| TNF-α (pg/mL) | 111.4±25.87 | 110.3±28.09 | 152.8±50.69 a | 10.49 | 0.0001 |
| IL-1β (pg/mL) | 70.45±10.87 | 76.64±17.78 | 77.89±12.97 | 1.897 | 0.158 |
| IL-6 (pg/mL) | 93.11±19.56 | 97.46±27.37 | 158.0±39.81 a | 34.87 | < 0.0001 |
| IL-8 (pg/mL) | 97.25±26.73 | 95.69±20.55 | 99.61±27.13 | 0.150 | 0861 |
| 颗粒酶B (ng/mL) | 3.37±0.44 | 3.35±0.89 | 5.98±1.34 a | 59.24 | < 0.0001 |
| TRAIL MFI | 196.7±42.03 | 184.9±27.58 | 288.5±39.13 a | 57.07 | < 0.0001 |
| FasL MFI | 129.5±28.20 | 121.1±27.92 | 122.0±36.05 | 0.533 | 0.589 |
| 注:与未转染、对照siRNA转染比较,a P < 0.05 | |||||
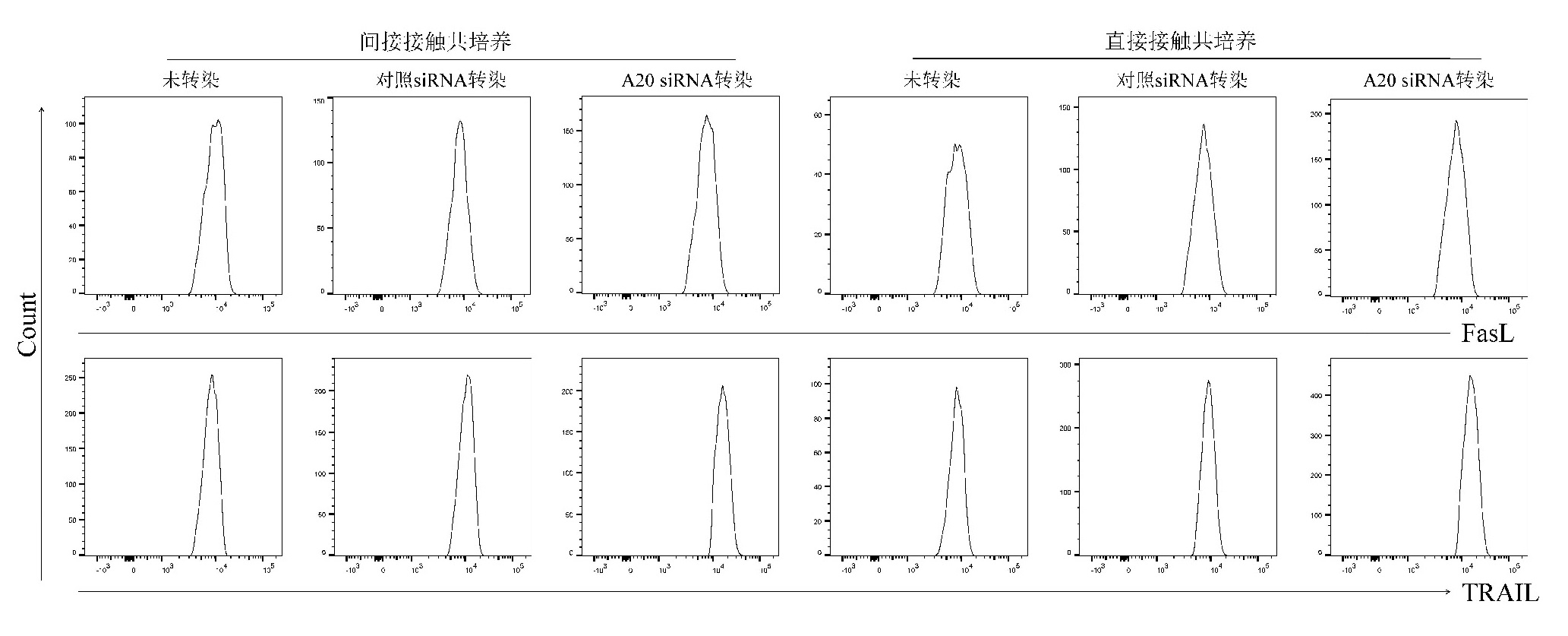
|
| 图 3 未转染、对照siRNA转染及A20 siRNA转染CD14+单核细胞与NCI-H889细胞间接/直接接触共培养后FasL和TRAIL MFI分析的典型流式图 Fig 3 Representative flow cytometry analysis for FasL and TRAIL MFI in direct/indirect contact co-culture system of CD14+ monocytes and NCI-H889 cells among untrasnfection, control siRNA transfection, and A20 siRNA transfection |
|
|
A20在多种感染性疾病中均发挥重要的免疫抑制作用,但A20在感染性疾病中表达变化的调控尚未完全阐明。在急性病毒感染中,呼吸道合胞病毒感染诱导A20水平降低,促进机体免疫应答,诱导病毒感染细胞凋亡,抑制病毒增殖[8]。相反,甲型流感病毒NS1蛋白则可诱导A20水平升高,通过抑制干扰素介导的抗病毒应答,促进病毒复制[9]。在慢性病毒感染中,乙型肝炎病毒和丙型肝炎病毒感染均可诱导A20水平升高,抑制单核细胞、树突状细胞功能,促进感染慢性化[10-11]。相反,获得性免疫缺陷综合征患者经高效抗逆转录病毒治疗后A20水平升高,促进肠道内皮屏障功能恢复[12]。在细菌感染性疾病中,A20可抑制牙龈卟啉单胞菌感染所致的牙龈局部IL-6和IL-8的分泌,降低牙龈角质形成细胞对凋亡的敏感性[13]。葡萄球菌M蛋白可诱导单核巨噬细胞中A20表达升高,抑制肺组织炎症应答[14]。因此,A20的表达可能受到病原体、感染部位、感染状态及机体免疫应答等多种因素的调控。本研究发现,VAP患者外周血和肺部感染部位CD14+单核细胞中A20水平升高,但在不同感染的病原菌之间的差异无统计学意义,提示VAP患者中A20表达升高可能与患者免疫功能抑制有关,但A20对VAP患者单核细胞活性的影响则有待进一步研究。
CD14+单核细胞是固有免疫应答中的重要成员。一方面,CD14+单核细胞可发挥抗原提呈和共刺激的功能,诱导CD4+T细胞活化,发挥连接固有免疫和适应性免疫的桥梁作用[15]。另一方面,CD14+单核细胞还可以通过分泌多种细胞因子、细胞毒性分子以及表面的细胞毒性受体,诱导靶细胞死亡,发挥细胞毒性作用[16]。本研究发现,抑制A20表达可促进VAP患者CD14+单核细胞对自体CD4+T细胞的直接活化作用,主要表现为直接接触共培养中Th1型细胞(CD4+IFN-γ+)和Th17型细胞(CD4+IL-17+)的增加。而在间接接触共培养中,抑制A20表达对CD14+单核细胞诱导CD4+T活化的作用则无显著影响。这提示CD14+单核细胞需要通过细胞间的直接接触发挥抗原提呈和共刺激作用,这与既往的研究结果一致[17-18],而VAP患者中高表达的A20则可抑制CD14+单核细胞诱导CD4+T细胞活化的功能。同时,抑制A20表达可促进VAP患者CD14+单核细胞的毒性作用,主要表现为诱导靶细胞死亡的增加,这一过程同时伴有TNF-α、IL-6和颗粒酶B分泌增加,细胞表面TRAIL水平升高,提示A20可能主要影响单核细胞中上述分子的表达。但是,CD14+单核细胞诱导的靶细胞死亡在直接接触和间接接触共培养之间的差异无统计学意义,提示CD14+单核细胞发挥细胞毒性并不依赖细胞间直接接触,虽然抑制A20可诱导CD14+单核细胞表面TRAIL水平的升高,但TRAIL发挥作用需要细胞间直接接触,因此,VAP患者中CD14+单核细胞主要通过分泌可溶型因子和毒性分子发挥细胞毒性作用,这与既往在川崎病中的研究结果一致[16]。但本研究仅进行了体外实验,且入组病例数有限,还需要体内实验对A20在VAP中的调控机制进行研究。
综上所述,VAP患者单核细胞中A20水平升高,可能发挥抑制单核细胞活性的作用,并可能成为VAP潜在的治疗靶点。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 贾凌, 陈娇, 杨敬辉, 等. 不同类型气管导管对呼吸机相关性肺炎的影响[J]. 中华急诊医学杂志, 2019, 28(10): 1292-1295. DOI:10.3760/cma.j.issn.1671-0282.2019.10.022 |
| [2] | Arumugam SK, Mudali I, Strandvik G, et al. Risk factors for ventilator-associated pneumonia in trauma patients: a descriptive analysis[J]. World J Emerg Med, 2018, 9(3): 203-210. DOI:10.5847/wjem.j.1920-8642.2018.03.007 |
| [3] | Keane S, Martin-Loeches I. Host-pathogen interaction during mechanical ventilation: systemic or compartmentalized response?[J]. Crit Care, 2019, 23(suppl 1): 134. DOI:10.1186/s13054-019-2410-0 |
| [4] | Qin M, Luo Y, Lu S, et al. Ginsenoside F1 ameliorates endothelial cell inflammatory injury and prevents atherosclerosis in mice through A20-mediated suppression of NF-κB signaling[J]. Front Pharmacol, 2017, 8: 953. DOI:10.3389/fphar.2017.00953 |
| [5] | 中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI:10.3760/cma.j.issn.1001-0939.2018.04.006 |
| [6] | 王红民, 张小红, 叶立群, 等. 白细胞介素-35调控CD4+CD25+CD127 dim/-调节性T细胞在呼吸机相关性肺炎发病中的作用[J]. 中华微生物学和免疫学杂志, 2017, 37(9): 674-681. DOI:10.3760/cma.j.issn.0254-5101.2017.09.005 |
| [7] | 张小红, 王红民, 靳莉, 等. 白细胞介素7对非小细胞肺癌患者CD8+T细胞抗肿瘤活性的影响[J]. 中华医学杂志, 2018, 98(30): 2429-2433. DOI:10.3760/cma.j.issn.0376-2491.2018.30.012 |
| [8] | Martín-Vicente M, González-Sanz R, Cuesta I, et al. Downregulation of A20 expression increases the immune response and apoptosis and reduces virus production in cells infected by the human respiratory syncytial virus[J]. Vaccines (Basel), 2020, 8(1): E100. DOI:10.3390/vaccines8010100 |
| [9] | Feng WJ, Sun XN, Shi N, et al. Influenza a virus NS1 protein induced A20 contributes to viral replication by suppressing interferon-induced antiviral response[J]. Biochem Biophys Res Commun, 2017, 482(4): 1107-1113. DOI:10.1016/j.bbrc.2016.11.166 |
| [10] | Fan YC, Zhang YY, Sun YY, et al. Altered expression of A20 gene in peripheral blood mononuclear cells is associated with the progression of chronic hepatitis B virus infection[J]. Oncotarget, 2016, 7(42): 68821-68832. DOI:10.18632/oncotarget.11993 |
| [11] | Lee J, Chan ST, Kim JY, et al. Hepatitis C virus induces the ubiquitin-editing enzyme A20 via depletion of the transcription factor upstream stimulatory factor 1 to support its replication[J]. mBio, 2019, 10(4): e01660-e01619. DOI:10.1128/mBio.01660-19 |
| [12] | Chitre AS, Kattah MG, Rosli YY, et al. A20 upregulation during treated HIV disease is associated with intestinal epithelial cell recovery and function[J]. PLoS Pathog, 2018, 14(3): e1006806. DOI:10.1371/journal.ppat.1006806 |
| [13] | Li YJ, Mooney EC, Xia XJ, et al. A20 restricts inflammatory response and desensitizes gingival keratinocytes to apoptosis[J]. Front Immunol, 2020, 11: 365. DOI:10.3389/fimmu.2020.00365 |
| [14] | Ma CQ, Gao X, Wu SH, et al. M protein of group a Streptococcus plays an essential role in inducing high expression of A20 in macrophages resulting in the downregulation of inflammatory response in lung tissue[J]. Front Cell Infect Microbiol, 2018, 8: 131. DOI:10.3389/fcimb.2018.00131 |
| [15] | Dhanda AD, Williams EL, Yates E, et al. Intermediate monocytes in acute alcoholic hepatitis are functionally activated and induce IL-17 expression in CD4+T cells[J]. J Immunol, 2019, 203(12): 3190-3198. DOI:10.4049/jimmunol.1800742 |
| [16] | Xing HJ, Tian G. Increased Interleukin-35 suppresses peripheral CD14+ monocytes function in patients with Kawasaki disease[J]. BMC Immunol, 2020, 21(1): 17. DOI:10.1186/s12865-020-00348-x |
| [17] | Liu TM, Wang H, Zhang DN, et al. Transcription factor MafB suppresses type I interferon production by CD14+ monocytes in patients with chronic hepatitis C[J]. Front Microbiol, 2019, 10: 1814. DOI:10.3389/fmicb.2019.01814 |
| [18] | Li S, Wang Z, Zhang G, et al. Interleukin-7 promotes lung-resident CD14+monocytes activity in patients with lung squamous carcinoma[J]. Int Immunopharmacol, 2019, 67: 202-210. DOI:10.1016/j.intimp.2018.12.022 |
 2021, Vol. 30
2021, Vol. 30




