2 浙江省台州市第一人民医院EICU 台州 318020
缺血-再灌注损伤是临床较常见的严重状况,特别是随着交通事故、高空作业坠落以及自然灾害等意外发生的增多,缺血-再灌注损伤的发生率越来越高[1-2]。据统计,缺血-再灌注损伤引起的死亡人数约占所有创伤引起死亡人数的40%左右[3]。肝脏作为机体质量要消化器官和免疫器官之一,极易在缺血-再灌注损伤过程中受到损伤,进而导致多器官功能障碍综合征的发生[4-5]。因此,迫切需要进一步研究肝缺血-再灌注损伤的相关机制和防治措施。已有研究表明[6-7],炎症是肝缺血-再灌注损伤的重要病理生理机制之一。研究表明,NF-κB信号通路作为机体质量要的炎症相关信号通路,被抑制后可有效降低炎症因子表达,减轻肝损伤[8]。褪黑激素(melatonin, MT)作为一种神经内分泌性激素具备抗氧化、抗肿瘤以及免疫调节等多种作用。外源性褪黑激素可显著改善肝缺血-再灌注损伤大鼠的肝脏组织形态和功能,具有良好的肝脏保护作用[9-10],但其作用的机制尚不完全清楚。因此,本研究拟从NF-κB信号通路出发,探讨外源性褪黑激素保护缺血-再灌注损伤肝损害的作用机制。
1 材料与方法 1.1 实验动物及分组自上海西普尔-必凯实验动物有限公司购买36只SPF级SD雄性大鼠,许可证号:SCXK(沪)2013-0016。将该36只雄性大鼠按照随机数表法随机分为假手术组、模型组和褪黑激素组,每组12只。所有大鼠饲养于实验动物中心,动物房温度控制在20~25℃,相对湿度维持在55%~65%,昼夜12 h,允许其自由饮水。分笼适应性饲养一周后进行造模,造模前各组大鼠均禁食不禁水12 h,所有动物方案均符合动物伦理学。
1.2 模型构建参照参考文献[11]制备缺血-再灌注损伤模型,方法为:首先,将5%戊巴比妥钠溶液经腹腔注射至大鼠体内进行麻醉,注射剂量为30 mg/kg;麻醉成功后,先采用夹钳将大鼠双侧股骨钳断,制成双侧股骨闭合骨折;然后,备皮、消毒,暴露双侧股动脉和左侧股静脉,将第一根导管一端插入左侧股动脉,另一端与监护仪连接以观察血压情况;将第二根导管一端插入右侧股动脉以进行放血;将第三根导管插入左侧股静脉以用于液体复苏;所有导管置入完成后观察大鼠身体状态,待状态平稳后自右侧股动脉导管缓慢放血,在10 min内使大鼠平均动脉压降至40 mmHg并维持1.5 h;最后,将放出的血液以及放血量2倍的林格式溶液自左侧股静脉在30 min内输入大鼠体内,缝合伤口,复苏。
1.3 干预方法假手术组仅分离双侧股动脉和左侧股静脉,不造成骨折和失血休克,术中经尾静脉注射1 mL生理盐水溶液;模型组按照上述方法制备模型,于放血休克90 min时经尾静脉注射1 mL生理盐水溶液;褪黑激素组按照上述方法制备模型,于放血休克90 min时经尾静脉注射1 mg[12]褪黑激素。于干预后24 h采用脊椎脱臼法处死所有大鼠并取材。
1.4 取材将5%戊巴比妥钠溶液经腹腔注射至大鼠体内进行麻醉,注射剂量为30 mg/kg;麻醉成功后,先采用一次性抗凝管采集每只大鼠腹主动脉血,然后每组随机选取6只大鼠采用灌注取材,自心脏注入4%多聚甲醛溶液进行灌注固定,然后取肝脏组织浸泡于4%多聚甲醛溶液中48 h进行固定;每组剩余6只大鼠采用直接取材,取肝脏组织放入超低温冰箱中保存。
1.5 试剂褪黑激素(Sigma,美国);抗体:IL-1β一抗(abcam,美国)、TNF-α一抗(abcam,美国)、NF-κB一抗(abcam,美国)、二抗(abcam,美国);HE染色试剂盒(碧云天,杭州);ELISA试剂盒:IL-1β(酶免公司,江苏)、TNF-α(酶免公司,江苏);Western blot检测试剂盒(abcam,美国);qPCR逆转录试剂盒(康为世纪生物科技公司,北京)。
1.6 检测方法 1.6.1 HE染色将包埋的石蜡组织切成5μm厚的组织切片,然后依次放入二甲苯溶液和梯度酒精中进行常规脱蜡,直至入水。按照HE染色试剂盒说明书进行操作,依次将标本浸入苏木精中染色,乙醇分化以及二甲苯透明,最后封片。
1.6.2 免疫组织化学将包埋的石蜡组织切成5μm厚的组织切片,然后依次放入二甲苯溶液和梯度酒精中进行常规脱蜡,直至入水,然后浸入枸橼酸缓冲液中充分进行抗原修复。PBS漂洗3次滴加内源性过氧化物酶阻断剂并反应10 min,PBS漂洗3次,滴加山羊血清封闭20 min后分别加入IL-1β一抗(1:500)、NF-κB一抗(1:300)和TNF-α一抗(1:500),放入4℃冰箱孵育中过夜;次日,PBS漂洗三次后滴加二抗溶液反应10 min,充分漂洗后加入链真菌抗生物素-过氧化物酶溶液反应10 min,滴加DAB进行显色,再用苏木精复染细胞核,中性树脂封片并观察表达。
1.6.3 Western blot取100 mg新鲜肝脏组织样品进行研磨,加入裂解液反应,提取总蛋白;吸取适量样品的上清液加入样品孔行SDS-PAGE的电泳和转膜,于摇床上振荡1.5~2 h封闭,检测抗原抗体反应,ECL化学发光仪显影电泳条带,用chemi capture软件,拍摄类型选择化学光,然后将膜移至黑色托盘正中间,放入仪器,采集图像。
1.6.4 ELISA采集每只大鼠的腹主动脉血后,将抗凝管放入离心机中以3500 r/min离心15 min,根据ELISA检测试剂盒操作说明书的要求逐步进行检测。最后,应用酶标仪在450 nm波长条件下测各孔的吸光值。
1.6.5 qPCR大鼠处死后,取肝脏组织迅速放入研钵中,液氮冷冻后充分研磨,用Trizol试剂提取总RNA,加入等体积异丙醇后振荡混匀,离心10 min,收集沉淀。75%乙醇清洗沉淀并风干后,用DEPC水溶解,根据转录试剂盒将RNA逆转录为cDNA。采用20 μL反应体系,在扩增仪中进行扩增,反应条件为预变性94℃ 10 min,变性94℃ 15 s、退火60℃ 15s,循环35次。计算各组大鼠海马组织NF-κB mRNA和IκB mRNA的相对表达水平。引物序列见表 1。
| 名称 | 引物序列 |
| NF-κB | 上游引物:5,AACAAAATGCCCCACGGTTA 3, |
| 下游引物:5,GGGACGATGCAATGGACTGT 3, | |
| IκB | 上游引物:5,GGGAGAAGAGCGACCCACAC 3, |
| 下游引物:5,GTAACACACTTAGAAGCCAGCAG 3, | |
| GADPH | 上游引物:5,ACGGCAAGTTCAACGGCACAG 3, |
| 下游引物:5,GAAGACGCCAGTAGACTCCACGAC 3, |
采用SPSS 24.0统计学软件进行统计分析,以均数±标准差(mean±SD)表示,符合正态分布的采用单因素方差分析, 不符合正态分布采用非参数检验比较,以P<0.05表示差异有统计学意义。
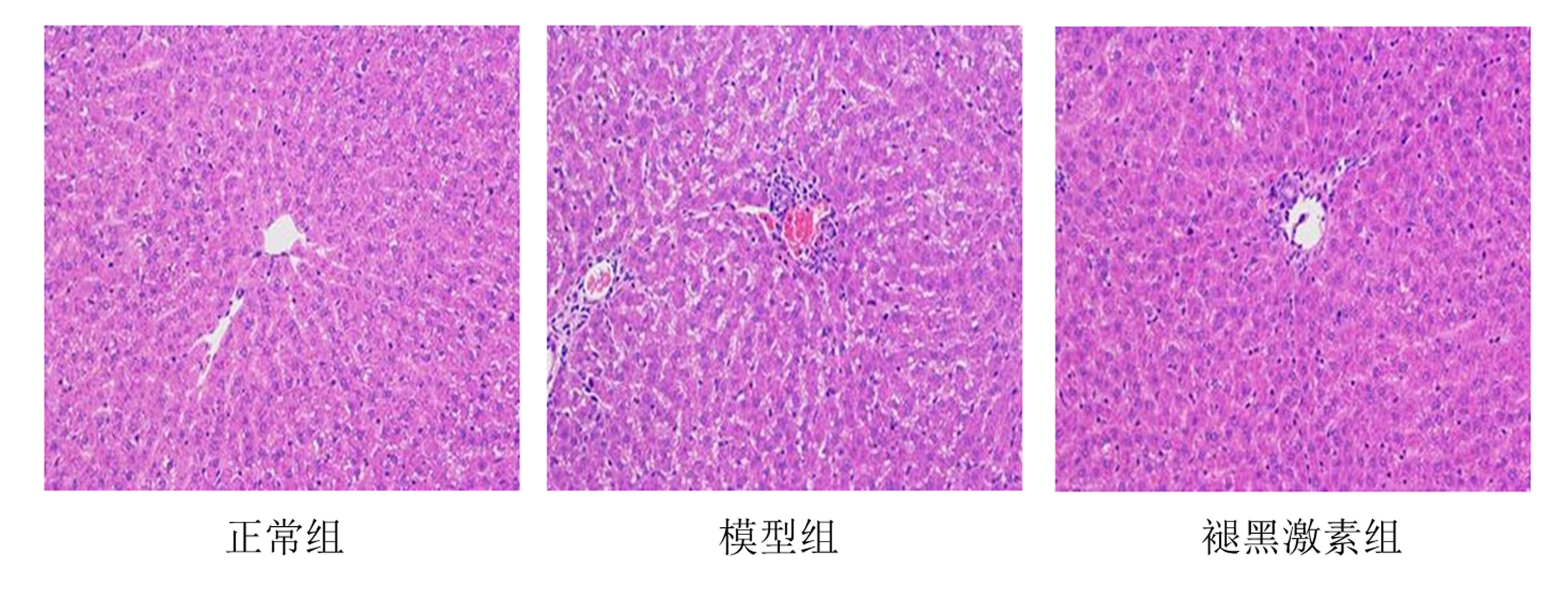
2 结果 2.1 HE染色观察外源性褪黑激素对缺血-再灌注损伤大鼠肝脏病理学改变的影响由图 1可见,假手术组肝脏组织结构完整,肝小叶形态及结构未见明显异常,干细胞形态正常,排列有序,细胞核染色清晰可见,未见明显炎细胞浸润及破坏;模型组肝脏组织可见充血改变,肝小叶形态及结构改变,肝细胞受损,排列紊乱,部分肝细胞细胞核裂解,可见明显的炎性浸润和破坏改变;褪黑激素组肝组织可见部分损伤,肝小叶形态及结构发生部分改变,部分干细胞受损,可见轻度炎性浸润,病理改变较模型组有明显改善。
|
| 图 1 HE染色观察3组大鼠肝脏的组织形态(×200) |
|
|
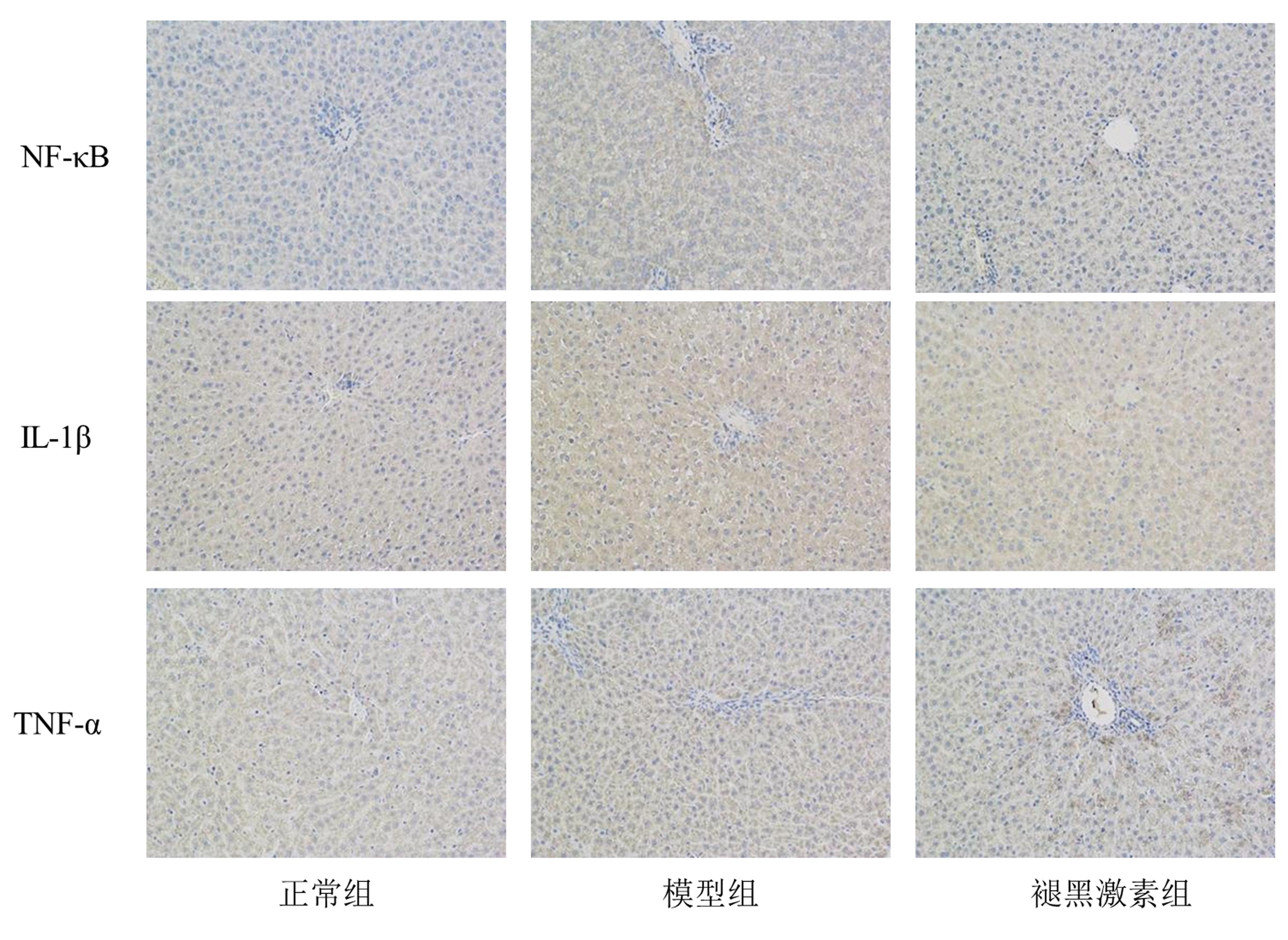
由图 2可见,IL-1β、NF-κB、TNF-α阳性表达呈棕褐色,各组均有不同程度的阳性表达,假手术组阳性表达较少,模型组阳性表达较多;由表 2可见,模型组IL-1β、NF-κB、TNF-α阳性表达显著多于假手术组(P < 0.05),褪黑激素组阳性表达均显著少于模型组(P < 0.05)。
|
| 图 2 免疫组织化学检测3组大鼠肝脏IL-1β、NF-κB、TNF-α的表达(×200) |
|
|
| 组别 | IL-1β | NF-κB | TNF-α | |||
| Area | IOD | Area | IOD | Area | IOD | |
| 假手术组 | 97174.3±19112.6 | 6432.8±1754.8 | 28161.7±12206.8 | 2178.9±1040.8 | 92309.8±7288.2 | 9748.2±807.9 |
| 模型组 | 265297.3±33589.4b | 22163.3±3153.7b | 268929.0±30865.6b | 22879.6±2657.1b | 181053.5±35100.4b | 18274.0±3427.5b |
| 褪黑激素组 | 167097.8±25629.0d | 12904.8±2403.1d | 146548.2±28570.4d | 12338.7±2473.9d | 143071.3±16466.9c | 14331.0±1806.3c |
| 注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01 | ||||||
由表 3可知,模型组血清中IL-1β和TNF-α含量均显著多于假手术组(P < 0.01),褪黑激素组显著少于模型组(P < 0.01)。
| 组别 | TNF-α | IL-1β |
| 假手术组 | 32.88±3.25 | 14.50±1.75 |
| 模型组 | 156.59±18.52b | 142.20±18.58b |
| 褪黑激素组 | 113.56±14.65d | 107.23±18.51d |
| 注:与假手术组比较,aP<0.05,bP<0.01;与模型组相比,cP<0.05,dP<0.01 | ||
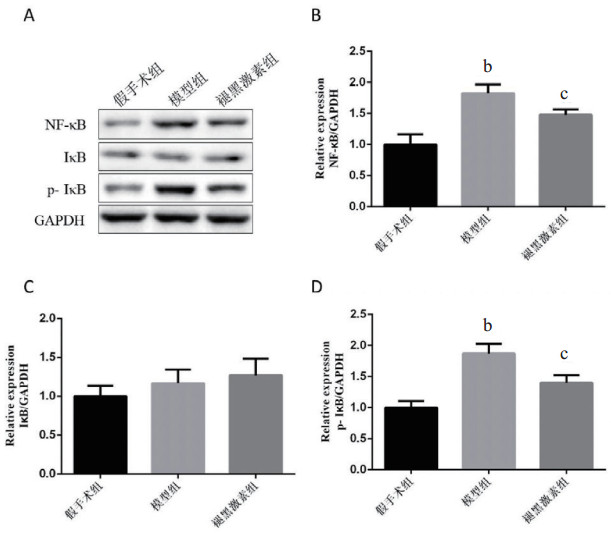
由图 3可知,3组大鼠肝脏中均有NF-κB蛋白、IκB蛋白和p-IκB蛋白表达量,假手术组NF-κB蛋白和p-IκB蛋白表达较少,模型组蛋白表达较多;模型组NF-κB蛋白和p-IκB蛋白相对表达量显著多于假手术组(P < 0.01),褪黑激素组的相对表达量显著少于模型组(P < 0.05)。3组大鼠肝脏中的IκB蛋白相对表达量差异无统计学意义(P > 0.05)。
|
| A:蛋白条带图,B: NF-κB蛋白表达水平统计图,C: IκB蛋白表达水平统计图,D: p-IκB蛋白表达水平统计图;与假手术组比较,aP <0.05,bP <0.01;与模型组比较,cP<0.05,dP<0.01 图 3 3组大鼠肝脏NF-κB、IκB和p-IκB蛋白的表达 |
|
|
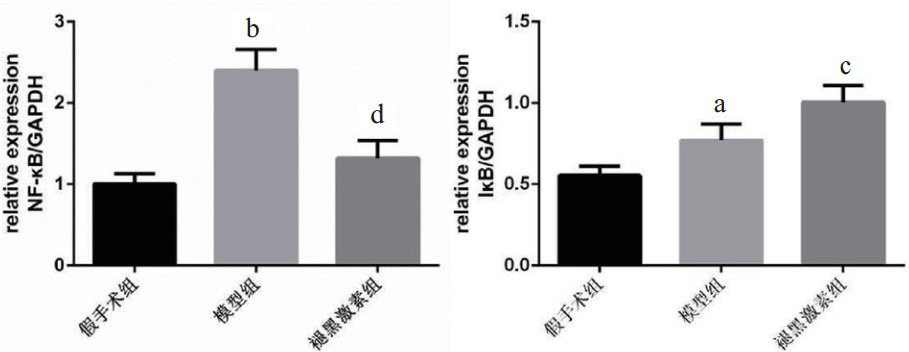
由图 4可知,与假手术组比较,模型组NF-κB mRNA相对表达量显著增多(P < 0.01),IκB mRNA相对表达量显著减少(P < 0.01);与模型组比较,褪黑激素组NF-κB mRNA相对表达量显著少于模型组(P < 0.01),IκB mRNA相对表达量显著增多(P < 0.05)。
|
| 与假手术组比较,aP<0.05,bP <0.01;与模型组比较,cP<0.05,dP<0.01 图 4 3组大鼠肝脏NF-κB和IκB mRNA表达的情况 |
|
|
缺血-再灌注损伤的特点是循环系统内有效血容量急剧降低、心脏有效输出量急剧减少从而导致循环系统灌注不足和微循环系统功能障碍,进而引发一系列病理生理反应,加剧多个脏器损伤,形成恶性循环。目前,针对缺血-再灌注损伤的治疗主要以迅速补充血容量、恢复循环系统有效血容量和针对病因治疗为主,以达到促进器官血流灌注恢复以降低器官损伤的目的[13-16]。但是,缺血-再灌注损伤的复苏会导致大量细胞毒性物质以及包括炎症在内的多种病理反应的产生,进一步加剧损伤,不利于缺血-再灌注损伤的恢复。有研究表明[17-18],肝损伤是缺血-再灌注损伤后复苏阶段重要的脏器损伤,可引起肝功能衰竭进而导致多器官功能障碍综合征的发生,严重者可导致死亡。因此,肝缺血-再灌注损伤是创伤导致死亡的常见病因。在肝缺血-再灌注损伤的病理生理过程中,炎症反应扮演了非常重要的角色。缺血-再灌注损伤后缺血缺氧的环境导致机体产生大量细胞毒性物质、细胞因子以及炎性因子,这些物质可以进一步引发包括炎症反应、凝血纤溶系统等多种病理生理反应,导致大量肝脏细胞凋亡、坏死等;而在休克复苏阶段,再灌注引起的氧供恢复可以导致机体产生大量氧自由基、钙离子以及炎性因子等物质,进一步加剧炎症反应,加重肝损伤[19-20]。
有学者发现NF-κB信号通路作为机体内重要的炎症和凋亡相关的信号通路,其所介导的炎症与创伤性后肝缺血-再灌注损伤引起的肝损害的病理反应有密切关系[21]。当肝脏组织受损后,大量细胞因子和炎症因子(IL-1β、TNF-α)被大量合成与分泌,可激活NF-κB信号通路。在NF-κB信号通路中,NF-κB是其中的关键分子。在生理状态下,NF-κB与IκB结合而失去活性,使NF-κB信号通路也处于静止状态[22-25]。在炎性因子的作用下,IκB发生磷酸化而与NF-κB分离,使NF-κB游离而具有相关的转录活性并进入细胞核发挥转录作用,与转录因子结合而调控下游多种效应蛋白的表达,包括炎症因子IL-1β和TNF-α,进而调控炎症。因此,在NF-κB信号通路的作用下,形成了炎症-炎症恶性循环,加剧肝损伤。在本研究内,缺血-再灌注损伤损伤的病理过程中存在大量炎性因子异常高表达以及NF-κB信号通路中关键分子NF-κB异常高表达和IκB磷酸化水平异常增高的情况,这提示NF-κB信号通路异常活化介导的炎症参与肝缺血-再灌注损伤过程中炎症反应并起重要的介导和调控作用。
已有的研究表明[26],褪黑激素是一种具有多种器官保护作用的神经内分泌性激素,参与多种相关的应激反应;外源性的褪黑激素对于肝损害具有一定程度的保护作用,但作用机制尚不明确。本研究结果进一步证实,外源性褪黑激素能够减轻因缺血-再灌注损伤所导致的大鼠肝损伤,改善肝组织形态结构,发挥肝保护作用;同时,本研究在应用外源性褪黑激素干预24 h后取大鼠的肝脏组织进行分析,通过免疫组织化学和ELISA检测发现,外源性褪黑色能够有效降低肝缺血-再灌注损伤大鼠血清中炎性因子IL-1β和TNF-α的含量及其表达,说明外源性褪黑激素对肝缺血-再灌注损伤过程中的炎症具有良好的抑制作用。为进一步研究其相关作用机制,本研究以与炎症有密切关系的NF-κB信号通路入手,通过多种手段检测了NF-κB信号通路中三种相关蛋白的分别表达情况,发现外源性褪黑激素能够有效抑制肝缺血-再灌注损伤过程中NF-κB信号通路。通过分析结果可以看出,究其原因主要是外源性褪黑激素通过抑制肝缺血-再灌注损伤后的NF-κB信号通路所介导的炎症表达,从而会从一定的程度之上减轻肝脏的损伤。为了进一步说明所证明的情况,本研究又从基因层面来检测了大鼠体内的相关蛋白的mRNA表达的水平,发现外源性褪黑激素显著降低肝缺血-再灌注损伤大鼠肝脏中的NF-κB相关的mRNA的表达量,进一步证实外源性褪黑激素对NF-κB信号通路的调控作用。
但是,本次实验亦存在不足之处。如:评估大鼠肝损伤的指标只有病理一个;评估指标不够全面,导致获得的实验数据不够完整;观察节点只有一个,均为干预后24 h后取材;褪黑素的干预剂量只设置了一个,应设置多组剂量组,从多节点、多角度评估,获得更完整的数据。
综上所述,外源性褪黑激素对缺血-再灌注损伤肝损害具有良好的保护作用,其机制可能与抑制大鼠肝缺血-再灌注损伤后NF-κB信号通路所介导的炎症有关。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | 丁威威, 朱维铭.创伤出血性休克治疗进展[J].中国实用外科杂志, 2018, 38(1): 87-89. DOI: CNKI:SUN:ZGWK.0.2018-01-026. |
| [2] | 刘良明, 白祥军, 李涛, 等. 缺血-再灌注损伤早期救治规范[J]. 创伤外科杂志, 2017, 19(12): 881-883, 891. DOI:10.3969/j.issn.1009-4237.2017.12.001 |
| [3] | Chang R, Holcomb JB. Optimal fluid therapy for traumatic hemorrhagic shock[J]. Crit Care Clin, 2017, 33(1): 15-36. DOI:10.1016/j.ccc.2016.08.007 |
| [4] | Owattanapanich N, Chittawatanarat K, Benyakorn T, et al. Risks and benefits of hypotensive resuscitation in patients with traumatic hemorrhagic shock: a meta-analysis[J]. Scand J Trauma Resusc Emerg Med, 2018, 26(1): 107. DOI:10.1186/s13049-018-0572-4 |
| [5] | Tremoleda JL, Watts SA, Reynolds PS, et al. Modeling acute traumatic hemorrhagic shock injury: challenges and guidelines for preclinical studies[J]. Shock (Augusta, Ga), 2017, 48(6): 610-623. DOI:10.1186/s13049-018-0572-4 |
| [6] | Liu H, Xiao X, Sun C, et al. Systemic inflammation and multiple organ injury in traumatic hemorrhagic shock[J]. Fron Biosci (Landmark edition), 2015, 20: 927-933. DOI:10.2741/4347 |
| [7] | Godinho M, Padim P, Evora PR, et al. Curbing inflammation in hemorrhagic trauma: a review[J]. Revista do Colegio Brasileiro de Cirurgioes, 2015, 42(4): 273-278. DOI:10.1590/0100-69912015004013 |
| [8] | Song Z, Zhao X, Liu M, et al. Recombinant human brain natriuretic peptide attenuates trauma-/haemorrhagic shock-induced acute lung injury through inhibiting oxidative stress and the NF-kappaB-dependent inflammatory/MMP-9 pathway[J]. Int J Exp Pathol, 2015, 96(6): 406-413. DOI:10.1111/iep.12160 |
| [9] | Wolf A, Thakral S, Mulier KE, et al. Evaluation of novel formulations of d-beta-hydroxybutyrate and melatonin in a rat model of hemorrhagic shock[J]. Intern J Pharm, 2018, 548(1): 104-112. DOI:10.1016/j.ijpharm.2018.06.046 |
| [10] | Wolf A, Mulier KE, Muratore SL, et al. D-beta-hydroxybutyrate and melatonin for treatment of porcine hemorrhagic shock and injury: a melatonin dose-ranging study[J]. BMC Res Notes, 2017, 10(1): 649. DOI:10.1186/s13104-017-2975-0 |
| [11] | Chamorro V, Pandolfi R, Moreno L, et al. Effects of quercetin in a rat model of hemorrhagic traumatic shock and reperfusion[J]. Molecules, 2016, 21(12): 763. DOI:10.3390/molecules21121739 |
| [12] | Cuzzocrea S, Reiter RJ. Pharmacological action of melatonin in shock, inflammation and ischemia/reperfusion injury[J]. Eur J Pharmacol, 2001, 426(1-2): 1-10. DOI: 10.1016/s0014-2999(01)01175-x. |
| [13] | 叶胜, 曹钰. Nrf2-HO1信号通路调控脑缺血-再灌注氧化应激损伤的研究进展[J]. 中华急诊医学杂志, 2019(12): 1571-1572. DOI:10.3760/cma.j.issn.1671-0282.2019.12.026 |
| [14] | 郭培培, 金朝, 李心怡, 等. 盐酸羟考酮对大鼠局灶性脑缺血-再灌注损伤的影响[J]. 中华急诊医学杂志, 2020, 29(7): 929-933. DOI:10.3760/cma.j.issn.1671-0282.2020.07.007 |
| [15] | Ma Y, Yu XY, Wang Y. Dose-related effects of dexmedetomidine on immunomodulation and mortality to septic shock in rats[J]. World J Emerg Med, 2018, 9(01): 56. DOI:10.5847/wjem.j.1920-8642.2018.01.009 |
| [16] | Ilhan M. Are radiological modalities really necessary for the long-term follow-up of patients having blunt solid organ injuries? A single center study[J]. World J Emerg Med, 2019, 10(3): 177. DOI:10.5847/wjem.j.1920-8642.2019.03.008 |
| [17] | Hutchings SD, Naumann DN, Hopkins P, et al. Microcirculatory impairment is associated with multiple organ dysfunction following traumatic hemorrhagic shock: The MICROSHOCK Study[J]. Crit Care Med, 2018, 46(9): e889-e896. DOI:10.1097/CCM.0000000000003275 |
| [18] | Spinella PC, Perkins JG, Cap AP. Lessons learned for the resuscitation of traumatic hemorrhagic shock[J]. US Army Med Dep J, 2016(2-16): 37-42. DOI:10.1097/CCM.0000000000003275 |
| [19] | Butler FK, Holcomb JB, Schreiber MA, et al. Fluid resuscitation for hemorrhagic shock in tactical combat casualty care: TCCC Guidelines Change 14-01-2 June 2014[J]. J Spec Oper Med, 2014, 14(3): 13-38. |
| [20] | Kalkwarf KJ, Cotton BA. Resuscitation for Hypovolemic Shock[J]. Surg Clin North Am, 2017, 97(6): 1307-1321. DOI:10.1016/j.suc.2017.07.011 |
| [21] | Jiang MP, Xu C, Guo YW, et al. beta-arrestin 2 attenuates lipopolysaccharide-induced liver injury via inhibition of TLR4/NF-kappaB signaling pathway-mediated inflammation in mice[J]. World J Gastroenterol, 2018, 24(2): 216-225. DOI:10.3748/wjg.v24.i2.216 |
| [22] | Zan J, Zhang H, Lu MY, et al. Isosteviol sodium injection improves outcomes by modulating TLRs/NF-κB-dependent inflammatory responses following experimental traumatic brain injury in rats[J]. Neuroreport, 2018, 29(10): 1. DOI:10.1097/WNR.0000000000001033 |
| [23] | Pilcher J, Eastlake L, Richards M, et al. Physiological effects of titrated oxygen via nasal high-flow cannulae in COPD exacerbations: A randomized controlled cross-over trial[J]. Respirology, 2017, 22(6): 1149-1155. DOI:10.1111/resp.13050 |
| [24] | Lee S, Ro H, In HJ, et al. Fisetin inhibits TNF-α/NF-κB-induced IL-8 expression by targeting PKCδ in human airway epithelial cells[J]. Cytokine, 2018, 108: 247-254. DOI:10.1016/j.cyto.2018.01.004 |
| [25] | Du J, Chi Y, Song Z, et al. Crocin reduces A. fumigatus -induced airway inflammation and NF-κB signal activation[J]. J Cell r Bioch, 2017, 119(2): 1746-1754. DOI:10.1002/jcb.26335 |
| [26] | Wang H, Li L, Zhao M, et al. Melatonin alleviates lipopolysaccharide-induced placental cellular stress response in mice[J]. J Pineal Res, 2011, 50(4): 418-426. DOI:10.1111/j.1600-079X.2011.00860.x |
 2020, Vol. 29
2020, Vol. 29




