2 绍兴市立医院重症医学科 312000
呼吸机相关性肺炎(ventilator associated pneumonia,VAP)是重症监护室内机械通气患者最常见的感染性疾病之一。重症患者存在多种VAP的相关危险因素,包括患者的基础状态、诊疗操作及药物治疗相关因素等[1]。临床上往往在发生VAP后才根据经验和药敏试验结果使用抗生素,如果早期广谱使用抗生素又可能增加细菌的耐药性。如果VAP发生早期,能够找到评估VAP预后的特异性指标,改变肺部的内环境,尽早撤机拔管可改善VAP的预后。
已有研究表明,高迁移率族蛋白B1(high mobility group box 1,HMGB1)和巨噬细胞的吞噬活性与宿主的免疫反应密切相关,对肺部的感染诊断和预后评估有一定的价值,但HMGB1对VAP患者能否早期撤机拔管、改善预后的价值有待进一步探讨[2]。因此,本研究拟探讨HMGB1和肺泡巨噬细胞活性在VAP患者预后评估中的意义。
1 资料与方法 1.1 一般资料收集2016年1月至2019年12月选择绍兴市人民医院和绍兴市立医院重症医学科需要机械通气并发生VAP的患者作为研究对象共102例。所有VAP患者在确诊后采集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)进行培养、分析。根据临床VAP的发生时间分成VAP早发组(机械通气≤4 d)50例和VAP晚发组(机械通气≥5 d)52例。
依据2013年中华医学会重症医学分会制定的《呼吸机相关性肺炎预防、诊断和治疗指南》[3]的诊断标准入选。VAP临床诊断依据:有创机械通气48 h以上或撤机、拔管后48 h以内胸部X线可见新发或进展性浸润影,如同时满足下述至少2项可考虑诊断VAP:⑴体温 > 38 ℃或 < 36℃;⑵外周血白细胞计数 > 10×109/L或 < 4×109/L;⑶气管支气管内出现脓性分泌物。排除标准:需除外肺水肿、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、肺结核、肺栓塞等疾病,需与微生物学诊断相结合。排除有肺纤维化,免疫性疾病,长期使用激素,肺部肿瘤,妊娠,年龄 < 18岁;排查入科前已经明确存在肺部感染的患者。本研究经医院伦理委员会批准(批号:2018-037),严格遵守医学伦理学规范,并签署知情同意书。
1.2 研究方法 1.2.1 一般资料采集研究对象的人口学资料及一般情况(基础疾病、性别、年龄),计算确诊当天的急性生理和慢性健康评分Ⅱ(APACHEⅡ),临床肺部感染评分(clinical pulmonary infection score, CPIS),氧合指数(PaO2/FiO2),以及ICU住院时间,7 d机械通气撤机拔管率等。
1.2.2 细胞因子检测BALF中细胞因子的检测参照《支气管肺泡灌洗液细胞学检测技术规范(草案)》[4]和《肺部感染性疾病支气管肺泡灌洗病原体检测中国专家共识(2017年版)》[5]用纤维支气管镜行机械通气时的气道管理, 用双层纱布过滤BALF液,去除黏液,将滤液放入50 mL的聚丙烯试管中。将滤液以1 500 r/min离心10 min。使上清液与细胞分离后,上清液进行可溶性成分分析,分离得的上清液贮存在-20℃冰箱备用。用ELISA法测定离心后上清液可溶性成分和细胞因子(TNF-α、IL-8、HMGB1)。操作步骤严格按照产品说明进行,试剂盒均购于Thermo Scientific公司。
1.2.3 巨噬细胞提取和吞噬活性检测BALF液离心后沉淀部分用10 mL预冷的Hanks液将细胞沉淀物再行悬浮。用相同容量预冷的Hanks液清洗两次。将细胞悬液接种到培养瓶中,在37℃,5% CO2环境下孵育90~120 min。轻微震荡摇匀后去除介质与非粘附细胞,加入1 mL预热的RPMI 1640培养液,轻微摇匀,反复清洗3~4次。用1 mL含有5 mmol/L EDTA的PBS孵育5 min提取粘附的巨噬细胞,紧接着移液,加入1 mL肺泡巨噬细胞培养基冷浸。用0.1%的锥虫蓝计数评价细胞的活力在95%以上。调整细胞浓度为2×106个分别置于培养板中及若干置于有载玻片的培养皿中。在成功分离培养巨噬细胞后,用荧光微球吞噬实验在上述培养皿中再加入按1:100稀释的FITC标记乳胶微球,同时在细胞培养箱中37 ℃孵育60 min,最后用4℃ PBS液清洗未被吞噬的微球。用表面荧光显微镜计数巨噬细胞的吞噬功能,计数每个巨噬细胞的FITC标记微球的个数,每张标本计数50个细胞。
1.2.4 肺泡巨噬细胞内HMGB1蛋白含量测定用Western blot法测定,先分离培养的肺泡巨噬细胞调整细胞浓度为5×106个分别置于培养皿中,冰上操作放入RIPA液裂解,吹打、震摇、离心,上清液进行SDS-PAGE电泳,转膜,用一抗HMGB1(1:1 000,Santa Cruz, USA)、β-actin(1:2 000,Santa Cruz, USA)孵育过夜,最后用二抗孵育2 h,ECL试剂显色,JY-Clear ECL型化学发光凝胶成像分析系统进行成像。目标蛋白的吸光度值与内参比值即为目标蛋白的相对含量。
1.3 统计学方法用SPSS 22.0统计学软件进行数据分析。正态分布的计量资料以均数±标准差(Mean±SD)表示,两组间比较采用独立样本t检验; 计数资料采用频数(百分率)表示,组间比较采用χ2检验或Fisher精确概率法。采用ROC曲线分析相关指标对患者预后的预测价值,Kaplan-Meier法绘制患者的7 d撤机拔管率,多因素Logistic回归分析影响患者预后的危险因素。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者基本情况共纳入102例患者,其中男54例,女48例,年龄(62.87±15.34)岁。原发病来源外科术后51例,脑血管及神经系统病变35例,心肺复苏后7例,其他9例。所有患者入组时CPIS评分(4.16±1.77)分,APACHEⅡ评分(17.55±6.35)分,机械通气时间为(5.96±1.82)d。VAP早发组和晚发组患者年龄、性别和疾病构成比上差异无统计学意义(均P > 0.05),VAP发生时两组的APACHEⅡ评分、CPIS评分、氧合指数亦差异无统计学意义(P > 0.05)。但进一步比较发现,VAP早发组的机械通气时间和ICU住院时间明显高于VAP迟发组,两组差异有统计学意义(均P < 0.05),见表 1。早发组死亡病例5例,晚发组6例,差异无统计学意义(χ2=2.79,P > 0.05)。
| 组别 | 例数 | 年龄(岁) | 男/女(例) | APACHEⅡ评分(分) | CPIS评分(分) | PaO2/FiO2(mmHg) | 机械通气时间(d) | ICU住院时间(d) |
| VAP早发组 | 50 | 55.2±11.8 | 23/27 | 19.3±5.3 | 4.7±1.8 | 295±110 | 5.5±1.9 | 6.8±1.4 |
| VAP迟发组 | 52 | 60.9±12.4 | 25/27 | 18.4±4.4 | 4.4±1.3 | 327±97 | 3.9±2.6 | 5.4±1.8 |
| t/χ2 | 0.35 | 0.56 | 0.74 | 0.48 | 2.15 | 1.95 | 3.90 | |
| P值 | 0.83 | 0.48 | 0.35 | 0.62 | 0.05 | 0.03 | < 0.01 | |
| 注:APACHEⅡ为急性生理和慢性健康评分Ⅱ;CPIS为临床肺部感染评分;PaO2/FiO2为氧合指数 | ||||||||
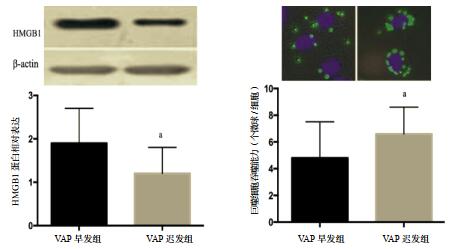
VAP确诊时早发组BALF中的TNF-α、IL-8、HMGB1浓度明显高于迟发组,两组比较差异有统计学意义(均P < 0.05),见表 2。进一步培养肺泡巨噬细胞,发现VAP晚发组巨噬细胞中HMGB1的蛋白相对含量低于VAP早发组,巨噬细胞的吞噬能力强于VAP早发组(均P < 0.05),见表 2,图 1。
| 组别 | 例数 | TNF-α (μg/L) | IL-8 (μg/L) | HMGB1 (μg/L) | 巨噬细胞HMGB1蛋白相对含量 | 吞噬功能(个微球/细胞) |
| VAP早发组 | 50 | 19.8±4.3 | 58.1±19.6 | 79.1±19.4 | 2.0±0.8 | 4.5±2.7 |
| VAP迟发组 | 52 | 15.0±4.1 | 37.1±18.7 | 41.4±16.8 | 1.3±0.7 | 6.9±2.1 |
| t值 | 2.85 | 4.75 | 7.85 | 3.99 | 2.95 | |
| P值 | 0.01 | < 0.01 | < 0.01 | < 0.01 | 0.03 | |
| 注:BALF为支气管肺泡灌洗液;TNF-α为肿瘤坏死因子α;IL-8为白介素8;HMGB1为高迁移率族蛋白B1 | ||||||
|
| 左图为两组肺泡巨噬细胞HMGB1相对蛋白含量的Western Blot结果;右图为巨噬细胞吞噬能力,绿色小点代表巨噬细胞吞噬的FITC标记乳胶微球(×400);与VAP早发组比较,aP < 0.05 图 1 肺泡巨噬细胞HMGB1的蛋白含量及吞噬能力 |
|
|
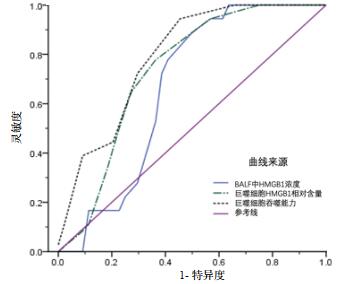
BALF中HMGB1水平预测患者7 d脱机拔管的ROC曲线下面积(AUC)为0.77(95%CI:0.65~0.79,P < 0.05),以50.0 μg/L为截断值,灵敏度和特异度分别为77.8%和70.2%;巨噬细胞HMGB1蛋白相对含量预测患者7 d脱机拔管的ROC曲线下面积为0.73(95%CI:0.61~0.86,P < 0.05),以1.4为截断值,灵敏度和特异度分别为72.2%和72.7%;巨噬细胞吞噬功能预测患者7 d脱机拔管率的ROC曲线下面积为0.79(95%CI:0.68~0.90,P < 0.01),以6.5个微球/细胞为截断值,灵敏度和特异度分别为72.5%和70.1%,见图 2。
|
| 图 2 BALF中HMGB1浓度、巨噬细胞HMGB1相对蛋白含量及吞噬能力预测患者7 d内机械通气撤机拔管的ROC曲线 |
|
|
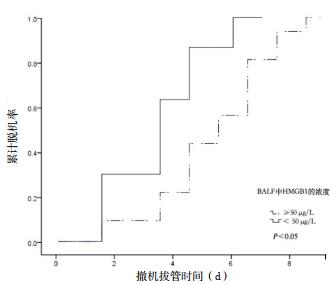
如图 3所示,HMGB-1 < 50.0 μg/L患者7 d机械通气撤机拔管率明显高于HMGB1≥50.0 μg/L患者(84.3% vs 66.7%,χ2=14.3, P < 0.01)。
|
| 图 3 依据HMGB1截断值对患者7 d内机械通气撤机拔管率的比较 |
|
|
单因素分析影响患者7 d机械通气撤机插管拔率的危险因素包括TNF-α、IL-8、HMGB1及肺泡巨噬细胞内HMGB1的蛋白相对含量和吞噬能力。多因素Logistic回归分析显示BALF中的HMGB1浓度、肺泡巨噬细胞内HMGB1的蛋白相对含量及巨噬细胞吞噬能力均是患者能否7 d内机械通气撤机拔管的独立危险因素,见表 3。
| 因素 | β值 | Wald值 | OR值 | 95% CI | P值 |
| APACHE Ⅱ评分 | 0.242 | 0.571 | 1.273 | 0.680~2.384 | 0.450 |
| CPIS评分 | 0.001 | 0.056 | 1.001 | 0.993~1.010 | 0.813 |
| 氧合指数 | 0.142 | 0.310 | 0.868 | 0.527~1.430 | 0.578 |
| TNF-α | 0.011 | 0.014 | 0.989 | 0.821~1.191 | 0.904 |
| IL-8 | 0.014 | 0.283 | 0.986 | 0.938~1.037 | 0.595 |
| BALF中HMGB1浓度 | 0.033 | 2.132 | 1.033 | 0.989~1.080 | 0.044 |
| 巨噬细胞HMGB1蛋白相对含量 | 1.233 | 3.935 | 1.433 | 1.015~1.613 | 0.007 |
| 巨噬细胞吞噬能力 | 0.741 | 8.622 | 2.099 | 1.280~3.442 | 0.003 |
| 注:β为回归系数,OR为比值比 | |||||
人工气道解决了患者急性呼吸衰竭的问题,但是破坏了呼吸系统的防御机制。由于危重症患者基础疾病严重、全身免疫功能低下,尽管医院感染的控制和VAP的集束化措施的开展,但是VAP仍然是机械通气患者最常见的感染性疾病之一。CHINET报道VAP发病率高达6%~52%,病死率为14%~50%,因此希望找到早期改善患者预后的指标,增强患者局部的机体免疫力,有利于改善患者预后[6-7]。已有文献提示,多种临床指标可能有助于判断VAP的预后,但是APACHEⅡ评分、CPIS评分等在VAP发生早期特异度或灵敏度不高,PCT、CRP等受到全身多种因素的干扰[8]。研究显示,HMGB1可能作为新的“晚期”炎症因子几乎参与了脓毒症的病理全过程,HMGB1与巨噬细胞的吞噬活性和宿主的免疫反应密切相关,对肺部的感染诊断和预后评估有较大价值[9]。
HMGB1是一种高度保守的核蛋白,广泛分布在哺乳动物的细胞内,它一旦分泌到细胞外即可诱导炎症反应[10];研究表明减少HMGB1从巨噬细胞内向细胞外释放可以减少组织的炎症反应[11]。本研究显示VAP确诊当天两组患者的APACHEⅡ评分、CPIS评分和氧合指数差异无统计学意义(均P > 0.05), 但从两组患者长期的预后如机械通气时间、ICU住院时间差异有统计学意义(均P < 0.05)。进一步从患者的BALF入手,发现VAP早发组中的TNF-α、IL-8、HMGB1以及巨噬细胞HMGB1的蛋白相对含量高于VAP迟发组(均P < 0.05),而巨噬细胞的吞噬活力亦明显低于VAP迟发组(P < 0.05)。这与既往的研究相似,但是这些指标不能反映组内患者的预后。本研究更关注VAP发生后患者7 d内的撤机拔管率,超过1周会增加二次感染的概率,甚至需要气管切开等治疗措施[12-13]。本研究发现BALF中HMGB1水平、巨噬细胞HMGB1相对含量和巨噬细胞吞噬能力预测患者7 d撤机拔管率的ROC曲线下面积分别为0.75、0.73、0.79,具有较高的预测效能。依据BALF中HMGB1截断值分组发现,HMGB-1 < 50.0 μg/L患者7 d机械通气撤机拔管率明显高于HMGB-1≥50.0 μg/L患者,差异有统计学意义(P < 0.01)。
通过多因素回归分析发现,VAP发生时BALF中HMGB1含量、巨噬细胞HMGB1蛋白相对含量及巨噬细胞的吞噬活力是影响患者7 d内撤机拔管的独立危险因素,而APACHEⅡ评分、CPIS评分、氧合指数和TNF-α、IL-8不能反映VAP发生后患者的预后。这一结果也不难解释,由于VAP发生时受到宿主全身因素影响较多,本研究又有较多的外科术后患者,这些评分和全身性炎症指标不足以反映肺部的局部情况,影响VAP患者脱机拔管的预后判断。而HMGB1和肺泡巨噬细胞的活力更加反映宿主的肺部局部的免疫情况,能更好地预测VAP的预后和转归。
综上所述,HMGB1和肺泡巨噬细胞的吞噬活力可以作为VAP患者预后的可靠指标,有助于指导VAP的治疗,但是是否对HMGB1的干预能进一步改善VAP患者的预后有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Qiu QM, Li ZW, Tang LM, et al. Expression of high mobility group protein B1 in the lungs of rats with Sepsis[J]. World J Emerg Med, 2011, 2(4): 302-306. DOI:10.5847/wjem.j.1920-8642.2011.04.011 |
| [2] | Wang R, Yang LP, Zhang YL, et al. Porcine reproductive and respiratory syndrome virus induces HMGB1 secretion via activating PKC-delta to trigger inflammatory response[J]. Virology, 2018, 518: 172-183. DOI:10.1016/j.virol.2018.02.021 |
| [3] | 中华医学会重症医学分会. 呼吸机相关性肺炎诊断、预防和治疗指南(2013)[J]. 中华内科杂志, 2013, 52(6): 524-543. DOI:10.3760/cma.j.issn.0578-1426.2013.06.024 |
| [4] | 中华医学会呼吸病学分会. 支气管肺泡灌洗液细胞学检测技术规范(草案)[J]. 中华结核和呼吸杂志, 2002, 25(7): 390-391. DOI:10.3760/j.issn.1001-0939.2002.07.003 |
| [5] | 中华医学会呼吸病学分会. 肺部感染性疾病支气管肺泡灌洗病原体检测中国专家共识(2017年版)[J]. 中华结核和呼吸杂志, 2017, 40(8): 578-583. DOI:10.3760/cma.j.issn.1001-0939.2017.08.007 |
| [6] | Peng Q, Yang L, Jin Z. Review: the role and mechanisms of macrophage autophagy in sepsis[J]. Inflammation, 2019, 42(1): 6-19. DOI:10.1007/s10753-018-0890-8 |
| [7] | Arumugam SK, Mudali I, Strandvik G, et al. Risk factors for ventilator-associated pneumonia in trauma patients: a descriptive analysis[J]. World J Emerg Med, 2018, 9(3): 203-210. DOI:10.5847/wjem.j.1920-8642.2018.03.007 |
| [8] | Nishibori M, Mori SJ, Takahashi HK. Anti-HMGB1 monoclonal antibody therapy for a wide range of CNS and PNS diseases[J]. J Pharmacol Sci, 2019, 140(1): 94-101. DOI:10.1016/j.jphs.2019.04.006 |
| [9] | Chen XH, Xu Y, Xiong P, et al. Effects of mimicked acetylated HMGB1 on macrophages and dendritic cells[J]. Mol Med Rep, 2018, 18(6): 5527-5535. DOI:10.3892/mmr.2018.9584 |
| [10] | 严一核, 孙雪东, 李智鑫, 等. 急性呼吸窘迫综合征患者肺泡微环境对肺成纤维细胞生物学活性的影响[J]. 中华危重症医学杂志(电子版), 2018, 11(3): 151-156. DOI:10.3877/cma.j.issn.1674-6880.2018.03.002 |
| [11] | Achouiti A, van der Meer A, Florquin S, et al. High-mobility group box 1 and the receptor for advanced glycation end products contribute to lung injury during Staphylococcus aureus pneumonia[J]. Crit Care, 2013, 17(6): R296. DOI:10.1186/cc13162 |
| [12] | 董亮, 张秀红, 梁锋鸣, 等. 髓样细胞可溶性触发受体-1在呼吸机相关性肺炎预后评估中的价值研究[J]. 中华急诊医学杂志, 2018, 27(1): 93-98. DOI:10.3760/cma.j.issn.1671-0282.2018.01.018 |
| [13] | Lai CC, Wang YH, Wang CY, et al. Risk of sepsis and mortality among patients with chronic obstructive pulmonary disease treated with angiotensin-converting enzyme inhibitors or angiotensin receptor blockers[J]. Crit Care Med, 2019, 47(1): e14-e20. DOI:10.1097/CCM.0000000000003475 |
 2020, Vol. 29
2020, Vol. 29




