2 北京大学第三医院危重医学科 100191;
3 北京999急救中心重症医学科 100085;
4 北京海淀医院重症医学科 100080;
5 北京海淀区中关村医院重症医学科 100080
2 Department of ICU, Peking University Third Hospital, Beijing 100191, China;
3 Department of ICU, Beijing 999 Emergency Center, Beijing 100085, China;
4 Department of ICU, Haidian Hospital, Beijing 100080, China;
5 Department of ICU, Zhongguancun Hospital, Beijing 100080, China
应激性黏膜病变(stress related mucosal disease,SRMD)又称应激性溃疡(stress ulcer,SU)、急性胃黏膜病变(acute gastric mucosal lesion,AGML)、急性糜烂性胃炎(acute erosive gastritis,AEG)和急性出血性胃炎(acute hemorrhagic gastritis,AHG)等,是指机体在严重创伤、复杂手术、危重疾病等严重应激状态下发生的急性消化道黏膜糜烂、溃疡、出血等病变[1]。而重症监护病房中的危重症患者在发病后24 h内即可发生应激相关的胃肠道黏膜损伤,发病后1~3 d胃镜检查发现75%~100%的危重症患者出现胃黏膜损伤,在这些患者中,15%~50%表现为隐性出血,5%~25%为显性出血,0.6%~5.0%为大出血。一旦发生大出血或穿孔,病死率可高达50%~80%[1-2]。预防和治疗SRMD将有助于降低具有临床意义的消化道出血,缩短住院时间和降低医疗费用。
SRMD的确切发病机制尚不清楚,目前认为可能与以下因素有关:胃黏膜血流减少;胃内酸度改变;胃黏膜内酸碱平衡破坏;黏液/碳酸氢盐屏障功能障碍;氧自由基的损害作用等。生理状况下,组织的完整性依赖胃黏膜损伤因素与保护因素之间的平衡。应激情况下局部血流量减少及再灌注损伤等使黏膜防御机制减弱,上述平衡被打破,损伤因子尤其是胃酸的作用增强,造成局部黏膜损害、糜烂及溃疡形成[3]。尽管在药物选择、疗效及安全性方面存在争议,但是针对危重症患者这一高危群体采取预防应激性黏膜病变出血的抑酸治疗这一观点得到广泛认同[2]。文献及指南推荐抑酸剂预防应激性黏膜病变的目标pH值是胃内pH值大于4,并且认为胃内pH值持续在4以上,就可以有效预防胃酸对受损胃黏膜的损伤,降低SRMD出血的发生率[1, 4-6]。目前广泛使用的质子泵抑制剂(proton pump inhibitors,PPI)能够迅速将胃内pH值提高到6并且维持在6以上,虽然抑酸效果好,但预防出血的效果与能够迅速将胃内pH值提高到4并且维持在4~5的组胺受体拮抗剂(histamine-2 receptor antagonists,H2RA)相比无肯定的意见,并且pH持续6以上带来了许多问题,比如上、下消化道细菌繁殖引起肺炎[1, 7-9]或腹泻[1, 10-11]等。为了避免使用PPI使胃内pH值大于6带来的不利影响以及减少药物之间的相互作用[12],H2RA重新进入了临床医生的视野。新一代H2RA类药物罗沙替丁由于其结构的优化避免了老一代H2RA的不良反应,在国外已逐渐取代PPI用于预防重症患者SRMD。本研究采用前瞻性随机对照方法,对罗沙替丁与奥美拉唑预防ICU重症患者应激性黏膜病变出血的疗效进行对比研究。
1 资料与方法 1.1 病例选择 1.1.1 入选标准年龄≥18岁,预计住ICU时间不少于5 d,具有SRMD的危险因素。
独立风险因素:凝血功能障碍,PLT < 5.0×109/L,INR > 1.5或APTT > 2倍正常值;机械通气≥48 h。
其他风险因素:⑴脊髓损伤;⑵多发伤;⑶多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS);⑷烧伤(> 35%体表面积);⑸肝部分切除;⑹颅脑损伤,昏迷指数GCS≤10;⑺肝肾移植;⑻入院前一年内有消化道溃疡或出血病史;⑼严重全身性感染;⑽合并休克或持续低血压;⑾隐匿性或明显出血 > 6 d;⑿皮质醇治疗(相当于氢化可的松 > 250 mg/d);⒀其他原因需要服用抗酸、抑酸及胃黏膜保护药物;⒁大手术(持续时间 > 4 h)。
出现一项独立风险因素或两项以上其他风险因素者考虑入组。所有病例入科时均经胃液或便潜血试验证实尚未发生应激性溃疡。
1.1.2 排除标准⑴对注射用奥美拉唑或罗沙替丁过敏;⑵孕妇;⑶入选时气管插管时间≥24 h;⑷上消化道手术或违禁药物过量;⑸胃切除手术或者胃黏膜损害有出血倾向;⑹胃酸分泌亢进病史(如Zollinger-Ellison综合征);⑺入选时前3 d内使用注射用PPI类、H2RA类药物、促胃动力药及胃黏膜保护剂;⑻不能耐受胃管;⑼未签署知情同意。
1.1.3 剔除标准⑴住ICU < 5 d;⑵胃液标本≤8个/d;⑶患者中途退出研究。
1.2 分组及干预方法 1.2.1 入选患者采用随机数字表法随机分为罗沙替丁试验组(通用名称:注射用盐酸罗沙替丁醋酸酯;商品名称:杰澳;英文名称:Roxatidine Acetate Hydrochloride for injection;规格:75 mg/支;生产厂家:北京四环制药有限公司;国药准字:H20120076)和奥美拉唑对照组(通用名称:注射用奥美拉唑钠;商品名称:洛赛克;英文名称:Omeprazole Sodium for injection;规格:40 mg/支;生产厂家:阿斯利康制药有限公司;国药准字:H20033394)。
1.2.2 用药方法试验组:注射用盐酸罗沙替丁醋酸酯75 mg溶于20 mL生理盐水注射液缓慢静脉推注,用药间隔12 h;对照组:注射用奥美拉唑40 mg溶于100 mL生理盐水注射液静脉滴注30 min,用药间隔12 h。用药疗程均以实际使用天数计算。
1.2.3 诊疗规范入组患者在ICU治疗期间均遵照重症医学诊疗规范进行诊疗,并遵照《2016年成人危重症患者营养支持治疗实施与评价指南》[13]进行评估及营养支持,对存在上述危险因素的患者常规进行应激性黏膜病变的预防及监测,并记录治疗期间家属是否签署《医疗措施限制撤销确定书》。
1.3 数据采集 1.3.1 人口学与基线指标姓名、性别、年龄、身高、体质量、入ICU主要诊断、来源科室、基础疾病、APACHE Ⅱ评分、第1天SOFA评分。
1.3.2 标本采集⑴用药前、用药开始后每2 h经鼻胃管抽取胃液,选取最后1~2 mL标本,抽取后立即使用精密pH试纸(生产厂家:上海三爱思试剂有限公司;分辨率为0.1)测量胃液pH值,连续测量5 d,共60个时间点/人(T1~T60)同时测量胃潜血。⑵首次用药前及第5天用药后送检胃液细菌培养。⑶第1~5天送检胃潜血和粪便潜血。
1.3.3 结局指标⑴主要结局比较5 d内不同组别胃内抽取物pH均数、pH≥4.0的时间比例及消化道出血发生率。
⑵次要结局:a.预后指标。ICU内是否死亡及是否转出ICU、住院天数、28 d病死率。b.营养支持情况。入组5 d内是否进行肠内营养支持及其剂量。c.不良反应。是否发生有临床意义的新发感染、药物相关不良事件:过敏反应;白细胞减少或嗜酸性粒细胞增多;恶心、呕吐、腹泻;注射部位血管痛、瘙痒、皮疹;肝脏转氨酶升高或其他严重不良事件。
⑶应激性黏膜病变出血(stress related mucosal disease bleeding,SRMDB)判定标准[1, 14-15]:有应激源相关病史及相关危险因素、在原发病后2周内出现上消化道出血症状、体征及实验室检查异常,即可拟诊SU;如内镜检查发现糜烂、溃疡等病变存在,即可确诊SU;其中SU合并出血时,根据病变严重程度不同,分为以下类型:①隐性出血。粪潜血试验阳性。②显性出血。呕血、呕咖啡样物质、黑便、胃管抽吸物呈血性。③有重要临床意义的出血(显性出血+以下任1条)。24 h内收缩压降低≥20 mmHg(1 mmHg=0.133 kPa);体位改变时心率增加20次/min或收缩压下降≥10 mmHg;24 h内血红蛋白下降≥20 g/L或需输注2个单位浓缩红细胞;需外科手术治疗的胃出血。
1.4 统计学方法采用SPSS 22.0软件进行统计分析,计量资料且符合正态分布以均数±标准差(Mean±SD)表示,组间比较采用方差分析;非正态分布的数据采用中位数(四分位数)[M(QL, QU)]进行统计描述并选择秩和检验。计数资料采用频数(%)表示,组间比较采用卡方检验;以P < 0.05为差异有统计学意义。
1.5 伦理学本研究经北京大学第三医院伦理委员会批准(2017医伦审第120-02),取得患者或代理人的知情同意。
2 结果 2.1 入组情况及干预方法 2.1.1 入组情况、人口学与基线指标2017年10月至2018年3月五家研究中心综合ICU共收治患者732例,最终入组91例,随机(随机数字法)分为试验组46人,对照组45例(图 1),两组患者人口学参数、APACHE Ⅱ评分、第1天SOFA评分、来源科室及基础疾病均差异无统计学意义(表 1)。
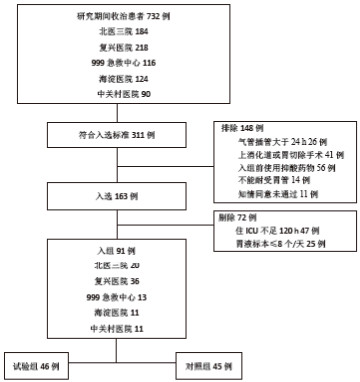
|
| 图 1 入选流程图 Fig 1 Flow chart of the subjects included in the study |
|
|
| 指标 | 试验组 (n=46) |
对照组 (n=45) |
F/χ2值 | P值 |
| 男性(例,%) | 25(54.35) | 33(73.33) | 3.457 | 0.060 |
| 年龄(岁,Mean±SD) | 61.48±23.15 | 66.48±17.48 | 1.160 | 0.249 |
| 身高(cm,Mean±SD) | 166.39±7.70 | 169.49±8.21 | 1.857 | 0.067 |
| 体质量(kg,Mean±SD) | 66.24±11.08 | 66.78±10.55 | 0.237 | 0.813 |
| BMI(kg/m2,Mean±SD) | 23.83±3.00 | 23.17±2.89 | 1.069 | 0.288 |
| APACHEⅡ评分(Mean±SD) | 18.93±6.28 | 19.81±7.24 | 0.596 | 0.553 |
| 第1天SOFA评分(Mean±SD) | 7.02±3.68 | 8.36±3.74 | 1.696 | 0.093 |
| 来源情况(例,%) | 4.705 | 0.195 | ||
| 急诊 | 15(32.61) | 18(40.00) | ||
| 本院其他科室 | 7(15.22) | 13(28.89) | ||
| 其他医院 | 9(19.57) | 5(11.11) | ||
| 手术室转入 | 15(32.61) | 9(20.00) | ||
| 基础疾病(例,%) | ||||
| 哮喘 | 3(6.52) | 2(4.44) | 0.229 | 0.889 |
| 慢性阻塞性肺疾病 | 10(21.74) | 12(26.67) | 0.352 | 0.764 |
| 冠心病 | 21(45.65) | 17(37.78) | 0.413 | 0.703 |
| 高血压 | 31(68.89) | 30(66.67) | 0.242 | 0.811 |
| 2型糖尿病 | 16(34.78) | 18(40.00) | 0.376 | 0.743 |
| 恶性肿瘤 | 6(13.04) | 9(20.00) | 0.448 | 0.698 |
| 慢性肾脏疾病 | 5(10.87) | 8(17.78) | 0.567 | 0.596 |
| 注:APACHE Ⅱ评分,急性生理及慢性健康评分;SOFA评分,序贯器官功能衰竭评估评分 | ||||
ICU内撤销限制医疗措施的患者共10例,试验组5例(10.87%),对照组5例(11.11%),两组比较差异无统计学意义(P > 0.05)。
2.2 胃液相关指标 2.2.1胃液pH值监测情况两组胃液pH值总体变化趋势一致,第一个24 h内两组pH值较为接近,此后对照组pH值水平始终高于试验组,并在第四个24 h后两组pH值曲线更趋接近(图 2)。
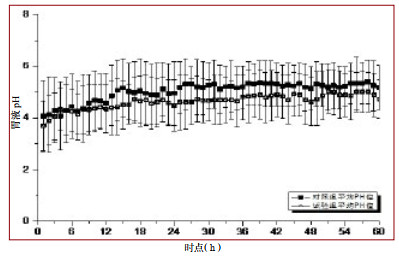
|
| 图 2 两组患者胃液pH变化趋势 Fig 2 Trend of intragastric pH change in patients of two groups |
|
|
罗沙替丁治疗组pH值≥4.0的患者占比稳步增加,在第2天时达到82.48%,在第5天时增加至90.76%,与对照组相比,两组差异无统计学意义(P > 0.05)。
每24 h内胃液pH均数的结果显示罗沙替丁治疗组患者在第一个24 h内即达到4.0以上,为(4.24±0.76),并持续稳定上升至第5天的5.08±0.77。与对照组相比,存在性别差异,在女性患者中两组比较差异无统计学意义,而在男性患者对照组患者的pH均数高于试验组,见表 2~3。
| 时点 | 性别 | 胃液pH≥4时间百分率 | F值 | P值 | |
| 试验组 (n=46) |
对照组 (n=45) |
||||
| 第1天 | 男 | 62.08±35.61 | 74.88±37.12 | 1.323 | 0.191 |
| 女 | 78.24±26.59 | 63.17±38.92 | 1.321 | 0.196 | |
| 合计 | 69.46±32.51 | 71.76±37.53 | 0.313 | 0.755 | |
| 第2天 | 男 | 82.28±28.41 | 86.33±24.50 | 0.582 | 0.563 |
| 女 | 82.71±30.55 | 83.58±36.23 | 0.073 | 0.942 | |
| 合计 | 82.48±29.07 | 85.60±27.68 | 0.524 | 0.601 | |
| 第3天 | 男 | 87.64±17.27 | 93.06±14.69 | 1.290 | 0.202 |
| 女 | 82.48±28.48 | 94.00±15.23 | 1.294 | 0.205 | |
| 合计 | 85.28±22.94 | 93.31±14.66 | 1.984 | 0.050 | |
| 第4天 | 男 | 89.64±18.98 | 96.09±11.80 | 1.590 | 0.117 |
| 女 | 86.38±28.45 | 98.17±4.28 | 1.417 | 0.167 | |
| 合计 | 88.15±23.55 | 96.64±10.33 | 1.457 | 0.129 | |
| 第5天 | 男 | 92.32±15.74 | 96.00±8.90 | 1.128 | 0.264 |
| 女 | 88.90±20.99 | 100.00±0.00 | 1.819 | 0.079 | |
| 合计 | 90.76±18.19 | 97.07±7.80 | 1.527 | 0.135 | |
| 时点 | 性别 | 胃液pH平均值 | F值 | P值 | |
| 试验组 (n=46) |
对照组 (n=45) |
||||
| 第1天 | 男 | 4.08±0.76 | 4.62±1.10 | 2.103 | 0.040 |
| 女 | 4.44±0.73 | 4.05±1.01 | 1.265 | 0.215 | |
| 合计 | 4.24±0.76 | 4.47±1.09 | 1.142 | 0.256 | |
| 第2天 | 男 | 4.48±0.64 | 5.03±1.01 | 2.369 | 0.021 |
| 女 | 4.83±1.01 | 5.14±1.18 | 0.804 | 0.428 | |
| 合计 | 4.64±0.84 | 5.06±1.05 | 2.107 | 0.038 | |
| 第3天 | 男 | 4.56±0.60 | 5.23±0.80 | 3.477 | 0.001 |
| 女 | 4.93±0.99 | 5.42±0.95 | 1.362 | 0.183 | |
| 合计 | 4.73±0.81 | 5.28±0.84 | 3.151 | 0.002 | |
| 第4天 | 男 | 4.75±0.64 | 5.27±0.72 | 2.875 | 0.006 |
| 女 | 4.89±0.64 | 5.16±0.74 | 1.463 | 0.149 | |
| 合计 | 4.88±0.83 | 5.36±0.75 | 2.858 | 0.005 | |
| 第5天 | 男 | 5.04±1.01 | 5.69±0.70 | 2.579 | 0.015 |
| 女 | 5.19±0.91 | 5.70±0.82 | 1.614 | 0.116 | |
| 合计 | 5.08±0.77 | 5.62±0.78 | 2.296 | 0.029 | |
罗沙替丁治疗组患者5 d内pH值的变化呈现了较好的稳定性,其总变异系数仅为0.15±0.07,每日变异系数维持在0.08~0.13,与对照组相比,差异无统计学意义(P > 0.05),见表 4。
| 观察指标 | 胃液pH值稳定性 | F值 | P值 | |
| 试验组 (n=46) |
对照组 (n=45) |
|||
| 总体变异 | 0.15±0.07 | 0.17±0.10 | 1.214 | 0.228 |
| 第1天 | 0.13±0.06 | 0.14±0.12 | 0.525 | 0.601 |
| 第2天 | 0.10±0.06 | 0.10±0.08 | 0.162 | 0.871 |
| 第3天 | 0.09±0.06 | 0.08±0.05 | -1.429 | 0.156 |
| 第4天 | 0.08±0.06 | 0.07±0.04 | -1.412 | 0.162 |
| 第5天 | 0.08±0.05 | 0.07±0.04 | -0.875 | 0.384 |
两组患者入组第1~5天的消化道出血发生率差异无统计学意义,见表 5。
| 时点 | 出血情况 | 消化道出血情况 | χ2值 | P值 | |
| 试验组 (n=46) |
对照组 (n=45) |
||||
| 第1天 | 无出血 | 31(67.39) | 36(80.00) | 2.273 | 0.332 |
| 隐性出血 | 15(32.61) | 9(20.00) | |||
| 大出血 | 0 | 0 | |||
| 第2天 | 无出血 | 31(67.39) | 34(75.56) | 1.462 | 0.567 |
| 隐性出血 | 15(32.61) | 11(24.44) | |||
| 大出血 | 0 | 1(2.22) | |||
| 第3天 | 无出血 | 29(63.04) | 31(68.89) | 0.087 | 0.768 |
| 隐性出血 | 17(36.96) | 14(31.11) | |||
| 大出血 | 0 | 0 | |||
| 第4天 | 无出血 | 29(63.04) | 29(64.44) | 0.064 | 0.872 |
| 隐性出血 | 17(36.96) | 15(33.33) | |||
| 大出血 | 0 | 1(2.22) | |||
| 第5天 | 无出血 | 26(56.52) | 27(60.00) | 1.112 | 0.693 |
| 隐形出血 | 19(41.30) | 18(40.00) | |||
| 大出血 | 1(2.18) | 0 | |||
两组患者ICU内死亡、转出ICU、住院时间、28 d病死率均差异无统计学意义,见表 6。
| 结局指标 | 试验组 (n = 46) |
对照组 (n = 45) |
χ2值 | P值 |
| ICU内死亡(例,%) | 7(15.22) | 8(17.78) | 0.082 | 0.764 |
| 转出ICU(例,%) | 28(60.87) | 29(64.44) | 1.136 | 0.691 |
| 住院天数[d, M(QL, QU)] | 22(10, 34) | 26(17, 52) | 3.147 | 0.116 |
| 28 d内死亡(例,%) | 12(23.91) | 12(26.67) | 1.028 | 0.715 |
两组患者胃肠营养支持治疗方面差异无统计学意义,见表 7。
| 观察指标 | 试验组 (n=46) |
对照组 (n=45) |
χ2值 | P值 |
| 第1天营养支持 | 6(13.04) | 5(11.11) | 0.369 | 0.852 |
| 第2天营养支持 | 28(60.87) | 25(55.56) | 0.998 | 0.724 |
| 第3天营养支持 | 31(67.39) | 28(62.22) | 0.827 | 0.746 |
| 第4天营养支持 | 40(86.96) | 39(86.67) | - | 0.988 |
| 第5天营养支持 | 42(91.30) | 43(95.56) | 0.556 | 0.768 |
试验组与对照组均未发生药物相关不良反应以及具有临床意义的新发感染。胃液细菌培养结果提示为ICU内常见病原菌,符合ICU中病原学流行病学特点,其中以革兰阴性杆菌为主,包括铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌、阴沟肠杆菌及大肠埃希菌等,少部分患者监测出革兰阳性球菌、杆菌及酵母菌,用药前后对比病原菌种类无明显变化。
3 讨论应激性黏膜病变(SRMD)是危重症患者的常见问题[3],SRMDB分为隐性出血、显性出血、有重要临床意义的大出血三种类型[16]。既往研究显示在未接受预防治疗的ICU患者中,隐性出血的发生率为15%~50%,显性出血发生率为5%~25%[17-18]。因此,针对危重症患者这一SRMD高危群体采取预防措施是不可忽视的环节而且已经达成共识[2]。目前预防SRMD的药物主要有三种:抑酸药,包括PPI类和H2RA类药物;抗酸药,包括氢氧化铝、铝碳酸镁、5%碳酸氢钠溶液等;胃黏膜保护剂,如硫糖铝等。抗酸药和胃黏膜保护剂降低SRMD相关出血风险的效果不及PPI和H2RA针剂,因此目前临床上首选抑酸药物,其中PPI类应用比例明显高于H2RA类[19]。但是,PPI与H2RA的治疗效果相比并不具有肯定优势[20-21]。Meta分析显示PPI预防ICU的危重患者的SRMDB优于H2RA[22-23],由于纳入分析的研究中存在低或极低证据的研究,偏倚难以避免[24]。但仅对其中证据等级高的研究进行亚组分析,结论也不支持PPI比H2RA更能降低出血率(RR=0.60,95%CI:0.27~1.35,P=0.21)[24-25]。近期一项大型回顾性队列研究纳入35 312例ICU机械通气时间≥24 h的患者,分析比较PPI或H2RA预防治疗患者消化道出血并发症情况,结果显示PPI组的消化道出血比例较高(5.9% vs 2.1%;P < 0.05),倾向评分校正后风险仍显著较高(OR=2.24;95% CI:1.81~2.76)[9]。本研究两组患者5 d内SRMDB发生率差异无统计学意义。
预防SRMDB应有效且合理抑酸,既往研究显示,维持胃内pH值≥4即可保护胃黏膜免受酸性损害,预防SRMDB的发生[1, 4-6, 26]。PPI与H2RA可通过不同的抑酸机制升高胃内pH值,还可促进血小板聚集和纤维蛋白凝块的形成,有利于止血和预防再出血[18]。一项研究发现,奥美拉唑静脉滴注80 mg即可使胃内pH值明显升高,24 h pH达(5.57±0.93),pH≥4.0的时间百分比达(81.07±15.75)%[27]。另有研究发现口服罗沙替丁150 mg可使胃内pH显著升高,24 h pH达(4.5±1.1)[28]。还有研究证实,连续监测罗沙替丁与奥美拉唑治疗后6 h胃内pH值,研究结果显示,罗沙替丁组前6 h胃内平均pH值显著高于奥美拉唑组(4.43 vs 2.65,P=0.036 7)[4],提示罗沙替丁升高胃内pH更迅速。尽管奥美拉唑提升胃内pH值作用优于H2RA,但有重要临床意义的大出血的发生差异无统计学意义[29]。本研究发现,罗沙替丁可迅速升高胃液pH值达到4.0以上,而奥美拉唑可迅速升高胃液pH值达到5.0以上,且两组pH值≥4.0的时间百分比差异无统计学意义,两组患者胃液酸度的变化趋势一致,且稳定性良好。研究同时证实,两组消化道出血发生率及其类型差异无统计学意义,提示罗沙替丁与奥美拉唑具有相似的控制胃液酸度及预防消化道出血的作用及效力。随着24 h动态pH监测的广泛开展,多项研究发现,每日两次标准剂量的PPI类药物仍不足以抑制夜间胃酸分泌,仍然有泌酸高峰出现。夜间胃内pH < 4.0的时间超过60 min称为夜间酸突破(nocturnal acid breakthrough,NAB)。ICU中部分危重症患者夜间不明原因的躁动即可能与此有关,NAB现象对SRMDB的预防极为不利[30],而H2RA无此不良反应。
胃内pH值> 4.0是预防SRMD的目标,合并出血时建议将pH值提升至6.0以上,PPI抑酸作用强,一度被推荐作为治疗的首选。但是越来越多的研究提示,ICU患者使用PPI使胃内pH值≥6.0,可以导致肺炎和腹泻增加,此外PPI存在着明显的药物之间的相互作用[7-12, 32]。PPI强效抑酸造成胃内低酸或无酸环境,导致胃肠道防御功能下降,细菌过度生长,带菌胃液反流致咽部细菌定植,咽部分泌物或反流的胃内容物发生误吸时,细菌即进入下呼吸道繁殖引起感染[33]。失去胃酸屏障致胃内细菌定植和肠道菌群过度生长,腹泻比例上升[9, 34]。研究表明,胃液pH值大于5.0,呼吸机相关肺炎发生率可高达69.2%[35],肺炎的发生率随着胃液pH值的升高而上升,尤其是耐药菌肺炎如耐万古霉素肠球菌及多重耐药的肺炎克雷伯杆菌肺炎[36],肺部感染的病原菌与消化道细菌具有80%以上的同源性[37]。此外,使用PPI将胃液pH值升高至5.0以上会导致难辨梭状芽孢杆菌大量生长[38],其所致的腹泻发生率显著增高,PPI的使用已经成为ICU患者并发院内获得性肺炎及呼吸机相关性肺炎的独立危险因素。本研究发现,两组均未发生新发肺炎及其他局部或全身性感染,未获得有临床意义的病原学阳性检查结果,病原菌阳性结果考虑与原发病及病原菌定植有关,未发现定植菌增加肺炎或其他部位感染风险的证据,从两组患者的胃液pH均数对比来看,罗沙替丁甚至可能具有更高的安全性。另外,PPI类药物作为肝药酶CYP2C19的抑制剂,会降低同样经由CYP2C19代谢的氯吡格雷、R-华法林及其他维生素K拮抗剂等常用药物的代谢,致其全身暴露量升高,反而增加出血风险[7]。罗沙替丁是最新一代H2RA类药物,可显著升高胃液pH值,24 h均数可达4.39,具有较高的选择性和竞争性,不依赖食物刺激,不干扰其他药物在肝脏内的代谢,较前三代药物有更强的抗胃酸分泌效力及胃黏膜保护作用[39],而且没有PPI上述不良反应[40-42]。
本研究发现接受PPI治疗的男性患者其胃液pH值水平明显高于女性,另一项关于反流性食道炎患者的研究中也发现,男性患者抑酸效果较好,而女性患者对PPI的疗效不佳[43],这可能与男性患者酸反流较多,女性患者幽门螺旋杆菌感染率高、胃黏膜腺体萎缩严重,且常合并胃肠道动力及情绪障碍有关[44]。而近期研究却发现,女性患者在接受长期PPI治疗中剂量减半的可能性高于男性3倍[45],因此不同性别患者对抑酸药物治疗的反应差异可能需要更加长期的监测以及更多的研究论证。尽管本研究发现男性患者接受PPI治疗胃液pH值水平较高,但男性及女性患者的胃液pH均数均达到4.0这一有效预防及治疗SRMDB的理论值,且时间百分比差异无统计学意义。
目前发表的指南多推荐危重症患者在入ICU 24~48 h内启动肠内营养[46]。《2015年应激性黏膜病变预防与治疗—中国普通外科专家共识意见》提出,早期应用肠内营养可增加消化道黏膜血流量,增加黏膜能量和代谢底物的供应,促进黏液和具有细胞保护作用的前列腺素E的释放,是预防SRMD的有效措施之一[1]。El-Kersh等[47]发现,应用肠内营养并使用PPI并不能使机械通气患者受益。也有研究显示,给予肠内营养对SRMD的预防作用甚至优于PPI及H2RA的应用[48]。本研究中试验组与对照组营养支持情况差异无统计学意义,ICU内的SRMDB发生率与营养支持启动时机及喂养量无关联,考虑与入组患者大多选择早期启动肠内营养,对消化道黏膜发挥了改善代谢、减轻应激及促进修复等保护作用有关。
综上所述,注射用罗沙替丁可迅速提高并维持胃液pH值至4.0以上,从而有效预防SRMDB的发生;与奥美拉唑比较,两者在抑制胃酸分泌、控制应激性消化道出血等方面具有相似的疗效,在合并新发感染、药物不良反应等方面,与奥美拉唑具有相似甚至更好的安全性。
本研究样本量较小,病例收集过程较为集中,观察周期较短,入选患者既往消化道功能、黏膜病变情况、是否存在胃内幽门螺旋杆菌定植及胃液pH值基础水平等资料收集不足。同时,不同性别患者主要疾病及伴随疾病等并未进行亚组分析。本研究重点分析了机械通气≤5 d时段内的胃液病原学检查结果,并未针对机械通气 > 5 d的病原学情况进行统计分析,而后者与上消化道的细菌定植关系密切[47]。此外,本研究未将肺泡灌洗液的病原学检查结果与胃液标本进行对比分析。因此,本研究结论需更大样本量、延长研究周期并丰富上述相关因素的临床研究以深入探讨。
利益冲突 所有作者均声明不存在利益冲突
| [1] | 中华医学会外科学分会. 应激性黏膜病变预防与治疗——中国普通外科专家共识(2015)[J]. 中国实用外科杂志, 2015, 35(7): 728-730. DOI:10.7504/CJPS.ISSN1005-2208.2015.07.10 |
| [2] | 柏愚, 李延青, 任旭, 等. 应激性溃疡防治专家建议(2018版)[J]. 中华医学杂志, 2018, 98(42): 3392-3395. DOI:10.3760/cma.j.issn.0376-2491.2018.42.003 |
| [3] | Bardou M, Quenot JP, Barkun A. Stress-related mucosal disease in the critically ill patient[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(2): 98-107. DOI:10.1038/nrgastro.2014.235 |
| [4] | Iida H, Kato S, Sekino Y, et al. Early effects of oral administration of omeprazole and roxatidine on intragastric pH[J]. J Zhejiang Univ Sci B, 2012, 13(1): 29-34. DOI:10.1631/jzus.b1100078 |
| [5] | Hastings PR, Skillman JJ, Bushnell LS, et al. Antacid titration in the prevention of acute gastrointestinal bleeding:a controlled, randomized trial in 100 critically ill patients[J]. N Engl J Med, 1978, 298(19): 1041-1045. DOI:10.1056/NEJM197805112981901 |
| [6] | Welage LS. Overview of pharmacologic agents for acid suppression in critically ill patients[J]. Am J Health Syst Pharm, 2005, 62(10 Suppl 2): S4-S10. DOI:10.1093/ajhp/62.10_Supplement_2.S4 |
| [7] | Bateman BT, Bykov K, Choudhry NK, et al. Type of stress ulcer prophylaxis and risk of nosocomial pneumonia in cardiac surgical patients: cohort study[J]. BMJ, 2013, 347(sep19 1): f5416. DOI:10.1136/bmj.f5416 |
| [8] | 孙家艳, 王兵侠, 曹鹏, 等. 质子泵抑制剂预防重症患者应激性溃疡获益与风险的队列研究:附1972例病例分析[J]. 中华危重病急救医学, 2019, 31(5): 539-544. DOI:10.3760/cma.j.issn.2095-4352.2019.05.004 |
| [9] | MacLaren R, Reynolds PM, Allen RR. Histamine-2 receptor antagonists vs proton pump inhibitors on gastrointestinal tract hemorrhage and infectious complications in the intensive care unit[J]. JAMA Intern Med, 2014, 174(4): 564-574. DOI:10.1001/jamainternmed.2013.14673 |
| [10] | Aseeri M, Schroeder T, Kramer J, et al. Gastric acid suppression by proton pump inhibitors as a risk factor for clostridium difficile-associated diarrhea in hospitalized patients[J]. Am J Gastroenterol, 2008, 103(9): 2308-2313. DOI:10.1111/j.1572-0241.2008.01975.x |
| [11] | Park YH, Seong J, Cho S, et al. Effects of proton pump inhibitor use on risk of Clostridium difficile infection:a hospital cohort study[J]. J Gastroenterol, 2019, 54(12): 1052-1060. DOI:10.1007/s00535-019-01598-2 |
| [12] | Tantry US, Kereiakes DJ, Gurbel PA. Clopidogrel and proton pump inhibitors: influence of pharmacological interactions on clinical outcomes and mechanistic explanations[J]. JACC Cardiovasc Interv, 2011, 4(4): 365-380. DOI:10.1016/j.jcin.2010.12.009 |
| [13] | McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient:Society of Critical Care Medicine(SCCM) and American Society for Parenteral and Enteral Nutrition(A.S.P.E.N.)[J]. JPEN J Parenter Enteral Nutr, 2016, 40(2): 159-211. DOI:10.1177/0148607115621863 |
| [14] | Cook DJ. Stress ulcer prophylaxis in critically ill patients. Resolving discordant meta-analyses[J]. JAMA, 1996, 275(4): 308-314. DOI:10.1001/jama.275.4.308 |
| [15] | Sesler JM. Stress-related mucosal disease in the intensive care unit:an update on prophylaxis[J]. AACN Adv Crit Care, 2007, 18(2): 119-126. DOI:10.1097/01.aacn.0000269254.39967.8e |
| [16] | Cook DJ, Griffith LE, Walter SD, et al. The attributable mortality and length of intensive care unit stay of clinically important gastrointestinal bleeding in critically ill patients[J]. Crit Care, 2001, 5(6): 368-375. DOI:10.1186/cc1071 |
| [17] | Wei JJ, Jiang RC, Li LH, et al. Stress-related upper gastrointestinal bleeding in adult neurocritical care patients: a Chinese multicenter, retrospective study[J]. Curr Med Res Opin, 2019, 35(2): 181-187. DOI:10.1080/03007995.2018.1448261 |
| [18] | 于学忠, 郭树彬, 周荣斌, 等. 中国急性胃黏膜病变急诊专家共识[J]. 中国急救医学, 2015, 35(9): 769-775. DOI:10.3969/j.issn.1002-1949.2015.09.001 |
| [19] | Krag M, Perner A, Wetterslev J, et al. Stress ulcer prophylaxis in the intensive care unit:an international survey of 97 units in 11 countries[J]. Acta Anaesthesiol Scand, 2015, 59(5): 576-585. DOI:10.1111/aas.12508 |
| [20] | Toews I, George AT, Peter JV, et al. Interventions for preventing upper gastrointestinal bleeding in people admitted to intensive care units[J]. Cochrane Database Syst Rev, 2018, 6: CD008687. DOI:10.1002/14651858.CD008687.pub2 |
| [21] | Lilly CM, Aljawadi M, Badawi O, et al. Comparative effectiveness of proton pump inhibitors vs histamine type 2 receptor blockers for preventing clinically important gastrointestinal bleeding during intensive care: a population-based study[J]. Chest, 2018, 154(3): 557-566. DOI:10.1016/j.chest.2018.05.015 |
| [22] | 周峻峰, 万献尧, 黄伟, 等. H2受体拮抗剂与质子泵抑制剂预防重症监护病房患者应激性溃疡出血和肺炎发生率的荟萃分析[J]. 中华危重病急救医学, 2010, 22(4): 221-225. DOI:10.3760/cma.j.issn.1003-0603.2010.04.009 |
| [23] | 邢晓璇, 梁华玉, 褚燕琦, 等. 质子泵抑制剂和H2受体阻滞剂预防应激性溃疡的系统评价再评价[J]. 实用药物与临床, 2017, 20(9): 1032-1038. DOI:10.14053/j.cnki.ppcr.201709012 |
| [24] | Barletta JF, Bruno JJ, Buckley MS, et al. Stress ulcer prophylaxis[J]. Crit Care Med, 2016, 44(7): 1395-1405. DOI:10.1097/CCM.0000000000001872 |
| [25] | Alhazzani W, Alenezi F, Jaeschke RZ, et al. Proton pump inhibitors versus histamine 2 receptor antagonists for stress ulcer prophylaxis in critically ill patients:a systematic review and meta-analysis[J]. Crit Care Med, 2013, 41(3): 693-705. DOI:10.1097/ccm.0b013e3182758734 |
| [26] | Allen ME, Kopp BJ, Erstad BL. Stress ulcer prophylaxis in the postoperative period[J]. Am J Health Syst Pharm, 2004, 61(6): 588-596. DOI:10.1093/ajhp/61.6.588 |
| [27] | 李珍, 胡晋红, 邹多武, 等. 静脉滴注奥美拉唑药代动力学和24 h动态pH监测[J]. 中国临床药理学杂志, 2000, 16(4): 286-288. DOI:10.3969/j.issn.1001-6821.2000.04.013 |
| [28] | Lazzaroni M, Sangaletti O, Bargiggia S, et al. Twenty-four-hour intragastric acidity following early evening or bedtime administration of roxatidine in duodenal ulcer patients[J]. Aliment Pharmacol Ther, 1996, 10(2): 187-191. DOI:10.1046/j.1365-2036.1996.716896000.x |
| [29] | Solouki M, Marashian SM, Kouchak M, et al. Comparison between the preventive effects of ranitidine and omeprazole on upper gastrointestinal bleeding among ICU patients[J]. Tanaffos, 2009, 8(4): 37-42. |
| [30] | 赵宏军, 张晓苹, 孙新芳, 等. 急性脑梗死患者应激性溃疡夜间酸突破现象研究[J]. 中国全科医学, 2010, 13(33): 3718-3720. DOI:10.3969/j.issn.1007-9572.2010.33.005 |
| [31] | 中国医师协会急诊医师分会. 中国急性胃黏膜病变急诊专家共识[J]. 中华急诊医学杂志, 2015, 24(10): 1072-1077. DOI:10.3760/cma.j.issn.1671-0282.2015.10.004 |
| [32] | Dial S, Delaney JA, Barkun AN, et al. Use of gastric acid-suppressive agents and the risk of community-acquired Clostridium difficile-associated disease[J]. JAMA, 2005, 294(23): 2989-2995. DOI:10.1001/jama.294.23.2989 |
| [33] | Eom CS, Jeon CY, Lim JW, et al. Use of acid-suppressive drugs and risk of pneumonia: a systematic review and meta-analysis[J]. Can Med Assoc J, 2011, 183(3): 310-319. DOI:10.1503/cmaj.092129 |
| [34] | Buendgens L, Bruensing J, Matthes M, et al. Administration of proton pump inhibitors in critically ill medical patients is associated with increased risk of developing Clostridium difficile–associated diarrhea[J]. J Crit Care, 2014, 29(4): 696.e11-696.e15. DOI:10.1016/j.jcrc.2014.03.002 |
| [35] | Daschner F, Reuschenbach K, Pfisterer J, et al. The effect of stress ulcer prevention on the incidence of pneumonia in artificial respiration[J]. Anaesthesist, 1987, 36(1): 9-18. |
| [36] | Stiefel U, Rao A, Pultz MJ, et al. Suppression of gastric acid production by proton pump inhibitor treatment facilitates colonization of the large intestine by vancomycin-resistant enterococcus spp. and klebsiella pneumoniae in clindamycin-treated mice[J]. Antimicrob Agents Chemother, 2006, 50(11): 3905-3907. DOI:10.1128/aac.00522-06 |
| [37] | 杨光, 万献尧, 吴向东. 危重症患者抑酸剂的选择[J]. 大连医科大学学报, 2010, 32(4): 441-443. |
| [38] | Buendgens L, Koch A, Tacke F. Prevention of stress-related ulcer bleeding at the intensive care unit:Risks and benefits of stress ulcer prophylaxis[J]. World J Crit Care Med, 2016, 5(1): 57-64. DOI:10.5492/wjccm.v5.i1.57 |
| [39] | 黄建权, 吕俊玲, 胡欣. 罗沙替丁醋酸酯药理作用与临床评价[J]. 中国新药杂志, 2014, 23(14): 1601-1605. |
| [40] | Jayatilaka S, Shakov R, Eddi R, et al. Clostridium difficile infection in an urban medical center:five-year analysis of infection rates among adult admissions and association with the use of proton pump inhibitors[J]. Ann Clin Lab Sci, 2007, 37(3): 241-247. DOI:10.0000/PMID17709687 |
| [41] | 庞宁, 郭代红, 王啸宇, 等. 基于自动监测系统的罗沙替丁与奥美拉唑临床用药安全性评价研究[J]. 药物流行病学杂志, 2018, 27(3): 176-179, 208. |
| [42] | Alhazzani W, Alshahrani M, Moayyedi P, et al. Stress ulcer prophylaxis in critically ill patients:review of the evidence[J]. Pol Arch Med Wewn, 2012, 122(3): 107-114. DOI:10.20452/pamw.1173 |
| [43] | 张国玲, 代小菊. 胃食管反流病患者的临床特征及其预后的影响因素分析[J]. 中国综合临床, 2016, 32(11): 1009-1012. DOI:10.3760/cma.j.issn.1008-6315.2016.11.012 |
| [44] | Hiyama T, Yoshihara M, Tanaka S, et al. Strategy for treatment of nonerosive reflux disease in Asia[J]. World J Gastroenterol, 2008, 14(20): 3123-3128. DOI:10.3748/wjg.14.3123 |
| [45] | Helgadóttir H, Metz DC, Lund SH, et al. Study of gender differences in proton pump inhibitor dose requirements for GERD[J]. J Clin Gastroenterol, 2017, 51(6): 486-493. DOI:10.1097/mcg.0000000000000542 |
| [46] | 江利冰, 李瑞杰, 刘丽丽, 等. 欧洲重症监护医学会危重症患者早期肠内营养临床实践指南[J]. 中华急诊医学杂志, 2017, 26(3): 270-271. DOI:10.3760/cma.j.issn.1671-0282.2017.03.007 |
| [47] | El-Kersh K, Jalil B, McClave SA, et al. Enteral nutrition as stress ulcer prophylaxis in critically ill patients: A randomized controlled exploratory study[J]. J Crit Care, 2018, 43: 108-113. DOI:10.1016/j.jcrc.2017.08.036 |
| [48] | Huang HB, Jiang W, Wang CY, et al. Stress ulcer prophylaxis in intensive care unit patients receiving enteral nutrition:a systematic review and meta-analysis[J]. Crit Care, 2018, 22(1): 20-28. DOI:10.1186/s13054-017-1937-1 |
| [49] | Kollef MH. Prevention of hospital-associated pneumonia and ventilator-associated pneumonia[J]. Crit Care Med, 2004, 32(6): 1396-1405. DOI:10.1097/01.ccm.0000128569.09113.fb |
 2020, Vol. 29
2020, Vol. 29




