重症肺炎是呼吸重症监护室常见的急危重症,极易引起急性呼吸窘迫综合征(ARDS)[1],一旦进展为ARDS,其呼吸窘迫、进行性低氧血症和呼吸衰竭更为严重。重症肺炎ARDS患者常合并感染性休克,病死率可达50%以上;及早了解血容量状态,精准控制液体量[2],并寻求简单快速的生物学指标进行预后预测,尽早进行干预措施和治疗方案的调整,对患者至关重要。Yang等[3]报道血清sFlt-1对脓毒症的诊断有一定的价值,笔者的研究已经证实血清sFlt-1可以预测重症肺炎患者28 d的病死率[4]。脉搏指示连续心排出量(PICCO)能精确连续监测心排量、血流动力学及EVLWI的变化,对感染性休克患者能起到很好的指导作用[5]。考虑到sFlt-1对重症肺炎的预后价值以及PICCO对感染性休克的指导价值,本研究回顾性分析探讨EVLWI联合sFlt-1在PICCO监测指导下对重症肺炎ARDS合并感染性休克患者的预后评估作用。
1 资料与方法 1.1 一般资料选取2016年1月至2017年12月入住郑州大学附属郑州中心医院RICU的重症肺炎ARDS合并感染性休克行PICCO监测并存活超过72 h的患者52例。重症肺炎的诊断标准符合2007年美国胸科学会和美国感染病学会制定的标准[6];ARDS的诊断标准符合“2012柏林定义”的制定的标准[7];感染性休克诊断符合中国严重脓毒症/脓毒性休克治疗指南(2014)[8]。根据28 d的预后情况将患者分为存活(31例)和死亡(21例)两组。
1.2 病例纳入和排除标准纳入标准:①年龄≥18岁,男女不限;②患病前均无免疫系统疾病;③同意参加试验者。排除标准:①孕期及哺乳期妇女;②过敏体质;③严重心、肝、肾功能不全者;④恶性肿瘤者;⑤严重精神障碍者;⑥不适合行PICCO检查的患者如房颤或心脏大量分流患者。本研究通过郑州大学附属郑州中心医院伦理委员会批准,所有入选患者均由本人或其家属签订知情同意书。
1.3 检测指标和方法 1.3.1 PICCO监测和数据收集入院患者取平卧位,经锁骨下静脉置入中心静脉导管(7.5 Fr,双腔导管,美国Arrow公司),连接监护仪,记录中心静脉压(CVP)。由股动脉置入PiCCO导管,连接PICCO监测仪(德国Pulsion公司),锁骨下静脉导管接PiCCO温度探头,测量时快速(5 s内)注入15 mL冰盐水,监测平均动脉压(MAP)、心排血指数(CI)、全心舒张期末容积指数(GEDVI)、胸腔内血容量指数(ITBVI)、EVLWI等,至少连续测量3次,取3次变异量<15%的数值。分别在入科第1、2、3天时记录各监测指标。
1.3.2 sFlt-1检测方法血清sFlt-1采用酶联免疫吸附试验(ELISA)法,试剂盒为人类sFlt-1/sVEGFR-1 ELISA Kit(Quantikine®,美国R & D Systems,Inc.)。
1.3.3 观察和收集指标收集两组患者入院时的身高、体质量、感染情况、血常规、肝肾功能、凝血功能,入住RICU的时间、血乳酸水平、血清sFlt-1水平和氧合指数(PaO2/FiO2),入院24 h内完成APACHEⅡ评分(采用APACHE Ⅱ评分系统1.0软件进行)和序贯器官衰竭评分(SOFA评分)以及28 d的生存率。于1 d、2 d和3 d时检测以上各指标并记录。
1.4 统计学方法用SPSS 17.0软件进行统计学处理,两组计数资料采用卡方(χ2)检验。计量资料正态分布者以均数±标准差(x±s)表示,非正态分布者以中位数(四分位间距,IQR)表示,两组组间方差齐性采用Levene检验,方差齐性两组间差异采用t检验,方差不齐采用Mann-Whitney U检验;两组以上定量资料采用单因素方差分析或Kruskal-Wallis检验;多因素分析采用Logistic多元回归分析;双变量之间的相关性采用Pearson相关分析法;绘制各指标对预后评价的受试者工作特征曲线(receiver-operating characteristic curve,ROC),比较ROC曲线下面积(AUC)、敏感度和特异度,通过Logistic回归形成联合预测因子,构建ROC曲线,确定联合指标预后的AUC。以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般临床资料比较共纳入重症肺炎ARDS合并感染性休克行PICCO监测且存活超过72 h的患者52例,其中男性32例,女性20例,年龄(58.33±18.64)岁。根据28 d预后分为存活组31例(59.62%),死亡组21例(40.38%),总病死率40.38%(21/52)。患者入选流程见图 1。存活组和死亡组之间性别、年龄、体质量指数(BMI)、合并的基础疾病、WBC、CRP、ALT、AST、BUN、PLT、PaO2/FiO2等差异无统计学意义(P均 > 0.05),死亡组血乳酸显著升高(P < 0.01);入院24 h内,死亡组APACHEⅡ评分和SOFA评分明显高于存活组(P均 < 0.05),RICU住院时间明显低于存活组(P < 0.05),见表 1。
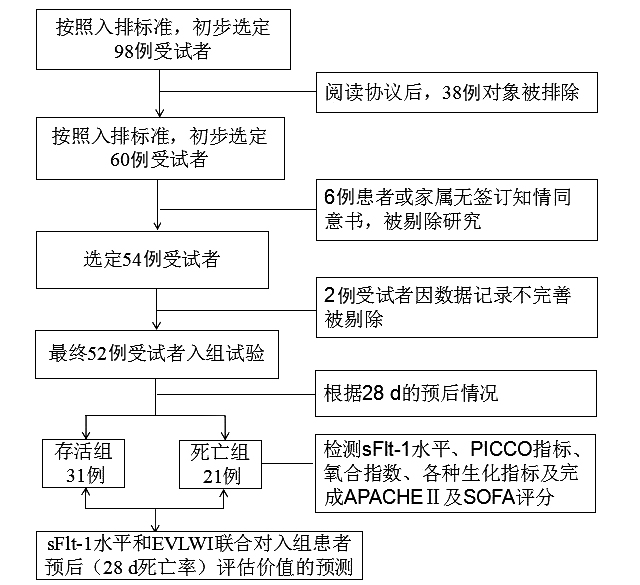
|
| 图 1 患者入选流程图 Figure 1 Research process flowchart |
|
|
| 指标 | 存活组 (n=31) |
死亡组 (n=21) |
检验值 | P值 |
| 年龄(岁) | 65.95±16.17 | 66.60±15.72 | t=-1.135 | 0.257 |
| 性别(男/女) | 18/13 | 14/7 | χ2=0.392 | 0.532 |
| BMI(kg/cm2) | 22.09±1.52 | 21.96±1.45 | t=1.469 | 0.142 |
| 伴发基础疾病(例) | ||||
| 高血压病 | 16 | 11 | χ2=0.003 | 0.957 |
| 冠心病 | 10 | 8 | χ2=0.188 | 0.664 |
| Ⅱ型糖尿病 | 11 | 9 | χ2=0.288 | 0.592 |
| 脑血管病 | 6 | 6 | χ2=0.599 | 0.439 |
| 慢性阻塞性肺疾病 | 3 | 4 | χ2=0.944 | 0.331 |
| WBC(×109/L) | 11.80±4.35 | 12.76±4.67 | t=-0.754 | 0.454 |
| CRP(mg/L) | 135.59±57.57 | 144.04±55.63 | t=-0.526 | 0.601 |
| PLT(×109/L) | 155.77±62.37 | 138.31±53.31 | t=1.048 | 0.299 |
| BUN[mmol/L,M(QL,QU)] | 10.76(4.96,21.68) | 13.18(6.59,22.37) | Z=-0.823 | 0.368 |
| ALT(U/L) | 51.73±31.81 | 65.52±43.77 | t=-1.317 | 0.194 |
| AST(U/L) | 59.32±41.74 | 78.52±66.05 | t=-1.286 | 0.204 |
| 血乳酸(mmol/L) | 5.85±2.03 | 7.17±3.12 | t=-2.847 | 0.011 |
| PaO2/FiO2(mmHg) | 138.56±29.07 | 127.47±27.95 | t=1.370 | 0.177 |
| APACHE Ⅱ评分 | 26.85±4.45 | 30.17±4.84 | t=-2.551 | 0.014 |
| SOFA评分 | 9.35±2.93 | 11.45±3.34 | t=-2.403 | 0.020 |
| RICU住院时间 | 9.96±2.26 | 8.33±2.15 | t=2.609 | 0.012 |
死亡组患者第1天的EVLWI明显高于存活组(P < 0.05),两组MAP、CI、GEDVI和ITBVI差异无统计学意义(P均 > 0.05),见表 2。
| 指标 | 存活组(n=31) | 死亡组(n=21) | t值 | P值 |
| MAP(mm Hg) | 41.23±14.67 | 39.45±15.38 | 0.963 | 0.203 |
| CI[L/(min· m2)] | 4.10±0.53 | 4.03±0.61 | 0.401 | 0.531 |
| EVLWI(mL/kg) | 10.48±2.42 | 12.08±2.71 | -2.311 | 0.025 |
| GEDVI(mL/m2) | 558.23±52.14 | 542.18±57.39 | 0.384 | 0.593 |
| ITBVI(mL/m2) | 11.80±4.35 | 12.76±4.67 | -0.754 | 0.454 |
在治疗第1、2、3天,随着治疗时间的延长,存活组EVLWI值、sFlt-1水平、血乳酸、APACHEⅡ评分和SOFA评分均明显降低(P均 < 0.05),PaO2/FiO2明显升高(P < 0.001);而死亡组EVLWI、sFlt-1水平和SOFA评分明显升高(P均 < 0.05)。两组间比较发现,死亡组在治疗第1、2、3天时的EVLWI值、sFlt-1水平、血乳酸、APACHEⅡ评分和SOFA评分均高于存活组(P均 < 0.05),而PaO2/FiO2在治疗第2、3天时明显低于存活组(P < 0.01),见表 3。
| 指标 | 治疗1 d | 治疗2 d | 治疗3 d | P值 |
| EVLWI(mL/kg) | ||||
| 存活组 (n=31) |
10.48±2.42 | 9.17±2.11 | 7.84±1.91 | < 0.001 |
| 死亡组 (n=21) |
12.08±2.71a | 13.48±2.45b | 14.36±2.51b | 0.019 |
| sFlt-1(ng/L) | ||||
| 存活组 (n=31) |
544.40±146.89 | 507.59±131.72 | 427.75±176.73 | 0.011 |
| 死亡组 (n=21) |
762.70±175.76b | 688.02±168.85b | 647.01±163.50b | 0.010 |
| PaO2/FiO2(mmHg) | ||||
| 存活组 (n=31) |
138.56±29.07 | 160.69±38.47 | 192.10±34.18 | < 0.001 |
| 死亡组 (n=21) |
127.47±27.95 | 118.58±28.51b | 121.20±24.40b | 0.552 |
| 血乳酸(mmol/L) | ||||
| 存活组 (n=31) |
5.85±2.03 | 4.56±1.56 | 3.85±1.03 | 0.008 |
| 死亡组 (n=21) |
7.17±3.12b | 6.28±3.59b | 6.70±2.39b | 0.812 |
| APACHEⅡ评分 | ||||
| 存活组 (n=31) |
26.85±4.45 | 21.82±2.90 | 18.42±3.57 | < 0.001 |
| 死亡组 (n=21) |
30.17±4.84a | 29.99±4.14b | 32.14±4.76b | 0.250 |
| SOFA评分 | ||||
| 存活组 (n=31) |
9.35±2.93 | 8.77±2.40 | 7.21±2.13 | 0.004 |
| 死亡组 (n=21) |
11.45±3.34a | 13.52±3.62b | 14.63±4.16b | 0.021 |
| 注:同时间点两组间比较采用t检验,aP < 0.05,bP < 0.01 | ||||
以患者存活情况为因变量,单因素分析中与预后显著相关的指标(sFlt-1水平、EVLWI、血乳酸)为自变量(表 3),筛选危险因素,结果表明sFlt-1和EVLWI与重症肺炎ARDS合并感染性休克死亡密切相关(P均 < 0.05),见表 4。
| 相关因素 | B值 | χ2值 | OR值 | 95%CI | P值 |
| sFlt-1(ng/L) | 0.98 | 20.47 | 5.17 | 3.42~8.37 | 0.001 |
| EVLWI(mL/kg) | 1.52 | 15.32 | 3.52 | 2.85~6.49 | 0.006 |
| 血乳酸(mmol/L) | 1.23 | 3.86 | 1.85 | 0.86~3.51 | 0.068 |
重症肺炎ARDS合并感染性休克患者在入住RICU治疗1、2、3 d时的sFlt-1水平分别与EVLWI及APACHEⅡ评分均显著相关(P均 < 0.01),见图 2。
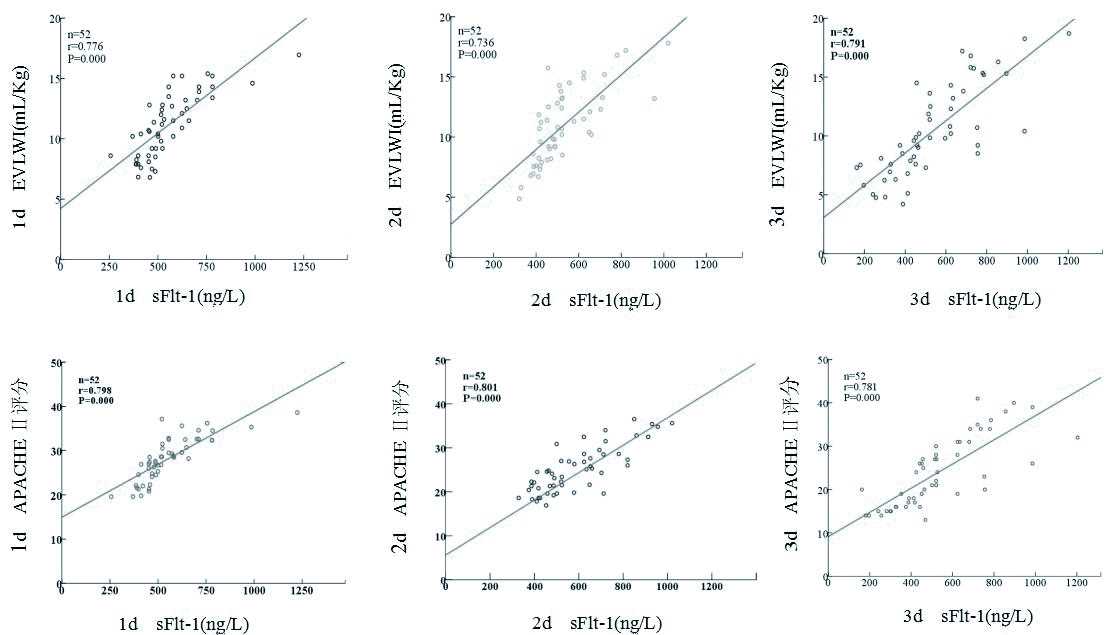
|
| 图 2 重症肺炎ARDS合并感染性休克患者入住RICU在不同时间点血清sFlt-1与EVLWI和APACHEⅡ评分的相关性 Figure 2 Correlation between serum sFlt-1 and EVLWI and APACHEⅡscores of patients with ARDS complicated with septic shock caused by severe pneumonia in RICU at the different times |
|
|
入住RICU第1、3天时,sFlt-1联合EVLWI预后评估的敏感度和特异度分别为89.7%,78.2%和86.3%,75.7%,AUC分别为0.875和0.856(P均 < 0.01),分别大于同期其他指标的AUC,见表 5和图 3。
| 指标 | AUC(x±s) | 95%CI(%) | P值 | 截断值 | 敏感度(%) | 特异度(%) |
| 1 d sFlt-1 | 0.826±0.058 | 71.3~93.9 | < 0.01 | 585.30 | 81.0 | 71.0 |
| 1 d EVLWI | 0.786±0.064 | 66.1~91.2 | 0.001 | 10.30 | 85.7 | 64.5 |
| 1 d APACHEⅡ评分 | 0.793±0.065 | 66.5~92.2 | < 0.01 | 27.33 | 79.5 | 68.4 |
| 1 d SOFA评分 | 0.814±0.059 | 69.9~92.9 | < 0.01 | 11.50 | 73.0 | 80.6 |
| 1 d sFlt-1+EVLWI | 0.875±0.055 | 76.7~96.3 | < 0.01 | 0.865 | 89.7 | 78.2 |
| 3 d sFlt-1 | 0.801±0.061 | 68.1~92.1 | < 0.01 | 507.00 | 81.0 | 77.4 |
| 3 d EVLWI | 0.819±0.062 | 69.8~93.9 | < 0.01 | 10.25 | 71.4 | 80.6 |
| 3 d APACHEⅡ评分 | 0.820±0.059 | 70.3~93.6 | < 0.01 | 18.50 | 85.7 | 67.7 |
| 3 d SOFA评分 | 0.812±0.058 | 69.8~92.5 | < 0.01 | 11.53 | 71.4 | 74.2 |
| 3 d sFlt-1+EVLWI | 0.856±0.051 | 75.7~95.6 | < 0.01 | 0.857 | 86.3 | 75.7 |
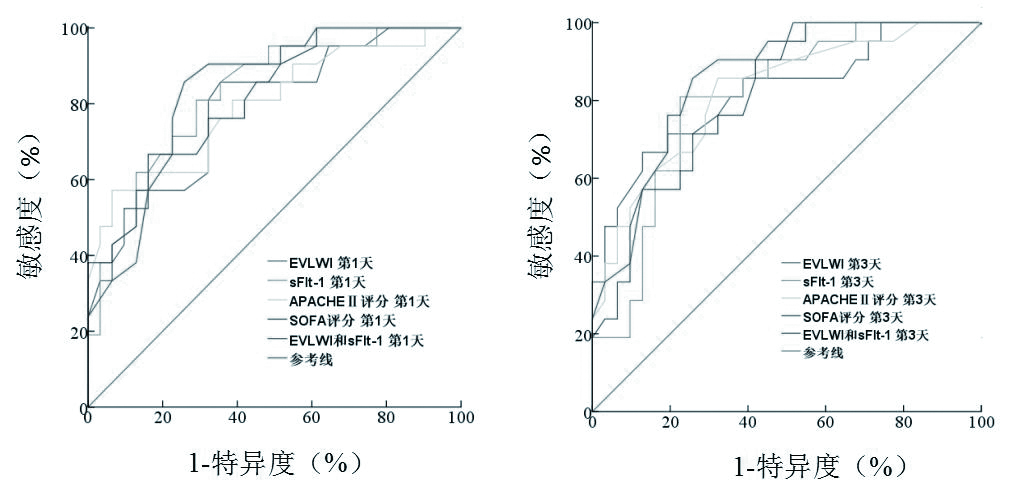
|
| 图 3 重症肺炎ARDS合并感染性休克患者入RICU第1天和第3天各指标对预后评估的ROC曲线 Figure 3 ROC curve for the indexes of prognosis of patients with ARDS complicated with septic shock caused by severe pneumonia in RICU on the 1st and 3rd |
|
|
重症肺炎的病理基础是感染引发的一系列炎症反应、促炎因子释放、血液动力学改变,即患者血液中内毒素水平升高和失控的全身炎症反应导致多器官衰竭[9],重症肺炎ARDS主要表现为毛细血管通透性升高,以肺泡、毛细血管屏障作用改变,血管外肺水增加[10]。该类患者合并感染性休克,则病死率极高,在病程中存在多种炎症因子的参与。早期报道CRP、PCT、IL-6及PTX3等炎症因子作为生物标志物,但其敏感度、特异度不高或存在争议,APACHEⅡ评分评估重症患者病情严重程度及预后,虽准确但繁琐。重症肺炎ARDS合并感染性休克患者病情危急,迫切需要寻找对其预后评估简单易行的生物标志物[11],及早进行干预治疗方案的调整。
近年来发现在抗血管生成中起重要作用的因子—sFlt-1,是一种具有酪氨酸激酶活性的糖蛋白,其通过减弱干扰血管内皮生长因子(VEGF)-VEGFR-1依赖的单核细胞和巨噬细胞的活化和迁移产生抗炎作用[12]。本研究中,检测入组患者的sFlt-1水平,结果说明sFlt-1与病情的严重程度密切相关,sFlt-1水平越高,病情越重,而有效治疗后,sFlt-1水平下降(表 3、图 2)。既往研究表明感染性休克患者具有较高sFlt-1水平,sFlt-1可作为判断脓毒症严重程度有用的生物标志物[14]。Shapiro等[16]研究显示在脓毒血症中,血清sFlt-1在预测疾病严重程度或感染性休克中有潜在作用,sFlt-1水平的变化被认为是对VEGF依赖的炎症反应的代偿保护。笔者既往研究[4]也表明,血清sFlt-1有望成为预测重症肺炎疾病严重程度及预后预测的分子标志物。这些既往研究和本研究结果提示:sFlt-1在重症肺炎引发的感染性休克的炎症反应中可能发挥了重要作用。本研究证实sFlt-1水平在治疗第1天和第3天分别与APACHEⅡ评分显著正相关(P均 < 0.01),提示sFlt-1水平越高,APACHEⅡ评分越高,患者病情越重,病死率越高,即sFlt-1水平与重症肺炎ARDS合并感染性休克患者的严重程度有关。ROC分析曲线显示,患者入住RICU1 d和3 d时,sFlt-1对重症肺炎ARDS并感染性休克患者预后评估的敏感度和特异度分别为81.0%及71.0%和81.0%及77.4%,AUC分别为0.826和0.801(P均 < 0.01),即对该患者预测能力中等,敏感度或特异性稍差,若能寻找联合简单易行的生物学指标,提高预测效能,更有价值。
重症肺炎ARDS合并感染性休克患者以毛细血管通透性增高,导致肺泡和毛细血管屏障作用改变,表现为血管外肺水增加,可造成肺水肿及组织破坏。临床上采用PICCO技术实时监测指导下采取优化的液体管理策略,连续动态监测患者EVLWI具有重要的意义[17],可指导血管活性药物选择及剂量调整,监测液体量,尽早进行精准的液体复苏,避免液体负荷过度。一项随机对照多中心研究[18]共纳入708例ARDS、感染性休克或该两种疾病合并的患者,结果发现PICCO监测可以改善ARDS及感染性休克等危重患者的预后,对重症监护的液体管理提供新证据。
表 3单因素分析结果表明,EVLWI值、sFlt-1水平、血乳酸、APACHEⅡ评分和SOFA评分在第1、2、3天均与预后显著相关(P均 < 0.05)。研究提示EVLWI(> 13.8 mL/kg)较高时,采取的治疗措施对患者的预后不良,患者的PaO2/FiO2也无改善,需更换治疗方案;EVLWI较低时,患者的PaO2/FiO2明显升高,预后较好。回顾性分析74例脓毒症患者,得出PTX3与EVLWI联合可作为临床早期评估脓毒症患者的病情及预测预后的生物标志物[17]。本研究和高延秋等[19-20]研究结果一致。本研究采用Logistic回归分析预后相关的独立危险因素,表 4表明EVLWI和sFlt-1与预后密切相关,均可以作为重症肺炎ARDS并感染性休克患者预后预测的独立危险因素,目前国内外未进行该项研究。
本研究相关性分析显示,重症肺炎ARDS合并感染性休克患者在入住RICU治疗1 d、2 d和3 d时的sFlt-1水平分别与EVLWI及APACHEⅡ评分均显著相关(P均 < 0.01)。提示患者病情越重,APACHEⅡ评分越高,sFlt-1水平和EVLWI也越高,降低sFlt-1水平和EVLWI,有助于减轻病情,改善预后。目前,临床上常将APACHEⅡ评分和SOFA评分用于评价危重症患者病情严重程度和预后的指标[21-23],虽准确但程序繁琐。本研究表 5的ROC分析显示,将sFlt-1联合EVLWI进行Logistic回归,形成联合预测因子进行预后评估,其敏感度和特异度分别为89.7%,78.2%和86.3%,75.7%,AUC分别为0.875和0.856(P均 < 0.01),均优于同期其他单独评价指标。说明sFlt-1和EVLWI单独作为重症肺炎ARDS并感染性休克患者预后评估的指标,预测能力不够稳定,特异度相对稍差,联合检测血清sFlt-1和EVLWI,对重症肺炎ARDS并感染性休克早期预后评估的敏感度和特异度均提高,操作简便,能动态监测,预测准确性更高,同时可以指导液体精准复苏和纠正ARDS及抗休克治疗的过程,两者形成互补,对改善患者预后更有价值。
综上所述,血清学指标sFlt-1和动态监测EVLWI的联合应用提高了重症肺炎ARDS并感染性休克患者预后预测效能,能早期快速指导临床进行治疗方案的调整,同时也为sFlt-1作为感染性疾病的生物标志物的开发提供参考。本研究中纳入的病例数较少,尚需进行大规模、多中心的临床研究加以证实,并深入进行sFlt-1的机制探讨。
| [1] | Chen C, Shi L, Li Y, et al. Disease-specific dynamic biomarkers selected by integrating inflammatory mediators with clinical informatics in ARDS patients with severe pneumonia[J]. Cell Biol Toxicol, 2016, 32(3): 169-184. DOI:10.1007/s10565-016-9322-4 |
| [2] | Silversides JA, Major E, Ferguson AJ, et al. Conservative fluid management or deresuscitation for patients with sepsis or acute respiratory distress syndrome following the resuscitation phase of critical illness: a systematic review and meta-analysis[J]. Intensive Care Med, 2017, 43(2): 155-170. DOI:10.1007/s00134-016-4573-3 |
| [3] | Yang KY, Liu KT, Chen YC, et al. Plasma soluble vascular endothelial growth factor receptor-1 levels predict outcomes of pneumonia-related septic shock patients: a prospective observational study[J]. Crit Care, 2011, 15(1): R11. DOI:10.1186/cc9412 |
| [4] | 高延秋, 张华, 李双凤, 等. 血浆可溶性血管内皮生长因子受体1在重症肺炎患者中的诊断与预测价值[J]. 郑州大学学报(医学版), 2017, 52(1): 63-67. DOI:10.13705/j.issn.1671-6825.2017.01.017 |
| [5] | 孙照琨, 陈蕊, 熊日成, 等. 老年脓毒血症性休克患者脉搏指示连续心排血量技术检测血流动力学特点[J]. 中华老年医学杂志, 2018, 37(4): 409-412. DOI:10.3760/cma.j.issn.0254-9026.2018.04.012 |
| [6] | Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults[J]. Clin Infect Dis, 2007, 44(suppl 2): S27-72. DOI:10.1086/511159 |
| [7] | Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [8] | 中国医师协会急诊医师分会. 中国急诊感染性休克临床实践指南[J]. 中华急诊医学杂志, 2016, 25(3): 274-287. DOI:10.3760/cma.j.issn.1671-0282.2016.03.005 |
| [9] | Tagami T, Matsui H, Yasunaga H. Antithrombin and mortality in severe pneumonia patients with sepsis-associated disseminated intravascular coagulation:an observational nationwide study: reply[J]. J Thromb Haemost, 2015, 13(4): 680-682. DOI:10.1111/jth.12821 |
| [10] | 李寅, 路玲, 王勇强, 等. 急性肺损伤时人中性粒细胞明胶酶相关脂质运载蛋白与血管外肺水指数的相关性分析[J]. 中华急诊医学杂志, 2017, 26(8): 873-878. DOI:10.3760/cmmj.issn.1671-0282.2017.08.008 |
| [11] | Huang H, Ideh RC, Giatu E, et al. Discovery and validation of biomarkers to guide clinical management of pneumonia in African children[J]. Clin Infect Dis, 2014, 58(12): 1707-1715. DOI:10.1093/cid/ciu202 |
| [12] | Zhang H, Wei L, Zhao G, et al. Periplaneta americana extract used in patients with systemic inflammatory response syndrome[J]. World J Emerg Med, 2016, 7(1): 50-54. DOI:10.5847/wjem.j.1920–8642.2016.01.009 |
| [13] | Martin-Saavedra FM, Wilson CG, Voellmy R, et al. Spatiotemporal control of vascular endothelial growth factor expression using a heat-shock-activated, rapamycin-dependent gene switch[J]. Hum Gene Ther Methods, 2013, 24(3): 160-170. DOI:10.1089/hgtb.2013.026 |
| [14] | Ostrowski SR, Sørensen AM, Windeløv NA, et al. High levels of soluble VEGF receptor 1 early after trauma are associated with shock, sympathoadrenal activation, glycocalyx degradation and inflammation in severely injured patients: a prospective study[J]. Scand J Trauma Resusc Emerq Med, 2012, 20(1): 27. DOI:10.1186/1757-7241-20-27 |
| [15] | Tsao PN, Chan FT, Wei SC, et al. Soluble vascular endothelial growth factor receptor-1 protects mice in sepsis[J]. Crit Care Med, 2007, 35(8): 1955-1960. DOI:10.1097/01.CCM.0000275273.56547.B8 |
| [16] | Shapiro NI, Yano K, Okada H, et al. A prospective, observational study of soluble FLT-1 and vascular endothelial growth factor in sepsis[J]. Shock, 2008, 29(4): 452-457. DOI:10.1097/SHK.0b013e31815072c1 |
| [17] | Liu XY, Ji WL, Wang JF, et al. Application strategy of PICCO in septic shock patients[J]. Exp Ther Med, 2016, 11(4): 1335-1339. DOI:10.3892/etm.2016.3040 |
| [18] | Zhang ZH, Xu X, Yao M, et al. Use of the PiCCO system in critically ill patients with septic shock and acute respiratory distress syndrome: a study protocol for a randomized controlled trial[J]. Trials, 2013, 14(1): 32. DOI:10.1186/1745-6215-14-32 |
| [19] | 高延秋, 张根生, 张华, 等. PICCO在重症肺炎ARDS合并感染性休克患者治疗中的应用研究[J]. 中华急诊医学杂志, 2018, 27(6): 663-667. DOI:10.3760/cma.j.issn.1671-0282.2018.06.018 |
| [20] | Horster S, Stemmler HJ, Strecher N, et al. Cardiac output measurements in septic patients: comparing the accuracy of USCOM to PiCCO[J]. Crit Care Res Pract, 2012, 2012: 270631. DOI:10.1155/2012/270631 |
| [21] | Desai S, Lakhani JD. Utility of SOFA and APACHE Ⅱ score in sepsis in rural set up MICU[J]. J Assoc Physicians India, 2013, 61(9): 608-611. |
| [22] | 刘慧琳, 刘桂花. 脓毒症患者降钙素原与APACHEⅡ评分的相关性探讨[J]. 中华急诊医学杂志, 2012, 21(4): 371-374. DOI:10.3760/cma.j.issn.1671-0282.2012.04.009 |
| [23] | 杨旭, 刘志. 联合应用早期体温峰值及48 h-△SOFA评分对急诊脓毒症患者预后评估的临床价值[J]. 中华急诊医学杂志, 2016, 25(1): 68-72. DOI:10.3760/cma.j.issn.1671-0282.2016.01.016 |
 2018, Vol. 27
2018, Vol. 27




