脓毒症的发病是复杂的环境因素和遗传因素共同作用导致的获得性疾病[1-2]。大量研究证实肠道屏障损害是脓毒症发生发展过程的“扳机点”,因此研究脓毒症肠道损伤机制可为治疗脓毒症开启新思路。IL-6、高迁移率族蛋白(HMGB1)均为重要的炎性介质,并在不同的时相均为致炎的关键点,而JAK/STAT途径与两者的产生密切相关[3-4]。本实验旨在建立脓毒症大鼠模型,通过使用抗IL-6单克隆抗体抑制脓毒症大鼠肠道炎症因子IL-6表达,观察IL-6/STAT3信号通路介导的炎症反应,探讨该通路是否对HMGB1有调控作用,以期为脓毒症治疗找到新的突破点。
1 材料与方法 1.1 主要试剂抗IL-6及抗HMGB1单克隆抗体购自英国Abcam公司;磷酸化(p)STAT3单克隆抗体购自美国GeneTex公司;免疫组化检测试剂盒购自北京中山生物技术公司;Western印迹检测试剂盒购自北京中杉金桥生物技术有限公司;二胺氧化酶(DAO)及D-乳酸试剂盒购自美国RD公司。
1.2 实验动物分组及构建模型实验动物分组:清洁级雄性SD大鼠120只,体质量200~250 g,购于福州吴氏实验动物中心,许可证:SCXK(闽)2014-0005。按随机数字表法随机分为三组:假手术组(S组),模型组(C组),治疗组(T组)。实验动物购买后饲养一周,水合氯醛麻醉后沿腹正中线切口,C组及T组采用盲肠结扎穿孔术(CLP)建立脓毒症模型,S组暴露盲肠,不行CLP,余操作同上。术后1 h T组腹腔注射抗IL-6单克隆抗体40 mg/kg,S组和C组腹腔注射等量乳酸钠林格液。分别在术后3 h、12 h、24 h、48 h从三组各取10只大鼠抽取心脏血5 mL,肝素抗凝,离心后置于-70 ℃冰箱备用。钝性分离小肠黏膜组织(距回盲部10 cm回肠),分块切割后用10%甲醛溶液固定,脱水包埋处理后制作石蜡切片,其余肠黏膜液氮冷冻,-70 ℃保存。
1.3 指标测定 1.3.1 小肠黏膜病理变化肠黏膜组织石蜡切片HE染色后参照Chiu法[5], 将小肠黏膜损伤分为六级:0级正常黏膜绒毛结构;1级肠黏膜绒毛顶端上皮下间隙增宽;2级绒毛上皮下间隙进一步扩大,绒毛顶端上皮抬高与固有层剥离;3级绒毛两边上皮成块脱落;4级上皮完全脱落仅有固有膜结构;5级黏膜固有膜崩解,出现出血和溃疡。
1.3.2 血浆二胺氧化酶(DAO)及D-乳酸测定参照试剂盒说明书采用分光光度法分别测定血浆DAO及D-乳酸浓度。
1.3.3 免疫组化法检测小肠黏膜HMGB1和IL-6蛋白表达具体操作按SP试剂盒说明。免疫组化结果判断:光镜下HMGB1阳性结果为细胞胞浆或胞核棕黄着色, IL-6阳性结果为细胞胞浆棕黄着色。每张切片随机选取5个高倍镜视野(×400)进行观察并摄片,用图像分析软件(Image Pro Plus 4.0)系统进行分析,计算阳性区域面积(area)、积分吸光度(IA),平均吸光度=IA/area,最后取平均光密度均值进行比较。
1.3.4 Western-blot检测小肠黏膜pSTAT3的表达称取100 mg小肠黏膜组织提取总蛋白,50 μg样本蛋白经SDS-PAGE电泳分离,半干电转后将蛋白质转移到NC膜上,封闭液封闭2 h,加入兔抗p‐STAT3单克隆抗体(用抗体稀释液稀释至1:500)、鼠抗β‐actin单克隆抗体(1:1 000)后与相应的二抗杂交,室温中孵育膜1 h,ECL发光法凝胶成像显示电泳条带,用Image凝胶图像处理系统分析目标带的分子量和净光密度值。分别取p-STAT3与β-Actin灰度值之比作为蛋白的相对表达量。
1.4 统计学方法计量资料以均数±标准差(x±s)表示,各时间点三组的病理评分、血浆DAO及D-乳酸浓度测定、IL-6与HMGB1蛋白表达组间均数比较采用单因素方差分析, 组间两两比较采用SNK检验。各时间点小肠黏膜病理评分与其HMGB1、IL-6蛋白表达相关性采用Spearman秩相关分析。使用SPSS 17.0软件对数据进行处理,以P < 0.05为差异有统计学意义。
2 结果 2.1 小肠黏膜形态变化及病理评分S组各时间点肠黏膜未见明显异常,病理评分无差异。C组与T组随时间推移,炎症反应加剧,小肠黏膜病理评分增高,在12 h、24 h、48 h小肠黏膜病理评分均高于S组。C组在12 h可见炎性细胞的浸润,小肠绒毛上皮下间隙明显增宽,绒毛顶端上皮与固有层剥离,48 h小肠黏膜大部分坏死脱落,肠黏膜形态改变,并伴大量中性粒细胞浸润,巨噬细胞增多,炎症反应显著。T组各时间点较C组损伤程度明显减轻,评分明显低于C组,见表 1。
| 组别 | 3 h | 12 h | 24 h | 48 h |
| S组 | 0.2±0.3 | 0.4±0.4 | 0.4±0.5 | 0.4±0.4 |
| C组 | 0.5±0.6 | 2.6±0.7a | 3.5±0.9a | 4.6±0.8a |
| T组 | 0.4±0.6 | 1.8±0.7ab | 2.8±0.6ab | 3.4±0.8ab |
| 注:与S组比较,aP < 0.05;与C组比较,bP < 0.05 | ||||
S组各时间点血浆DAO、D-乳酸浓度无明显差别,而C组及T组血浆DAO及D-乳酸浓度随时间延长逐渐增高,且在各时间点均高于S组,T组与C组相比,在12 h、24 h、48 h血浆DAO、D-乳酸浓度显著降低,见表 2。
| 指标 | 组别 | 3 h | 12 h | 24 h | 48 h |
| 血浆DAO(U/mL) | S组 | 2.97±0.22 | 3.03±0.12 | 3.12±0.13 | 3.30±0.14 |
| C组 | 4.55±0.08a | 6.55±0.37a | 9.88±0.19a | 14.30±0.45a | |
| T组 | 4.11±0.51a | 5.23±0.51ab | 7.66±0.34ab | 11.40±0.65ab | |
| 血浆D-乳酸(μg/mL) | S组 | 8.96±0.47 | 9.19±0.30 | 8.87±0.34 | 8.92±0.57 |
| C组 | 10.78±0.71a | 15.83±0.18a | 21.76±0.37a | 29.85±0.22a | |
| T组 | 10.07±0.30a | 13.49±0.36ab | 18.55±0.57ab | 26.27±0.72ab | |
| 注:与S组比较,aP < 0.05;与C组比较,bP < 0.05 | |||||
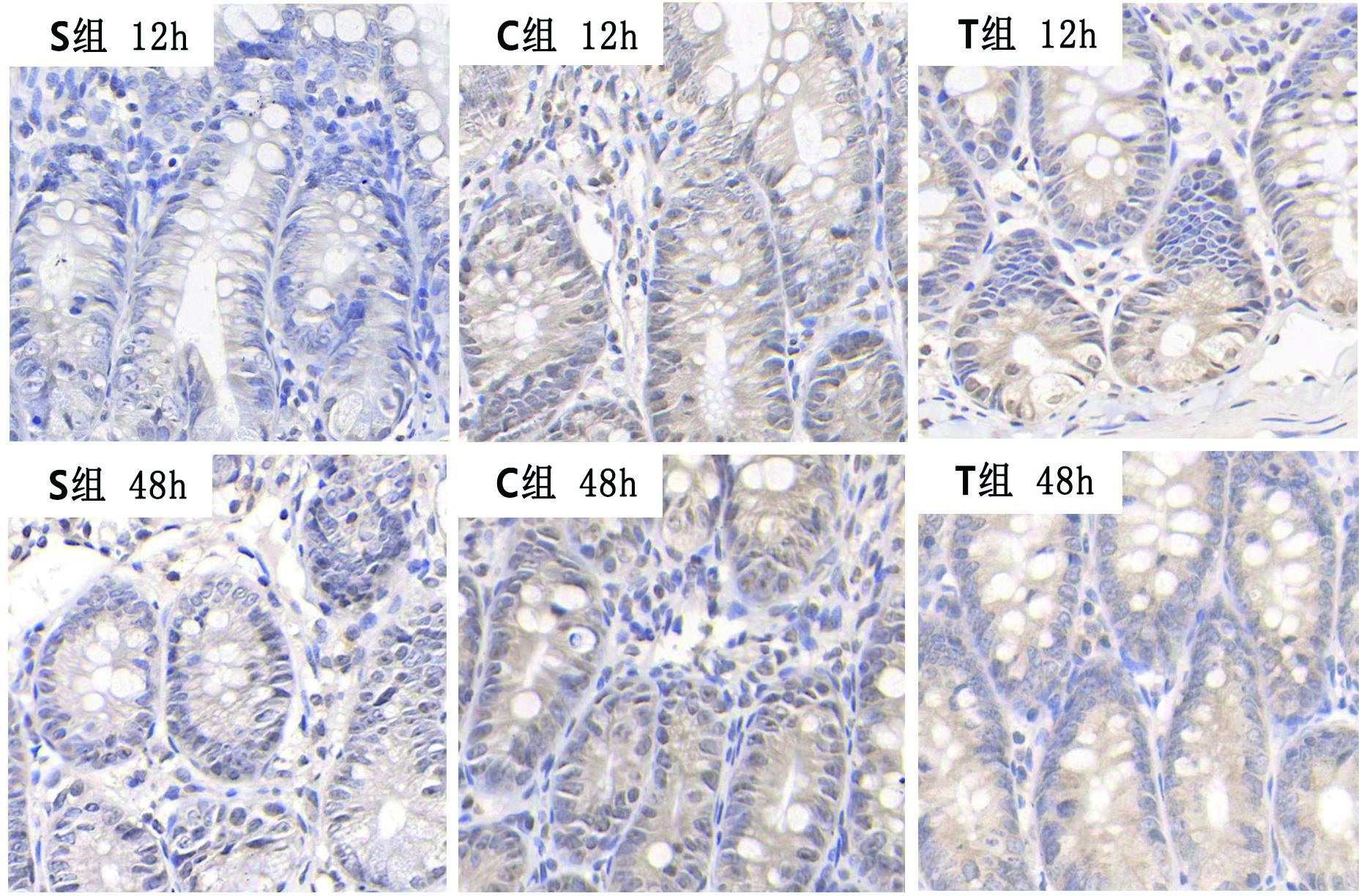
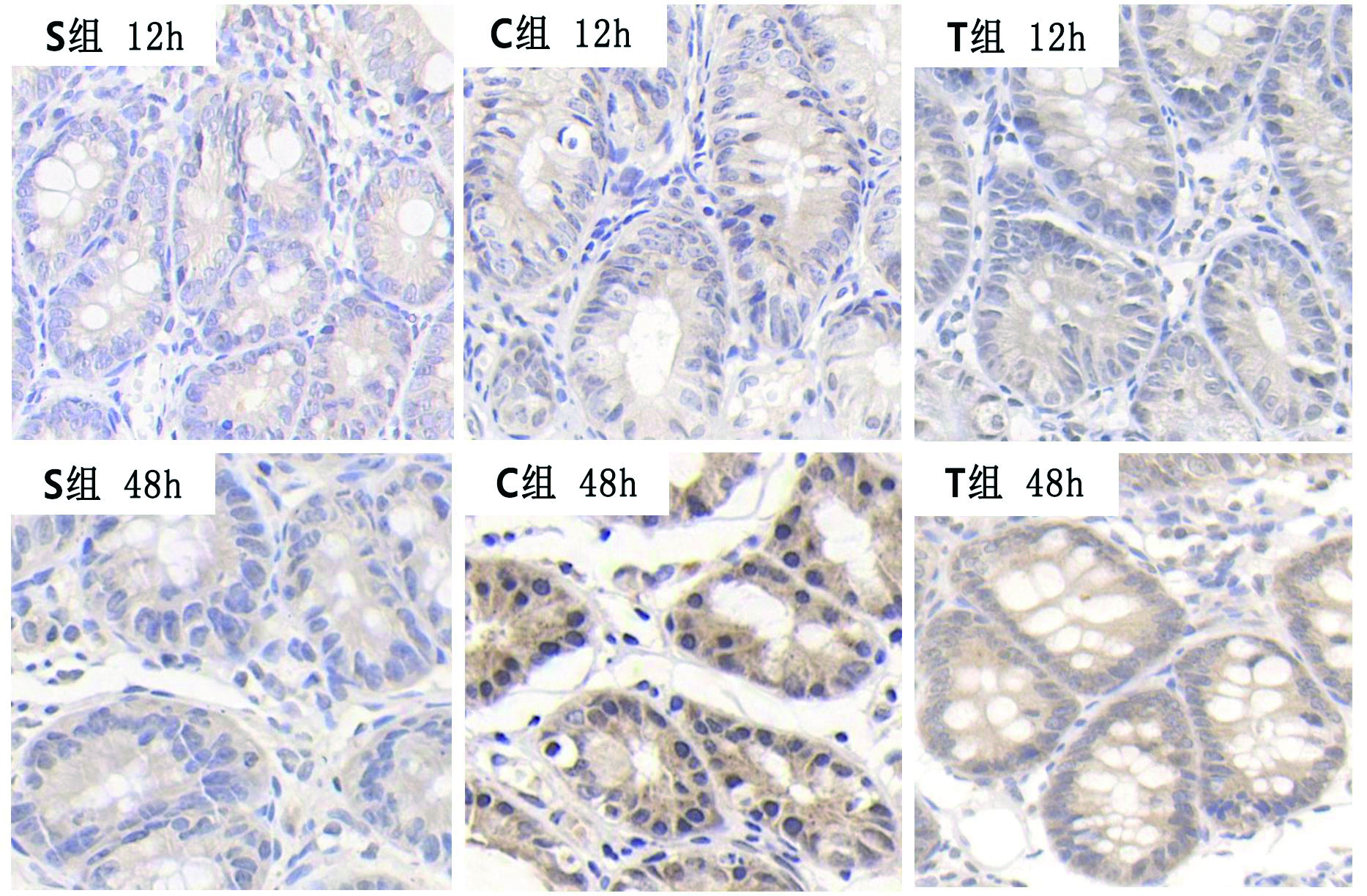
S组IL-6及HMGB1蛋白在各时间点表达无明显差异,与S组相比,C组和T组小肠黏膜IL-6、HMGBl表达明显增加,而与C组比较,T组小肠黏膜两者表达均减低,见表 3、图 1、2。
| 指标 | 组别 | 3 h | 12 h | 24 h | 48 h |
| IL-6 | S组 | 0.120 1±0.002 6 | 0.091 3±0.035 1 | 0.134 2±0.021 3 | 0.118 0±0.012 2 |
| C组 | 0.295 1±0.021 3a | 0.471 5±0.002 3a | 0.564 3±0.015 8a | 0.502 1±0.023 5a | |
| T组 | 0.260 1±0.032 1ab | 0.414 0±0.014 3ab | 0.520 1±0.021 2ab | 0.483 7±0.011 4ab | |
| HMGB1 | S组 | 0.291 0±0.002 1 | 0.282 3±0.011 7 | 0.303 2±0.013 2 | 0.311 2±0.012 4 |
| C组 | 0.301 1±0.003 6 | 0.367 5±0.023 0a | 0.512 4±0.010 8a | 0.628 0±0.014 2a | |
| T组 | 0.291 3±0.014 3 | 0.342 2±0.006 7a | 0.461 0±0.013 8ab | 0.575 3±0.020 1ab | |
| 注:与S组比较,aP < 0.05;与C组比较,bP < 0.05 | |||||
|
| 图 1 各组大鼠小肠组织IL-6表达(SP×400) Figure 1 The expression of IL-6 protein in intestinal mucosa of rats in different groups |
|
|
|
| 图 2 各组大鼠小肠粘膜HMGB1蛋白表达(SP×400) Figure 2 The expression of HMGB1 protein in intestinal mucosa of rats |
|
|
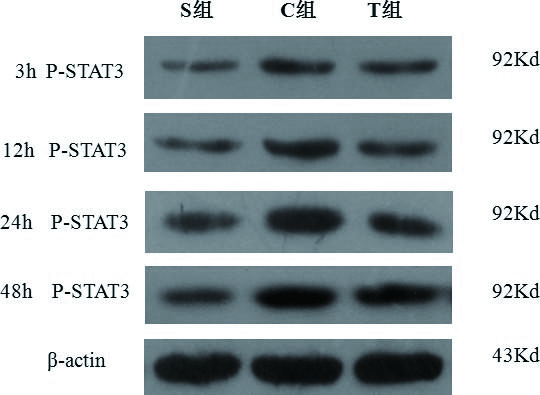
S组小肠黏膜p-STAT3在各时间点的蛋白表达均无明显差别,C组和T组在12 h、24 h、48 h的p-STAT3蛋白表达均高于S组,随时间延长C组p-STAT3的表达逐渐升高,T组各时间点表达趋势同C组,但表达水平相对较低,见表 4、图 3。
| 组别 | 3 h | 12 h | 24 h | 48 h |
| S组 | 0.13±0.02 | 0.13±0.01 | 0.14±0.03 | 0.13±0.03 |
| C组 | 0.22±0.05 | 0.57±0.05a | 0.73±0.07a | 0.86±0.06a |
| T组 | 0.25±0.03 | 0.43±0.04ab | 0.52±0.04ab | 0.41±0.03ab |
| 注:与S组比较,aP < 0.05;与C组比较,bP < 0.05 | ||||
|
| 图 3 各组大鼠小肠组织p-STAT3蛋白表达 Figure 3 The expression of p-STAT3protein in intestinal tissues of rats |
|
|
Spearman秩相关分析结果表明:小肠黏膜病理评分与其HMGB1、IL-6蛋白表达成正相关,见表 5。
| 指标 | 病理评分 | ||||
| 3 h | 12 h | 24 h | 48 h | ||
| HMGB1 | r值 | 0.237 | 0.572 | 0.665 | 0.702 |
| P值 | 0.078 | 0.026 | 0.010 | 0.008 | |
| IL-6 | r值 | 0.505 | 0.610 | 0.823 | 0.598 |
| P值 | 0.029 | 0.019 | 0.005 | 0.021 | |
在脓毒症发生早期,促炎因子与抑炎因子经常处于平衡/失衡相互对立统一的变化中,在众多促炎因子中,前炎症细胞因子TNF-α、IL-1β和IL-6起重要作用[6]。在SIRS和脓毒血症患者中,IL-6水平同其APACHEⅡ评分之间有显著的正相关性[7],因此,IL-6可作为反映机体炎症和疾病严重程度的重要指标。HMGB1是重症炎性疾病发病机制中的关键调控因子[8], 可引起脓毒症时肺、脑等脏器的损害,其表达水平与脓毒症患者预后高度相关[9-11]。为观察这两种炎症介质在脓毒症大鼠肠道损伤中的作用,本实验采用CLP法构建脓毒症大鼠模型,通过光镜下观察小肠黏膜形态学改变及检测血中DAO与D-乳酸来评估肠道损伤程度。DAO存在于小肠黏膜上层绒毛细胞的胞质中D-乳酸主要来源于肠道固有细菌的代谢和裂解产物, 当肠黏膜屏障受损时两者可进入血液循环, 因此检测血液中DAO、D-乳酸可以反映肠黏膜上皮细胞损伤程度和通透性改变[12-13]。本研究显示脓毒症组随时间推移,小肠黏膜炎症反应加剧,小肠组织病理评分及DAO、D-乳酸含量逐渐升高,并且HMGBl、IL-6蛋白表达明显增加,Spearman秩相关分析结果表明小肠黏膜病理评分与其IL-6、HMGB1蛋白表达成正相关,提示IL-6、HMGBl参与了脓毒症大鼠肠道损伤。
IL-6与受体结合后,与信号转导蛋白gpl30形成复合物而激活JAK2,JAK2可激活STAT3[14]。活化的STAT3易位到细胞核内后与相应基因启动子的STAT3结合位点结合,诱导HMGBl转录活性升高[15]。转录因子STAT3是一种膜上激活的核转录调节蛋白,通过JAK/STAT途径参与多种生长因子与细胞因子等细胞内信号转导[16]。有体外研究证实JAK2/STAT3信号通路参与了LPS诱发大鼠腹腔巨噬细胞HMGBl合成[17]。本实验通过注射抗IL-6单克隆抗体,特异性地与IL-6结合, 阻止IL-6与IL-6R结合形成IL-6/IL-6R/gpl30复合体, 从而阻止下游信号通路激活,抑制IL-6介导的促炎作用。实验显示抗IL-6单克隆抗体处理组病理评分及DAO、D-乳酸较单纯脓毒症组明显减低,IL-6、HMGBl、p-STAT3蛋白表达也明显下降。因此笔者推测抗IL-6单克隆抗体可能通过抑制IL-6而抑制了脓毒症大鼠肠黏膜组织p-STAT3的激活,进而抑制HMGB1蛋白的释放而减轻肠道黏膜损伤。反之也表明IL-6/STAT3信号通路具有上调脓毒症大鼠肠黏膜组织HMGBl的作用。因此,临床上以IL-6/STAT3-HMGB1发病机制作为干预的靶点对脓毒症肠道损伤治疗或许成为可能。
| [1] | 姚晨玲, 刘成龙, 宋振举, 等. 白介素-1受体相关蛋白酶-4基因多态性与脓毒症的易感性[J]. 中华急诊医学杂志, 2012, 21(2): 128-132. DOI:10.3760/cma.j.isn.1671-0282.2012.02.005 |
| [2] | Gu W, Zeng L, Zhou J, et al. Clinical relevance of 13cytokine gene polymorphisms in Chinese major trauma patients[J]. Intensive Care Med, 2010, 36(7): 1261-1265. DOI:10.1007/s00134-010-1797-5 |
| [3] | Lee MJ, LeeJK, Choi JW, et al. Interleukin-6 induces S100A9 expression in colonic epithelial cells through STAT3 activation in experimental ulcerative colitis[J]. PLoS One, 2012, 7(9): e38801. DOI:10.1371/journalpone.0038801 |
| [4] | 王松柏, 姚咏明, 董宁, 等. JAK/STAT通路介导脓毒症大鼠肝组织高迁移率族蛋白B1 mRNA表达的研究[J]. 中国危重病急救医学, 2003, 15(3): 147-149. DOI:10.3760/j.issn:1003-0603.2003.03.006 |
| [5] | Chiu CJ, McArdle AH, Brown R, et al. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg, 1970, 101(4): 478-483. DOI:10.1001/archsurg.1970.01340280030009 |
| [6] | Jarrar D, Kuebler JF, Rue LW, et al. Alveolar macrophage activation after trauma-hemorrhage and sepsis is dependent on NF-kappaB and MAPK/ERK mechanisms[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 283(4): 799-805. DOI:10.1152/ajplung.00465.2001 |
| [7] | Zhao XW, Yan L, Xu D, et al. Enterogenous infection of Candida albicans in immunocompromised rats under severe acute pancreatitis[J]. World J Emerg Med, 2016, 7(4): 294-299. DOI:10.5847/wjem.j.1920–8642.2016.04.010 |
| [8] | Yanai H, Matsuda A, An J, et al. Conditional ablation of HMGB1 in mice reveals its protective function against en- dotoxemia and bacterial infection[J]. Proc Natl Acad Sci USA, 2013, 110(51): 20699-20704. DOI:10.1073/pnas.1320808110 |
| [9] | 任超, 李秀花, 许碧磊, 等. 中枢拮抗高迁移率族蛋白B1对脓毒症脑损伤的影响[J]. 中华急诊医学杂志, 2016, 25(4): 433-438. DOI:10.3760/cma.j.issn.1671-0282.2016.04.008 |
| [10] | 金善子, 胡博, 栾正刚. 高迁移率族蛋白1在脓毒症急性肺损伤中作用的研究进展[J]. 中华急诊医学杂志, 2018, 27(4): 459-462. DOI:10.3760/cma.j.issn.1671-0282.2018.04.026 |
| [11] | Huang LF, Yao YM, Sheng ZY. Novel insights for high mobility group box 1 protein-mediated cellular immune response in sepsis: A systemic review[J]. World J Emerg Med, 2012, 3(3): 165-171. DOI:10.5847/wjem.j.issn.1920–8642.2012.03.001 |
| [12] | Luk GD, Bayless TM, Baylin SB. Diamine oxidase (histaminase). A circulating marker for rat intestinal mucosal maturation and integrity[J]. J Clin Invest, 1980, 66(1): 66-70. DOI:10.1172/JCI109836 |
| [13] | Sun XQ, Fu XB. Relationship between plasma D(-)-lactate and intestinal damage after severe injuries in rats[J]. World J Gastroenterol, 2001, 7(4): 555-8. DOI:10.3748/wjg.v7.i4.555 |
| [14] | Cooney RN. Suppressors of cytokine signaling(SOCS):inhibitors of the JAK/ STAT pathway[J]. Shock, 2002, 17(2): 83-90. DOI:10.1097/00024382-200202000-00001 |
| [15] | Liu H, Yao Y, Wang S, et a1. Inhibition of Janus kinase 2 and signal transduction and activator of transcription 3 protect against cecal ligntion and puncture-induced multiple organ damage and mortality[J]. J Trauma, 2009, 66(3): 859-865. DOI:10.1097/TA.0b013e318164d05f |
| [16] | Ivashkiv LB, Hu X. Signaling by STATs[J]. Arthritis Res Ther, 2004, 6(4): 159-168. DOI:10.1186/ar1197 |
| [17] | Liu H, Yao YM, Yu Y, et al. Role of JAK/STAT pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages[J]. Shock, 2007, 27(1): 55-60. DOI:10.1097/01.shk.0000233197.40989.31 |
 2018, Vol. 27
2018, Vol. 27




