体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)被越来越多地用于严重心肺功能衰竭患者,成为一种挽救性治疗的手段。这类患者往往伴有多器官功能障碍,肾脏是最容易受累的器官。急性肾损伤(acute kidney injury, AKI)的分级诊断标准(the risk/injury/failure/loss of kidney function/end-stage kidney disease,RIFLE)和急性肾损伤网络工作组(AKI network,AKIN)已被广泛使用[1-2]。这些定义已并入改善全球肾脏病预后组织(kidney disease: improving global outcomes,KDIGO)临床实践指南中。RIFLE和AKIN已在各种人群环境中得到验证,包括ECMO患者[3-4]。ECMO辅助下AKI具有高发生率、高病死率的特点。据报道,ECMO支持下AKI发生率达70%~85%[5-6],需要持续性肾脏替代治疗(continuous renal replacement therapy,CRRT)治疗的患者病死率高达80%[7-10]。AKI的发生大大增加了机械通气的时间和ECMO持续的时间。与静脉静脉体外膜氧合(venovenous ECMO,VV ECMO)相比,静脉动脉体外膜氧合(venoarterial ECMO,VA ECMO)期间AKI更常见[11-12],且发生AKI的患者结局更差[13]。AKI发生的原因很复杂,往往是多因素的,包括患者及ECMO相关因素。而AKI尤其是重度AKI一旦发生,有效延缓其发展的措施有限,目前的治疗以综合治疗为主,肾脏替代治疗(renal replacement therapy,RRT)是主要的支持手段,优化RRT治疗可能改善ECMO合并AKI患者的预后。在临床工作中,了解ECMO期间AKI发生的原因,ECMO联合RRT治疗,对未来预防AKI,管理此类高风险患者,降低病死率至关重要。
1 ECMO支持下AKI发生的原因 1.1 循环容量过少ECMO辅助下整体血流动力学发生了变化,尤其是VA ECMO,其不依赖Frank-Starling机制。循环容量过少导致肾灌注减少引起AKI。循环容量过少常见于有效血容量不足,失血,毛细血管渗漏等。疾病本身(如心脏骤停、严重感染等)和ECMO管路均可诱发全身炎症反应综合征(SIRS),导致液体渗漏和有效循环容量降低,人体反射性激活肾素血管紧张素醛固酮系统,肾入球小动脉收缩使肾小球滤过率下降,加重肾脏损害[14]。ECMO管理中,出现“抖管”现象、泵前负压过高、床旁超声发现引流管头端所在的下腔静脉塌陷等,首先考虑容量不足,管理过程中应该防止容量不足造成的肾前性肾损伤[15]。
1.2 液体过负荷ECMO前和ECMO期间液体超载均会增加AKI的风险[16-17]。首先液体过负荷会造成中心静脉压(central venous pressure,CVP)升高,通过整个静脉系统传导造成肾静脉压力增高,肾脏灌注压减少,肾小球滤过率下降[18]。其次容量过负荷导致心室扩张,一旦超过心室肌最适肌节长度(2.2 μm),则心输出量下降,肾脏灌注减少[19]。再次容量过负荷易导致肾间质水肿,肾间质水肿会作用于肾小管,形成肾小管内高压,经传导形成肾小囊内高压,肾小球滤过率下降。当ECMO流量不稳定时,盲目过度补液会加重组织水肿,肾组织灌注依赖于肾小球后小动脉的压力,补液过多导致肾小球后小动脉压力增加,导致肾灌注压减低[20]。
1.3 感染造成急性肾损伤感染是与ECMO相关的最常见的并发症之一,对病死率有显著影响。据报道,ECMO患者呼吸机相关性肺炎的发病率高(24.4例/1000 ECMO·d),其中肠杆菌科为主要的细菌[21]。此外,导管相关感染的风险也值得特别警惕,中心静脉导管相关的血流感染的发病率高达1~6.2例/(1000导管·d)[22]。感染性休克导致循环血容量的减少易诱发AKI[23],此外致病微生物通过释放内毒素直接破环肾小球和肾小管结构造成肾功能受损[24]。现研究证实肾损伤分子-1(kidney injury molecule-1,KIM-1)、肝型脂肪酸结合蛋白(liver fatty acid binding protein,L-FABP)、胰岛素样生长因子结合蛋白-7(insulin-like growth factor-binding protein-7,IGFBP-7)、组织抑制物金属蛋白酶-2(tissue inhibitor of metalloproteinases-2,TIMP-2)、肾袢分泌尿调节素(uromodulin,UMOD)、中性粒细胞明胶酶相关脂质(neutrophil gelatinase-associated lipocalin,NGAL)等可用于感染导致相关肾功能不全的早期诊断[25]。
1.4 全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)对肾脏的损伤ECMO的并发症之一是ECMO相关炎症反应。当患者的血液第一次接触到体外回路的外来表面时,各种凝血和炎症级联反应被激活,ECMO开始后促炎细胞因子的快速上升被认为与先天免疫反应有关,严重者可能导致内皮损伤、微循环中断和体内器官功能障碍。尽管在泵和电路设计、氧合器和肝素结合方面有了重大改进,但ECMO诱导的SIRS反应仍然是一个临床问题[26]。SIRS时,中性粒细胞被损伤因素激活释放大量炎症介质(肿瘤坏死因子、白细胞介素、心肌抑制因子、花生四烯酸代谢产物、血小板活化因子、一氧化氮、蛋白酶及活化的氧自由基、激肽等)损伤肾小管、肾间质,诱发AKI[15, 27]。
1.5 缺血再灌注损伤缺血再灌注损伤(ischemia reperfusion injury,IRI)是指组织或器官在缺血后重新获得血供时, 不仅未使组织器官的功能恢复, 反而加重了组织代谢障碍及结构破坏的现象[28]。IRI可引起肾小管上皮细胞结构紊乱和功能障碍, 同时, 一系列促炎症因子, 包括白介素(IL-1、IL-6、IL-8)、转化生长因子TGF-β、肿瘤坏死因子TNF-α、干扰素IFN-γ等与氧自由基爆发性释放、钙超载等微观机制共同导致肾脏灌注受损[15, 29]。
1.6 VA ECMO支持下的平流对肾脏的影响VA ECMO同时支持心肺功能,当患者自身心功能差,而ECMO支持力度较大时,动脉血管主要流淌ECMO泵出的平流血液,此时脉压差减小,人体正常脉压差大约在40 mmHg(1 mmHg=0.133 kPa),维持正常的脉压差可以有效扩张肾入球小动脉,增加肾灌注,有利于保护肾功能[30],而VA ECMO泵出的平流血液无此效应,目前ECMO支持下的平流血液对于肾灌注的影响程度需要进一步研究探索[31]。
1.7 ECMO支持下溶血现象对肾脏的影响ECMO支持下由于负压引血,在氧合器中进行血液氧合,再由正压回血入体内,在此过程中由于机械作用会出现红细胞破裂的现象[32],易堵塞肾小管,造成急性肾损伤。此外,红细胞的破坏伴随着促氧化、促炎成分如血红蛋白、血色素等的释放,进一步加重肾功能损伤[33]。游离血红蛋白(free hemoglobin,fHb)和游离铁是这个过程的主要贡献者,fHb与过氧化氢反应并清除进行氧化还原反应形成有毒的自由基,游离血红蛋白会转化为高铁血红蛋白沉积于肾小管造成肾损害[15]。
1.8 肾毒性药物的使用由于行ECMO支持的都是危重患者,大多合并有复杂耐药菌感染,因此选用抗菌药物需要慎重。氨基糖苷类、阿昔洛韦、四环素类、多粘菌素类、磺胺类、两性霉素B、喹诺酮类、利福平、异烟肼等均可以导致肾损伤,诱发肾衰竭,涉及的机制包括直接的肾毒性、氧化应激、间质性肾炎、免疫性肾炎、肾梗阻[34]。非甾体抗炎药也可导致AKI,可能机制为其抑制环氧化酶导致前列腺素合成受阻,造成肾脏微循环的微动静脉扩张和收缩平衡被打破,微动脉更易收缩,肾灌注不足所致[35]。抗癌药易诱发AKI,其和抗癌药物使用的种类和剂量有关,主要机制是直接细胞毒性和免疫介导的药物毒性有关[36]。此外造影剂的使用和含马兜铃酸类中药的使用也易诱发AKI[37-38]。
1.9 血管活性药物的使用血管加压药物的使用在ECMO患者导致AKI一直是有争议的话题,特别是大剂量血管活性药物使用有血管过度收缩的风险。休克的严重程度和缺血再灌注应激都会导致肾脏自动调节功能的丧失[39],重症患者为了维持正常血压,会使用大剂量血管活性药物如去甲肾上腺素,去甲肾上腺素通过α-1受体激活增加全身血管阻力。此外,通过β-1激活,去甲肾上腺素增加心输出量(cardiac output,CO),这两种作用共同介导平均动脉压(mean arterial pressure,MAP)的增加。血管收缩,加之重症患者交感系统激活,本身肾脏的血流灌注相对减少,肾血管自身反射性收缩和血管活性药物大剂量使用会诱发AKI,但是,目前关于去甲肾上腺素对健康动物的肾脏血流动力学影响,已有的数据显示,肾血流(renal blood flow,RBF)可升高[40]、不变[41]或降低[42],研究证实去甲肾上腺素在升压方面是安全的[39, 43]。另外的药物血管加压素通过激活位于集合管内肾小管细胞基底表面的V2受体而具有众所周知的特殊肾脏效应[39],除了V2受体外,加压素还与V1a受体结合,刺激V1a受体可诱导血管平滑细胞收缩,从而使血管收缩[39]。但是,V1a受体在肾脏循环中的分布是不均匀,低剂量输注加压素的血管收缩特性主要影响肾脏传出动脉,而其对肾脏传入动脉的影响可以忽略不计。通过传出动脉血管收缩的增加,肾小球的灌注压力会上升,因此,肾小球滤过率(glomerular filtration rate,GFR)也会上升。目前血管加压素对肾功能的影响还需要更多研究[44]。
1.10 微血栓的形成非内皮化ECMO接口和血管内皮糖萼层破坏可能单独或联合导致高凝状态,在肾血管内形成微血栓[45]。目前ECMO材料的改进形成较少的血栓,且能够清除回路中较大的栓子,但是微血栓仍然存在,微栓子可以堵塞肾血管造成AKI[15]。
1.11 高碳酸血症,腹内高压等长期高碳酸血症会导致酸中毒、缺氧、肺顺应性差和肺动脉高压,右心功能障碍引起血流动力学改变,可进一步加剧器官损伤并增加AKI的风险[46]。高呼气末正压(positive end-expiratory pressure,PEEP)可引起胸内压升高,可能引起肾灌注不足并损害肾功能[47]。然而,高PEEP结合“超低”潮气量实际上可能减少整体胸内压并改善肾功能。此外,过高腹内压会影响腹腔脏器血流,尤其是增加肾动脉、肾静脉、下腔静脉的压力,导致肾灌注减少和肾小球滤过率下降,造成AKI。
2 ECMO支持下急性肾损伤治疗 2.1 精细化的容量管理重症患者易伴有血流动力学紊乱,精细化容量管理非常重要,动态监测容量变化并不断调整治疗以寻求最佳平衡点,其目标是使细胞外液达到并维持干体重,尤其是在ECMO早期采用限制性液体复苏策略[48],从而使患者获益最大化。对于危重患者,输液时机、液体的剂量及种类都至关重要,其中胶体液(血浆、白蛋白等)复苏相比晶体液能降低肺水肿程度并改善肺功能,抑制炎症反应、预防血管内皮损伤[49]。羟基乙基淀粉对肾脏的毒性作用已经明确,应尽量避免输注[50]。准确评估患者的容量状态是液体治疗的基础,但由于ECMO辅助打破了人体正常的血液循环平衡,常规的血流动力学监测方法如脉搏指示连续心排血量监测(pulse index continuous cardiac output,PICCO)变得不可靠。其次微循环和大循环表现的不一致性,即使大循环血流动力学稳定,微循环也有可能出现缺血缺氧的状态。尿量是反应肾灌注有效的指标,可间接反应容量的变化,当尿量小于0.5 mL/(h·kg)时,需要紧急判断是否出现肾前性肾衰竭。然而,尿量等传统指标有局限性,恰当地使用各种监测手段有助于为临床医生提供补液或利尿的依据。目前较常用的床旁超声可以直观反映血管的通畅性、管路的位置、右心室(RV)的功能、肺水肿等情况,而且床旁超声快速无创,成为综合评估ECMO患者血流动力学的重要手段。近红外光谱(near-infrared spectroscopy,NIRS)可以评估组织对近红外光谱的吸收,提供组织区域氧饱和度的实时数据,脑氧饱和度的监测可以反应脑组织的灌注,为临床医师调整患者容量提供一定的依据。
2.2 利尿剂的使用研究证实液体超载(定义为体重比基线增加超过10%)可明显增加患者60 d内的病死率[51],当患者出现肺水肿等容量过负荷时,应积极利尿。当容量过负荷造成AKI伴有少尿时,利尿剂效果个体差异较大[52-53],渗透性利尿剂如甘露醇会加重肾脏损伤,应尽量避免使用[54]。
2.3 肾脏替代治疗(RRT) 2.3.1 RRT开始的时机、模式、剂量连续和间歇RRT模式都是有效的管理策略,可以清除过量液体并维持电解质平衡。目前并没有强有力证据表明两种治疗模式在预后方面有明显差异。一般来说,连续肾脏替代治疗(CRRT)推荐用于血流动力学不稳定的患者,这些患者不能耐受容量的波动。CRRT可提供较为稳定的容量管理模式,更适合危重症患者[55-57]。据报道,有20%~100%的AKI患者在ECMO治疗之前或期间接受肾脏替代治疗[16, 55-59],但是目前RRT启动的最佳时机尚不明确[60-61],研究显示相比于AKI出现12 h内开始CRRT,延迟启动策略,CRRT的起动时间推迟到强制性适应证(明显的高钾血症或代谢性酸中毒或肺水肿)或直到血尿素氮浓度达到140 mg/dL,延迟CRRT的启动时机并没有获益更大,反而潜在危害更大[62]。Kielstein等[10]研究发现需要RRT的ECMO患者明显增加病死率,且RRT持续时间越长,病死率越高。在ECMO管理中,排出过量液体是进行CRRT最常见的原因,其次是纠正电解质紊乱[63]。对于危重患者,CRRT的启动应根据患者疾病背景、肾脏功能评估及风险事件的预判进行个体化判断[61]。作为指导原则,在利尿剂治疗无效的成年ECMO患者和AKI导致代谢紊乱,阻碍心肺衰竭恢复的情况下,应考虑RRT[64]。ECMO联合CRRT时,目前临床常采用的模式为连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration,CVVH)、和连续性静脉-静脉血液透析滤过(continuous veno-venous hemodiafiltration,CVVHDF)。有研究显示,持续CVVH可以清除炎症介质,降低体内炎症反应,有利机体功能恢复[65-66]。但部分研究发现持续CVVH/CVVHDF的炎症吸附不能降低患者的病死率,对于患者生存获益无明显影响[67-68]。ECMO患者标准溶质清除剂量通常为20~25 mL/(kg·h),RRT回路中的血流量通常维持在100~250 mL/min之间[69]。
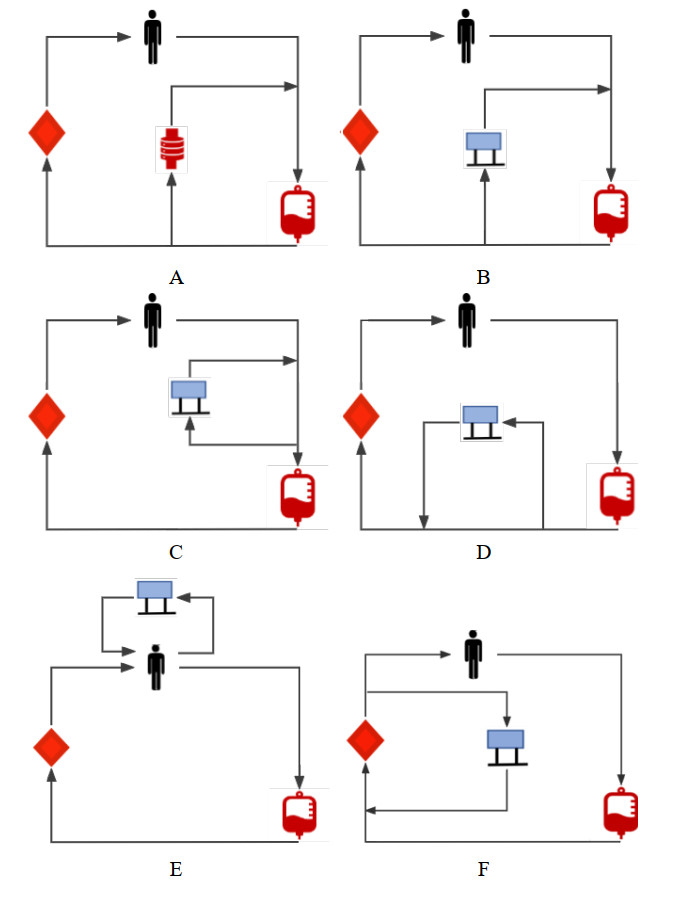
2.3.2 ECMO与CRRT连接方式目前ECMO与CRRT通常有以下三种连接方式[70]:(1)CRRT独立运行;(2)将滤器直接连接于ECMO血流通路中(in-line hemofilter),而不需要CRRT设备;(3)将CRRT设备连接到ECMO血流通路(具体连接方式见图 2,连接方式优缺点见表 1)。目前没有证据表明那种方式更优,临床上根据患者的具体情况来选择合适的连接方式。一般来说,连接CRRT机的回血端需在氧合器前,以便氧合器能够捕捉空气和血凝块,避免直接导致患者空气栓塞和血栓栓塞。目前临床常用的方式是在氧合器后引血并在氧合器或泵前回血,此方法可能会出现ECMO管路中的再循环(内分流)。ECMO回路在离心泵前的压力是高负压(从− 40到− 100 mmHg),泵和氧合器之间的压力是高正压,而CRRT机器常在0~20 mmHg的低正压下工作。因压力不匹配可能导致CRRT回路中的报警频发,导致CRRT机器停泵。目前处理压力报警的方法主要有改变连接方案、调整CRRT报警临界值、选择可以兼容ECMO运行的CRRT机器,降低CRRT血流和联合压力分流器来控制压力[71-73],但效果常常不理想,也容易导致血流动力学紊乱,引起溶血或血栓形成,未来还需要不断探索。

|
| 图 1 体外膜肺氧合(ECMO)支持下急性肾损伤(AKI)发生的原因 |
|
|
|
| (A)嵌入式血滤器;(B)进入ECMO回路的完全RRT回路:正压和负压下的回路部分;(C)进入ECMO回路的完全RRT回路:负压下的回路部分;(D)进入ECMO回路的完全RRT回路:正压下的回路部分;(E)单独RRT管路;(F)RRT回路从氧合器的膜后回到膜前 图 2 连续性肾脏替代治疗(CRRT)与体外膜肺氧合(ECMO)相结合的方法 |
|
|
| CRRT与ECMO的连接方式 | 优点 | 缺点 |
| CRRT独立运行 | 保证超滤和溶质清除的效果 溶质清除模式不受限制 精确把控超滤量 无需额外抗凝或选择使用单独抗凝剂 更换CRRT管路时无需ECMO团队参与 |
需要单独建立血管通路 更高的体外血容量 穿刺并发症 增加院内感染的风险 |
| 将滤器连接与ECMO血流通路中 | 连接相对容易 成本低 可做大容量超滤 无需单独的抗凝剂 |
无压力监测 超滤量不精确 超滤过度风险 溶质清除效率低 易形成湍流和溶血风险 |
| CRRT设备与氧合器相连 | 精确把控超滤量 保证超滤和溶质清除的效果 溶质清除模式不受限制 无需单独的血管通路 无需额外的抗凝 |
干扰氧合器的潜在风险 CRRT机压力可能超出安全范围之外 带入空气风险 易形成湍流和溶血风险 连接处血栓形成风险 |
通常ECMO氧合器和管路通路都有肝素涂层,但CRRT滤器抗凝需求比ECMO高,CRRT滤器容易凝血和堵塞,并产生小血凝块影响ECMO氧合器的寿命。当ECMO联合CRRT时,全身静脉输注普通肝素是标准的抗凝方式,但在严重系统出血时,全身肝素使用受限,可考虑在CRRT通路中加用枸橼酸局部抗凝,与肝素相比,枸橼酸抗凝可延长滤器寿命[74](具体抗凝方式及优缺点见表 2)。此外,直接凝血酶抑制剂比伐卢定相比肝素可能提供生存益处[75]。现有研究发现出血高风险ECMO患者采用甲磺酸萘莫司他(nafamostat mesylate,NM)抗凝可能是一种备选方案[76-77]。NM是一种人工合成的超短效丝氨酸蛋白酶抑制剂,可以通过灭活凝血酶、抑制凝血因子激活起到抗凝的作用,NM相对分子质量小(539.58),能被CRRT清除,仅在体外循环回路局部抗凝,降低全身反应。ECMO联合CRRT应用NM抗凝的效果目前还不清楚。监测凝血功能非常重要,有研究显示监测抗Xa活性相比监测活化凝血时间(activated clotting time,ACT)更有价值[78],枸橼酸抗凝时,钙离子应该通过单独的中心静脉通路输入,以减少系统中的凝血。当有肝衰竭、缺氧,严重休克的情况时谨慎使用枸橼酸抗凝,以避免出现枸橼酸蓄积[79]。
| 抗凝策略 | 优点 | 缺点 |
| 全身抗凝治疗 | ||
| 普通肝素 | 护理相对简单 | 抗凝效果较差 |
| 比伐卢定 | ||
| 甲磺酸萘莫司他 | ||
| 全身+CRRT局部抗凝 | ||
| 普通肝素/比伐卢定/甲磺酸萘莫司他+局部枸橼酸抗凝 | (1)抗凝效果较好 (2)如遇出血等情况可以中断全身抗凝治疗 |
护理相对复杂 |
有肾毒性的药物应该减量使用,此外,造影剂对于肾脏的毒性作用早已经证实[80],因此,对于有替代辅助检查时,应尽量避免造影剂对于肾脏的损伤。溶血严重者,应该碱化尿液,加速血红蛋白的排出,保护肾功能。关于ECMO置管的大小,尤其是置管经过腹主动脉和下腔静脉的那段需要特别关注,是否影响流体切力从而影响肾小球滤过率还需要更多研究[81]。
综上所述,随着ECMO在重症患者中的使用持续性增长,并发AKI的风险很高,AKI也是影响预后的重要因素之一。关注影响AKI发生的相关原因,不断探索ECMO合并AKI的最优治疗策略,包括RRT治疗,它有助于容量管理,清除有害溶质及炎症因子。因ECMO联合RRT技术的复杂性,需要重症医护团队熟悉设备的工作原理,掌握此类重症患者的病理生理学,才能够提高该技术的有效性和安全性,从而降低ECMO下AKI发病率和病死率。此外,应用ECMO并发AKI患者行RRT的时机及预后尚存争议,需进行高质量前瞻性研究获取可靠的临床证据和结论,以指导临床治疗。
利益冲突 所有作者声明无利益冲突
| [1] | Joannidis M, Metnitz B, Bauer P, et al. Acute kidney injury in critically ill patients classified by AKIN versus RIFLE using the SAPS 3 database[J]. Intensive Care Med, 2009, 35(10): 1692-1702. DOI:10.1007/s00134-009-1530-4 |
| [2] | Bellomo R, Kellum JA, Ronco C. Defining and classifying acute renal failure: from advocacy to consensus and validation of the RIFLE criteria[J]. Intensive Care Med, 2007, 33(3): 409-413. DOI:10.1007/s00134-006-0478-x |
| [3] | Yan XL, Jia SJ, Meng X, et al. Acute kidney injury in adult postcardiotomy patients with extracorporeal membrane oxygenation: evaluation of the RIFLE classification and the Acute Kidney Injury Network criteria[J]. Eur J Cardiothorac Surg, 2010, 37(2): 334-338. DOI:10.1016/j.ejcts.2009.07.004 |
| [4] | Mariscalco G, Cottini M, Dominici C, et al. The effect of timing of cardiac catheterization on acute kidney injury after cardiac surgery is influenced by the type of operation[J]. Int J Cardiol, 2014, 173(1): 46-54. DOI:10.1016/j.ijcard.2014.02.010 |
| [5] | Cheng R, Hachamovitch R, Kittleson M, et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1, 866 adult patients[J]. Ann Thorac Surg, 2014, 97(2): 610-616. DOI:10.1016/j.athoracsur.2013.09.008 |
| [6] | Askenazi DJ, Selewski DT, Paden ML, et al. Renal replacement therapy in critically ill patients receiving extracorporeal membrane oxygenation[J]. Clin J Am Soc Nephrol, 2012, 7(8): 1328-1336. DOI:10.2215/CJN.12731211 |
| [7] | Chan-Yu L, Tsai FC, Tian YC, et al. Evaluation of outcome scoring systems for patients on extracorporeal membrane oxygenation[J]. Ann Thorac Surg, 2007, 84(4): 1256-1262. DOI:10.1016/j.athoracsur.2007.05.045 |
| [8] | Chen YC, Tsai FC, Chang CH, et al. Prognosis of patients on extracorporeal membrane oxygenation: the impact of acute kidney injury on mortality[J]. Ann Thorac Surg, 2011, 91(1): 137-142. DOI:10.1016/j.athoracsur.2010.08.063 |
| [9] | Hsiao CC, Chang CH, Fan PC, et al. Prognosis of patients with acute respiratory distress syndrome on extracorporeal membrane oxygenation: the impact of urine output on mortality[J]. Ann Thorac Surg, 2014, 97(6): 1939-1944. DOI:10.1016/j.athoracsur.2014.02.021 |
| [10] | Kielstein JT, Heiden AM, Beutel G, et al. Renal function and survival in 200 patients undergoing ECMO therapy[J]. Nephrol Dial Transplant, 2013, 28(1): 86-90. DOI:10.1093/ndt/gfs398 |
| [11] | Chang X, Guo Z, Xu L, et al. Acute kidney injury in patients receiving ECMO: risk factors and outcomes[J]. Int J Clin Exp Med, 2017, 10(12): 16663-16669. |
| [12] | Passos Silva M, Caeiro D, Fernandes P, et al. Extracorporeal membrane oxygenation in circulatory and respiratory failure-A single-center experience[J]. Rev Port Cardiol, 2017, 36(11): 833-842. DOI:10.1016/j.repc.2017.01.003 |
| [13] | Mou Z, He J, Guan T, et al. Acute kidney injury during extracorporeal membrane oxygenation: VA ECMO versus VV ECMO[J]. J Intensive Care Med, 2022, 37(6): 743-752. DOI:10.1177/08850666211035323 |
| [14] | Peerapornratana S, Manrique-Caballero CL, Gómez H, et al. Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment[J]. Kidney Int, 2019, 96(5): 1083-1099. DOI:10.1016/j.kint.2019.05.026 |
| [15] | Kilburn DJ, Shekar K, Fraser JF. The complex relationship of extracorporeal membrane oxygenation and acute kidney injury: causation or association?[J]. Biomed Res Int, 2016, 2016: 1094296. DOI:10.1155/2016/1094296 |
| [16] | Selewski DT, Askenazi DJ, Bridges BC, et al. The impact of fluid overload on outcomes in children treated with extracorporeal membrane oxygenation: a multicenter retrospective cohort study[J]. Pediatr Crit Care Med, 2017, 18(12): 1126-1135. DOI:10.1097/PCC.0000000000001349 |
| [17] | Schmidt M, Bailey M, Kelly J, et al. Impact of fluid balance on outcome of adult patients treated with extracorporeal membrane oxygenation[J]. Intensive Care Med, 2014, 40(9): 1256-1266. DOI:10.1007/s00134-014-3360-2 |
| [18] | Vanderheyden M, Verstreken S, Houben R. Recurrent episodes of fluid retention in a patient with heart failure and chronic kidney disease: the additional value of implantable monitoring systems[J]. Case Rep Cardiol, 2021, 2021: 5122917. DOI:10.1155/2021/5122917 |
| [19] | Legrand M, Dupuis C, Simon C, et al. Association between systemic hemodynamics and septic acute kidney injury in critically ill patients: a retrospective observational study[J]. Crit Care, 2013, 17(6): R278. DOI:10.1186/cc13133 |
| [20] | Pickkers P, Darmon M, Hoste E, et al. Acute kidney injury in the critically ill: an updated review on pathophysiology and management[J]. Intensive Care Med, 2021, 47(8): 835-850. DOI:10.1007/s00134-021-06454-7 |
| [21] | Biffi S, Di Bella S, Scaravilli V, et al. Infections during extracorporeal membrane oxygenation: epidemiology, risk factors, pathogenesis and prevention[J]. Int J Antimicrob Agents, 2017, 50(1): 9-16. DOI:10.1016/j.ijantimicag.2017.02.025 |
| [22] | Buetti N, Timsit JF. Management and prevention of central venous catheter-related infections in the ICU[J]. Semin Respir Crit Care Med, 2019, 40(4): 508-523. DOI:10.1055/s-0039-1693705 |
| [23] | Uchino S, Kellum JA, Bellomo R, et al. Acute renal failure in critically ill patients: a multinational, multicenter study[J]. JAMA, 2005, 294(7): 813-818. DOI:10.1001/jama.294.7.813 |
| [24] | Lemichez E, Lecuit M, Nassif X, et al. Breaking the wall: targeting of the endothelium by pathogenic bacteria[J]. Nat Rev Microbiol, 2010, 8(2): 93-104. DOI:10.1038/nrmicro2269 |
| [25] | Wen YM, Parikh CR. Current concepts and advances in biomarkers of acute kidney injury[J]. Crit Rev Clin Lab Sci, 2021, 58(5): 354-368. DOI:10.1080/10408363.2021.1879000 |
| [26] | Millar JE, Fanning JP, McDonald CI, McAuley DF, Fraser JF. The inflammatory response to extracorporeal membrane oxygenation (ECMO): a review of the pathophysiology[J]. Critical Care, 2016, 20(1): 387. DOI:10.1186/s13054-016-1570-4 |
| [27] | Andrade-Oliveira V, Foresto-Neto O, Watanabe IKM, et al. Inflammation in renal diseases: new and old players[J]. Front Pharmacol, 2019, 10: 1192. DOI:10.3389/fphar.2019.01192 |
| [28] | Pefanis A, Ierino FL, Murphy JM, et al. Regulated necrosis in kidney ischemia-reperfusion injury[J]. Kidney Int, 2019, 96(2): 291-301. DOI:10.1016/j.kint.2019.02.009 |
| [29] | Wu MY, Yiang GT, Liao WT, et al. Current mechanistic concepts in ischemia and reperfusion injury[J]. Cell Physiol Biochem, 2018, 46(4): 1650-1667. DOI:10.1159/000489241 |
| [30] | Vlek ALM, van der Graaf Y, Braam B, et al. Blood pressure and decline in kidney function in patients with atherosclerotic vascular disease: a cohort study[J]. Am J Kidney Dis, 2009, 54(5): 820-829. DOI:10.1053/j.ajkd.2009.07.007 |
| [31] | Ingyinn M, Rais-Bahrami K, Evangelista R, et al. Comparison of the effect of venovenous versus venoarterial extracorporeal membrane oxygenation on renal blood flow in newborn lambs[J]. Perfusion, 2004, 19(3): 163-170. DOI:10.1191/0267659104pf736oa |
| [32] | Williams DC, Turi JL, Hornik CP, et al. Circuit oxygenator contributes to extracorporeal membrane oxygenation-induced hemolysis[J]. ASAIO J, 2015, 61(2): 190-195. DOI:10.1097/MAT.0000000000000173 |
| [33] | Merle NS, Grunenwald A, Figueres ML, et al. Characterization of renal injury and inflammation in an experimental model of intravascular hemolysis[J]. Front Immunol, 2018, 9: 179. DOI:10.3389/fimmu.2018.00179 |
| [34] | Perazella MA. Pharmacology behind common drug nephrotoxicities[J]. Clin J Am Soc Nephrol, 2018, 13(12): 1897-1908. DOI:10.2215/CJN.00150118 |
| [35] | Radi ZA, Khan KN. Cardio-renal safety of non-steroidal anti-inflammatory drugs[J]. J Toxicol Sci, 2019, 44(6): 373-391. DOI:10.2131/jts.44.373 |
| [36] | Kintzel PE, Dorr RT. Anticancer drug renal toxicity and elimination: dosing guidelines for altered renal function[J]. Cancer Treat Rev, 1995, 21(1): 33-64. DOI:10.1016/0305-7372(95)90010-1 |
| [37] | Yang B, Xie Y, Guo MJ, et al. Nephrotoxicity and Chinese herbal medicine[J]. Clin J Am Soc Nephrol, 2018, 13(10): 1605-1611. DOI:10.2215/CJN.11571017 |
| [38] | Hossain MA, Costanzo E, Cosentino J, et al. Contrast-induced nephropathy: Pathophysiology, risk factors, and prevention[J]. Saudi J Kidney Dis Transpl, 2018, 29(1): 1-9. DOI:10.4103/1319-2442.225199 |
| [39] | Fage N, Asfar P, Radermacher P, et al. Norepinephrine and vasopressin in hemorrhagic shock: a focus on renal hemodynamics[J]. Int J Mol Sci, 2023, 24(4): 4103. DOI:10.3390/ijms24044103 |
| [40] | Anderson WP, Korner PI, Selig SE. Mechanisms involved in the renal responses to intravenous and renal artery infusions of noradrenaline in conscious dogs[J]. J Physiol, 1981, 321(1): 21-30. DOI:10.1113/jphysiol.1981.sp013969 |
| [41] | Bellomo R, Kellum JA, Wisniewski SR, et al. Effects of norepinephrine on the renal vasculature in normal and endotoxemic dogs[J]. Am J Respir Crit Care Med, 1999, 159(4): 1186-1192. DOI:10.1164/ajrccm.159.4.9802055 |
| [42] | Mills LC, Moyer JH, Handley CA. Effects of various sympathicomimetic drugs on renal hemodynamics in normotensive and hypotensive dogs[J]. Am J Physiol, 1960, 198: 1279-1283. DOI:10.1152/ajplegacy.1960.198.6.1279 |
| [43] | Monnet X, Lai C, Ospina-tascon G, et al. Evidence for a personalized early start of norepinephrine in septic shock[J]. Critical Care, 2023, 27(1): 322. DOI:10.1186/s13054-023-04593-5 |
| [44] | Bellomo R, Wan L, May C. Vasoactive drugs and acute kidney injury[J]. Crit Care Med, 2008, 36(4 Suppl): S179-S186. DOI:10.1097/CCM.0b013e318169167f |
| [45] | Reed RC, Rutledge JC. Laboratory and clinical predictors of thrombosis and hemorrhage in 29 pediatric extracorporeal membrane oxygenation nonsurvivors[J]. Pediatr Dev Pathol, 2010, 13(5): 385-392. DOI:10.2350/09-09-0704-OA.1 |
| [46] | van den Akker JP, Egal M, Johan Groeneveld AB. Invasive mechanical ventilation as a risk factor for acute kidney injury in the critically ill: a systematic review and meta-analysis[J]. Crit Care, 2013, 17(3): R98. DOI:10.1186/cc12743 |
| [47] | Jacob LP, Chazalet JJ, Payen DM, et al. Renal hemodynamic and functional effect of PEEP ventilation in human renal transplantations[J]. Am J Respir Crit Care Med, 1995, 152(1): 103-107. DOI:10.1164/ajrccm.152.1.7599806 |
| [48] | Vignon P, Evrard B, Asfar P, et al. Fluid administration and monitoring in ARDS: which management?[J]. Intensive Care Med, 2020, 46(12): 2252-2264. DOI:10.1007/s00134-020-06310-0 |
| [49] | Chang R, Holcomb JB, Johansson PI, et al. Plasma resuscitation improved survival in a cecal ligation and puncture rat model of sepsis[J]. Shock, 2018, 49(1): 53-61. DOI:10.1097/SHK.0000000000000918 |
| [50] | Perner A, Haase N, Guttormsen AB, et al. Hydroxyethyl starch 130/0.42 versus Ringer's acetate in severe sepsis[J]. N Engl J Med, 2012, 367(2): 124-134. DOI:10.1056/NEJMoa1204242 |
| [51] | Bouchard J, Soroko SB, Chertow GM, et al. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury[J]. Kidney Int, 2009, 76(4): 422-427. DOI:10.1038/ki.2009.159 |
| [52] | Rosner MH, Ostermann M, Murugan R, et al. Indications and management of mechanical fluid removal in critical illness[J]. Br J Anaesth, 2014, 113(5): 764-771. DOI:10.1093/bja/aeu297 |
| [53] | Karajala V, Mansour W, Kellum JA. Diuretics in acute kidney injury[J]. Minerva Anestesiol, 2009, 75(5): 251-257. |
| [54] | Yang B, Xu J, Xu FY, et al. Intravascular administration of mannitol for acute kidney injury prevention: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(1): e85029. DOI:10.1371/journal.pone.0085029 |
| [55] | Antonucci E, Lamanna I, Fagnoul D, et al. The impact of renal failure and renal replacement therapy on outcome during extracorporeal membrane oxygenation therapy[J]. Artif Organs, 2016, 40(8): 746-754. DOI:10.1111/aor.12695 |
| [56] | Chen H, Yu RG, Yin NN, et al. Combination of extracorporeal membrane oxygenation and continuous renal replacement therapy in critically ill patients: a systematic review[J]. Crit Care, 2014, 18(6): 675. DOI:10.1186/s13054-014-0675-x |
| [57] | Han SS, Kim HJ, Lee SJ, et al. Effects of renal replacement therapy in patients receiving extracorporeal membrane oxygenation: a meta-analysis[J]. Ann Thorac Surg, 2015, 100(4): 1485-1495. DOI:10.1016/j.athoracsur.2015.06.018 |
| [58] | Lee H, Cho YH, Chang HW, et al. The outcome of extracorporeal life support after general thoracic surgery: timing of application[J]. Ann Thorac Surg, 2017, 104(2): 450-457. DOI:10.1016/j.athoracsur.2017.02.043 |
| [59] | Aubron C, Cheng AC, Pilcher D, et al. Factors associated with outcomes of patients on extracorporeal membrane oxygenation support: a 5-year cohort study[J]. Crit Care, 2013, 17(2): R73. DOI:10.1186/cc12681 |
| [60] | Ostermann M, Wald R, Bagshaw SM. Timing of Renal Replacement Therapy in Acute Kidney Injury[M/OL]//DING X, RONCO C. Contributions to Nephrology: 187. S. Karger AG, 2016: 187: 106-120. [2022-10-27]. https://www.karger.com/Article/FullText/442369. DOI: 110.1159/000442369. |
| [61] | Ostermann M, Joannidis M, Pani A, et al. Patient selection and timing of continuous renal replacement therapy[J]. Blood Purif, 2016, 42(3): 224-237. DOI:10.1159/000448506 |
| [62] | Gaudry S, Hajage D, Martin-Lefevre L, et al. Comparison of two delayed strategies for renal replacement therapy initiation for severe acute kidney injury (AKIKI 2): a multicentre, open-label, randomised, controlled trial[J]. Lancet, 2021, 397(10281): 1293-1300. DOI:10.1016/S0140-6736(21)00350-0 |
| [63] | Fleming GM, Askenazi DJ, Bridges BC, et al. A multicenter international survey of renal supportive therapy during ECMO: the Kidney Intervention During Extracorporeal Membrane Oxygenation (KIDMO) group[J]. ASAIO J, 2012, 58(4): 407-414. DOI:10.1097/MAT.0b013e3182579218 |
| [64] | Bridges BC, Dhar A, Ramanathan K, et al. Extracorporeal life support organization guidelines for fluid overload, acute kidney injury, and electrolyte management[J]. ASAIO J, 2022, 68(5): 611-618. DOI:10.1097/MAT.0000000000001702 |
| [65] | Friesecke S, Stecher SS, Gross S, et al. Extracorporeal cytokine elimination as rescue therapy in refractory septic shock: a prospective single-center study[J]. J Artif Organs, 2017, 20(3): 252-259. DOI:10.1007/s10047-017-0967-4 |
| [66] | Kogelmann K, Scheller M, Drüner M, et al. Use of hemoadsorption in sepsis-associated ECMO-dependent severe ARDS: a case series[J]. J Intensive Care Soc, 2020, 21(2): 183-190. DOI:10.1177/1751143718818992 |
| [67] | Supady A, Weber E, Rieder M, et al. Cytokine adsorption in patients with severe COVID-19 pneumonia requiring extracorporeal membrane oxygenation (CYCOV): a single centre, open-label, randomised, controlled trial[J]. Lancet Respir Med, 2021, 9(7): 755-762. DOI:10.1016/S2213-2600(21)00177-6 |
| [68] | Park JT, Lee H, Kee YK, et al. High-dose versus conventional-dose continuous venovenous hemodiafiltration and patient and kidney survival and cytokine removal in sepsis-associated acute kidney injury: a randomized controlled trial[J]. Am J Kidney Dis, 2016, 68(4): 599-608. DOI:10.1053/j.ajkd.2016.02.049 |
| [69] | Chan CT, Blankestijn PJ, Dember LM, et al. Dialysis initiation, modality choice, access, and prescription: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference[J]. Kidney Int, 2019, 96(1): 37-47. DOI:10.1016/j.kint.2019.01.017 |
| [70] | Ostermann M, Connor M Jr, Kashani K. Continuous renal replacement therapy during extracorporeal membrane oxygenation: why, when and how?[J]. Curr Opin Crit Care, 2018, 24(6): 493-503. DOI:10.1097/MCC.0000000000000559 |
| [71] | Suga N, Matsumura Y, Abe R, et al. A safe procedure for connecting a continuous renal replacement therapy device into an extracorporeal membrane oxygenation circuit[J]. J Artif Organs, 2017, 20(2): 125-131. DOI:10.1007/s10047-017-0952-y |
| [72] | de Tymowski C, Augustin P, Houissa H, et al. CRRT connected to ECMO: managing high pressures[J]. ASAIO J, 2017, 63(1): 48-52. DOI:10.1097/MAT.0000000000000441 |
| [73] | Na SJ, Choi HJ, Chung CR, et al. Using additional pressure control lines when connecting a continuous renal replacement therapy device to an extracorporeal membrane oxygenation circuit[J]. BMC Nephrol, 2018, 19(1): 369. DOI:10.1186/s12882-018-1172-2 |
| [74] | Liu C, Mao Z, Kang HJ, et al. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy in critically ill patients: a meta-analysis with trial sequential analysis of randomized controlled trials[J]. Crit Care, 2016, 20(1): 144. DOI:10.1186/s13054-016-1299-0 |
| [75] | Li DH, Sun MW, Zhang JC, et al. Is bivalirudin an alternative anticoagulant for extracorporeal membrane oxygenation (ECMO) patients? A systematic review and meta-analysis[J]. Thromb Res, 2022, 210: 53-62. DOI:10.1016/j.thromres.2021.12.024 |
| [76] | Lim JY, Kim JB, Choo SJ, et al. Anticoagulation during extracorporeal membrane oxygenation; nafamostat mesilate versus heparin[J]. Ann Thorac Surg, 2016, 102(2): 534-539. DOI:10.1016/j.athoracsur.2016.01.044 |
| [77] | Park JH, Her C, Min HK, et al. Nafamostat mesilate as a regional anticoagulant in patients with bleeding complications during extracorporeal membrane oxygenation[J]. Int J Artif Organs, 2015, 38(11): 595-599. DOI:10.5301/ijao.5000451 |
| [78] | Delmas C, Jacquemin A, Vardon-Bounes F, et al. Anticoagulation monitoring under ECMO support: a comparative study between the activated coagulation time and the anti-xa activity assay[J]. J Intensive Care Med, 2020, 35(7): 679-686. DOI:10.1177/0885066618776937 |
| [79] | Foti L, Villa G, Romagnoli S, et al. Acute kidney injury and extracorporeal membrane oxygenation: review on multiple organ support options[J]. Int J Nephrol Renovasc Dis, 2021, 14: 321-329. DOI:10.2147/IJNRD.S292893 |
| [80] | Briguori C, Tavano D, Colombo A. Contrast agent: associated nephrotoxicity[J]. Prog Cardiovasc Dis, 2003, 45(6): 493-503. DOI:10.1053/pcad.2003.YPCAD16 |
| [81] | Tonna JE, Abrams D, Brodie D, et al. Management of adult patients supported with venovenous extracorporeal membrane oxygenation (VV ECMO): guideline from the extracorporeal life support organization (ELSO)[J]. ASAIO J, 2021, 67(6): 601-610. DOI:10.1097/MAT.0000000000001432 |
 2024, Vol. 33
2024, Vol. 33




