2. 湖南省儿童医院疑难综合科,长沙 410007
2. Department of Pediatric Emergency Center, Hunan Children's Hospital, Changsha 410007, China
川崎病(Kawasaki disease, KD)是儿童原发性血管炎、获得性心脏病最常见的病因[1],川崎病休克综合征(Kawasaki disease shock syndrome, KDSS)为血流动力学不稳定的KD,为川崎病的一种危重表现形式[2],KDSS患儿病情进展迅速,可出现各脏器功能受损,如救治不及时可危及患儿生命。因此,早期识别KDSS的危险因素,早期进行干预对改善KDSS患儿的预后具有重要的临床价值。严重的血管炎、促炎细胞因子过度表达和急性心肌炎或短暂的瓣膜返流引起心肌功能障碍是KDSS的主要原因[3]。肝素结合蛋白(heparin-binding protein, HBP)是由中性粒细胞释放的一种多功能促炎性介质蛋白[4],在休克早期的血管渗漏中起着重要的作用[5],已被证实在感染及非感染性休克患者中明显升高[6],可早期预测感染性休克患者序贯器官衰竭[7],而血清白蛋白(albumin, ALB)在维持血管胶体渗透压、血管内皮功能完整、减轻机体炎症反应及降低脏器功能衰竭的发生率等方面具有重要的意义。HBP及血清ALB两者反映休克患者病情严重程度的作用存在差别,对预后判断均有一定的临床价值,联合两者的比值可能会增加预测效能,成为KDSS更好的预测指标。本研究通过分析HBP与血清ALB比值指标在KDSS中水平变化,探讨其在评价KDSS患儿病情的价值。
1 资料与方法 1.1 研究对象本研究为回顾性研究, 选择2019年1月至2022年5月入住湖南省儿童医院儿童重症监护室、疑难综合科的所有资料完整的川崎病患儿为研究对象。纳入标准:(1)符合KD的诊断标准[8],KDSS及难治性KDSS的诊断标准[2];(2)住院时间≥24 h;(3)年龄 > 28 d且 < 18岁。排除标准:(1)存在原发性心血管基础疾病;(2)近期服用过糖皮质激素或免疫抑制剂等;(3)合并严重先天性心脏病、重度营养不良患儿。
本研究经医院医学伦理委员会批准(HCHLL-2022-109),患儿监护人均知情同意并签署知情同意书。
1.2 研究分组根据HBP及ALB的结果,计算HBP/ALB比值,根据HBP/ALB比值,按两者的中位数及上下四分位数将研究对象分为三组:低比值组(< 25%)、中比值组(25%~75%)、高比值组(> 75%)三组。
1.3 研究方法 1.3.1 临床资料收集收集入院2 h内、诊断KDSS及诊断后24 h血HBP、ALB、血生化、C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)及脏器指标,住院过程中(病程第5~7天、2周、3周)及出院后随访半年心脏彩超和心电图,以及患儿并发症及预后情况等相关指标。
1.3.2 HBP测定标本库中选取入组患儿血浆标本(入院24 h内采集静脉血4 mL,30 min内离心,3 000~3 500 r/min离心20 min(离心半径8 cm)后离心分离血浆标本,于−80℃恒温冰箱内保存)室温下复温,采用全自动荧光免疫分析仪(西门子公司ADVIA Centaur)及HBP测定试剂盒(中翰盛泰生物技术股份有限公司)通过酶联免疫吸附试验进行血浆HBP水平检测,所有操作程序均严格依照厂家说明书由同一专业人员进行。
1.3.3 血流动力学评估本研究采用的是由德国OSYPKA提供的ICON®监护系统监测患儿无创心输出量监测指标每搏输出变异(stroke output variation, SVV)及胸腔液体水平(trends in thoracic fluid content, TFC)等指标。
1.4 统计学方法采用Epidata 3.0软件建立数据库录入数据,采用SPSS 18.0统计软件进行数据分析。计量资料符合正态分布的以均数±标准差(x±s)表示,两组比较采用成组t检验,治疗前后比较采用自身配对t检验。呈偏态分布的计量资料采用中位数(四分位数)[M(Q1, Q3)]表示,比较采用Kruskal-Wallis H秩和检验,组间比较采用Dunn's多重比较法检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。绘制受试者工作特征(receiver operator characteristic, ROC)曲线,评估研究指标对KDSS及预后的预测效能。以P < 0.05为差异有统计学意义。
2 结果 2.1 患儿的一般情况本研究共纳入患儿111例,男56例、女55例,年龄11.6(9.5, 24.5)月,出现冠脉受损24例,无冠脉受损87例,心电图表现异常27例,平均动脉压为63.0(58.0, 67.0)mmHg(1 mmHg=0.133 kPa),KDSS发病率15.3%(17/111)。
2.2 不同HBP/ALB水平临床特征比较111例患儿HBP/ALB为10.234(1.827, 28.768),其中低比值组28例,中比值组56例,高比值组27例,三组比较高比值组KDSS的发生率、冠脉受累、心电图异常的比例明显高于低、中比值组,差异有统计学意义。见表 1。
| 指标 | 低比值组(n=28) | 中比值组(n=56) | 高比值组(n=27) | 统计值 | P值 |
| 一般情况 | |||||
| 年龄(月)a | 10.5 (8.0, 14.0) | 11.5 (7.8, 22.3) | 20.0 (6.0, 48.0) | 4.204 | 0.122 |
| 男性b | 15 (53.5) | 29 (51.8) | 12 (44.4) | 0.539 | 0.764 |
| KDSSb | 0 (0) | 5 (8.9) | 12 (44.4) | 24.489 | < 0.001 |
| 冠脉受累b | 3 (10.7) | 10 (17.9) | 11 (40.7) | 8.258 | 0.016 |
| 心电图异常b | 2 (7.1) | 13 (23.2) | 12 (44.4) | 10.466 | 0.005 |
| 心血管相关指标 | |||||
| 肌钙蛋白a | 0.01 (0.01, 0.01) | 0.01 (0.01, 0.02) | 0.03 (0.01, 0.41)cd | 10.837 | 0.004 |
| NT-proBNP (pg/mL)a | 1043.0 (426.5, 4 083.5) | 687.5 (461.0, 1 775.0) | 1438.0 (621.0, 18300.0) cd | 9.795 | 0.007 |
| CK-MB (U/L)a | 14.5 (11.6, 17.4) | 12.5 (8.7, 16.1) | 12.7 (8.7, 24.3) | 3.539 | 0.170 |
| 乳酸(mmol/L)a | 1.0 (0.7, 1.3) | 1.0 (0.6, 1.3) | 1.9 (1.3, 3.5)cd | 7.569 | 0.023 |
| SVVa | 10.8 (8.6, 11.1) | 13.4 (9.8, 16.7) | 24.1 (15.6, 28.9)cd | 35.534 | < 0.001 |
| TFCa | 18.7 (16.2, 19.3) | 20.6 (15.8, 23.1) | 32.2 (23.5, 34.1)cd | 69.277 | < 0.001 |
| 其他生化指标 | |||||
| D-二聚体(mg/L)a | 0.5 (0.3, 1.5) | 0.5 (0.4, 1.2) | 1.2 (0.5, 3.5)cd | 6.496 | 0.039 |
| ALB (g/L)a | 39.9 (36.8, 42.2) | 38.6 (34.7, 42.2) | 29.6 (27.0, 39.0)cd | 19.203 | < 0.001 |
| 血钠(mmol/L)a | 136.5 (134.4, 137.9) | 135.8 (133.6, 137.7) | 124.9 (120.7, 131.1)cd | 7.376 | 0.025 |
| 总胆红素(µmol/L)a | 25.9 (18.8, 36.9) | 28.6 (16.1, 41.9) | 34.5 (26.4, 42.4) | 0.947 | 0.623 |
| 丙氨酸转氨酶(U/L)a | 25.6 (18.4, 34.1) | 21.4 (15.2, 32.6) | 22.8 (18.0, 51.6) | 1.723 | 0.422 |
| 乳酸脱氢酶(IU/L)a | 414.5 (382.3, 559.3) | 429.5 (377.5, 505.5) | 456.0 (301.0, 512.0) | 4.087 | 0.130 |
| 肌酐(µmol/L)a | 24.0 (22.0, 30.5) | 23.0 (20.0, 28.5) | 23.0 (20.0, 28.0) | 0.798 | 0.671 |
| WBC (×109/L)a | 8.6 (6.5, 11.3) | 10.9 (8.6, 13.5) | 15.3 (11.9, 28.9)cd | 12.315 | 0.002 |
| 血小板(×1012/L)a | 337.5 (247.3, 413.3) | 320.0 (185.8, 320.0) | 231.0 (130.0, 350.0) | 5.310 | 0.070 |
| HBP (μg/L)a | 35.9 (15.9, 55.9) | 123.5 (42.3, 745.1)c | 342.3 (59.8, 800.0) c | 72.912 | < 0.001 |
| CRP (mg/L)a | 31.4 (10.5,43.2) | 55.3 (13.8, 81.1) | 83.1 (21.8, 123.2) cd | 20.765 | < 0.001 |
| PCT (ng/mL)a | 10.08 (8.06, 22.2) | 10.4 (8.1, 30.7) | 18.1 (11.6, 41.3) cd | 15.630 | < 0.001 |
| 注:KDSS为川崎病休克综合征,NT-proBNP为N末端脑尿肽,CK-MB为肌酸激酶同工酶,SVV为无创心输出量监测指标每搏输出变异,TFC为胸腔液体水平,ALB为白蛋白,WBC为白细胞,HBP为肝素结合蛋白,CRP为C反应蛋白,PCT为降钙素原;a为M(Q1, Q3),b为(例,%);与低比值组比较,cP < 0.05;与中比值组比较,dP < 0.05 | |||||
与低、中比值组比较,高比值组的肌钙蛋白、NT-proBNP、乳酸、SVV、TFC值均更高,差异均有统计学意义,而低、中比值组间比较差异无统计学意义。见表 1。
2.4 HBP/ALB水平与其他实验室指标的关系与低、中比值组比较,高比值组白细胞(white blood cell,WBC)、CRP、PCT、D-二聚体值更高,而ALB及血钠值偏低,差异有统计学意义,而低、中比值组间比较差异无统计学意义。其他脏器指标胆红素、乳酸脱氢酶、丙氨酸转氨酶、肌酐、血小板三组间比较,差异无统计学意义。
2.5 HBP/ALB水平与容量监测中、高比值组患儿休克治疗前及休克缓解后SVV、TFC均呈下降趋势,较治疗前有改善(均P < 0.05),两组休克治疗前高比值组SVV、TFC值明显高于中比值组,两组比较差异有统计学意义。见表 2。
| 组别 | 患儿(例) | SVV | t值 | P值 | TFC | t值 | P值 | ||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||||||
| 中比值组 | 5 | 17.3±2.8 | 10.1±2.7 | 4.139 | 0.003 | 31.3±2.7 | 20.6±3.1 | 5.820 | < 0.001 |
| 高比值组 | 12 | 24.1±2.5 | 11.5±1.9 | 13.900 | < 0.001 | 36.2±3.5 | 19.6±5.3 | 9.054 | < 0.001 |
| t值 | -4.945 | -1.227 | -2.785 | 0.39 | |||||
| P值 | < 0.001 | 0.238 | 0.013 | 0.702 | |||||
| 注:SVV为无创心输出量监测指标每搏输出变异,TFC为胸腔液体水平 | |||||||||
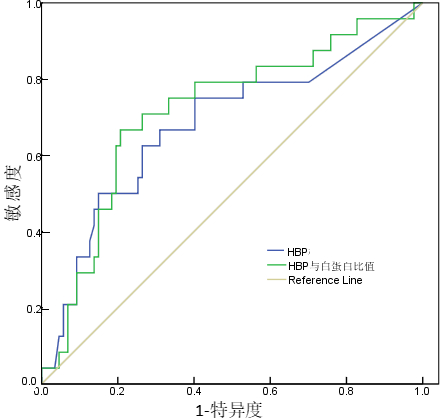
对HBP、HBP/ALB两项指标进行ROC曲线分析,评估预测KDSS及冠脉受损发生的预测效能。结果显示在预测KDSS中HBP/ALB曲线下面积、敏感度和特异度(分别为0.942、0.882、0.883)均高于HBP单项指标。在预测冠脉受损方面曲线下面积及敏感度高于HBP单项指标,但特异度稍低于HBP。(见表 3,图 1、图 2)。
| 指标 | AUC | 95%CI | 截断值 | 敏感度 | 特异度 |
| 预测KDSS | |||||
| HBP(μg/L) | 0.776 | 0.675~0.909 | 324.45 | 0.842 | 0.670 |
| HBP/ALB | 0.942 | 0.854~0.968 | 30.11 | 0.882 | 0.883 |
| 预测冠脉受损 | |||||
| HBP(μg/L) | 0.679 | 0.361~0.946 | 233.60 | 0.750 | 0.598 |
| HBP/ALB | 0.715 | 0.611~0.913 | 3.28 | 0.833 | 0.457 |
| 注:KDSS为川崎病休克综合征,HBP为肝素结合蛋白 | |||||

|
| 图 1 KD患儿HBP及HBP/ALB比值预测KDSS的ROC曲线图 Fig 1 ROC curves of HBP and HBP/albumin Ratio predicting KDSS in children with KD |
|
|
|
| 图 2 KD患儿HBP及HBP/ALB比值预测冠脉受损的ROC曲线图 Fig 2 ROC curve of HBP and HBP/albumin ratio predicting coronary artery damage in children with KD |
|
|
KDSS是血流动力学改变的危重症KD,发病率低,病情进展迅速,可合并出现多脏器衰竭,甚至生命危险[9]。本研究中KDSS占KD的15.3%(17/111),比以往报道比例偏高[10],考虑与本研究所选患儿科室重症比例偏高有关,发现KDSS组患儿中合并3个及以上脏器功能障碍患儿占52.9%(9/17例),17例患儿经积极救治均好转出院,未见死亡病例。
严重的血管炎、促炎细胞因子过度表达和急性心肌炎或短暂的瓣膜返流引起心肌功能障碍是KDSS的主要原因[11]。研究发现KDSS患者体内炎症因子白介素(interleukin, IL)-6、IL -10、肿瘤坏死因子-α等明显高于无休克患者,大量炎症因子可刺激血管内皮细胞表达黏附分子,促进中性粒细胞浸润及活性氧的释放,从而加重血管内皮损伤引起血管渗漏[3]。肝素结合蛋白是由中性粒细胞释放的一种蛋白分子,是一种多功能促炎性的介质蛋白,在体内可激活单核巨噬细胞以及调节血管的内皮功能[4, 12]。HBP作为血管内皮细胞最主要的上游信号,可通过活化血管内皮细胞,使细胞内游离钙离子的浓度上升,肌动蛋白纤维收缩,内皮细胞的骨架结构重排,使内皮细胞的形态发生改变,细胞周围间隙增加,而使细胞旁的渗透性增加[13]。近几年在感染性疾病及休克的诊断以及预后的评估等方面中备受关注[14-16],研究证实,HBP在感染性及非感染性休克患者中浓度高于未休克患者[6]。HBP在休克发生的病理生理过程中血管内皮细胞的调节中起着非常重要的作用[13],既往研究发现HBP在血压明显下降前即可明显升高,有些患者甚至在休克前12 h已经出现升高[17]。本研究发现HBP在预测KDSS方面具有一定的临床价值,说明HBP可能参与KDSS发生的病理过程。D-二聚体可监测血管内活化血栓及纤维溶解活动,KD患儿血管内皮损伤及抗凝系统功能失调均可引起D-二聚体水平明显升高,同时本研究发现本研究中高比值组D-二聚体明显高于低、中比值组,说明HBP在KDSS中可能参与血管内皮损伤及休克发生。
血清ALB是一种具有抗炎、抗氧化以及维持血管内皮功能完整等功能的急性期蛋白,在减轻机体炎症反应及降低脏器功能衰竭的发生率等方面具有重要的意义[18]。KD患儿由于发热、应激等原因导致机体ALB代谢增加,而同时体内合成急性期蛋白增加等均可造成血清ALB水平下降,同时KDSS患儿血管内皮损伤、心血管功能障碍等因素均可引起ALB等相关介质大量漏出,血管内ALB的漏出可导致血浆胶体渗透压的下降,有效循环血量下降,继而造成脏器功能不全,同时体内ALB与免疫相关抗体合成的各种酶数量及活性相关,从而引起免疫功能下降。血ALB水平可反映病情的严重程度[19-20],SVV是评估血管内液体量的指标,升高提示低前负荷、血容量低[21]。TFC是胸液的状态和胸液变化的测量指标,其中胸液含量代表血管外、血管内和胸腔内的全部液体成分。TFC高提示组织内液体增多或组织间隙内水肿[22]。本研究选取SVV、TFC两个参数监测患儿血管内外液体的情况。本研究发现高比值组SVV及TFC明显高于中比值组,治疗前SVV、TFC的值明显高于休克改善后结果,同时高比值组血钠及血ALB明显下降,通过对HBP及HBP/ALB两项指标进行对比分析发现HBP/ALB比值在预测KDSS方面优于前者,说明血管内液体外渗是KDSS发生的重要病理过程之一,HBP/ALB比值在预测KDSS方面具有一定的临床价值。
HBP是调节相关炎症反应的主要因子,既往研究发现经过HBP处理后的单核细胞/巨噬细胞炎症介质释放明显增加[23]。巨噬细胞释放的单核细胞趋化蛋白-1等介质参与多种心血管疾病的发生与发展过程[24],通过小鼠动物实验发现清除小鼠体内的巨噬细胞能够显著抑制心脏纤维化的形成[25]。既往研究通过对201例KD患者进行右心室的活检发现,所有患者都有心肌炎和纤维化改变[26],进行心内膜下心肌活检,发现心肌细胞紊乱,KD患者在持续纤维化和心肌细胞变性[27],尸检发现KD患者出现弥漫性心肌纤维化,冠状动脉瘤壁转化生长因子-B表达增加[28],可见KD患者早期即已出现心肌炎的表现。既往研究表明低血压一般发生在严重的炎症期间,该时期患者的肌钙蛋白、BNP等指标表现升高,BNP是KDSS的独立危险因素[29-30]。本研究发现HBP/ALB高比值组炎性指标WBC、CRP、PCT均高于中比值组,且肌钙蛋白及BNP明显高于低、中比值组,高比值组KDSS的发生率及冠脉受累、心电图异常的发生率明显高于其余两组,说明HBP可能参与KD心血管损伤及发展的过程,需进一步进行研究验证。
综上所述,HBP/ALB比值在早期预测KDSS有益的标志物,同时在对疾病的严重程度及监测病情方面具有一定的临床价值,但本研究纳入的KDSS病例数较少,需要大样本的数据进一步验证本研究的结果。
利益冲突 所有作者声明无利益冲突
作者贡献声明 康霞艳:论文撰写、数据收集;袁远宏、范江花:数据收集及整理、统计学分析;肖政辉、罗海燕、张新萍:研究设计、论文修改
| [1] | Huang WC, Huang LM, Chang IS, et al. Epidemiologic features of Kawasaki disease in Taiwan, 2003-2006[J]. Pediatrics, 2009, 123(3): e401-e405. DOI:10.1542/peds.2008-2187 |
| [2] | Kanegaye JT, Wilder MS, Molkara D, et al. Recognition of a Kawasaki disease shock syndrome[J]. Pediatrics, 2009, 123(5): e783-e789. DOI:10.1542/peds.2008-1871 |
| [3] | Li YD, Zheng Q, Zou LX, et al. Kawasaki disease shock syndrome: clinical characteristics and possible use of IL-6, IL-10 and IFN-γ as biomarkers for early recognition[J]. Pediatr Rheumatol Online J, 2019, 17(1): 1. DOI:10.1186/s12969-018-0303-4 |
| [4] | Kocak S, Acar T, Ertekin B, et al. The role of heparin-binding protein in the diagnosis of acute mesenteric ischemia[J]. Turk J Trauma Emerg Surg, 2019, 25(3): 205-212. DOI:10.5505/tjtes.2018.49139 |
| [5] | Liu L, Shao YM, Zhang YX, et al. Neutrophil-derived heparin binding protein triggers vascular leakage and synergizes with myeloperoxidase at the early stage of severe burns (With video)[J]. Burns Trauma, 2021, 9: tkab030. DOI:10.1093/burnst/tkab030 |
| [6] | Chew MS, Linder A, Santen S, et al. Increased plasma levels of heparin-binding protein in patients with shock: a prospective, cohort study[J]. Inflamm Res, 2012, 61(4): 375-379. DOI:10.1007/s00011-011-0422-6 |
| [7] | 杨亚南, 邵换璋, 史源, 等. 肝素结合蛋白联合SOFA评分对脓毒性休克的预测价值[J]. 中华危重病急救医学, 2019, 31(3): 336-340. DOI:10.3760/cma.j.issn.2095-4352.2019.03.015 |
| [8] | 中华医学会儿科学分会心血管学组, 中华医学会儿科学分会风湿学组, 中华医学会儿科学分会免疫学组, 等. 川崎病诊断和急性期治疗专家共识[J]. 中华儿科杂志, 2022, 60(1): 6-13. DOI:10.3760/cma.j.cn112140-20211018-00879 |
| [9] | Gamez-Gonzalez LB, Moribe-Quintero I, Cisneros-Castolo M, et al. Kawasaki disease shock syndrome: unique and severe subtype of Kawasaki disease[J]. Pediatr Int, 2018, 60(9): 781-790. DOI:10.1111/ped.13614 |
| [10] | Qiu HX, Li C, He YE, et al. Association between left ventricular ejection fraction and Kawasaki disease shock syndrome[J]. Cardiol Young, 2019, 29(2): 178-184. DOI:10.1017/S1047951118002056 |
| [11] | Zhang QY, Liao Y, Du JB. Kawasaki disease shock syndrome: a report of two cases and literature review[J]. Pediatr Investig, 2019, 3(2): 81-85. DOI:10.1002/ped4.12127 |
| [12] | Stjärne Aspelund A, Hammarström H, Inghammar M, et al. Heparin-binding protein, lysozyme, and inflammatory cytokines in bronchoalveolar lavage fluid as diagnostic tools for pulmonary infection in lung transplanted patients[J]. Am J Transplant, 2018, 18(2): 444-452. DOI:10.1111/ajt.14458 |
| [13] | 刘双庆, 姚咏明. 中性粒细胞来源肝素结合蛋白与髓过氧化物酶协同诱发严重烧伤早期血管渗漏[J]. 中华烧伤与创面修复杂志, 2022, 38(3): 250. DOI:10.3760/cma.j.issn.1009-2587.2022.03.106 |
| [14] | Kahn F, Tverring J, Mellhammar L, et al. Heparin-binding protein as a prognostic biomarker of sepsis and disease severity at the emergency department[J]. Shock, 2019, 52(6): e135-e145. DOI:10.1097/SHK.0000000000001332 |
| [15] | Wu YL, Yo CH, Hsu WT, et al. Accuracy of heparin-binding protein in diagnosing sepsis: a systematic review and meta-analysis[J]. Crit Care Med, 2021, 49(1): e80-e90. DOI:10.1097/CCM.0000000000004738 |
| [16] | Honore PM, De Bels D, Barreto Gutierrez L, et al. Heparin-binding protein in sepsis: player! predictor! positioning?[J]. Ann Intensive Care, 2019, 9(1): 71. DOI:10.1186/s13613-019-0546-3 |
| [17] | Linder A, Åkesson P, Inghammar M, et al. Elevated plasma levels of heparin-binding protein in intensive care unit patients with severe sepsis and septic shock[J]. Crit Care, 2012, 16(3): R90. DOI:10.1186/cc11353 |
| [18] | 杨春燕, 李宝云, 许平, 等. 血清白蛋白水平对晚期早产儿感染预后的预测价值[J]. 中国新生儿科杂志, 2015, 30(3): 196-199. DOI:10.3969/j.issn.1673-6710.2015.03.012 |
| [19] | 钱素云, 刘娟. 脓毒症/严重脓毒症/脓毒性休克患儿血清白蛋白水平与预后关系的研究[J]. 中华儿科杂志, 2012, 50(3): 184-187. DOI:10.3760/cma.j.issn.0578-1310.2012.03.006 |
| [20] | 钟隽镌, 张静, 郑璇儿, 等. 血乳酸与血清清蛋白比值对新生儿脓毒性休克的早期预测价值[J]. 中华实用儿科临床杂志, 2019, 34(18): 1386-1389. DOI:10.3760/cma.j.issn.2095-428X.2019.18.007 |
| [21] | Della Rocca G, Costa MG. Hemodynamic-volumetric monitoring[J]. Minerva Anestesiol, 2004, 70(4): 229-232. |
| [22] | van de Water JM, Mount BE, Dinesh Chandra KM, et al. TFC (thoracic fluid content): a new parameter for assessment of changes in chest fluid volume[J]. Am Surg, 2005, 71(1): 81-86. DOI:10.1177/000313480507100116 |
| [23] | Bentzer P, Fisher J, Kong HJ, et al. Erratum to: Heparin-binding protein is important for vascular leak in sepsis[J]. Intensive Care Med Exp, 2017, 5(1): 6. DOI:10.1186/s40635-017-0119-4 |
| [24] | Liu XL, Zhang PF, Ding SF, et al. Local gene silencing of monocyte chemoattractant protein-1 prevents vulnerable plaque disruption in apolipoprotein E-knockout mice[J]. PLoS One, 2012, 7(3): e33497. DOI:10.1371/journal.pone.0033497 |
| [25] | 李玉琳, 张聪聪, 吴依娜, 等. 骨髓来源单核巨噬细胞对高血压小鼠心脏损伤和重构的影响[J]. 中国心血管杂志, 2013, 18(2): 45-49. DOI:10.3969/j.issn.1007-5410.2013.02.010 |
| [26] | Yutani C, Go S, Kamiya T, et al. Cardiac biopsy of Kawasaki disease[J]. Arch Pathol Lab Med, 1981, 105(9): 470-473. |
| [27] | Yonesaka S, Nakada T, Sunagawa Y, et al. Endomyocardial biopsy in children with Kawasaki disease[J]. Acta Paediatr Jpn, 1989, 31(6): 706-711. DOI:10.1111/j.1442-200x.1989.tb01384.x |
| [28] | Gordon JB, Kahn AM, Burns JC. When children with Kawasaki disease grow up: Myocardial and vascular complications in adulthood[J]. J Am Coll Cardiol, 2009, 54(21): 1911-1920. DOI:10.1016/j.jacc.2009.04.102 |
| [29] | 仇慧仙, 薛超超, 陈其, 等. 川崎病休克综合征的临床特点及危险因素分析[J]. 中华危重症医学杂志(电子版), 2015, 8(4): 230-234. DOI:10.3877/cma.j.issn.1674-6880.2015.04.005 |
| [30] | 李丰, 张园海, 邵兰, 等. 川崎病并发休克6例临床分析[J]. 临床儿科杂志, 2012, 30(10): 939-941. DOI:10.3969/j.issn.1000-3606.2012.10.012 |
 2024, Vol. 33
2024, Vol. 33




