血清降钙素原(procalcitonin,PCT)是反映细菌感染导致全身炎症反应的主要指标。一直以来,血清PCT被用作严重细菌感染和脓毒症诊断的生物标志物。2017年,美国食品药品监督管理局(food and drug administration, FDA)[1]首次批准勃拉姆斯(B·R·A·H·M·S)血清PCT 0.25 µg/L阈值应用于下呼吸道感染(lower respiratory tract infection,LRTI)抗菌药物指导。PCT在指导抗菌药物应用方面得到越来越广泛的认同,特别是在抗菌药物临床合理应用、成人LRTI分级管理,儿童感染性疾病等领域形成了多个专家共识[2-4]。虽然临床上血清PCT已在儿童LRTI广泛应用,但目前仍缺乏统一指导原则。
为使血清PCT更为科学、合理地应用于儿童LRTI管理,《中华急诊医学杂志》组织儿童重症、急诊、呼吸、感染等多个领域专家,共同完成《降钙素原在儿童下呼吸道感染临床应用专家共识》。专家组就血清PCT在儿童LRTI病原鉴别诊断、抗菌药物管理、严重程度评估和疾病分流管理的应用及血清PCT正确解读等多个主题,通过广泛查阅文献,结合儿科临床实践,遴选出与儿童LRTI管理密切相关的14个临床问题,通过德尔菲法投票[5],多次会议讨论,最终达成共识。本共识适用于各级医疗机构儿科临床医师,共识的目标人群为疑似或明确诊断为LRTI的儿童。本共识已在国际实践指南注册平台(http://guidelines-registry.cn/index)注册,注册号:PREPARE-2022CN567。
1 方法 1.1 共识专家组及撰写组组成与职责共识专家组由儿童重症、急诊、呼吸、感染等21位专家组成,主要负责临床问题遴选、共识意见修订、投票达成共识。共识撰写组由12名临床研究人员组成,包括3名专业型博士及9名主任/副主任医师。其主要职责是: (1)调研临床问题;(2)文献复习;(3)起草推荐意见共识表;(4)记录专家共识制订过程;(5)协调共识制订的各种工作。
1.2 共识制订方法 1.2.1 确定临床问题撰写组通过文献复习初步提出临床问题,专家组成员通过评分,优选、增减相关临床问题。撰写组根据专家投票和反馈意见,最终遴选出14个临床问题。
1.2.2 初拟共识意见撰写组通过文献复习和专家咨询,形成推荐意见,制订共识表。本共识非基于系统评价的循证指南,故不作证据质量分级。
1.2.3 达成共识方法文献检索范围包括:PubMed、Medline、中文相关数据库(中国知网、万方医学网、维普中文科技期刊数据库),检索日期从1994年1月至2022年6月;采用德尔菲投票方法,充分采纳专家意见,最后形成推荐意见和推荐等级。专家组进行投票并征求意见;同意率≥90%为强推荐,75%~90%之间为弱推荐,<75%不形成推荐。
2 血清PCT在儿童LRTI病原诊断和鉴别诊断的应用 2.1 如何根据血清PCT水平进行儿童细菌性LRTI诊断和病原鉴别?推荐意见1:血清PCT低水平(<0.25 µg/L)时呼吸道感染常见细菌(肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌)引起的LRTI概率极小,可早期辅助排除,有助于儿童LRTI细菌性与病毒性病原的鉴别。(强推荐)
推荐依据:健康人群中,血清PCT水平<0.1 µg/L。在伴有全身表现的严重细菌感染时,血清PCT水平迅速升高,甚至可达100 µg/L以上[6]。LRTI主要病原微生物包括呼吸道病毒、常见呼吸道感染病菌(如肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌)、非典型病原(如肺炎支原体、肺炎衣原体、军团菌) 等。不同种类病原微生物感染,其血清PCT水平明显不同。Nascimento-Carvalho等[7]对159例社区获得性肺炎(community-acquired pneumonia,CAP)住院患儿进行前瞻性临床观察研究,发现菌血症肺炎患者血清PCT中位值为4.22 µg/L;非菌血症细菌性肺炎血清PCT中位值为1.47 µg/L;非典型病原性肺炎PCT中位值为0.18 µg/L;而病毒性肺炎PCT中位值为0.65 µg/L。
血清PCT可用于儿童细菌性LRTI的早期识别。美国Stockmann等[8]的一项多中心、前瞻性病原学研究,共纳入532例影像学证实的儿童CAP,结果显示血清PCT<0.25 µg/L有助于儿童CAP常见细菌感染的早期排除,对肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌所致CAP的阴性预测值(negative predictive value,NPV)高达96%;也有助于识别无需抗菌药物治疗的患者,当PCT<0.1 µg/L,敏感性增至100%,特异度降至20%,NPV为100%。
另一项针对儿童CAP的前瞻性临床队列研究发现,<5岁患儿中,肺炎链球菌肺炎血清PCT水平显著高于非肺炎链球菌感染(2 µg/L vs.0.5 µg/L),血清PCT<0.25 µg/L时肺炎链球菌感染的NPV为93%,有助于识别抗菌药物治疗不能受益的CAP患儿[9]。瑞士Annick的多中心前瞻性临床队列研究显示,血清PCT≥1.5 µg/L对肺炎链球菌肺炎诊断的敏感性为94.4%, 特异度为53%;血清PCT升高是肺炎链球菌CAP的敏感预测因子,但血清PCT阈值设定为≥1.5 µg/L特异度不高,使用低位阈值排除细菌性肺炎准确性更高,当血清PCT阈值为0.5 µg/L时,细菌性肺炎的NPV为93%[10]。血清PCT指导抗菌药物管理优化临床使用国际专家共识建议,即使在高度怀疑细菌感染的非ICU患者,血清PCT<0.25 µg/L时细菌感染的概率也较低[11]。
血清PCT有助于儿童LRTI细菌性与病毒性感染鉴别。病毒感染时,血清PCT水平一般不升高或仅轻微上升。一项针对成人COVID-19新冠肺炎的前瞻性观察研究发现,93%的新冠肺炎非重症患者入院时血清PCT均<0.25 µg/L[12]。2009年新型H1N1流感流行期间的成人研究显示,94%经核酸检测确诊的H1N1感染患者血清PCT水平低于0.25 µg/L,在流感流行期间,因血清PCT检测方便快捷,血清PCT<0.25 µg/L有助于在得到病毒核酸检测结果前用于发热门诊及急诊的筛查和快速分流疑似患者[13]。总体来说病毒性LRTI的血清PCT水平较低,但值得注意的是,儿童腺病毒肺炎患者血清PCT水平相对较高。国内一项针对腺病毒引起的急性呼吸道感染住院儿童的横断面研究发现,3型、7型腺病毒肺炎血清PCT>0.5 µg/L的患儿占38.3%,其中50%的7型腺病毒肺炎患儿血清PCT水平>0.5 µg/L[14]。
血清PCT可用于病毒性肺炎合并细菌性感染的早期发现。一项针对5岁以下儿童H1N1流感的回顾性临床研究显示,血清PCT监测有利于儿童H1N1合并细菌感染的早期诊断,与单纯H1N1感染患儿比较,合并细菌感染组患儿血清PCT明显升高(1.46 µg/L vs. 0.21 µg/L)[15]。PCT还有助于识别儿童重症呼吸道合胞病毒(respiratory syncytial virus,RSV)肺炎合并细菌感染,在70例儿童重症RSV患儿的研究中,血清PCT对单纯RSV感染和RSV合并细菌感染的重症肺炎儿童具有中高等级的鉴别效能, 血清PCT阈值为2.25 µg/L时, 其敏感性55%,特异度92%,阳性预测值(positive predictive value, PPV)55%,NPV92% [16]。
血清PCT在鉴别儿童重症病毒性LRTI是否合并细菌感染方面同样具有临床价值。Kotula等[17]在75名5岁以下,因病毒性LRTI入住儿童重症监护室(pediatric intensive care unit,PICU)的患儿中,将血清PCT阈值浓度分别设为0.9、1、1.4、2(µg/L),以用来鉴别病毒性LRTI是否合并细菌感染,发现诊断最有效的血清PCT浓度为1.4 µg/L,敏感性、特异度、PPV和NPV分别为46%、83%、68%、76%。
血清PCT有助于辅助儿童肺炎支原体CAP的诊断。肺炎支原体是儿童较为常见的非典型肺炎病原体,研究发现血清PCT<0.25 µg/L有助于辅助儿童肺炎支原体CAP的诊断。瑞士一项儿童CAP前瞻性队列研究显示,肺炎支原体感染的CAP患者,血清PCT水平通常低于0.25 µg/L。血清PCT<0.25 µg/L,结合年龄、体温、呼吸道症状等可将儿童肺炎支原体CAP的诊断准确率从0.82提高至0.90[18]。
2.2 如何根据血清PCT水平评估LRTI患儿出现全身性细菌感染的风险?推荐意见2:细菌性LRTI患儿血清PCT≥2 µg/L时,菌血症及脓毒症风险明显增加。(强推荐)
推荐依据:LRTI可能进展为全身性细菌感染,早期识别并给予及时合理的抗菌药物治疗至关重要。Nascimento-Carvalho等[7]研究显示,血清PCT≥2 µg/L用于鉴别菌血症与病毒感染、菌血症与非典型病原感染及菌血症与非菌血症性常见细菌感染的NPV分别为95%、89%、93%,血清PCT有助于识别CAP住院儿童的菌血症发生。一项发表于柳叶刀感染病学杂志的Meta分析,纳入30项研究,3 244例患者,其中包括4个PICU的数据,显示PCT作为诊断脓毒症的标记物平均敏感性为0.77,特异度为0.79,AUC为0.85[19]。
2.3 PCT联合其他指标是否可提高细菌性LRTI诊断准确性?推荐意见3:血清PCT单一指标或联合白细胞(white blood cell,WBC)、血清淀粉样蛋白(serum amyloid A,SAA)及C-反应蛋白(C-reactive protein, CRP)等临床常用生物学标志物均可以较好的帮助识别儿童细菌性呼吸道感染;多项指标联合时,诊断效能更高。(强推荐)
推荐依据:临床常应用血清PCT联合CRP作为细菌培养结果报告前进行急性呼吸道感染病原学快速鉴别的依据。研究显示[20]细菌感染组中血清CRP、PCT水平及阳性率均高于健康对照组;血清PCT联合CRP对细菌感染诊断的敏感性(99.3%)、特异度(98.6%)及诊断符合率(99%)均高于单独PCT(敏感性75.3%,特异度92%)或单独CRP(敏感性74.7%,特异度91.3%)。有研究[21]发现,呼吸道细菌感染组患儿血清PCT、CRP和WBC水平显著高于病毒感染组和肺炎支原体感染组;血清PCT、CRP和WBC三项联合检测细菌阳性率显著高于单一指标;血清PCT、CRP和WBC三者联合诊断革兰阳性(G+)菌感染与革兰阴性(G-)菌感染的阳性率分别达86.7%和83.3%。以血清PCT≥0.5 µg/L、CRP≥10 mg/L、SAA≥10 mg/L为阳性阈值,细菌感染组中PCT、SAA和CRP阳性率分别为83%、72%和62%;PCT、SAA和CRP三者联合的细菌感染诊断阳性率可高达89%[22]。
血清PCT联合肾上腺髓质素前体(mid-regional pro-adrenomedullin,MR-proADM)可以早期评估脓毒症和局部感染,且有利于儿童重症LRTI的预后评估。临床上MR-proADM更多的用于评估脓毒症和预后判断,也有应用血清PCT和MR-proADM联合诊断细菌感染的研究。Angeletti等[23]观察182例细菌感染患者在入院时、入院12~24 h和抗菌药物治疗的第3或第5天血清PCT和MR-proADM的水平。结果显示血清PCT>0.1 µg/L联合MR-proADM>0.8 nmol/L可提高细菌感染的诊断率,并有助于评估抗菌药物治疗的有效性。一项瑞士的随机对照研究发现[24],血清PCT指导下的LRTI抗菌药物治疗中,ICU入住率与MR-proADM水平逐日升高相关,由于MR-proADM下降缓慢,在指导抗菌药物停用方面,PCT的决策价值更为明确,观察二者的相关性和变化趋势有助于评估儿童重度LRTI的预后。
3 血清PCT在儿童LRTI抗菌药物管理的应用是否可根据血清PCT阈值指导儿童LRTI抗菌药物启动、调整及停用?
推荐意见4: PCT可用于指导儿童LRTI抗菌药物启动、调整和停用,有助于减少不必要抗菌药物使用、缩短抗菌药物疗程和减少相关不良事件。(弱推荐)
推荐依据:2017年FDA批准使用血清PCT指导LRTI抗菌药物治疗决策的制定[1]。尽管相关循证证据大部分来自于成人,但也有基于血清PCT指导儿童LRTI抗菌药物方案制定的临床研究报道,具有参考指导意义。
血清PCT指导儿童细菌性LRTI抗菌药物治疗可缩短用药疗程。Baer等[25]的多中心proPAED研究显示,血清PCT指导抗感染策略、缩短抗菌药物疗程;意大利Esposito等[26]对319例肺炎患儿,采用血清PCT指导抗菌药物治疗策略,入组患儿被分为PCT指导治疗组和循证治疗组:PCT指导治疗组在入院后PCT≥0.25 µg/L时启动抗菌药物治疗;循证治疗组依据意大利儿科学会CAP管理指南实施抗菌药物治疗方案[27],结果显示,PCT指导治疗组抗菌药物疗程短于循证治疗组。
血清PCT可减少儿童LRTI不必要的抗菌药物使用及抗菌药物相关不良事件。Ruuskanen等[28]报道儿童CAP病毒感染占85%。美国儿科传染病学会和美国传染病学会、英国胸科学会均指出:抗菌药物治疗不能使所有CAP儿童获益[29-30]。临床表现、实验室或影像学检查无法准确判断CAP致病病原体[31],由此可导致临床过度使用抗菌药物。Alejandre等[32]报道,血清PCT指导1岁以下重症毛细支气管炎患儿治疗可减少不必要的抗菌药物使用:当血清PCT>1 µg/L时启动抗菌药物治疗,当PCT≤1 µg/L或下降幅度>PCT峰值的50%应在未来3~5 d内停用抗菌药物。采用血清PCT指导重症毛细支气管炎患儿治疗,可减少不必要的抗菌药物使用。此外,上述Esposito等[26]研究中,血清PCT指导治疗组较循证治疗组抗菌药物相关不良事件(给药期间或者给药后5 d内发生疼痛、呕吐、腹泻、皮疹)显著减少。
采用血清PCT指导抗菌药物管理策略后,抗菌药物处方率下降、停用抗菌药物决策增多、抗菌药物疗程缩短。针对儿童LRTI,基于血清PCT阈值启动抗菌药物建议:PCT<0.1 µg/L,强烈建议不使用抗菌药物;PCT<0.25 µg/L,建议不使用抗菌药物;PCT≥0.25 µg/L,建议抗菌药物治疗;PCT≥0.5 µg/L,强烈建议抗菌药物治疗[8, 25-26, 33-34]。重症患儿PCT持续≥0.5 µg/L时,推荐延长抗菌药物疗程或升级[35]。基于PCT阈值停用抗菌药物建议:针对低细菌感染风险患儿,停用抗菌药物PCT阈值为0.1 µg/L;针对极低细菌感染风险患儿,停用抗菌药物PCT阈值为0.25 µg/L[25-26]。
4 动态监测血清PCT在儿童LRTI的临床应用 4.1 动态监测血清PCT在儿童LRTI临床价值如何?推荐意见5:推荐在儿童LRTI中动态监测血清PCT,有助于及时启动抗菌药物治疗、评价抗菌药物治疗效果、指导及时停药、减少不必要的抗菌药物使用。(强推荐)
推荐依据:血清PCT在细菌感染后2~4 h升高,24~48 h达到峰值,半衰期约24~35 h[36-37]。连续动态监测PCT在儿童LRTI中,有助于及时启动抗菌药物治疗。在Esposito等[26]的研究中,血清PCT指导治疗组启动抗菌药物治疗的阈值为入院时PCT≥0.25 µg/L。如入院时PCT<0.25 µg/L则暂不给予抗菌药物治疗,动态监测PCT直至≥0.25 µg/L才启动抗菌药物治疗。这项临床研究是首次使用PCT指导儿童CAP抗生素治疗的前瞻性研究,结果显示,血清PCT指导儿童CAP抗感染治疗,可以显著减少CAP儿童的抗生素使用和抗生素相关不良事件。
连续监测血清PCT可以评价儿童LRTI抗菌药物治疗效果。Cohen等[38]对125例儿童CAP连续监测血清PCT直至β-内酰胺类抗菌药物治疗后至少48 h的回顾性研究发现,PCT是CAP住院儿童对β-内酰胺类抗菌药物治疗有反应的独立预测因子。PCT≥3.0 µg/L时,预测β-内酰胺类抗菌药物治疗有效的敏感性55.7%,特异度78.9%。由此可见,血清PCT可用于评估儿童LRTI抗菌药物治疗效果。
连续监测血清PCT可以减少儿童LRTI不必要的抗菌药物使用。Kotula等[17]报道连续监测血清PCT有助于在儿童病毒性LRTI中选择正确的治疗决策,减少抗菌药物应用:该研究纳入75例患儿,首次血清PCT>1.4 µg/L可用于评估病毒性LRTI是否合并细菌感染,44%的病例根据24 h内的第二次PCT结果选择了正确的治疗策略:在连续监测血清PCT水平较低的患儿中停止或不启动抗菌药物,而水平较高的患儿继续使用抗菌药物,高水平PCT患儿最终被证实存在细菌感染。Kotula等[7]指出:在连续监测血清PCT时,如果PCT≥1.4 µg/L有利于确认细菌感染的临床诊断和治疗决策;反之,PCT始终<1.4 µg/L,应停用抗菌药物。
可见,儿童LRTI动态监测PCT,有助于及时启动抗菌药物治疗、评价抗菌药物治疗效果、减少不必要的抗菌药物使用。
4.2 血清PCT监测时机和监测频率如何确定?推荐意见6:推荐根据儿童LRTI严重程度决定监测血清PCT时机和频率:轻症患者,可入院时检测PCT以指导抗菌药物启用、后动态监测以指导抗菌药物调整或停用;重症患者入院时和入院后前3 d,可适当增加检测频次,以调整抗菌药物使用。(强推荐)
推荐依据:监测血清PCT水平及其动态变化,结合患儿临床症状、体征、影像学、病原学等结果,综合评估患者细菌感染的风险,可指导儿童LRTI抗菌药物的合理应用。由于PCT在血液循环中的半衰期约24~35 h,严重肾功能损害时半衰期延长。因此,每24 h监测PCT足以显示其变化[39-40]。
目前尚无针对儿童LRTI实施血清PCT监测频率的临床报道。2020年国内《降钙素原指导抗菌药物临床合理应用专家共识》中强推荐已启动抗菌治疗的患者,合理监测PCT的动态变化,及时评估治疗疗效。推荐ICU抗感染治疗初期每24 h监测,PCT无明显下降, 不降反升,需积极寻找原因,调整治疗方案;非重症LRTI患者可适当降低监测频率至48~72 h[4]。
Smith等[41]报道成人CAP中血清PCT监测方案:该研究中将低危CAP定义为肺炎严重程度指数(pneumonia severity index,PSI)风险等级≤3级或CURB-65评分≤2;高危CAP为PSI风险等级4或5,或CURB-65评分≥3;低危CAP:入院时、第3、5、7天监测PCT,用于指导抗菌药物起始时机和疗程;高危CAP:入院时、第3、5、7天监测PCT,用于指导抗菌药物疗程延续或停用。Ito等[42]研究成人CAP连续监测血清PCT显示:入院后第1天(D1)和第3天(D3)监测PCT, 发现PCT比值(PCT D3/D1)≥1是初始抗感染治疗失败的重要预测因子,也是30 d死亡的显著预测因子。
综上,推荐根据儿童LRTI严重程度连续监测血清PCT:轻症患者入院时检测PCT以指导抗菌药物启用、随后动态监测以指导抗菌药物延续或停用;重症患者入院时和入院前3 d内适当增加检测频次,以调整抗菌药物使用。
5 血清PCT在儿童LRTI严重程度评估及疾病分流管理的应用 5.1 血清PCT是否可用于儿童细菌性LRTI严重程度评估?推荐意见7:依据临床症状和体征,推荐血清PCT辅助用于儿童细菌性LRTI严重程度评估,PCT值越高提示LRTI感染越严重。(弱推荐)
推荐依据:相对于非重症患儿,重症肺炎患儿血清PCT明显增高[43-45]。据Florin等[44]在477名经影像学验证的CAP患儿中,血清PCT 0.52 µg/L阈值区分重度CAP的NPV为0.94。PCT>0.5 µg/L与影像学肺炎显著相关[45]。儿童CAP荟萃分析显示:PCT、CRP、IL-6、中性粒细胞计数在重度CAP中显著升高,PCT水平可预测儿童CAP严重程度[46]。早期血清PCT检测有助于预测儿童LRTI严重程度和预后。当PCT在0.5~2.0 µg/L时,考虑细菌感染可能;医院获得性肺炎(hospital-acquired pneumonia,HAP)患儿中PCT>2 µg/L提示细菌感染[47],且病情较为严重。当PCT在2~10 µg/L,可能为脓毒症或脓毒性休克,且存在发生多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)风险;如PCT持续高值>4 d,要求考虑调整抗感染治疗策略;PCT≥10 µg/L,常合并MODS,存在高死亡风险。
Aygun等[48]回顾性研究显示:初始血清PCT与接受机械通气、使用正性肌力药物、发生急性肾损伤(acute kidney injury, AKI)、接受持续肾脏替代治疗和血制品输注、PICU住院时间及病死率之间存在显著相关性。因此,初始血清PCT可用于预测PICU患儿严重程度和预后。Florin等[44]在CAP的研究中还发现,血清PCT对需要胸腔引流的脓胸(AUC: 0.83)和输注血管活性药物治疗(AUC: 0.78)者具有较好的预测价值。因此,早期血清PCT可预测儿童细菌性LRTI严重程度和预后。而在病毒性LRTI,血清PCT不作为评估严重程度的指标。
5.2 是否可根据血清PCT的水平进行LRTI门急诊分流?推荐意见8:结合临床症状、体征及其他指标,采用血清PCT<0.25 µg/L可辅助早期识别不需要抗菌药物治疗及住院的患儿,有助于门急诊分流。(弱推荐)
推荐依据:因CAP住院的儿童患者中,血清PCT水平越低其存在常见细菌感染的风险越小。Stockmann等[8]研究中,血清PCT<0.25 µg/L对常见细菌感染有较高的NPV(96%),且在120名血清PCT<0.1 μg/L的患儿中,没有检测到常见细菌。针对CAP患儿的研究发现,住院患者的血清PCT高于门诊患者(中位数17.81 µg/L vs. 0.72 µg/L)[43]。HAP研究中,HAP患者血清PCT水平远高于健康人的血清PCT(1.57 µg/L vs. 0.1 µg/L)[47]。且PCT是评估CAP严重程度的有效指标,可用于识别需要住院的CAP患儿。因此,在门诊即测PCT,以PCT<0.25 µg/L为阈值可以排除常见细菌感染,结合临床表现和影像学有助于识别患者是否需要住院(见图 1),利于门急诊患者分流。健康儿童及不同细菌感染状态下PCT水平参考表 1[2]。

|
| 图 1 血清PCT指导儿童LRTI病原学诊断、严重程度评估及疾病分流管理 |
|
|
| 状态 | PCT水平(μg/L) |
| 健康儿童 | <0.05 |
| 局部感染 | 0.05~0.50 |
| 侵袭性感染 | 0.5~2.0 |
| 严重感染(脓毒症) | 2~ 10 |
| 脓毒性休克 | >10 |
推荐意见9:推荐将血清PCT引入LRTI管理流程,根据不同严重程度,采用不同的血清PCT阈值指导LRTI患儿的抗菌药物应用。(强推荐)
推荐依据:Rossin等[34]采用血清PCT<0.25 μg/L结合CRP<100 mg/L为阈值的CAP临床路径用于抗菌药物管理,使广谱抗菌药物暴露显著减少,证明血清PCT结合CAP临床路径是抗菌药物管理的有效工具。Pérez-López等[49]应用PCT<0.5 μg/L和CRP<20 mg/L为阈值也得到一致结论:在没有明显临床表现的非重症患儿中,可暂时不启动抗菌药物。Wrotek等[50]研究显示,在普通病房,采用PCT 0.4 µg/L的阈值有利于流感患儿抗菌药物管理。
6 血清PCT的正确解读 6.1 新生儿细菌感染是否可以参考儿童血清PCT阈值?推荐意见10:血清PCT是早期诊断和监测新生儿感染的有用指标。由于PCT在生后早期出现生理性升高,故生后72 h内应参考相应日龄的PCT范围,72 h后可以参考儿童PCT阈值。(强推荐)
推荐依据:目前血清PCT在新生儿LRTI应用方面的研究较少,难以形成明确共识。而PCT在新生儿细菌感染,尤其是新生儿早发型脓毒症(early-onset sepsis,EOS)和晚发型脓毒症(late-onset sepsis,LOS)的诊断方面都具有较好的价值,值得临床推广使用。
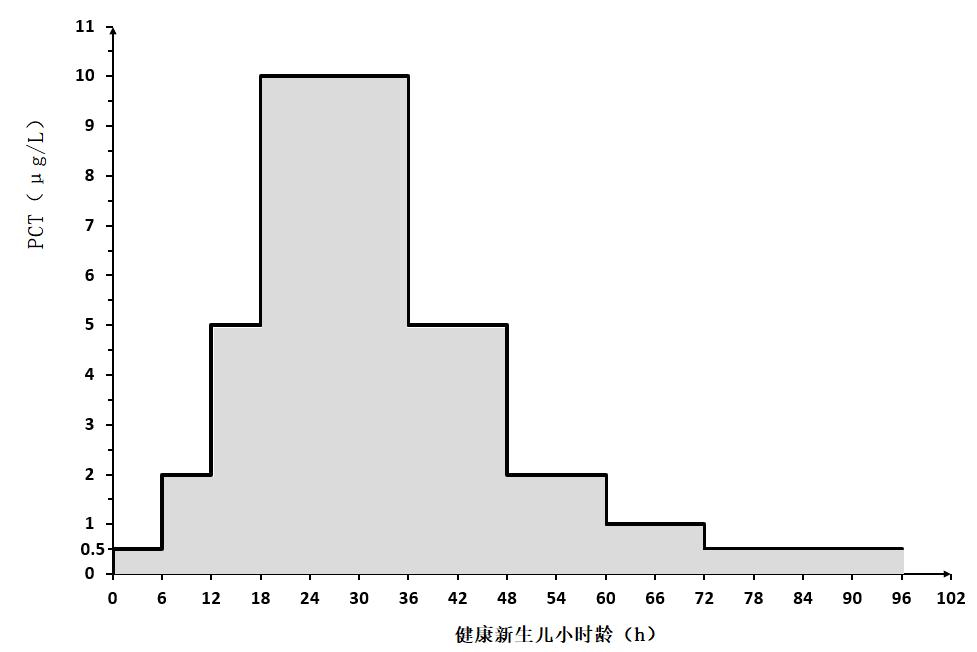
新生儿EOS的诊断需考虑其出生早期PCT生理性升高的特点。生后72 h内的PCT水平与日龄密切相关,生后PCT即出现生理性升高(详见图 2),24 h达到峰值(平均1.5~2.5 µg/L,范围0.1~20.0 µg/L),此后逐渐下降,72h后接近儿童水平(<0.5 µg/L)[51]。故PCT在EOS和LOS中的诊断价值不尽相同:由于PCT生后72h内的生理值范围较大,故目前尚不能明确其用于EOS的阈值[52],而更多作为抗菌药物停药的指征。此外,呼吸窘迫综合征、围生期窒息、颅内出血等非感染性疾病以及胎膜早破>18 h、产前或产时用药等因素均可导致新生儿PCT水平升高[53]。
血清PCT在新生儿LOS的早期诊断及抗菌药物停药方面都具有参考价值。LOS不受血清PCT生后72 h内生理性升高的影响,PCT用于诊断LOS的敏感度和特异度均优于EOS[54-55]。Kurul等[56]肯定了血清PCT在识别新生儿LOS方面的价值,并提出PCT升高幅度与LOS严重程度及患儿死亡风险之间显著相关。有研究表明可以将血清PCT作为诊断LOS的有效指标[55, 57]。到目前为止,虽然关于PCT与新生儿脓毒症的研究尚不充分,鉴于出生72 h后的新生儿晚发型细菌感染与儿童感染情况相近,因此本共识推荐:在诊断新生儿细菌感染时,应充分考虑新生儿的日龄并参考PCT生后72 h内的生理性参考值范围;而当PCT恢复至正常水平(72 h后),即可参考儿童的PCT阈值(表 1)。
6.2 早产儿生后早期血清PCT变化水平是否与足月儿一致?推荐意见11:早产儿生后早期(72 h内)的血清PCT水平同足月儿一样具有生理性升高的特点,但其与胎龄及日龄相关的参考值范围尚存在争议,在解读血清PCT值时应考虑早产儿的胎龄、日龄、临床合并症等因素。(强推荐)
推荐依据:健康早产儿的血清PCT水平同健康足月儿一样会在生后早期出现生理性升高,但其升高的幅度、峰值大小及峰值出现时间等尚不明确。Chisea等[58]在对比健康早产儿与足月儿血清PCT的数值曲线发现:早产儿PCT平均浓度峰值高于足月儿,其数值变化与足月儿相比出现更早、变化幅度更大、持续时间更长。同时,Chisea首次提出“胎龄与PCT呈负相关”,早产儿PCT的大致变化趋势[58-61]为:早期早产儿(胎龄<34周)与晚期早产儿(胎龄在34~36周)不同;从出生至生后5 d,早期早产儿的血清PCT水平明显高于晚期早产儿和足月儿,但晚期早产儿与足月儿之间差异无统计学意义[59]。王思云等[60]也肯定了胎龄与PCT水平的负相关性,认为晚期早产儿和足月儿采用PCT诊断EOS可采用共同的参考标准,而早期早产儿需单独考虑。但也有研究持不同观点,如Turner等[62]纳入283个血清PCT值(来自健康早产儿)绘制的PCT参考曲线显示:PCT浓度随胎龄增加而降低,其峰值在生后28h出现并低于足月儿。Liu等[63]表示早产儿的血清PCT峰值出现时间晚于足月儿,且胎龄<32周的早产儿血清PCT浓度在生后36 h内保持在较低水平,随后才会逐渐增加。Naramura等[64]则否认了胎龄与PCT之间的相关性。
总之,早产儿生后早期血清PCT水平呈先升高后降低的变化趋势,但PCT水平与胎龄及日龄的参考值范围目前仍存在争议。因此,未来需更多研究深入阐明不同胎龄早产儿血清PCT水平的变化趋势,完善PCT在早产儿细菌感染中的诊断价值。
6.3 除外细菌性感染,是否存在其他导致血清PCT升高的临床因素?推荐意见12:PCT值升高并不代表一定是细菌感染,非感染因素也可能导致血清PCT升高。血清PCT值须结合临床指标进行判读方有意义, 不能单纯以PCT结果判断感染情况;需考虑到PCT结果假阳性和假阴性的可能性;动态观察PCT的变化比单次的检测值更有价值。(强推荐)
推荐依据:除外感染因素,血清PCT增高亦可见于以下临床情况:
(1)某些非感染因素所致的全身炎症性疾病,如川崎病,尤其是对静脉输注免疫球蛋白无应答者[65-67]。
(2)外科手术[68-71]、烧伤[72]、创伤[73]、肝衰竭[74-75]、对乙酰氨基酚中毒[76]、急性重型胰腺炎[77]、器官移植[78-79]等所致的大量炎症因子释放也可导致PCT升高。
(3)一些慢性肾病,当PCT清除能力下降时,也会出现PCT水平增高,而透析后PCT则显著下降[80]。
(4)PCT可由一些组织的神经内分泌细胞分泌,如甲状腺髓样癌可导致PCT升高[81]。
(5)近期接种疫苗,会使PCT增高,但程度低于严重细菌感染者[82]。
因此,对于存在上述临床干扰因素时,解读PCT结果需要谨慎,动态观察PCT水平变化比单次PCT值更有价值。
6.4 血清PCT值不升高是否可以除外细菌感染?推荐意见13:血清PCT值正常也不能完全排除细菌性感染;局部细菌感染以及中性粒细胞减少、严重营养不良等发生细菌感染时,PCT值可以不升高,需要动态观察PCT水平变化并结合临床综合判断。(强推荐)
推荐依据:即使有细菌感染,但血清PCT水平不升高的临床情况包括:
(1)局部细菌感染通常不会诱导PCT的产生,如扁桃体炎、轻度软组织感染、迁延性细菌性支气管炎、脓肿等,因此PCT不能用于局部感染的诊断[2, 83]。
(2)当中性粒细胞减少合并细菌感染时,PCT诱导受到抑制,可无明显升高,其峰值通常出现在感染发生24 h后,延迟或动态PCT监测可提高诊断的准确性[84-86]。
(3)儿童严重营养不良[87]、Ⅰ型糖尿病合并乳糜泻[88]可导致PCT值下降。
6.5 影响血清PCT检测准确性的检验相关因素有哪些?推荐意见14:血清PCT检测目前尚未形成国际公认的参考物质和方法,因此各检测平台需建立自己的溯源体系,并通过大量临床研究和证据建立自己的参考阈值;PCT检测应确保高敏感度和足够的精密度并避免超线性测定,以保证有效的临床决策。(强推荐)
推荐依据:目前PCT的标本类型为血清或血浆,其离体浓度稳定,受外界因素影响较少。但PCT的检测方法有多种,可分为定量、半定量和定性三大类,不同方法获得的结果之间缺乏可比性[83]。不同方法各有其优势及不足,定量检测主要用于医院进行感染诊断、排除相关疾病或判断疾病严重程度等;定性或半定量检测则可用于基层、社区或床边初筛时快速检测。现有的PCT研究和阈值均基于血标本检测,因此不推荐检测其他体液标本。
大部分儿童LRTI感染较为局限,需要采用更低的诊断阈值,因此,血清PCT检测应确保高敏感度和足够的精密度[89];建议临床应用中尽量避免超线性检测以保证临床决策的安全性[11]。2019年我国国家药监局首次批准赛默飞公司的时间分辨荧光免疫法PCT检测(Kryptor PCT),敏感度为0.06 µg/L,且将PCT 0.25 µg/L作为轻中度下呼吸道细菌感染鉴别诊断的阈值[90]。
另外,需注意血清PCT结果是否具有溯源性。由于血清PCT检测未实现国际标准化,应采用有溯源体系的检测平台,以确保检测的高敏感度和精密度以及阈值和结果的适用性[3]。不同溯源体系的检测方法需要建立各自的参考区间和临床决策阈值。本共识中所提及的研究均基于勃拉姆斯(B·R·A·H·M·S)溯源体系,建议PCT检测采用勃拉姆斯溯源体系的检测平台(赛默飞的时间分辨荧光免疫分析平台,罗氏的电化学发光平台,生物梅里埃的酶联免疫荧光平台,雅培、奥森多、西门子、索灵、长光华医的化学发光平台)。
本共识针对血清PCT在儿童LRTI应用的14个焦点问题给出推荐意见,为儿童LRTI的诊治提供帮助,并制定了结合PCT的疾病诊疗流程,方便临床医师使用。在临床实践中,血清PCT可辅助儿童LRTI细菌性感染的早期识别,指导抗菌药物的合理使用和停药。不同严重程度的感染应该采用不同的血清PCT阈值,同时要注意检测系统在低值区间的准确性及是否具有溯源性,以确保临床能够安全地做出决策。本共识推荐意见的证据等级总体不高,大量文献、数据来自国外,中国儿童LRTI的数据偏少,后续需要更多的高质量的证据充实。
主要执笔人:闫钢风 任晓旭 李旭芳 项龙 石永言 冯雍 刘婷彦
专家组成员(按姓氏笔画排序):马岳峰 王莹 王崇 孔凡斌 石永言 史文元 冯忠军 冯雍 任晓旭 刘冬青 刘春峰 刘婷彦 刘新光 闫钢风 许峰 杜映荣 李娅 李广平 李旭芳 杨俊梅 杨海鸥 肖政辉 张育才 张波 张晓波 张晨美 陆国平 陈大鹏 陈军 陈志敏 林建成 尚云晓 项龙 胡炎伟 段江 姜小建 祝益民 莫丽亚 钱素云 徐翼 高恒妙 银广悦 蔡会欣
利益冲突 所有作者声明无利益冲突
| [1] | FDA Nesws Release. FDA clears test to help manage antibiotic treatment for lower respiratory tract infections and sepsis. [EB/oL], http://www.fda.gov/newserents/press-announcements[2017-02-23]. |
| [2] | 中华医学会儿科学分会医院感染管理与控制专业委员会. 血清降钙素原检测在儿童感染性疾病中的临床应用专家共识[J]. 中华儿科杂志, 2019, 57(1): 9-15. DOI:10.3760/cma.j.issn.0578-1310.2019.01.005 |
| [3] | 降钙素原在成人下呼吸道感染性疾病分级管理中的应用专家共识组. 降钙素原在成人下呼吸道感染性疾病分级管理中的应用专家共识[J]. 中华急诊医学杂志, 2021, 30(4): 393-401. DOI:10.3760/cma.j.issn.1671-0282.2021.04.004 |
| [4] | 中国医药教育协会感染疾病专业委员会. 降钙素原指导抗菌药物临床合理应用专家共识[J]. 中华医学杂志, 2020, 100(36): 2813-2821. DOI:10.3760/cma.j.cn112137-20200714-02112 |
| [5] | Ziglio E, Adler M. Gazing into the oracle: the Delphi method and its application to social policy and public health[M]. London: Jessica Kingsley Publishers, 1996. |
| [6] | Karzai W, Oberhoffer M, Meier-Hellmann A, et al. Procalcitonin: a new indicator of the systemic response to severe infections[J]. Infection, 1997, 25(6): 329-334. DOI:10.1007/BF01740811 |
| [7] | Nascimento-Carvalho CM, Cardoso MR, Barral A, et al. Procalcitonin is useful in identifying bacteraemia among children with pneumonia[J]. Scand J Infect Dis, 2010, 42(9): 644-649. DOI:10.3109/00365541003796775 |
| [8] | Stockmann C, Ampofo K, Killpack J, et al. Procalcitonin accurately identifies hospitalized children with low risk of bacterial community-acquired pneumonia[J]. J Pediatric Infect Dis Soc, 2018, 7(1): 46-53. DOI:10.1093/jpids/piw091 |
| [9] | Fonseca TS, Vasconcellos ÂG, Gendrel D, et al. Recovery from childhood community-acquired pneumonia in a developing country: prognostic value of serum procalcitonin[J]. Clin Chim Acta, 2019, 489: 212-218. DOI:10.1016/j.cca.2017.12.021 |
| [10] | Galetto-Lacour A, Alcoba G, Posfay-Barbe KM, et al. Elevated inflammatory markers combined with positive pneumococcal urinary antigen are a good predictor of pneumococcal community-acquired pneumonia in children[J]. Pediatr Infect Dis J, 2013, 32(11): 1175-1179. DOI:10.1097/INF.0b013e31829ba62a |
| [11] | Schuetz P, Beishuizen A, Broyles M, et al. Procalcitonin (PCT)-guided antibiotic stewardship: an international experts consensus on optimized clinical use[J]. Clin Chem Lab Med, 2019, 57(9): 1308-1318. DOI:10.1515/cclm-2018-1181 |
| [12] | Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [13] | Canavaggio P, Boutolleau D, Goulet H, et al. Procalcitonin for clinical decisions on influenza-like illness in emergency department during influenza a(H1N1)2009 pandemic[J]. Biomarkers, 2018, 23(1): 10-13. DOI:10.1080/1354750X.2016.1276626 |
| [14] | Wang FM, Yang CY, Qian Y, et al. Clinical characteristics of human adenovirus infection in hospitalized children with acute respiratory infection in Beijing[J]. Chin J Pediatr, 2022, 60(1): 30-35. DOI:10.3760/cma.j.cn112140-20210809-00658 |
| [15] | Li ZH, He LY, Li SH, et al. Combination of procalcitonin and C-reactive protein levels in the early diagnosis of bacterial co-infections in children with H1N1 influenza[J]. Influenza Other Respir Viruses, 2019, 13(2): 184-190. DOI:10.1111/irv.12621 |
| [16] | Do Q, Dao TM, Nguyen TNT, et al. Procalcitonin identifies bacterial coinfections in Vietnamese children with severe respiratory syncytial virus pneumonia[J]. Biomed Res Int, 2020, 2020: 7915158. DOI:10.1155/2020/7915158 |
| [17] | Kotula JJ 3rd, Moore WS 2nd, Chopra A, et al. Association of procalcitonin value and bacterial coinfections in pediatric patients with viral lower respiratory tract infections admitted to the pediatric intensive care unit[J]. J Pediatr Pharmacol Ther, 2018, 23(6): 466-472. DOI:10.5863/1551-6776-23.6.466 |
| [18] | Meyer Sauteur PM, Krautter S, Ambroggio L, et al. Improved diagnostics help to identify clinical features and biomarkers that predict Mycoplasma pneumoniae community-acquired pneumonia in children[J]. Clin Infect Dis, 2019, 71(7): 1645-1654. DOI:10.1093/cid/ciz1059 |
| [19] | Wacker C, Prkno A, Brunkhorst FM, et al. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2013, 13(5): 426-435. DOI:10.1016/S1473-3099(12)70323-7 |
| [20] | Ge X, Li P, Wu ZG. Clinical diagnostic value of combined detection of serum C-reactive protein and procalcitonin for bacterial infectious diseases in children[J]. J Coll Physicians Surg Pak, 2019, 29(2): 189-190. DOI:10.29271/jcpsp.2019.02.189 |
| [21] | Li Y, Min LF, Zhang X. Usefulness of procalcitonin (PCT), C-reactive protein (CRP), and white blood cell (WBC) levels in the differential diagnosis of acute bacterial, viral, and mycoplasmal respiratory tract infections in children[J]. BMC Pulm Med, 2021, 21(1): 386. DOI:10.1186/s12890-021-01756-4 |
| [22] | Yin HL, Mo SM. Value of combined detection of serum amyloid A, C-reactive protein and procalcitonin in differential diagnosis of respiratory tract infection in children of China[J]. Ann Med, 2022, 54(1): 1732-1737. DOI:10.1080/07853890.2022.2064542 |
| [23] | Angeletti S, Spoto S, Fogolari M, et al. Diagnostic and prognostic role of procalcitonin (PCT) and MR-pro-Adrenomedullin (MR-proADM) in bacterial infections[J]. APMIS, 2015, 123(9): 740-748. DOI:10.1111/apm.12406 |
| [24] | Baumann P, Fuchs A, Gotta V, et al. The kinetic profiles of copeptin and mid regional proadrenomedullin (MR-proADM) in pediatric lower respiratory tract infections[J]. PLoS One, 2022, 17(3): e0264305. DOI:10.1371/journal.pone.0264305 |
| [25] | Baer G, Baumann P, Buettcher M, et al. Procalcitonin guidance to reduce antibiotic treatment of lower respiratory tract infection in children and adolescents (ProPAED): a randomized controlled trial[J]. PLoS One, 2013, 8(8): e68419. DOI:10.1371/journal.pone.0068419 |
| [26] | Esposito S, Tagliabue C, Picciolli I, et al. Procalcitonin measurements for Guiding antibiotic treatment in pediatric pneumonia[J]. Respir Med, 2011, 105(12): 1939-1945. DOI:10.1016/j.rmed.2011.09.003 |
| [27] | Ranganathan SC, Sonnappa S. Pneumonia and other respiratory infections[J]. Pediatr Clin North Am, 2009, 56(1): 135-156. |
| [28] | Ruuskanen O, Lahti E, Jennings LC, et al. Viral pneumonia[J]. Lancet, 2011, 377(9773): 1264-1275. DOI:10.1016/S0140-6736(10)61459-6 |
| [29] | Bradley J S, Byington C L, SHAH S S, et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America[J]. Clin Infect Dis, 2011, 53(7): e25-76. |
| [30] | Harris M, Clark J, Coote N, et al. British Thoracic Society guidelines for the management of community acquired pneumonia in children: update 2011[J]. Thorax, 2011, 66(Suppl 2): ii1-ii23. DOI:10.1136/thoraxjnl-2011-200598 |
| [31] | Clark JE. Determining the microbiological cause of a chest infection[J]. Arch Dis Child, 2015, 100(2): 193-197. DOI:10.1136/archdischild-2013-305742 |
| [32] | Alejandre C, Balaguer M, Guitart C, et al. Procalcitonin-guided protocol decreased the antibiotic use in paediatric patients with severe bronchiolitis[J]. Acta Paediatr, 2020, 109(6): 1190-1195. DOI:10.1111/apa.15148 |
| [33] | Barbieri E, Rossin S, Giaquinto C, et al. A procalcitonin and C-reactive protein-guided clinical pathway for reducing antibiotic use in children hospitalized with bronchiolitis[J]. Children (Basel), 2021, 8(5): 351. DOI:10.3390/children8050351 |
| [34] | Rossin S, Barbieri E, Cantarutti A, et al. Multistep antimicrobial stewardship intervention on antibiotic Prescriptions and treatment duration in children with pneumonia[J]. PLoS One, 2021, 16(10): e0257993. DOI:10.1371/journal.pone.0257993 |
| [35] | Katz SE, Crook J, Gillon J, et al. Use of a procalcitonin-guided antibiotic treatment algorithm in the pediatric intensive care unit[J]. Pediatr Infect Dis J, 2021, 40(4): 333-337. DOI:10.1097/INF.0000000000002986 |
| [36] | Dandona P, Nix D, Wilson MF, et al. Procalcitonin increase after endotoxin injection in normal subjects[J]. J Clin Endocrinol Metab, 1994, 79(6): 1605-1608. DOI:10.1210/jcem.79.6.7989463 |
| [37] | Brunkhorst FM, Heinz U, Forycki ZF. Kinetics of procalcitonin in iatrogenic sepsis[J]. Intensive Care Med, 1998, 24(8): 888-889. DOI:10.1007/s001340050683 |
| [38] | Cohen JF, Leis A, Lecarpentier T, et al. Procalcitonin predicts response to beta-lactam treatment in hospitalized children with community-acquired pneumonia[J]. PLoS One, 2012, 7(5): e36927. DOI:10.1371/journal.pone.0036927 |
| [39] | Adamik B, Kübler-Kielb J, Golebiowska B, et al. Effect of sepsis and cardiac surgery with cardiopulmonary bypass on plasma level of nitric oxide metabolites, neopterin, and procalcitonin: correlation with mortality and postoperative complications[J]. Intensive Care Med, 2000, 26(9): 1259-1267. DOI:10.1007/s001340000610 |
| [40] | Marc E, Ménager C, Moulin F, et al. Procalcitonin and viral meningitis: reduction of unnecessary antibiotics by measurement during an outbreak[J]. Arch Pediatr, 2002, 9(4): 358-364. DOI:10.1016/s0929-693x(01)00793-x |
| [41] | Smith KJ, Wateska A, Nowalk MP, et al. Cost-effectiveness of procalcitonin-guided antibiotic use in community acquired pneumonia[J]. J Gen Intern Med, 2013, 28(9): 1157-1164. DOI:10.1007/s11606-013-2400-x |
| [42] | Ito A, Ishida T, Tachibana H, et al. Serial procalcitonin levels for predicting prognosis in community-acquired pneumonia[J]. Respirology, 2016, 21(8): 1459-1464. DOI:10.1111/resp.12846 |
| [43] | Don M, Valent F, Korppi M, et al. Efficacy of serum procalcitonin in evaluating severity of community-acquired pneumonia in childhood[J]. Scand J Infect Dis, 2007, 39(2): 129-137. DOI:10.1080/00365540600951283 |
| [44] | Florin TA, Ambroggio L, Brokamp C, et al. Biomarkers and disease severity in children with community-acquired pneumonia[J]. Pediatrics, 2020, 145(6): e20193728. DOI:10.1542/peds.2019-3728 |
| [45] | Ratageri VH, Panigatti P, Mukherjee A, et al. Role of procalcitonin in diagnosis of community acquired pneumonia in Children[J]. BMC Pediatr, 2022, 22(1): 217. DOI:10.1186/s12887-022-03286-2 |
| [46] | Fernandes CD, Arriaga MB, Costa MCM, et al. Host inflammatory biomarkers of disease severity in pediatric community-acquired pneumonia: a systematic review and Meta-analysis[J]. Open Forum Infect Dis, 2019, 6(12): ofz520. DOI:10.1093/ofid/ofz520 |
| [47] | Wang WL, Zhu YT, Yin LL, et al. Utilization of serum procalcitonin as a biomarker in the diagnosis and treatment of children with bacterial hospital-acquired pneumonia[J]. Mol Cell Biochem, 2021, 476(1): 261-267. DOI:10.1007/s11010-020-03902-8 |
| [48] | Aygun F. Procalcitonin value is an early prognostic factor related to mortality in admission to pediatric intensive care unit[J]. Crit Care Res Pract, 2018, 2018: 9238947. DOI:10.1155/2018/9238947 |
| [49] | Pérez-López A, Irwin A, Rodrigo C, et al. Role of C reactive protein and procalcitonin in the diagnosis of lower respiratory tract infection in children in the outpatient setting[J]. BMJ, 2021, 373: n1409. DOI:10.1136/bmj.n1409 |
| [50] | Wrotek A, Wrotek O, Jackowska T. Low levels of procalcitonin are related to decreased antibiotic use in children hospitalized due to influenza[J]. Diagnostics (Basel), 2022, 12(5): 1148. DOI:10.3390/diagnostics12051148 |
| [51] | Stocker M, van Herk W, El Helou S, et al. Procalcitonin-guided decision making for duration of antibiotic therapy in neonates with suspected early-onset sepsis: a multicentre, randomised controlled trial (NeoPIns)[J]. Lancet, 2017, 390(10097): 871-881. DOI:10.1016/S0140-6736(17)31444-7 |
| [52] | Go H, Nagano N, Katayama D, et al. Diagnostic accuracy of biomarkers for early-onset neonatal bacterial infections: evaluation of serum procalcitonin reference curves[J]. Diagnostics (Basel), 2020, 10(10): E839. DOI:10.3390/diagnostics10100839 |
| [53] | van Rossum A, Wulkan R, Oudesluys-Murphy A. Procalcitonin as an early marker of infection in neonates and children[J]. Lancet Infect Dis, 2004, 4(10): 620-630. DOI:10.1016/S1473-3099(04)01146-6 |
| [54] | Memar MY, Varshochi M, Shokouhi B, et al. Procalcitonin: The marker of pediatric bacterial infection[J]. Biomed Pharmacother, 2017, 96: 936-943. DOI:10.1016/j.biopha.2017.11.149 |
| [55] | Aloisio E, Dolci A, Panteghini M. Procalcitonin: Between evidence and critical issues[J]. Clin Chim Acta, 2019, 496: 7-12. DOI:10.1016/j.cca.2019.06.010 |
| [56] | Kurul Ş, Simons SHP, Ramakers CRB, et al. Association of inflammatory biomarkers with subsequent clinical course in suspected late onset sepsis in preterm neonates[J]. Crit Care, 2021, 25(1): 12. DOI:10.1186/s13054-020-03423-2 |
| [57] | Liu CM, Fang CZ, Xie LL. Diagnostic utility of procalcitonin as a biomarker for late-onset neonatal sepsis[J]. Transl Pediatr, 2020, 9(3): 237-242. DOI:10.21037/tp-20-127 |
| [58] | Chiesa C, Natale F, Pascone R, et al. C reactive protein and procalcitonin: reference intervals for preterm and term newborns during the early neonatal period[J]. Clin Chim Acta, 2011, 412(11/12): 1053-1059. DOI:10.1016/j.cca.2011.02.020 |
| [59] | Fukuzumi N, Osawa K, Sato I, et al. Age-specific percentile-based reference curve of serum procalcitonin concentrations in Japanese preterm infants[J]. Sci Rep, 2016, 6: 23871. DOI:10.1038/srep23871 |
| [60] | 王思云, 余加林. 降钙素原在新生儿早发型败血症中的诊断价值[J]. 中华当代儿科杂志, 2020, 22(4): 316-322. DOI:10.7499/j.issn.1008-8830.1910171 |
| [61] | Lee J, Bang YH, Lee EH, et al. The influencing factors on procalcitonin values in newborns with noninfectious conditions during the first week of life[J]. Korean J Pediatr, 2017, 60(1): 10-16. DOI:10.3345/kjp.2017.60.1.10 |
| [62] | Turner D, Hammerman C, Rudensky B, et al. Procalcitonin in preterm infants during the first few days of life: introducing an age related nomogram[J]. Arch Dis Child Fetal Neonatal Ed, 2006, 91(4): F283-F286. DOI:10.1136/adc.2005.085449 |
| [63] | Liu YF, Tong XM, Zheng FY, et al. Physiological changes in serum procalcitonin concentrations in premature infants early after birth[J]. Chin J Contemp Pediatr, 2013, 15(2): 81-84. |
| [64] | Naramura T, Tanaka K, Inoue T, et al. New reference ranges of procalcitonin excluding respiratory failure in neonates[J]. Pediatr Int, 2020, 62(10): 1151-1157. DOI:10.1111/ped.14282 |
| [65] | Shao SR, Luo CY, Zhou KY, et al. Predictive value of serum procalcitonin for both initial and repeated immunoglobulin resistance in Kawasaki disease: a prospective cohort study[J]. Pediatr Rheumatol Online J, 2019, 17(1): 78. DOI:10.1186/s12969-019-0379-5 |
| [66] | Nakamura N, Muto T, Masuda Y, et al. Procalcitonin as a biomarker of unresponsiveness to intravenous immunoglobulin for Kawasaki disease[J]. Pediatr Infect Dis J, 2020, 39(9): 857-861. DOI:10.1097/INF.0000000000002716 |
| [67] | Niu MM, Jiang Q, Ruan JW, et al. Clinical implications of procalcitonin in Kawasaki disease: a useful candidate for differentiating from sepsis and evaluating IVIG responsiveness[J]. Clin Exp Med, 2021, 21(4): 633-643. DOI:10.1007/s10238-021-00709-9 |
| [68] | Bobillo-Perez S, Girona-Alarcon M, Sole-Ribalta A, et al. Infection…what else? The usefulness of procalcitonin in children after cardiac surgery[J]. PLoS One, 2021, 16(10): e0254757. DOI:10.1371/journal.pone.0254757 |
| [69] | Silvetti S, Lembo R, Mesini A, et al. Procalcitonin and early postoperative infection after pediatric cardiopulmonary bypass surgery[J]. J Cardiothorac Vasc Anesth, 2021, 35(12): 3688-3693. DOI:10.1053/j.jvca.2021.04.036 |
| [70] | Farias JS, Villarreal EG, Dhargalkar J, et al. C-reactive protein and procalcitonin after congenital heart surgery utilizing cardiopulmonary bypass: when should we be worried?[J]. J Card Surg, 2021, 36(11): 4301-4307. DOI:10.1111/jocs.15952 |
| [71] | Bavare A, Rissmiller B, Devaraj S, et al. Perioperative procalcitonin in predicting infection in children undergoing surgical procedures[J]. J Surg Res, 2021, 258: 332-338. DOI:10.1016/j.jss.2020.09.028 |
| [72] | Pilanci O, Ergin S, Sirekbasan S, et al. Serum neopterin and procalcitonin levels in relationship with pediatric burn wound infections[J]. Acta Microbiol Immunol Hung, 2016, 63(1): 47-56. DOI:10.1556/030.63.2016.1.3 |
| [73] | 刘少锋, 袁高品, 杨健, 等. 降钙素原评估儿童创伤严重程度和创伤后脓毒症的研究[J]. 四川大学学报(医学版), 2012, 43(5): 706-710. DOI:10.13464/j.scuxbyxb.2012.05.027 |
| [74] | Bolia, Srivastava A, Marak R, et al. Role of procalcitonin and C-reactive protein As biomarkers of infection in children with liver disease[J]. J Pediatr Gastroenterol Nutr, 2016, 63(4): 406-411. DOI:10.1097/MPG.0000000000001181 |
| [75] | 郭张妍, 裴亮, 刘春峰. 儿童急性肝衰竭血清降钙素原变化及其临床意义[J]. 中国小儿急救医学, 2014, 21(8): 493-496. DOI:10.3760/cma.j.issn.1673-4912.2014.08.006 |
| [76] | Tschiedel E, Assert R, Felderhoff-Müser U, et al. Undue elevation of procalcitonin in pediatric paracetamol intoxication is not explained by liver cell injury alone[J]. Ann Hepatol, 2018, 17(4): 631-637. DOI:10.5604/01.3001.0012.0932 |
| [77] | 吴颖, 许清源, 张瑞东, 等. 儿童急性淋巴细胞白血病并发急性胰腺炎的危险因素分析[J]. 中华实用儿科临床杂志, 2022, 37(11): 825-830. DOI:10.3760/cma,j.cm101070-20210606-00650 |
| [78] | Shah NN, Watson TM, Yates B, et al. Procalcitonin and cytokine profiles in engraftment syndrome in pediatric stem cell transplantation[J]. Pediatr Blood Cancer, 2017, 64(3). DOI:10.1002/pbc.26273 |
| [79] | Zant R, Melter M, Knoppke B, et al. Kinetics of interleukin-6, procalcitonin, and C-reactive protein after pediatric liver transplantation[J]. Transplant Proc, 2014, 46(10): 3507-3510. DOI:10.1016/j.transproceed.2014.08.048 |
| [80] | Mouche A, Parmentier C, Herbez Rea C, et al. Procalcitonin serum levels in stage 5 chronic kidney disease children on hemodialysis[J]. Pediatr Nephrol, 2021, 36(8): 2405-2409. DOI:10.1007/s00467-021-04966-4 |
| [81] | Eckelt F, Pfaeffle R, Kiess W, et al. Calcitonin and complementary biomarkers in the diagnosis of hereditary medullary thyroid carcinoma in children and adolescents[J]. J Pediatr Endocrinol Metab, 2021, 34(12): 1491-1504. DOI:10.1515/jpem-2021-0163 |
| [82] | Dauber A, Weiss S, Maniaci V, et al. Procalcitonin levels in febrile infants after recent immunization[J]. Pediatrics, 2008, 122(5): e1119-e1122. DOI:10.1542/peds.2008-1884 |
| [83] | Meisner M. Update on procalcitonin measurements[J]. Ann Lab Med, 2014, 34(4): 263-273. DOI:10.3343/alm.2014.34.4.263 |
| [84] | Lin SG, Hou TY, Huang DH, et al. Role of procalcitonin in the diagnosis of severe infection in pediatric patients with fever and Neutropenia: a systemic review and meta-analysis[J]. Pediatr Infect Dis J, 2012, 31(10): e182-e188. DOI:10.1097/INF.0b013e31825da45d |
| [85] | Arif T, Phillips RS. Updated systematic review and meta-analysis of the predictive value of serum biomarkers in the assessment and management of fever during neutropenia in children with cancer[J]. Pediatr Blood Cancer, 2019, 66(10): e27887. DOI:10.1002/pbc.27887 |
| [86] | Doerflinger M, Haeusler GM, Li-Wai-Suen CSN, et al. Procalcitonin and interleukin-10 may assist in early prediction of bacteraemia in children with cancer and febrile neutropenia[J]. Front Immunol, 2021, 12: 641879. DOI:10.3389/fimmu.2021.641879 |
| [87] | Page AL, de Rekeneire N, Sayadi S, et al. Diagnostic and prognostic value of procalcitonin and C-reactive protein in malnourished children[J]. Pediatrics, 2014, 133(2): e363-e370. DOI:10.1542/peds.2013-2112 |
| [88] | Tompa A, Åkesson K, Karlsson S, et al. Suppressed immune profile in children with combined type 1 diabetes and celiac disease[J]. Clin Exp Immunol, 2020, 201(3): 244-257. DOI:10.1111/cei.13454 |
| [89] | Lee CC, Kwa ALH, Apisarnthanarak A, et al. Procalcitonin (PCT)-guided antibiotic stewardship in Asia-Pacific countries: adaptation based on an expert consensus meeting[J]. Clin Chem Lab Med, 2020, 58(12): 1983-1991. DOI:10.1515/cclm-2019-1122 |
| [90] | 赛默飞世尔科技(中国)有限公司. 降钙素原检测试剂盒(时间分辨荧光免疫法)说明书[Z]. |
 2022, Vol. 31
2022, Vol. 31