2. 北京协和医学院中日友好医院, 北京 100029;
3. 中日友好医院心脏科, 北京 100029
2. ina-Japan Friendship Hospital, Peking Union Medical College, Beijing 100029, China;
3. Department of Cardiology, China-Japan Friendship Hospital, Beijing 100029, China
急性心肌炎是一种炎症性心肌病,最常见的病因为病毒感染,其临床表现多样,轻者可表现为无症状或仅有心悸、呼吸困难和短暂心电图改变,重者可出现致死性心律失常、心源性休克乃至猝死[1-4]。大部分急性心肌炎患者预后良好,但仍有1/5的患者表现为暴发型,病程进展迅速,极易出现院内死亡、恶性心律失常、心源性休克及心力衰竭等不良事件[5-6]。急性心肌炎患者院内不良事件的发生率约为7%~30%[5, 7-8]。随着临床中循环辅助装置的广泛使用,重症心肌炎尤其是暴发性心肌炎患者的院内病死率大幅下降[5]。早期识别重症患者,有助于提高急性心肌炎患者的救治成功率。
以往关于心肌炎患者预后危险因素的研究不少,但是结论不一致,包括临床表现,如左心室射血分数(left ventricular ejection fraction, LVEF)下降、心肌损伤标记物升高,以及多种心电图异常,如QRS > 120 ms和传导阻滞[3, 9-11]。此外,基于心肌活检的病理分型及心脏核磁特征对心肌炎患者的预后也有较高预测价值[12-18],但是心肌活检为有创检查,而心脏核磁也受到可及性的影响。目前,临床中缺少快速、有效的指标早期预测急性心肌炎患者院内恶化。D-二聚体是纤维蛋白的一种特异性降解产物,也是炎症激活的指标[19]。在急性炎症性疾病中,D-二聚体是重要的预后标志物,其在急性心肌炎患者的预后缺少研究。本研究对入院时血清D-二聚体水平及联合心肌损伤标记物对急性心肌炎患者发生院内不良事件的预测价值进行探讨,以早期识别高危患者。
1 资料与方法 1.1 研究对象回顾性连续入选2010年1月1日至2021年10月31日在中日友好医院住院的急性心肌炎患者,纳入标准为:(1)年龄≥15岁;(2)符合2013欧洲心脏病学会心肌炎病因、诊断、管理和治疗共识[1]的诊断标准,即①新出现的心电图(ECG)和(或)Holter和(或)负荷试验异常(如心律失常、ST/T波改变等);②肌钙蛋白T/I(cTnT/I)升高(cTnT≥0.014 ng/mL;cTnI≥0.04 ng/mL);③影像学检查提示新出现或无法解释的心脏结构或功能异常;④急性胸痛、呼吸困难、心悸、不明原因的心律失常、心脏性猝死或心源性休克等临床表现。同时满足④及①②③中的1条及以上,且无冠脉疾病(冠状动脉狭窄≥50%)或已知的可解释症状的其他病因;无④者满足①②③中2条及以上;(3)出现心脏症状到入院的时间≤30 d。排除标准:(1)合并冠心病、瓣膜性心脏病、肥厚型心肌病或其他心肌病;(2)应用免疫检查点抑制剂或其他抗肿瘤药物;(3)合并免疫系统疾病;(4)无法获得实验室检查等资料。本研究符合《赫尔辛基宣言》的原则并通过医院伦理审批,审批号为2019-77-K49。
1.2 临床数据收集患者的基本情况:年龄、性别、体重指数(body mass index, BMI)、个人史,即吸烟、饮酒史,及生命体征;入院首份ECG表现,包括PR间期及QRS间期;经胸超声心动指标,包括LVEF及左心室舒张末期内径(left ventricular end-diastolic dimension, LVEDD);入院24 h内实验室检查:白细胞计数、血红蛋白、C反应蛋白、纤维蛋白(原)降解产物、血肌酐、cTnT/I、肌红蛋白(myoglobin, Myo)、肌酸激酶同工酶(creatinine kinase-MB, CK-MB)及B型利钠肽(brain natriuretic peptide, BNP)/N末端B型利钠肽前体(N-terminal pronatriuretic peptide, NT-proBNP)水平。血清D-二聚体的测定时间为入院后24 h内,利用免疫比浊法测定(法国Stago STA-R Evolution血凝仪)。心肌损伤标志物阳性的定义为满足以下任一种情况:cTnT≥0.014 ng/mL;cTnI≥0.04 ng/mL;Myo≥60 ng/mL;CK-MB≥25 IU/L或≥4.3 ng/mL。
1.3 院内不良事件及定义不良事件定义为住院期间发生的任何原因的死亡、恶性室性心律失常、心源性休克及新发心力衰竭的复合终点。恶性室性心律失常的定义为持续性室速和室颤,持续性室速为超过30 s或需要药物、电复律终止。心源性休克定义为:在血容量充足的情况下存在低血压(收缩压 < 90 mmHg,1 mmHg = 0.133 kPa),需要使用血管升压药物或机械循环支持以维持血压。新发心力衰竭定义为:既往无心力衰竭病史,出现心衰的症状和(或)体征,如严重呼吸困难、运动耐量降低、颈静脉怒张、肺部啰音、第三心音(奔马律)、肝颈静脉回流征阳性及下肢水肿等,并伴有NT-proBNP≥300 ng/L或BNP≥100 ng/L或超声心动图示LVEF < 50%。
1.4 统计学方法符合正态分布的数据以均数±标准差(x±s)表示,两组间比较采用独立样本t检验。非正态分布的变量以中位数(四分位数)[M(Q1, Q3)]表示,两组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,两组间比较采用Pearson卡方检验或Fisher精确检验。根据入院时D-二聚体水平的中位数将患者分为两组:D-二聚体高水平组和低水平组。采用Logistic多因素分析探索院内不良事件的独立预测因素。采用受试者工作特征(ROC)曲线评估入院血清D-二聚体对急性心肌炎患者发生院内不良事件的预测价值。采用双侧检验,以P < 0.05为差异有统计学意义。应用SPSS 25.0统计软件进行数据分析。
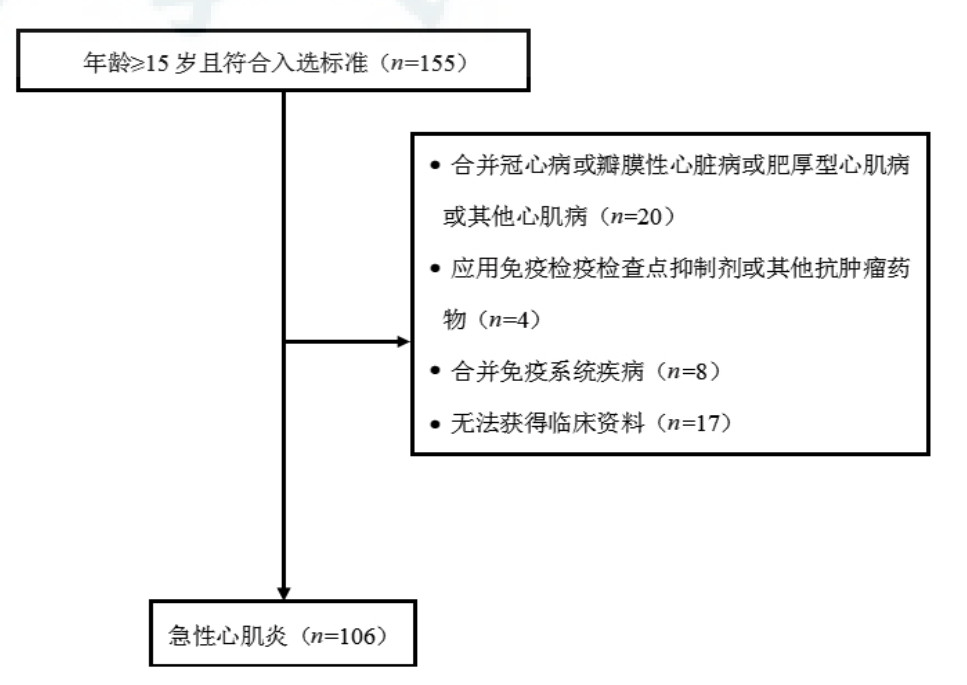
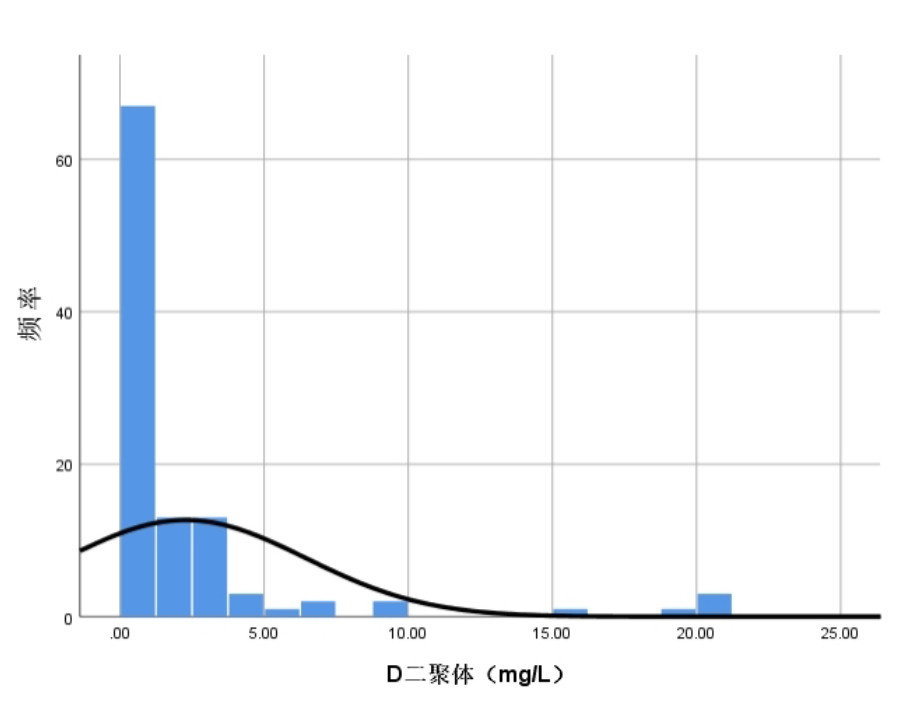
2 结果 2.1 基线特征初筛155例患者,排除合并冠心病或瓣膜性心脏病或肥厚型心肌病或其他心肌病的患者20例、应用免疫检疫检查点抑制剂或其他抗肿瘤药物的患者4例,合并免疫系统疾病的患者8例及无法获得如入院血清D-二聚体水平患者17例后,最终纳入106例(图 1)。研究人群年龄(36±16)岁,男性占62.3%(表 1)。前驱症状以发热最常见,占57.5%,呼吸系统症状(如咳嗽、咳痰、流涕及呼吸困难等)占48.1%,其次为胃肠道症状(如腹痛、腹泻等)占25.5%。呼吸困难(52.8%)及胸痛(39.6%)患者较多,其次为乏力(27.4%)及心悸(23.6%),以晕厥(1.9%)为首发表现的患者较少。入院时血清D-二聚体水平呈偏态分布,为0.79(0.31, 2.24)mg/L(图 2)。
|
| 图 1 患者筛选流程图 Fig 1 Patient screening flow chart |
|
|
|
| 图 2 患者入院血清D-二聚体水平的频率分布 Fig 2 Frequency distribution of serum D-dimer levels at admission |
|
|
| 指标 | 总体(n=106) | D-二聚体 < 0.79mg/L(n=54) | D-二聚体≥0.79mg/L(n=52) | P值 |
| 年龄(岁)a | 32(24, 44) | 32(23, 41) | 32(25, 47) | 0.463 |
| 男性b | 66(62.3) | 35(64.8) | 31(59.6) | 0.581 |
| BMI(kg/m2)a | 23.04(20.72, 25.44) | 23.39(20.55, 25.47) | 22.86(20.76, 25.91) | 0.758 |
| 吸烟b | 36(34.0) | 18(33.3) | 18(34.6) | 0.889 |
| 饮酒b | 16(15.1) | 8(14.8) | 8(15.4) | 0.935 |
| 收缩压(mmHg)c | 118±18 | 121±14 | 114±21 | 0.014 |
| 舒张压(mmHg)c | 73±12 | 76±10 | 71±13 | 0.032 |
| 心率(次/min)c | 88±23 | 79±15 | 97±26 | < 0.001 |
| 实验室检查 | ||||
| 白细胞计数(×109/L)c | 8.43±3.53 | 7.73±2.86 | 9.17±4.01 | 0.047 |
| 血红蛋白(g/L)c | 134±18 | 138±17 | 129±18 | 0.020 |
| C反应蛋白(mg/dL)a | 3.04(0.58, 19.6) | 1.30(0.13, 8.97) | 6.82(1.61, 20.05) | 0.011 |
| 血肌酐(μmmol/L)a | 72.40(62.70, 92.82) | 68.80(60.18, 81.93) | 86.95(67.63, 117.83) | < 0.001 |
| 心肌标志物升高 | 78(73.6) | 37(68.5) | 41(78.8) | 0.228 |
| BNP(ng/mL)a | 89.80(34.90, 354.30) | 66.05(20.05, 172.33) | 142.00(37.10, 500.60) | 0.151 |
| NT-ProBNP(ng/mL)a | 677.50(173.50, 3729.75) | 177.00(90.00, 564.50) | 2836.50(876.50, 9730.75) | < 0.001 |
| PR间期 > 200 msb | 11/96(11.5) | 4/53(7.5) | 7/43(16.3) | 0.211 |
| QRS间期 > 120 msb | 15/98(15.3) | 4/54(7.4) | 11/44(25.0) | 0.016 |
| LVEF(%)a | 60(49, 67) | 65(60, 69) | 59(45, 65) | 0.002 |
| LVEDD(mm)a | 48(44, 52) | 48(44, 53) | 48(44, 50) | 0.420 |
| 住院期间治疗b | ||||
| 抗心律失常药物 | 8(7.5) | 2(3.7) | 6(11.5) | 0.157 |
| 免疫治疗 | 24(22.6) | 2(3.7) | 22(42.3) | < 0.001 |
| 糖皮质激素 | 21(19.8) | 2(3.7) | 19(36.5) | < 0.001 |
| 免疫球蛋白 | 10(9.4) | 1(1.9) | 9(17.3) | 0.007 |
| ACEI/ARB | 22(20.8) | 11(20.4) | 11(21.2) | 0.921 |
| β受体阻滞剂 | 30(28.3) | 15(27.8) | 15(28.8) | 0.903 |
| 注:BMI为身体质量指数,FDP为纤维蛋白(原)降解产物,BNP为B型利钠肽,NT-proBNP为N末端B型利钠肽前体,LVEF为左心室射血分数,LVEDD为左心室舒张末期内径,ACEI/ARB为血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体拮抗剂;a为M(Q1, Q3),b为例(%),c为(x±s) | ||||
两组患者在年龄、性别、BMI及个人史方面差异无统计学意义。与D-二聚体低水平组比较,D-二聚体高水平组患者入院时的收缩压[(114±21)mmHg vs. (121±14) mmHg, P=0.014]及舒张压[(71±13)mmHg vs. (76±10)mmHg, P=0.032]更低,心率[(97±26)次/min vs. (79±15)次/min,P < 0.001]更快,白细胞计数[(9.17±4.01)×109/L vs. (7.73±2.86)×109/L, P=0.047)、C反应蛋白水平[6.82(1.61, 20.05) mg/dL vs. 1.30(0.13, 8.97) mg/dL, P=0.011]、血肌酐[86.95(67.63, 117.83) μmol/L vs. 68.80(60.18, 81.93) μmol/L,P < 0.001]及NT-proBNP水平[2836.50(876.50, 9730.75) ng/mL vs. 177.00(90.00, 564.50) ng/mL, P < 0.001]更高,血红蛋白水平[(129±18) vs. (138±17) g/L, P=0.020)更低。此外,高水平组患者心电图出现QRS间期 > 120 ms(25.0% vs. 7.4%, P=0.016)的比例更高,左室射血分数更低(59% vs. 65%, P=0.002)(表 1)。
住院期间共11例患者使用机械通气,其中无创呼吸机6例,有创呼吸机5例。4例患者接受了主动脉内球囊反搏和(或)体外膜肺氧合治疗。D-二聚体较高平组患者住院期间接受免疫治疗(42.3% vs. 3.7%,P < 0.001)的比例更高。两组应用血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体拮抗剂(ACEI/ARB)、β受体阻滞剂及抗心律失常药物差异无统计学意义(表 1)。
共12例(11%)患者入院后2周内行心脏核磁检查,2例表现为局部心肌水肿,8例表现为局部纤维化,2例未见明显水肿或纤维化病灶。4例患者行心肌心内膜活检,病理证实为淋巴细胞性心肌炎。共69例患者在院期间完善病原学检测,EB病毒阳性6例(8.7%)、肺炎支原体5例(7.2%)、巨细胞病毒2例(2.9%)、乙型流感病毒2例(2.9%)及副流感病毒1例(1.4%)(表 2)。
| 病原学指标 | IgG阳性(例,%) | IgM阳性(例, %) |
| EB病毒 | 38(55.1) | 6(8.7) |
| 巨细胞病毒 | 34(49.3) | 2(2.9) |
| 单纯疱疹病毒 | 23(33.3) | 0(0.0) |
| 风疹病毒 | 22(31.9) | 0(0.0) |
| 肺炎衣原体 | 4(5.8) | 0(0.0) |
| 肺炎支原体 | 3(4.3) | 5(7.2) |
| 副流感病毒 | 0(0.0) | 1(1.4) |
| 乙型流感病毒 | 1(1.4) | 2(2.9) |
| 腺病毒 | 1(1.4) | 0(0.0) |
共47例患者发生院内不良事件,其中死亡5例(10.6%),心源性休克15例(31.9%),恶性室性心律失常4例(8.5%),新发的心力衰竭23例(48.9%)。D-二聚体高水平组患者发生院内不良事件风险明显较高(67.3% vs. 22.2%,P < 0.001)。其中,心源性休克发生率明显较高(26.9% vs. 1.9%,P < 0.001)。(表 3)Logistic多因素分析显示院内不良事件的独立预测因素为入院时血清D-二聚体水平(OR=2.379,95%CI:1.329~4.259,P=0.004)及心肌损伤标记物升高(OR=5.850,95%CI:1.247~27.437,P=0.005)(表 4)。
| 不良事件 | 总体 | D-二聚体 < 0.79 mg/L(n=54) | D-二聚体≥0.79 mg/L(n=52) | P值 |
| 全因死亡 | 5(4.7) | 1(1.9) | 4(7.7) | 0.201 |
| 心源性休克 | 15(14.2) | 1(1.9) | 14(26.9) | < 0.001 |
| 室速或室颤 | 4(3.8) | 1(1.9) | 3(5.8) | 0.358 |
| 心力衰竭 | 23(21.7) | 9(16.7) | 14(26.9) | 0.200 |
| 总计 | 47(44.3) | 12(22.2) | 35(67.3) | < 0.001 |
| 变量 | β值 | 标准误差 | Wald χ2值 | P值 | OR值 | 95% CI |
| 血清D-二聚体水平(mg/L) | 0.867 | 0.297 | 8.507 | 0.004 | 2.379 | 1.329~4.259 |
| 心肌损伤标记物阳性 | 1.767 | 0.788 | 5.109 | 0.025 | 5.850 | 1.247~27.437 |
| 白细胞计数(×109/L) | 0.013 | 0.087 | 0.021 | 0.885 | 1.013 | 0.853~1.202 |
| 心率(次/min) | 0.003 | 0.014 | 0.063 | 0.802 | 1.003 | 0.977~1.031 |
| 血肌酐(μmol/L) | 0.001 | 0.007 | 0.014 | 0.906 | 1.001 | 0.987~1.015 |
| PR间期 > 200 ms | 1.144 | 0.877 | 1.702 | 0.192 | 3.140 | 0.563~17.523 |
| QRS间期 > 120 ms | 1.454 | 0.883 | 2.709 | 0.100 | 4.279 | 0.758~24.158 |
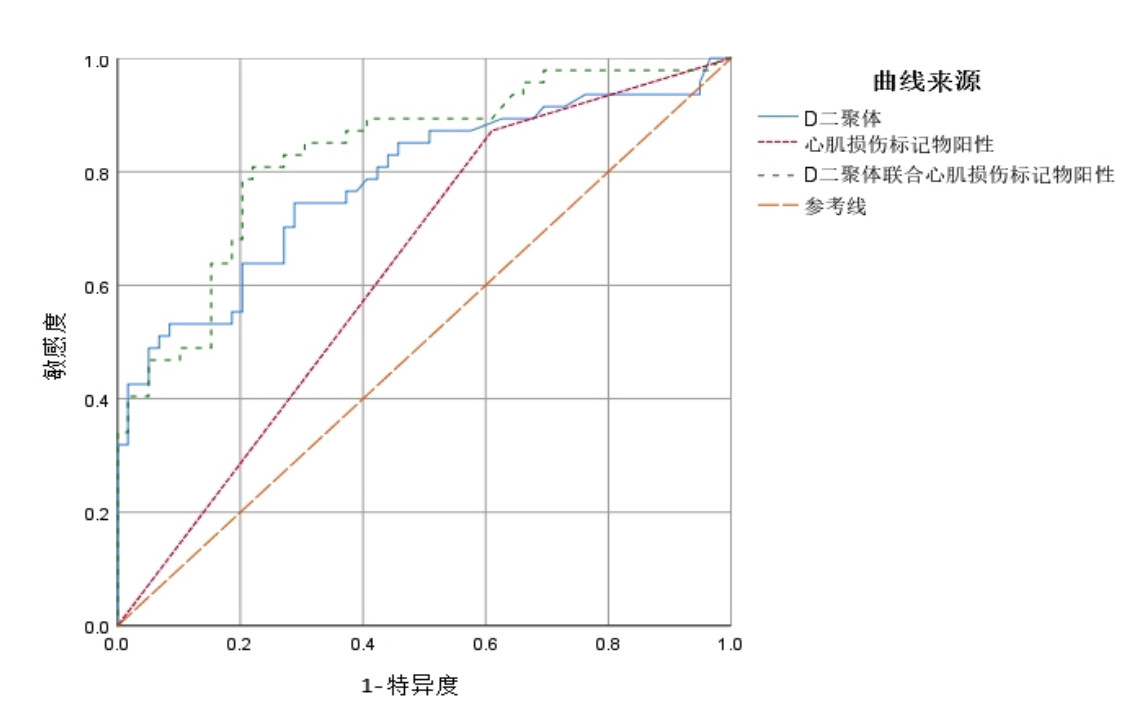
入院血清D-二聚体水平升高预测院内不良事件的曲线下面积(AUC)为0.781(95%CI:0.690~0.873),最佳界值为0.79 mg/L,敏感度为74.5%,特异度为71.2%。心肌损伤标记物阳性预测院内不良事件的AUC为0.631(95%CI:0.525~0.737),敏感度为87.2%,特异度为39.0%。入院血清D-二聚体水平升高联合心肌损伤标记物阳性预测院内不良事件的AUC为0.831(95%CI:0.752~0.910),敏感度为80.9%,特异度为78.0%(图 3)。
|
| 图 3 血清D-二聚体水平及联合心肌损伤标记物预测患者发生院内不良事件的受试者工作特征曲线 Fig 3 Receiver operating characteristic curve of serum D-dimer level and myocardial injury markers in predicting in-hospital adverse events |
|
|
本研究发现入院血清D-二聚体水平升高是急性心肌炎患者住院期间发生死亡、心源性休克、恶性室性心律失常及新发心力衰竭的独立风险因素,后续需要免疫治疗、血流动力学支持治疗的比例更高,提示该组患者病程进展更迅速。此外,入院血清D-二聚体水平升高联合心肌损伤标记物阳性的预测效果更佳。本研究为早期识别短期预后不良的重症心肌炎患者提供了临床依据。
急性心肌炎住院患者的预后差异较大,某些患者可迅速进展为重症或者暴发性心肌炎。本研究中死亡和心源性休克患者的比例达18.9%。此外,新发心力衰竭的发生率为21.7%。赵妍等[7]研究发现,入院时QRS间期 > 120 ms、CK-MB > 24 U/L及LVEF < 40%是急性心肌炎患者院内死亡或接受心脏移植的独立危险因素。左心室功能不全、LVEF < 50%、宽QRS-T角、QRS波低电压及延迟强化与急性心肌炎患者远期预后不良相关[20-22]。Xu等[3]针对403例急慢性心肌炎患者的回顾性研究发现,肌酐清除率 < 60 mL/min、年龄≥50岁、室性心动过速、NYHA心功能3级以上、男性及cTnT水平≥50 µg/L是患者院内死亡的独立危险因素。Shah等[23]针对27 129例初诊为心肌炎患者的回顾性研究提示,相比于男性,女性发生院内死亡的风险较高(3.5% vs. 1.8%,P < 0.001),本研究未发现性别与急性心肌炎患者院内不良事件风险相关。新西兰Wong等[20]针对心肌炎患者长期预后的回顾性研究(平均年龄39岁)发现,左心室功能不全(呼吸困难、胸片提示肺淤血)及LVEF < 50%是不良事件(全因死亡、失代偿性心力衰竭再住院、室性心律失常、心肌炎复发及心脏移植)的预测因素。Yu等[10]研究发现,肌钙蛋白水平持续高且BNP不高的暴发性心肌炎患者心肌损伤更重,预后更加不良。Liu等[11]针对83例暴发性心肌炎患者的研究发现,入院后24及48 h内高敏cTnI的变化是患者院内死亡的有力预测因子,而存活的暴发性心肌炎患者24 h内高敏cTnI会呈下降趋势。本研究也证实心肌损伤标记物升高的患者院内预后较差,因研究跨度较大,只有67.3%的患者检测肌钙蛋白。
本研究发现入院血清D-二聚体升高是急性心肌炎患者发生院内不良事件的独立危险因素,以往报道较少。血清D-二聚体是反映机体凝血及纤溶激活和(或)亢进的指标,炎症状态与高凝及血栓形成相关,炎症可促进机体的凝血与纤溶过程,因此,D-二聚体在很多炎症性疾病明显增高,包括病毒感染相关炎症综合征[24-27]。血清D-二聚体水平联合C反应蛋白升高的患者发生院内全因死亡、病情危重、静脉血栓栓塞及急性肾损伤的风险更高[26, 28]。入院血清D-二聚体水平升高与COVID-19患者院内死亡风险增加相关,有助于早期识别预后不良的患者[29-30],这些患者部分合并了心肌损伤或心肌炎。
本研究中分别有12例和4例患者进行心脏磁共振和心肌活检。心肌活检是诊断心肌炎的金标准,不同病理类型的心肌炎患者预后也存在差异[12-13, 17-18]。Leone等[12]研究发现,巨细胞性心肌炎和嗜酸性粒细胞性心肌炎患者的病死率及复发率均较高,常表现为暴发性进程。Ammirati等[13]针对220例经活检证实的急性心肌炎患者的研究发现,暴发性心肌炎组巨细胞性心肌炎患者的比例为14%。即使给予机械循环支持,巨细胞心肌炎患者预后仍然较差[17]。但是,我国心肌炎患者最常见的病理亚型为淋巴细胞性心肌炎[12-13, 31-32]。但心肌活检作为一项有创检查手段,患者的接受度普遍较低,临床应用受限。近年来,心脏核磁已成为公认的有效诊断和评估心肌炎的无创手段,对心肌炎患者远期预后有预测价值[14-16]。Berg等[14]动态观察24例心肌炎患者3个月后心脏核磁表现的研究发现,3个月后仍表现为延迟强化的患者发生心律失常、严重胸痛或呼吸困难的比例较高。Aquaro等[15]针对187例心肌炎患者的研究发现,6个月时复查心脏核磁表现为不伴水肿的延迟强化的患者预后更差。但该项检查对设备及专业人员的要求较高,在相对低级别的医院中应用受限,对于长期预后的预测价值较大。
急性心肌炎患者可出现多种心电图异常,且研究提示某些心电图异常可能提示预后较差[23, 25]。本研究中QRS波群增宽提示预后较差。Inaba等[5]发现入院时QRS波群增宽是暴发性心肌炎的独立预测因素。此外,Chen等[21]针对178例急性心肌炎患者长期随访(中位随访时间5.7年)的研究发现,13%的患者存在QRS-T角≥100°,且QRS-T角度是患者死亡的预测因子。Fischer等[22]针对587例急性或亚急性心肌炎患者的研究发现,QRS波低电压及宽QRS-T角(≥90°)与患者的长期预后,即全因死亡、失代偿性心衰再住院、心脏移植、持续室性心动过速及心肌炎复发的复合终点独立相关。心肌炎患者出现QRS波群增宽及宽QRS-T角等心电图异常提示受累心肌范围较大,并累及心脏传导系统,心律失常发生率较高,预后不良。本研究未收集患者QRS-T角度及QRS波电压数据。
本研究为回顾性单中心队列研究,且样本量较小,仅对急性心肌炎患者院内预后进行探讨,未进行远期预后的分析。但急性心肌炎的年发病率仅0.018%左右,多数患者度过急性期后远期预后较好[6, 9, 33]。其次,本研究中急性心肌炎为临床诊断,仅1例患者经心肌心内膜活检证实淋巴细胞性心肌炎,D-二聚体对于不同病理类型心肌炎的预后价值有待研究。第三,仅12例患者行心脏核磁检查,未对心肌延迟强化与预后的关系进行分析。第四,本研究未收集T淋巴细胞和B淋巴细胞等炎症相关指标。最后,本研究剔除了因化疗、免疫检查点抑制剂治疗等相关的免疫性心肌炎的患者,在此类患者中生物标志物对预后的价值有待进一步研究。
本研究发现入院血清D-二聚体水平升高对急性心肌炎患者发生院内不良事件具有较好的预测价值,联合心肌损伤标记物阳性预测效果更佳,有助于早期识别容易发生院内不良事件的高风险人群。血清D-二聚体水平升高,尤其是合并心肌损伤标记物阳性的患者应该给予更为严密监测与积极治疗。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈意浓、李青、于璐瑶、朱龙洋负责数据采集、论文书写及论文修改;王喆、焦思琪、杨亚柳、闫梦雯负责数据采集及统计分析;张丽芳、李佳慧、吴文静负责数据质控、数据解释及论文审阅;孙艺红负责研究设计、论文修改及定稿
| [1] | Caforio ALP, Pankuweit S, Arbustini E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases[J]. Eur Heart J, 2013, 34(33) 2636-2648, 2648a-2648d. DOI:10.1093/eurheartj/eht210 |
| [2] | Ammirati E, Veronese G, Cipriani M, et al. Acute and fulminant myocarditis: a pragmatic clinical approach to diagnosis and treatment[J]. Curr Cardiol Rep, 2018, 20(11): 114. DOI:10.1007/s11886-018-1054-z |
| [3] | Xu D, Zhao RC, Gao WH, et al. A risk prediction model for in-hospital mortality in patients with suspected myocarditis[J]. Chin Med J (Engl), 2017, 130(7): 782-790. DOI:10.4103/0366-6999.202747 |
| [4] | Yajima T, Knowlton KU. Viral myocarditis: from the perspective of the virus[J]. Circulation, 2009, 119(19): 2615-2624. DOI:10.1161/CIRCULATIONAHA.108.766022 |
| [5] | Inaba O, Satoh Y, Isobe M, et al. Factors and values at admission that predict a fulminant course of acute myocarditis: data from Tokyo CCU network database[J]. Heart Vessels, 2017, 32(8): 952-959. DOI:10.1007/s00380-017-0960-0 |
| [6] | Rroku A, Kottwitz J, Heidecker B. Update on myocarditis - what we know so far and where we may be heading[J]. Eur Heart J Acute Cardiovasc Care, 2020: 2048872620910109. DOI:10.1177/2048872620910109 |
| [7] | 赵妍, 田间, 王文尧, 等. 急性心肌炎患者院内不良事件的相关因素分析[J]. 岭南心血管病杂志, 2019, 25(3) 336-339, 351. DOI:10.3969/j.issn.1007-9688.2019.03.22 |
| [8] | Younis A, Matetzky S, Mulla W, et al. Epidemiology characteristics and outcome of patients with clinically diagnosed acute myocarditis[J]. Am J Med, 2020, 133(4): 492-499. DOI:10.1016/j.amjmed.2019.10.015 |
| [9] | 中华医学会心血管病学分会精准医学学组, 中华心血管病杂志编辑委员会, 成人暴发性心肌炎工作组. 成人暴发性心肌炎诊断与治疗中国专家共识[J]. 中华心血管病杂志, 2017, 45(9): 742-752. DOI:10.3760/cma.j.issn.0253-3758.2017.09.004 |
| [10] | Yu SR, Zhang CY, Xiong WJ, et al. An hypothesis: disproportion between cardiac troponin and B-type natriuretic peptide levels-A high risk and poor prognostic biomarker in patients with fulminant myocarditis?[J]. Heart Lung Circ, 2021, 30(6): 837-842. DOI:10.1016/j.hlc.2020.12.012 |
| [11] | Liu C, Wang ZQ, Chen KQ, et al. The absolute and relative changes in high-sensitivity cardiac troponin I are associated with the in-hospital mortality of patients with fulminant myocarditis[J]. BMC Cardiovasc Disord, 2021, 21(1): 571. DOI:10.1186/s12872-021-02386-8 |
| [12] | Leone O, Pieroni M, Rapezzi C, et al. The spectrum of myocarditis: from pathology to the clinics[J]. Virchows Arch, 2019, 475(3): 279-301. DOI:10.1007/s00428-019-02615-8 |
| [13] | Ammirati E, Veronese G, Brambatti M, et al. Fulminant versus acute nonfulminant myocarditis in patients with left ventricular systolic dysfunction[J]. J Am Coll Cardiol, 2019, 74(3): 299-311. DOI:10.1016/j.jacc.2019.04.063 |
| [14] | Berg J, Kottwitz J, Baltensperger N, et al. Cardiac magnetic resonance imaging in myocarditis reveals persistent disease activity despite normalization of cardiac enzymes and inflammatory parameters at 3-month follow-up[J]. Circ Heart Fail, 2017, 10(11): e004262. DOI:10.1161/CIRCHEARTFAILURE.117.004262 |
| [15] | Aquaro GD, Ghebru Habtemicael Y, Camastra G, et al. Prognostic value of repeating cardiac magnetic resonance in patients with acute myocarditis[J]. J Am Coll Cardiol, 2019, 74(20): 2439-2448. DOI:10.1016/j.jacc.2019.08.1061 |
| [16] | Georgiopoulos G, Figliozzi S, Sanguineti F, et al. Prognostic impact of late gadolinium enhancement by cardiovascular magnetic resonance in myocarditis: a systematic review and meta-analysis[J]. Circ Cardiovasc Imaging, 2021, 14(1): e011492. DOI:10.1161/CIRCIMAGING.120.011492 |
| [17] | Ammirati E, Camici PG. Still poor prognosis for patients with giant cell myocarditis in the era of temporary mechanical circulatory supports[J]. Int J Cardiol, 2018, 253: 122-123. DOI:10.1016/j.ijcard.2017.10.124 |
| [18] | Brambatti M, Matassini MV, Adler ED, et al. Eosinophilic myocarditis: characteristics, treatment, and outcomes[J]. J Am Coll Cardiol, 2017, 70(19): 2363-2375. DOI:10.1016/j.jacc.2017.09.023 |
| [19] | Li JL, Wang Y, Li J, et al. Prognostic value of pretreatment D-dimer level in small-cell lung cancer: a meta-analysis[J]. Technol Cancer Res Treat, 2021, 20: 1533033821989822. DOI:10.1177/1533033821989822 |
| [20] | Wong BTW, Christiansen JP. Clinical characteristics and prognostic factors of myocarditis in new Zealand patients[J]. Heart Lung Circ, 2020, 29(8): 1139-1145. DOI:10.1016/j.hlc.2020.01.007 |
| [21] | Chen S, Hoss S, Zeniou V, et al. Electrocardiographic predictors of morbidity and mortality in patients with acute myocarditis: the importance of QRS-T angle[J]. J Card Fail, 2018, 24(1): 3-8. DOI:10.1016/j.cardfail.2017.11.001 |
| [22] | Fischer K, Marggraf M, Stark AW, et al. Association of ECG parameters with late gadolinium enhancement and outcome in patients with clinical suspicion of acute or subacute myocarditis referred for CMR imaging[J]. PLoS One, 2020, 15(1): e0227134. DOI:10.1371/journal.pone.0227134 |
| [23] | Shah Z, Mohammed M, Vuddanda V, et al. National trends, gender, management, and outcomes of patients hospitalized for myocarditis[J]. Am J Cardiol, 2019, 124(1): 131-136. DOI:10.1016/j.amjcard.2019.03.036 |
| [24] | Weitz JI, Fredenburgh JC, Eikelboom JW. A test in context: D-dimer[J]. J Am Coll Cardiol, 2017, 70(19): 2411-2420. DOI:10.1016/j.jacc.2017.09.024 |
| [25] | Borowiec A, Dąbrowski R, Kowalik I, et al. Elevated levels of d-dimer are associated with inflammation and disease activity rather than risk of venous thromboembolism in patients with granulomatosis with polyangiitis in long term observation[J]. Adv Med Sci, 2020, 65(1): 97-101. DOI:10.1016/j.advms.2019.12.007 |
| [26] | Zhang W, Sang L, Shi JR, et al. Association of D-dimer elevation with inflammation and organ dysfunction in ICU patients with COVID-19 in Wuhan, China: a retrospective observational study[J]. Aging (Albany NY), 2021, 13(4): 4794-4810. DOI:10.18632/aging.202496 |
| [27] | Dufort EM, Koumans EH, Chow EJ, et al. Multisystem inflammatory syndrome in children in New York State[J]. N Engl J Med, 2020, 383(4): 347-358. DOI:10.1056/NEJMoa2021756 |
| [28] | Smilowitz NR, Kunichoff D, Garshick M, et al. C-reactive protein and clinical outcomes in patients with COVID-19[J]. Eur Heart J, 2021, 42(23): 2270-2279. DOI:10.1093/eurheartj/ehaa1103 |
| [29] | Zhou F, Yu T, du RH, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study[J]. Lancet, 2020, 395(10229): 1054-1062. DOI:10.1016/S0140-6736(20)30566-3 |
| [30] | Cummings MJ, Baldwin MR, Abrams D, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study[J]. Lancet, 2020, 395(10239): 1763-1770. DOI:10.1016/S0140-6736(20)31189-2 |
| [31] | Hang WJ, Chen C, Seubert JM, et al. Fulminant myocarditis: a comprehensive review from etiology to treatments and outcomes[J]. Signal Transduct Target Ther, 2020, 5(1): 287. DOI:10.1038/s41392-020-00360-y |
| [32] | Veronese G, Ammirati E, Chen C, et al. Management perspectives from the 2019 Wuhan international workshop on fulminant myocarditis[J]. Int J Cardiol, 2021, 324: 131-138. DOI:10.1016/j.ijcard.2020.10.063 |
| [33] | Ammirati E, Frigerio M, Adler ED, et al. Management of acute myocarditis and chronic inflammatory cardiomyopathy: an expert consensus document[J]. Circ Heart Fail, 2020, 13(11): e007405. DOI:10.1161/CIRCHEARTFAILURE.120.007405 |
 2022, Vol. 31
2022, Vol. 31




