2. 新疆医科大学第一附属医院急救创伤中心·急救重症监护室, 乌鲁木齐 830011
脓毒症是指因感染引起机体反应失调导致的危及生命的器官功能障碍,在全球以其高发病率、高病死率成为急危重症医学面临的重要临床问题[1-2]。尽管脓毒性休克的治疗取得了一些进展,但它仍然是导致ICU患者死亡的主要原因[3-5]。有相关数据显示,40%~50%的脓毒症患者存在心肌损伤[6]。脓毒症诱发的心肌功能障碍与脓毒症患者的病死率相关[7-8],与无心功能不全的脓毒症患者相比,脓毒性休克患者出现心功能障碍时病死率高达70%~90%,病死率明显升高[9-10]。
既往研究表明脓毒症心功能障碍可能与多种机制有关,包括炎症反应、线粒体功能障碍、细胞凋亡、心肌细胞收缩性与钙离子转运异常、氧化应激、补体免疫损伤等[11-16]。各项研究表明,炎症反应与脓毒症心肌损伤的发生发展密切相关[17-18]。脂多糖(lipopolysaccharide, LPS)可通过激活相关炎症细胞,引起相关促炎细胞因子的合成与释放、增强炎症反应,最终可能导致不同程度的心功能不全[19]。已有研究表明,核转录因子κB(nuclear transcription factor-κB, NF-κB)激活是炎症反应的中心事件[20]。近年来发现NF-κB相关信号通路可能参与脓毒症心功能障碍发生的多种机制,作为脓毒症治疗新的靶点而具有研究价值。
本研究建立LPS诱导的SD大鼠脓毒症模型,探讨吡咯烷二硫代氨基甲酸酯(pyrrolidine dithiocarbamate, PDTC)能否通过抑制NF-κB的活化改善LPS诱导的脓毒症大鼠炎症反应、心肌损伤并改善心功能。
1 材料与方法 1.1 实验动物本实验使用雄性SD大鼠33只(健康6~8周,体重180~200 g),购自新疆医科大学动物实验中心[动物许可证号:SYXK(新)2018-0003],适应性饲养1周。新疆医科大学动物实验中心伦理委员会批准后进行动物实验(伦理审批号:IACUC20200924-21)。
1.2 动物造模方法对SD大鼠腹腔注射浓度为1 mg/mL的LPS(15 mg/kg)诱导脓毒症心脏功能障碍模型。LPS来源于大肠杆菌(O55︰B5,Sigma,美国)。采用随机数表法将33只大鼠随机分为3组:(1)LPS组(n=15)腹腔内注射LPS;(2)PDTC+LPS组(n=12)LPS给药前1 h腹腔内注射PDTC;(3)对照组(n=6)腹腔内注射等体积生理盐水。
1.3 心脏多普勒超声注射LPS后7 h时对存活大鼠腹腔内注射浓度为1%的戊巴比妥钠(45 mg/kg),麻醉后行心脏多普勒超声检测心功能。在乳头肌短轴切面采集M型超声心动图,获取心率(heart rate, HR)、左室舒张末期容积、左室收缩末期容积、每搏输出量(stroke volume, SV)、射血分数(ejection fraction, EF)、心输出量(cardiac output, CO)和左室短轴缩短率(left ventricular fraction shortening, LVFS)。
1.4 酶联免疫吸附法(ELISA)完善心脏超声后于腹主动脉处穿刺抽取动脉血,经过离心机4℃、3 000 r/min条件下离心15 min,取上清液用于ELISA检测检测大鼠心肌损伤标记物和炎症细胞因子含量。严格按照试剂盒(江莱生物,上海)操作,测定动脉血中心肌钙蛋白I(cardiac troponin I, cTnI)、肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、白介素-6(interleukin, IL-6)的含量。
1.5 组织学检查取大鼠心脏组织经固定、脱水、石蜡包埋(徕卡,德国)、切片后制成约3 μm的石蜡切片,苏木精-伊红(HE)染色后光学显微镜下观察心脏病理学改变。
将烤片脱蜡后的组织切片用过氧化物酶阻断剂避光室温孵育,EDTA抗原修复10 min后自来水浴冷却至室温。山羊血清封闭、NF-κB p65(ab76302 1︰400,Abcam,Cambridge,英国)特异性一抗4 ℃孵育过夜。第2天用二抗孵育后DAB显色液显色及苏木精复染,在显微镜下观察,检测心肌组织中NF-κB p65表达及活化后核易位情况。NF-κB p65处于静息状态时,胞质中出现棕褐色变化为阳性表现;当NF-κB p65活化后转移至细胞核,胞核中出现棕褐色变化为阳性表现,并用光学显微镜拍摄图像,采用软件ipwin32分析图像后获得细胞核中NF-κB p65阳性表达的光密度值。
1.6 Western blotting检测将30~40 mg心尖组织中的总蛋白用SDS-聚丙烯酰胺凝胶电泳法法转移到聚偏二氟乙烯膜上。用BSA封闭液在室温下封闭膜2 h,再与甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH;1︰20 000)、NF-κB p65(1︰1 000)、磷酸化核因子κB p65(Phospho-nuclear factor kappa-B p-p65, p-NF-κB p65;1︰1 000)、TNF(1︰1 000)、IL-6(1︰500)特异性一抗在4 ℃下孵育过夜。第2天,膜与酶标二级抗体在37 ℃下孵育2 h。使用超敏化学发光检测试剂盒(MBoster,武汉)将膜浸泡10 s,然后使用Image Lab系统观察膜上的蛋白带。数据结果显示为目标蛋白和内参蛋白(GAPDH)之间的灰度值比。
1.7 统计学方法实验数据采用SPSS 25.0软件(Chicago,IL,美国)进行统计分析。正态分布的计量资料以均数±标准差(x±s)表示,两组间差异采用独立样本t检验比较分析。采用GraphPad Prism 8.0.1软件作图,以P < 0.05为差异有统计学意义。
2 结果实验雄性SD大鼠造模7 h后对照组存活6只,LPS组存活8只,LPS+PDTC组存活9只,所有检测数据均来自于存活大鼠。
2.1 炎症指标及心肌损伤标记物ELISA检测各组大鼠动脉血清中炎症细胞因子(TNF-α、IL-6)及心肌损伤标记物(cTnI)的含量。与对照组相比,LPS组大鼠血清TNF-α、IL-6和cTnI明显升高(P < 0.01),表明LPS可诱导脓毒症大鼠的炎症反应和心肌损伤。与LPS组相比,LPS+PDTC组大鼠血清TNF-α、IL-6和cTnI显著减低(P < 0.01),提示PDTC预处理可显著减轻LPS所致的炎症反应及心肌损伤。见表 1。
| 指标 | 对照组(n=6) | LPS组(n=8) | LPS+PDTC组(n=9) | 检测项目 |
| TNF-α(pg/mL) | 7.67±4.05 | 23.03±7.09a | 7.26±3.95b | ELISA |
| IL-6(pg/mL) | 3.70±2.52 | 17.95±7.16a | 5.55±4.70b | ELISA |
| cTnI(pg/mL) | 24.34±9.36 | 75.82±31.27a | 26.44±16.01b | ELISA |
| NF-κB p65平均光密度值 | 42.09±11.91 | 67.53±4.81a | 44.98±10.06b | IHC |
| p-NF-κB p65/NF-κB p65 | 0.86±0.11 | 2.55±0.08a | 1.90±0.15b | Western blotting |
| TNF-α/GAPDH | 1.95±0.12 | 2.40±0.10a | 1.76±0.22b | Western blotting |
| IL-6/GAPDH | 1.22±0.12 | 2.06±0.15a | 1.16±0.21b | Western blotting |
| 注:TNF-α为肿瘤坏死因子-α,IL-6为白介素-6,cTnI为心肌钙蛋白I,NF-κB p65为核转录因子-κB p65,p-NF-κB p65/NF-κB p65为核转录因子-κB p65磷酸化比值,GAPDH为甘油醛-3-磷酸脱氢酶;与对照组比较,aP < 0.01;与LPS组比较,bP < 0.01 | ||||
用超声心动图评价LPS给药和PDTC预处理对大鼠左心室功能的影响。与对照组相比,LPS组大鼠的HR减慢(P < 0.05),SV、EF、LVFS、CO显著降低(P < 0.01)。与LPS组相比,LPC+PDTC组SV、HR、EF、LVFS、CO均显著升高(均P < 0.05)。结果表明LPS诱导的脓毒症大鼠心脏收缩功能明显受损,发生心功能障碍;PDTC预处理可显著减轻LPS所致的收缩功能损害。见表 2、图 1。
| 分组 | HR(次/min) | SV(mL) | EF(%) | CO(mL/min) | LVFS(%) |
| 对照组(n=6) | 348.33±39.83 | 84.24±3.92 | 80.38±1.45 | 80.48±6.09 | 43.52±1.44 |
| LPS组(n=8) | 299.38±32.06a | 57.49±3.03b | 69.52±2.79b | 45.48±2.13b | 34.41±2.24b |
| LPS+PDTC组(n=9) | 364.72±31.26d | 71.69±3.93c | 82.50±1.23d | 67.56±3.59d | 45.67±1.26d |
| 注:HR为心率,SV为每搏输出量,EF为射血分数,CO为心输出量,LVFS为左室短轴缩短率;与对照组比较,aP < 0.05,bP < 0.01;与LPS组比较,cP < 0.05,dP < 0.01 | |||||
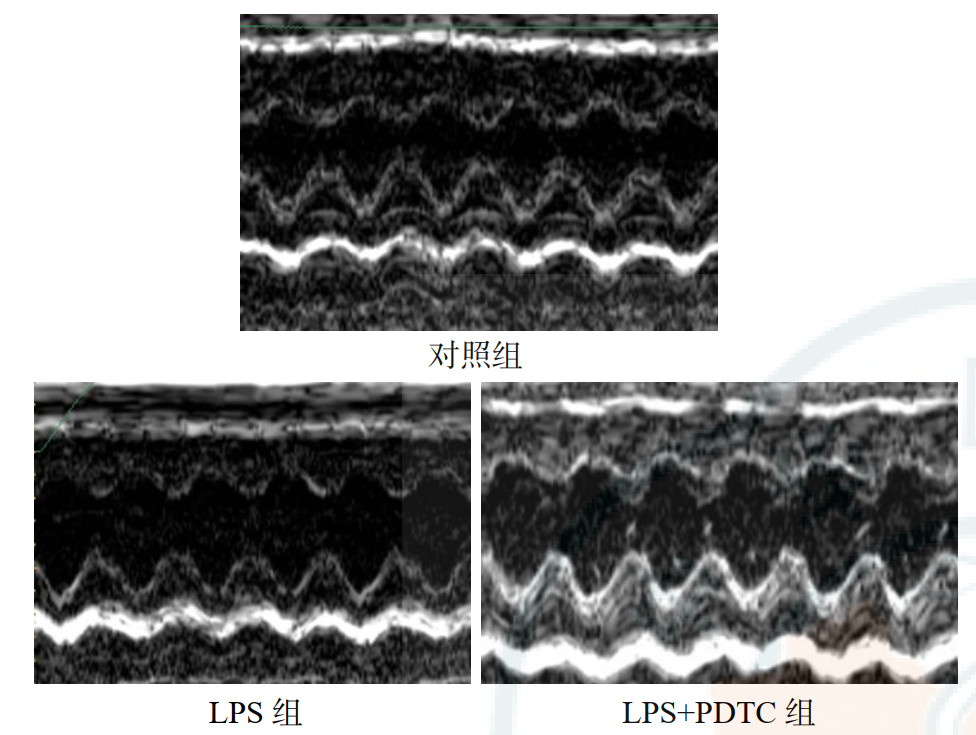
|
| 图 1 在心室短轴切面中各组大鼠的代表性M型超声心动图像 |
|
|
为评估LPS诱导的脓毒症大鼠及PDTC预处理后大鼠心肌组织病理学变化,对各组大鼠心肌组织进行HE染色。与对照组相比,LPS组可见到明显炎症细胞浸润,心肌细胞水肿,肌原纤维排列紊乱甚至心肌纤维断裂,出现核碎裂、溶解和消失等改变。与LPS组相比,LPS+PDTC组心肌炎症细胞浸润程度减轻,肌原纤维排列紊乱甚至心肌纤维断裂现象及细胞核的改变也明显改善,提示PDTC预处理明显改善了LPS所致的大鼠炎症反应和心肌细胞损伤。见图 2。
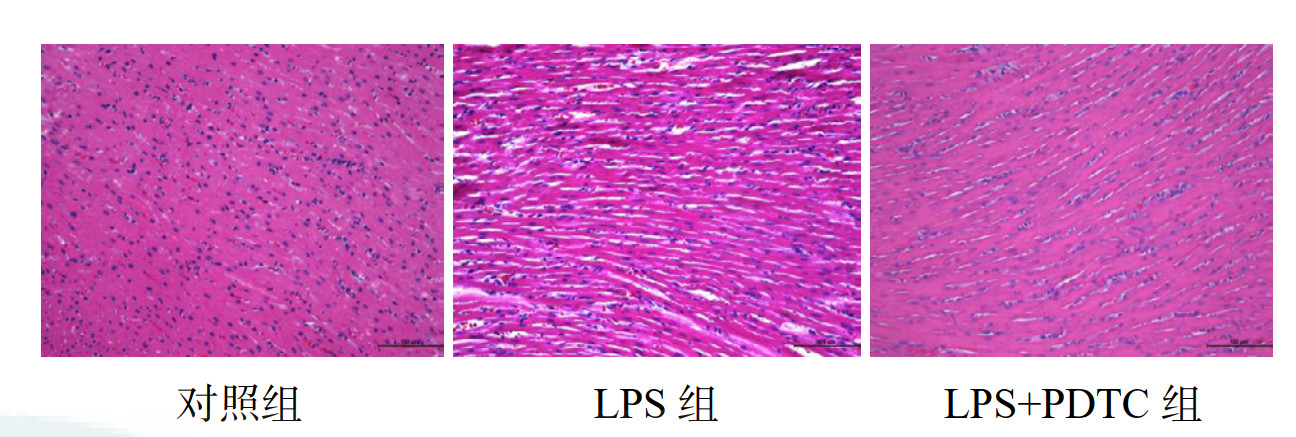
|
| 图 2 各组大鼠心肌组织病理改变(HE×200) |
|
|
为评估LPS给药及PDTC预处理后大鼠心肌组织中NF-κB p65表达及核转位情况,对各组大鼠心肌组织进行免疫组化染色(IHC)。结果显示:(1)在对照组中有一定含量的NF-κB p65于心肌细胞胞质中表达。(2)与对照组相比,LPS组NF-κB p65胞质中阳性表达明显减少,心肌细胞及巨噬细胞的胞核上阳性表达显著增加,提示NF-κB p65发生核转位,表明心肌细胞细胞质中静息状态的NF-κB p65被LPS激活后,大量活化转移至细胞核上(P < 0.01)。(3)与LPS组相比,LPS+PDTC组NF-κB p65胞核阳性表达明显减少,胞质阳性表达增加,提示PDTC预处理抑制心肌细胞胞质中NF-κB p65的活化,减少核转位现象(P < 0.01)。见表 1、图 3。
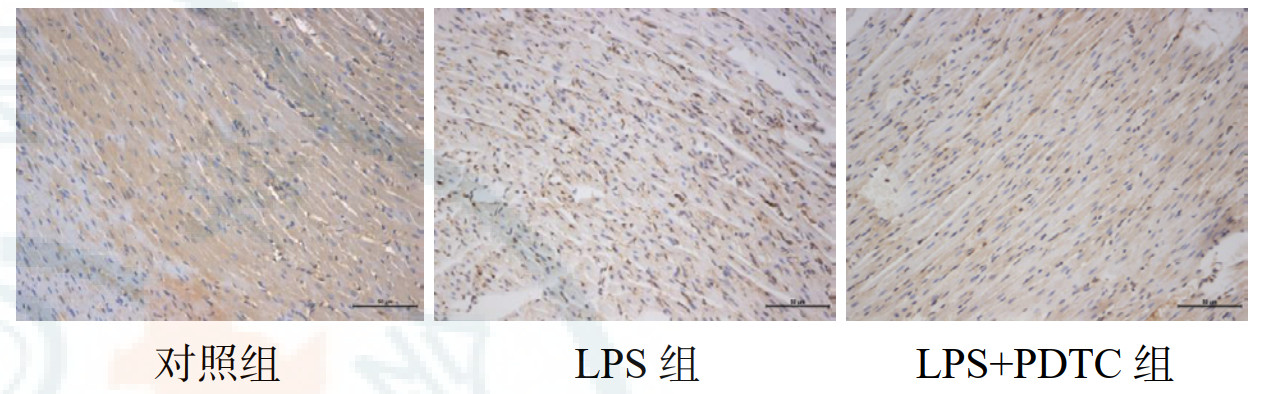
|
| 图 3 各组大鼠心肌组织NF-κB p65的比较(IHC×200) |
|
|
用蛋白质免疫印记方法检测各组大鼠心肌组织中NF-κB p65、p-NF-κB p65含量及磷酸化水平及炎症细胞因子(TNF-α、IL-6)含量。
与对照组相比,LPS组心肌组织中p-NF-κB p65显著增加,p-NF-κB p65/NF-κB p65比值增大(P < 0.01)。与LPS组相比,LPS+PDTC组心肌组织中p-NF-κB p65明显减少,p-NF-κB p65/NF-κB p65比值减小(P < 0.05)。表明LPS可增加脓毒症大鼠心肌组织中NF-κB p65磷酸化水平,促进NF-κB活化。同时PDTC预处理可减少NF-κB p65磷酸化水平,抑制脓毒症大鼠心肌组织中NF-κB的活化。见表 1,图 4。

|
| 图 4 各组大鼠心肌组织TNF-α、IL-6、p-NF-κB p65及NF-κB p65结果 |
|
|
与对照组相比,LPS组心肌组织中TNF-α、IL-6蛋白含量明显增加(均P < 0.01)。与LPS组相比,LPS+PDTC组心肌组织中TNF-α、IL-6显著减少(均P < 0.01)。表明LPS可刺激脓毒症大鼠心肌组织中炎症细胞因子(TNF-α、IL-6)含量明显增加,同时PDTC预处理可显著减低由LPS诱导的脓毒症大鼠心肌组织中TNF-α、IL-6水平,即减轻心肌组织炎症水平。见表 1,图 4。
3 讨论脓毒症心肌损伤及心功能障碍涉及多种病理生理机制,包括炎症因子激活及炎性介质的释放,而NF-κB激活是其中的中心事件。NF-κB是一种在大多数细胞类型中普遍表达的转录因子,能够调节许多细胞介质的基因表达,最常见的形式是由p50和p65两种多肽组成的二聚体,NF-κB没有被激活时,常作为结合其抑制蛋白B(IκB)的无活性复合体形式存在于细胞质中[21]。NF-κB的激活需要IκB的磷酸化,IκB磷酸化及降解后,也导致NF-κB p65亚基的磷酸化和核转位[22]。NF-κB移位到细胞核中与相应的靶序列结合,对免疫和炎症反应中相关重要基因的表达发挥转录调控作用,如TNF-α、IL-6和IL-1β等[23]。许多炎症性疾病,如类风湿性关节炎、多发性硬化症和炎症性肠病,都与NF-κB的激活有关[24],并有研究表明抑制NF-κB激活可改善脓毒性休克模型的多器官损伤并提高存活率[25]。
PDTC是一种巯基化合物,具有抗氧化和抗炎作用,已被广泛用作NF-κB抑制剂[26-28]。既往研究表明,PDTC可通过抑制NF-κB活化等机制改善双氯芬酸诱导的急性肾损伤[29];也可通过稳定IκB-α抑制NF-κB p65亚单位的核转位[30];还可通过抗氧化清除活性氧作用抑制IκB从NF-κB复合体解离[31]。因此本团队猜测,PDTC在体内抗炎机制可能包括了抗氧化和抑制NF-κB活化两种方式。本实验观察到:与LPS组相比,LPS+PDTC组心肌组织中NF-κp65的磷酸化水平及核转位减少,血浆和心肌组织中TNF-α、IL-6水平显著减低。因此本研究推测PDTC预处理可通过抑制NF-κB p65的磷酸化和核转位减轻脓毒症大鼠炎症反应。这其中有无抗氧化机制参与,则需要进一步研究。
既往研究表明NF-κB在心血管疾病中处于高度激活状态,并在心脏的炎症反应、氧化应激、细胞凋亡和自噬中也起着关键作用[32-34]。在心力衰竭模型中,PDTC给药可显著改善心肌细胞的凋亡及心功能不全[35-37]。PDTC还可通过降低I-κB的降解改善肝硬化心肌病大鼠心肌收缩力[38]。NF-κB的激活通常要经过IKKs的磷酸化激活、I-κB的磷酸化、NF-κB的磷酸化及核转位和入核后与靶基因相关序列结合等途径,而NF-κB p65亚基的磷酸化和核转位是NF-κB活化的标志[39]。因此对NF-κB的抑制主要集中在这几个环节[40]。本实验观察到:与LPS组相比,LPS+PDTC组心肌组织中NF-κB p65的磷酸化水平及核转位减少、血清中心肌损伤标记物cTnI明显减低、HE染色提示心肌损伤程度减轻、M型超声心动图提示心脏收缩功能障碍显著改善。因此本研究推测PDTC预处理可通过抑制NF-κB p65的磷酸化和核转位改善脓毒症大鼠心肌损伤,并显著改善心功能。但PDTC对NF-κB活化其他环节有无影响,则需要进一步研究。
本研究有以下几点不足:首先,临床上PDTC的预给药(脓毒症前1 h)并不容易实现,因此脓毒症后使用PDTC是否会产生与本研究相同的结果还有待观察。其次PDTC的药理及毒副作用尚不完全明确,目前PDTC只应用于动物实验,尚未应用于临床。如何适当利用PDTC抑制核NF-κB活化、又能避免其毒副作用尚需进一步研究。
综上所述,本实验发现PDTC预处理可通过抑制NF-κB活化改善LPS诱导的脓毒症大鼠炎症反应、心肌损伤并改善心功能。NF-κB可能成为脓毒症治疗中新的靶点,为降低脓毒症心肌损伤发生率及病死率提供新的方向。
利益冲突 所有作者声明无利益冲突
作者贡献声明 黎雪琴、杨凯、白雪、刘紫阳:参与实验操作、设计、文章撰写、数据采集、统计分析、图片与图表制作;许哲敏、杨梦:参与实验操作、数据采集、图片与图表制作;彭鹏:文章内容修改、审阅以及后期文章处理、获取研究经费、行政、技术或材料支持
| [1] | 曹钰, 柴艳芬, 邓颖, 等. 中国脓毒症/脓毒性休克急诊治疗指南(2018)[J]. 临床急诊杂志, 2018, 19(9): 567-588. DOI:10.13201/j.issn.1009-5918.2018.09.001 |
| [2] | Angus DC, Linde-Zwirble WT, Lidicker J, et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care[J]. Crit Care Med, 2001, 29(7): 1303-1310. DOI:10.1097/00003246-200107000-00002 |
| [3] | Kimmoun A, Ducrocq N, Levy B. Mechanisms of vascular hyporesponsiveness in septic shock[J]. Curr Vasc Pharmacol, 2013, 11(2): 139-149. DOI:10.2174/1570161111311020004 |
| [4] | Marshall JC, Cook DJ, Christou NV, et al. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome[J]. Crit Care Med, 1995, 23(10): 1638-1652. DOI:10.1097/00003246-199510000-00007 |
| [5] | Esper AM, Martin GS. Extending international sepsis epidemiology: the impact of organ dysfunction[J]. Crit Care, 2009, 13(1): 120. DOI:10.1186/cc7704 |
| [6] | Turner A, Tsamitros M, Bellomo R. Myocardial cell injury in septic shock[J]. Crit Care Med, 1999, 27(9): 1775-1780. DOI:10.1097/00003246-199909000-00012 |
| [7] | Flynn A, Chokkalingam Mani B, Mather PJ. Sepsis-induced cardiomyopathy: a review of pathophysiologic mechanisms[J]. Heart Fail Rev, 2010, 15(6): 605-611. DOI:10.1007/s10741-010-9176-4 |
| [8] | Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction[J]. Crit Care Med, 2007, 35(6): 1599-1608. DOI:10.1097/01.CCM.0000266683.64081.02 |
| [9] | 李青松, 陈俊杰, 李永宁, 等. 姜黄素抑制NLRP3炎症小体减轻早期脓毒症大鼠心肌细胞损伤的机制研究[J]. 中华急诊医学杂志, 2022, 31(2): 173-178. DOI:10.3760/cma.j.issn.1671-0282.2022.02.007 |
| [10] | Merx MW, Weber C. Sepsis and the heart[J]. Circulation, 2007, 116(7): 793-802. DOI:10.1161/CIRCULATIONAHA.106.678359 |
| [11] | Balija TM, Lowry SF. Lipopolysaccharide and sepsis-associated myocardial dysfunction[J]. Curr Opin Infect Dis, 2011, 24(3): 248-253. DOI:10.1097/QCO.0b013e32834536ce |
| [12] | Sabroe I, Dower SK, Whyte MKB. The role of toll-like receptors in the regulation of neutrophil migration, activation, and apoptosis[J]. Clin Infect Dis, 2005, 41(Supplement_7): S421-S426. DOI:10.1086/431992 |
| [13] | Ramana KV, Willis MS, White MD, et al. Endotoxin-induced cardiomyopathy and systemic inflammation in mice is prevented by aldose reductase inhibition[J]. Circulation, 2006, 114(17): 1838-1846. DOI:10.1161/CIRCULATIONAHA.106.630830 |
| [14] | Zhu XS, Bernecker OY, Manohar NS, et al. Increased leakage of sarcoplasmic reticulum Ca2+ contributes to abnormal myocyte Ca2+ handling and shortening in sepsis[J]. Crit Care Med, 2005, 33(3): 598-604. DOI:10.1097/01.ccm.0000152223.27176.a6 |
| [15] | Zheng XT, Chen WW, Gong FC, et al. The role and mechanism of pyroptosis and potential therapeutic targets in sepsis: a review[J]. Front Immunol, 2021, 12: 711939. DOI:10.3389/fimmu.2021.711939 |
| [16] | Moine P, Abraham E. Immunomodulation and sepsis: impact of the pathogen[J]. Shock, 2004, 22(4): 297-308. DOI:10.1097/01.shk.0000140663.80530.73 |
| [17] | 刘峰宇, 孙同文. 脓毒症心肌病的诊疗进展[J]. 中华急诊医学杂志, 2022, 31(7): 858-861. DOI:10.3760/cma.j.issn.1671-0282.2022.07.003 |
| [18] | 曹剑英, 张彦周, 丁显飞, 等. KLF4在LPS诱导的心肌细胞损伤中的作用研究[J]. 中华急诊医学杂志, 2021, 30(6): 704-709. DOI:10.3760/cma.j.issn.1671-0282.2021.06.012 |
| [19] | Zhao H, Zhang M, Zhou FX, et al. Cinnamaldehyde ameliorates LPS-induced cardiac dysfunction via TLR4-NOX4 pathway: the regulation of autophagy and ROS production[J]. J Mol Cell Cardiol, 2016, 101: 11-24. DOI:10.1016/j.yjmcc.2016.10.017 |
| [20] | Zingarelli B, Sheehan M, Wong HR. Nuclear factor-kappaB as a therapeutic target in critical care medicine[J]. Crit Care Med, 2003, 31(1 Suppl): S105-S111. DOI:10.1097/00003246-200301001-00015 |
| [21] | Zingarelli B. Nuclear factor-kappaB[J]. Crit Care Med, 2005, 33(12 Suppl): S414-S416. DOI:10.1097/01.ccm.0000186079.88909.94 |
| [22] | Zhang Q, Lenardo M, Baltimore D. 30 years of NF-κB: a blossoming of relevance to human pathobiology[J]. Cell, 2017, 168: 37-57. DOI:10.1016/j.cell.2016.12.012 |
| [23] | Blackwell TS, Christman JW. The role of nuclear factor-kappa B in cytokine gene regulation[J]. Am J Respir Cell Mol Biol, 1997, 17(1): 3-9. DOI:10.1165/ajrcmb.17.1.f132 |
| [24] | Li QT, Verma IM. NF-κB regulation in the immune system[J]. Nat Rev Immunol, 2002, 2(10): 725-734. DOI:10.1038/nri910 |
| [25] | Liu SF, Malik AB. NF-kappa B activation as a pathological mechanism of septic shock and inflammation[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(4): L622-L645. DOI:10.1152/ajplung.00477.2005 |
| [26] | Ferraz CR, Calixto-Campos C, Manchope MF, et al. Jararhagin-induced mechanical hyperalgesia depends on TNF-α, IL-1β and NFκB in mice[J]. Toxicon, 2015, 103: 119-128. DOI:10.1016/j.toxicon.2015.06.024 |
| [27] | Pinho-Ribeiro FA, Fattori V, Zarpelon AC, et al. Pyrrolidine dithiocarbamate inhibits superoxide anion-induced pain and inflammation in the paw skin and spinal cord by targeting NF-κB and oxidative stress[J]. Inflammopharmacology, 2016, 24(2/3): 97-107. DOI:10.1007/s10787-016-0266-3 |
| [28] | Vafa O, Wade M, Kern S, et al. C-myc can induce DNA damage, increase reactive oxygen species, and mitigate p53 function[J]. Mol Cell, 2002, 9(5): 1031-1044. DOI:10.1016/S1097-2765(02)00520-8 |
| [29] | Borghi SM, Fattori V, Ruiz-Miyazawa KW, et al. Pyrrolidine dithiocarbamate inhibits mouse acute kidney injury induced by diclofenac by targeting oxidative damage, cytokines and NF-κB activity[J]. Life Sci, 2018, 208: 221-231. DOI:10.1016/j.lfs.2018.07.038 |
| [30] | Xu M, Wang KN, Wu K, et al. Pyrrolidine dithiocarbamate inhibits nuclear factor κB and toll-like receptor 4 expression in rats with acute necrotizing pancreatitis[J]. Gut Liver, 2015, 9(3): 411-416. DOI:10.5009/gnl14050 |
| [31] | 梁英健, 李鑫, 张晓娟, 等. NF-κB在脓毒症血浆诱导的内皮细胞损伤和凋亡中的作用[J]. 中国病理生理杂志, 2013, 29(8): 1508-1511. DOI:10.3969/j.issn.1000-4718.2013.08.030 |
| [32] | Németh ZH, Deitch EA, Szabó C, et al. Pyrrolidinedithiocarbamate inhibits NF-kappaB activation and IL-8 production in intestinal epithelial cells[J]. Immunol Lett, 2003, 85(1): 41-46. DOI:10.1016/s0165-2478(02)00208-0 |
| [33] | Cuzzocrea S, Chatterjee PK, Mazzon E, et al. Pyrrolidine dithiocarbamate attenuates the development of acute and chronic inflammation[J]. Br J Pharmacol, 2002, 135(2): 496-510. DOI:10.1038/sj.bjp.0704463 |
| [34] | PhD NA, BSc NC, Bs UL, et al. Transcription factor and kinase-mediated signaling in atherosclerosis and vascular injury[J]. Curr Atheroscler Rep, 2006, 8(3): 252-260. DOI:10.1007/s11883-006-0081-1 |
| [35] | Liuzzo G, Santamaria M, Biasucci LM, et al. Persistent activation of nuclear factor kappa-B signaling pathway in patients with unstable angina and elevated levels of C-reactive protein evidence for a direct proinflammatory effect of azide and lipopolysaccharide-free C-reactive protein on human monocytes via nuclear factor kappa-B activation[J]. J Am Coll Cardiol, 2007, 49(2): 185-194. DOI:10.1016/j.jacc.2006.07.071 |
| [36] | Pierce GL, Lesniewski LA, Lawson BR, et al. Nuclear factor-κB activation contributes to vascular endothelial dysfunction via oxidative stress in overweight/obese middle-aged and older humans[J]. Circulation, 2009, 119(9): 1284-1292. DOI:10.1161/CIRCULATIONAHA.108.804294 |
| [37] | Li SM, Fang J, Chen LL. Pyrrolidine dithiocarbamate attenuates cardiocyte apoptosis and ameliorates heart failure following coronary microembolization in rats[J]. Balkan Med J, 2019, 36(4): 245-250. DOI:10.4274/balkanmedj.galenos.2019.2019.3.8 |
| [38] | Frustaci A, Chimenti C, Setoguchi M, et al. Cell death in acromegalic cardiomyopathy[J]. Circulation, 1999, 99(11): 1426-1434. DOI:10.1161/01.cir.99.11.1426 |
| [39] | 朱铁年, 刘建坤, 刘桂红, 等. 吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠心肌的保护作用[J]. 中国病理生理杂志, 2011, 27(6): 1149-1153. |
| [40] | Liu HQ, Lee SS. Nuclear factor-kappaB inhibition improves myocardial contractility in rats with cirrhotic cardiomyopathy[J]. Liver Int, 2008, 28(5): 640-648. DOI:10.1111/j.1478-3231.2008.01692.x |
 2022, Vol. 31
2022, Vol. 31




