2. 浙江省湖州市中心医院重症医学科,湖州 313000;
3. 浙江省湖州市第一人民医院重症医学科,湖州 313000;
4. 浙江大学医学院附属第二医院心内科,杭州 310009
随着移植的普及和免疫抑制剂的大量使用等,HIV阴性肺孢子菌肺炎(HIV-negative pneumocystis pneumonia,HIVn-PCP)发生率逐渐增加,且病情进展迅速,易发生严重呼吸衰竭,其病死率较HIV阳性PCP患者更高(高达35%~55%)[1-3],其中需要机械通气者病死率更是高达60%~75%[4-5]。目前关于HIV阳性PCP临床文章相对较多,但针对HIVn-PCP的研究比较少,值得临床进一步研究和探讨。由于PCP的确诊需要在痰、肺泡灌洗液或肺组织等标本中检出肺孢子菌[6],这需要六胺银染色或者特异PCR检测等技术,而诱导痰及自行咳出痰的阳性率较低,且目前能常规开展这些检测的医疗机构较少,故临床上PCP确诊存在较大难度。目前发表的研究大都是结合病史、临床特征以及影像学的疑诊PCP病例,而针对PCP尤其是HIVn-PCP确诊病例的研究甚少。为此,本研究拟分析HIVn-PCP确诊患者的临床特征和预后相关因素等,旨在提高临床医师对HIVn-PCP的认识和诊治水平。
1 资料与方法 1.1 一般资料本研究是一项回顾性研究,经浙江大学附属第二医院人体研究伦理委员会批准(伦理批号:2020-851),免除患者知情同意。通过病案检索收集2016年3月至2020年6月期间入住本院的HIVn-PCP确诊病例。根据住院期间是否病死,分为生存组(n=24例)及死亡组(n=22例)。
纳入标准为:①具有肺炎的相关临床症状如发热、咳嗽、呼吸困难等;②胸片或CT提示肺部渗出影;③微生物学确诊:痰、气道抽吸物或肺泡灌洗液PCR和(或)六胺银法检测PCP结果阳性。排除标准为:①年龄小于18周岁;② HIV抗体阳性;③妊娠;④临床资料不完整。
1.2 资料收集收集HIVn-PCP患者一般资料,包括年龄、性别、身体质量指数(body mass index, BMI)值,临床症状,既往史(恶性肿瘤、自身免疫性疾病、糖尿病,长期糖皮质激素使用、免疫抑制剂应用或放化疗史等)等。收集患者入院当日或次日血常规、超敏C反应蛋白、降钙素原、肝肾功能、血清β-1, 3-葡聚糖等实验室指标及影像学资料等。另外,收集患者住院期间并发症、抗PCP治疗方案、治疗期间是否应用激素和机械通气等指标。
1.3 统计学方法正态分布的计量资料以均数±标准差(x±s)表示,非正态分布者以中位数和四分位间距[M(Q1, Q3)]表示,符合正态分布的计量资料采用成组t检验,不符合正态分布的计量资料采用秩和检验。计数资料以比例表示,采用χ2检验。使用Logistic回归模型分析和探索HIVn-PCP患者住院期间病死率的独立危险因素,选择单因素P < 0.05的变量进行下一步多因素Logistic回归分析。采用SPSS 23.0统计软件,以P < 0.05为差异有统计学意义。
2 结果 2.1 基本情况比较本研究初步纳入50例PCP确诊病例,其中排除4例HIV阳性病例,最终有46例HIVn-PCP病例纳入研究。其中男性24例(52.00%),女性22例(48.00%),年龄(56.43±14.47)岁,总病死率为47.83%(22/46)。大部分患者都有长期应用皮质激素(25/46,54.35%)、应用免疫抑制剂(13/46,28.26%)或放化疗(16/46,34.78%)等病史。主要临床表现为呼吸困难(40/46, 86.96%),发热(39/46,84.78%),咳嗽和(或)咳痰(29/46, 63.04%),胸部影像学表现均有磨玻璃影(46/46, 100%,图 1),其次为胸腔积液(20/46, 43.48%)及肺实变(9/46, 19.57%)。
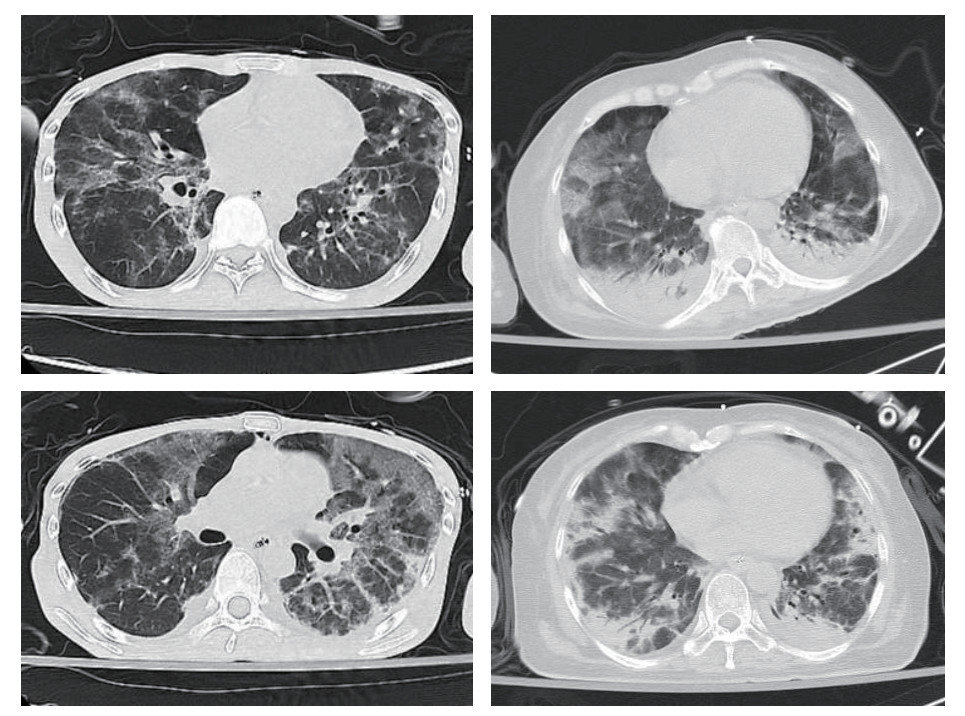
|
| 图 1 HIVn-PCP患者胸部CT:两肺多发斑片影及磨玻璃影,两下肺实变 |
|
|
与生存组相比,死亡组患者年龄及BMI值均较高,差异均具有统计学意义(P < 0.05)。两组患者在基础疾病、临床表现及影像学表现上均无统计学意义(P > 0.05),见表 1。
| 指标 | 生存组(n=24) | 死亡组(n=22) | 统计值(F/χ2/Z) | P值 |
| 年龄(岁, x±s) | 50.88±16.33 | 62.50±9.62 | -2.970 | 0.005 |
| 性别(n, %) | 0.095 | 0.758 | ||
| 男性 | 12(50.00) | 12(54.55) | ||
| 女性 | 12(50.00) | 10(45.45) | ||
| BMI(kg/m2,x±s) | 20.99±3.74 | 23.36±3.71 | -2.153 | 0.037 |
| 基础疾病(n, %) | ||||
| 糖尿病 | 7(29.17) | 3(13.64) | 0.842 | 0.359 |
| 恶性肿瘤 | 10(41.67) | 8(36.36) | 0.136 | 0.713 |
| 自身免疫性疾病 | 10(41.67) | 12(54.55) | 0.763 | 0.382 |
| 近期内激素治疗史 | 13(54.17) | 12(54.55) | 0.001 | 0.979 |
| 免疫抑制剂治疗史 | 5(20.83) | 8(36.36) | 1.366 | 0.243 |
| 化疗和(或)放疗 | 10(41.67) | 6(27.27) | 1.048 | 0.306 |
| 症状(n, %) | ||||
| 发热 | 20(83.33) | 19(86.36) | < 0.001 | > 0.999 |
| 咳嗽和(或)咳痰 | 17(70.83) | 12(54.55) | 1.307 | 0.253 |
| 呼吸困难 | 19(79.17) | 21(95.45) | 1.441 | 0.230 |
| 肺部影像表现(n, %) | ||||
| 磨玻璃影 | 24(100) | 22(100) | - | - |
| 实变 | 6(25) | 3(13.64) | 0.280 | 0.596 |
| 胸腔积液 | 10(41.67) | 10(45.45) | 0.067 | 0.796 |
死亡组血白细胞、中性粒细胞、超敏C反应蛋白、乳酸脱氢酶等实验室指标均高于生存组,差异均具有统计学意义(P < 0.05),而血清白蛋白显著低于生存组(P < 0.05),而其他指标在两组中差异无统计学意义(P > 0.05),见表 2。
| 指标 | 生存组(n=24) | 死亡组(n=22) | 统计值(F) | P值 |
| 血白细胞(×109/L) | 6.56±3.28 | 8.93±4.34 | -2.103 | 0.041 |
| 血中性粒细胞(×109/L) | 5.39±2.99 | 7.85±4.14 | -2.323 | 0.025 |
| 血淋巴细胞(×109/L) | 0.58±0.41 | 0.72±0.73 | -0.766 | 0.448 |
| 血红蛋白(g/L) | 105.96±16.35 | 109.68±25.97 | -0.576 | 0.568 |
| 血小板(×109/L) | 167.04±67.43 | 149.64±82.95 | 0.784 | 0.437 |
| 超敏C反应蛋白(mg/L) | 58.21±49.35 | 109.56±92.76 | -2.227 | 0.034 |
| 降钙素原(ng/mL) | 0.17±0.14 | 1.99±4.03 | -1.961 | 0.065 |
| 乳酸脱氢酶(U/L) | 421.42±210.65 | 566.36±215.30 | -2.307 | 0.026 |
| 谷丙转氨酶(U/L) | 34.96±30.02 | 42.59±42.25 | -0.711 | 0.481 |
| 谷草转氨酶(U/L) | 33.42±24.15 | 73.41±113.70 | -1.684 | 0.099 |
| 血清白蛋白(g/L) | 30.31±5.14 | 25.34±5.43 | 3.192 | 0.003 |
| 血肌酐(μmol/L) | 65.00±48.01 | 57.50±27.83 | 0.640 | 0.525 |
| 血清β-1, 3-葡聚糖(pg/mL) | 306.65±342.64 | 260.82±217.77 | 0.446 | 0.659 |
| CD4+计数(×109/L) | 0.18±0.182 | 0.18±0.196 | 0.052 | 0.959 |
| 氧分压(mmHg) | 92.88±59.69 | 88.31±19.56 | 0.325 | 0.747 |
| 乳酸(mmol/L) | 2.16±0.88 | 1.78±0.61 | 1.580 | 0.123 |
| 注:1 mmHg=0.133 kpa | ||||
与生存组相比,死亡组出现感染性休克、并发血流感染的比率以及出现呼吸衰竭、需要气管插管机械通气均明显增高,另外死亡组在治疗期间应用糖皮质激素(甲泼尼龙≥80 mg/d)的比率也更高,差异有统计学意义(P < 0.05)。住院期间两组患者治疗方案选择的差异无统计学意义(P > 0.05),但生存组接受抗PCP治疗的时间及总住院时间均要长于死亡组(P < 0.05),见表 3。
| 指标 | 生存组(n=24) | 死亡组(n=22) | 统计值(F/χ2/Z) | P值 |
| 呼衰(PaO2 < 60 mmHg) | 17(70.83) | 22(100.00) | 5.477 | 0.019 |
| 气管插管机械通气 | 6(25.00) | 22(100.00) | 27.107 | < 0.001 |
| 甲泼尼龙≥80 mg/d | 14(58.33) | 21(95.45) | 8.693 | 0.003 |
| 抗PCP治疗时间(d) | 20.54±10.15 | 10.77±9.31 | 3.392 | 0.001 |
| SMZco+卡泊芬净联合治疗 | 16(66.67) | 20(90.91) | 2.668 | 0.102 |
| 并发症 | ||||
| 感染性休克 | 1(4.17) | 14(63.63) | 18.473 | < 0.001 |
| 气胸,纵隔气肿或皮下气肿 | 1(4.17) | 4(18.18) | 1.105 | 0.293 |
| 合并感染 | 12(50) | 17(77.27) | 3.6644 | 0.056 |
| 合并细菌感染 | 8(33.33) | 13(59.10) | 3.069 | 0.080 |
| 合并其他真菌感染 | 3(12.50) | 3(13.63) | < 0.001 | > 0.999 |
| 合并血流感染 | 0(0.00) | 5(22.73) | 3.999 | 0.046 |
| 合并巨细胞病毒和(或)EB病毒 | 2(8.33) | 8(36.36) | 3.781 | 0.052 |
| 总住院时间(d) | 26.08±13.52 | 17.09±13.42 | 2.262 | 0.029 |
| 注:PaO2为动脉血氧分压;PCP为肺孢子肺菌炎;ICU为重症医学科;1 mmHg=0.133 kPa | ||||
单因素Logistic回归分析结果显示,年龄,BMI,白细胞,中性粒细胞,乳酸脱氢酶(lactic dehydrogenase, LDH),血清白蛋白,超敏C反应蛋白,甲泼尼龙≥80 mg/d及气管插管机械通气等指标是影响HIVn-PCP患者住院期间病死率的危险因素。将上述因素纳入多因素Logistic回归分析后,并未发现影响HIVn-PCP患者住院期间死亡的独立危险因素,见表 4。
| 变量 | 单因素回归 | 多因素回归 | ||
| OR值(95%CI) | P值 | OR值(95%CI) | P值 | |
| 年龄 | 1.071(1.014~1.130) | 0.013 | 1.211(0.973~1.508) | 0.087 |
| BMI | 1.197(1.003~1.428) | 0.046 | 1.173(0.551~2.495) | 0.679 |
| 白细胞 | 1.181(1.001~1.393) | 0.049 | 1.139(0.057~22.841) | 0.932 |
| 中性粒细胞 | 1.219(1.015~1.465) | 0.034 | 1.072(0.039~29.394) | 0.967 |
| 乳酸脱氢酶 | 1.003(1.000~1.006) | 0.034 | 0.999(0.991~1.006) | 0.714 |
| 血清白蛋白 | 0.837(0.737~0.951) | 0.006 | 0.792(0.522~1.200) | 0.271 |
| 超敏C反应蛋白 | 1.010(1.001~1.020) | 0.038 | 1.012(0.977~1.048) | 0.497 |
| 甲泼尼龙≥80 mg/d | 15.000(1.723~130.589) | 0.014 | 21.942(0.000~1209912) | 0.579 |
| 气管插管机械通气 | 7.615(1.421~40.803) | 0.018 | 5761212790(0.000~) | 0.998 |
| 注:OR为比值比;95%CI为95%可信区间 | ||||
本文通过对46例HIVn-PCP患者的临床资料进行分析,研究结果发现,这类患者合并自身免疫性疾病占47.8%,恶性肿瘤占39.1%,其住院期间病死率高达47.83%。这些患者的临床表现以呼吸困难(86.96%)、发热(84.78%)和咳嗽(63.04%)等为主要表现,胸部影像学表现均有磨玻璃影,与既往PCP相关研究结果相似[7-8]。除此之外,死亡组平均年龄及BMI均高于生存组,年龄越大, 免疫功能减退更明显, 更易发生感染且更严重,最终预后相对更差。在一个关于免疫功能低下的成人PCP研究中亦有发现,年龄、BMI等指标与这些患者住院病死相关[9]。
在实验室指标中,死亡组患者的血白细胞、中性粒细胞及超敏C反应蛋白水平更高,而血清白蛋白水平更低。研究发现,超敏C反应蛋白是反映炎症程度的一个独立指标,且与感染严重程度相关[10-11]。另外,有研究发现高超敏C反应蛋白和高中性粒细胞与PCP患者住院病死率相关[12]。血清白蛋白是一个反映营养状况的指标,同时它也可反应炎症及疾病的严重程度。在有严重感染时,更低的白蛋白水平往往提示预后不良[13]。另外,虽然LDH是一个非特异性指标,但它是预测AIDS合并PCP患者近期预后的独立危险因素之一[14],可反映这类患者肺部炎症和损伤程度。在一项肾移植合并PCP的研究中亦发现LDH与此类患者不良预后相关[12]。在本研究中,死亡组LDH指标显著高于生存组,表明该指标与HIVn-PCP患者住院病死可能相关。
在治疗因素方面,本研究发现糖皮质激素(甲泼尼龙≥80 mg/d)、更短的抗PCP治疗时间及机械通气与HIVn-PCP患者住院期间不良预后相关。死亡组患者发生急性呼吸衰竭及气管插管机械通气均高于生存组,而死亡组的抗PCP治疗时间及总住院时间较生存组更短。尽管有研究发现在出现低氧性呼吸衰竭的HIV阴性PCP患者中,抗PCP治疗的时间与治疗结果之间没有关联[15],但在本研究显示,死亡组的抗PCP治疗时间及住院时间更短,可能与死亡组合并有更严重的感染,病情进展更快等因素相关。临床上在PCP的治疗中会使用糖皮质激素,有回顾性研究显示辅助使用糖皮质激素可能不会改善HIVn-PcP患者的预后[16-17]。另外有研究显示使用糖皮质激素可能并不能改善患者的预后,甚至导致HIVn-PCP患者病死增加[18]。本研究结果与后者的研究结果类似,糖皮质激素可能与HIVn-PCP患者住院病死率增加相关。
综上所述,本研究发现年龄,BMI,白细胞,中性粒细胞,LDH,血清白蛋白,超敏C反应蛋白,甲泼尼龙≥80 mg/d及气管插管机械通气等指标是影响HIVn-PCP患者住院期间病死率的危险因素。但多元回归分析并未发现这类患者住院死亡的独立危险因素,这可能与样本量较少相关,其次本研究为临床回顾性分析,部分病历资料不完整,进行多元回归分析时导致结果有所偏差,统计效力不足。这有待于未来进一步开展前瞻性多中心大样本研究。
利益冲突 所有作者声明无利益冲突
作者贡献说明 沈其锴、刘凤琪:数据收集及整理、统计学分析、论文撰写;姬晓伟、谢波、崔巍:课题指导以及数据分析;张淑芳、张根生:课题指导、研究设计以及论文修改
| [1] | Kim SJ, Lee J, Cho YJ, et al. Prognostic factors of Pneumocystis jirovecii pneumonia in patients without HIV infection[J]. J Infect, 2014, 69(1): 88-95. DOI:10.1016/j.jinf.2014.02.015 |
| [2] | Morris A, Norris KA. Colonization by Pneumocystis jirovecii and its role in disease[J]. Clin Microbiol Rev, 2012, 25(2): 297-317. DOI:10.1128/CMR.00013-12 |
| [3] | Fillatre P, Decaux O, Jouneau S, et al. Incidence of Pneumocystis jiroveci pneumonia among groups at risk in HIV-negative patients[J]. Am J Med, 2014, 127(12): 1242. DOI:10.1016/j.amjmed.2014.07.010 |
| [4] | Azoulay É, Thiéry G, Chevret S, et al. The prognosis of acute respiratory failure in critically ill cancer patients[J]. Medicine (Baltimore), 2004, 83(6): 360-370. DOI:10.1097/01.md.0000145370.63676.fb |
| [5] | Zhang GS, Chen MM, Zhang SF, et al. Efficacy of caspofungin combined with trimethoprim/sulfamethoxazole as first-line therapy to treat non-HIV patients with severe Pneumocystis pneumonia[J]. Exp Ther Med, 2018, 15(2): 1594-1601. DOI:10.3892/etm.2017.5516 |
| [6] | 王瑜琼, 黄琳娜, 詹庆元. 肺孢子菌肺炎诊断方法的研究进展[J]. 中华结核和呼吸杂志, 2020, 43(10): 878-880. |
| [7] | 黄絮, 翁利, 易丽, 等. 结缔组织病患者肺孢子菌肺炎合并急性呼吸衰竭的临床特点及预后分析[J]. 中华结核和呼吸杂志, 2018, 41(3): 196-200. |
| [8] | 沈再红, 李肃, 杨隽, 等. 造血干细胞移植后肺孢子菌肺炎23例临床研究[J]. 中华急诊医学杂志, 2021, 30(10): 1248-1253. DOI:10.3760/cma.j.issn.1671-0282.2021.10.016 |
| [9] | Schmidt JJ, Lueck C, Ziesing S, et al. Clinical course, treatment and outcome of Pneumocystis pneumonia in immunocompromised adults: a retrospective analysis over 17 years[J]. Crit Care, 2018, 22(1): 307. DOI:10.1186/s13054-018-2221-8 |
| [10] | 陈淼, 林晓军, 张红璇, 等. 降钙素原和C反应蛋白在肺炎合并脓毒血症中的意义[J]. 中华急诊医学杂志, 2017, 26(7): 807-810. DOI:10.3760/cma.j.issn.1671-0282.2017.07.017 |
| [11] | Chalmers JD, Singanayagam A, Hill AT. C-reactive protein is an independent predictor of severity in community-acquired pneumonia[J]. Am J Med, 2008, 121(3): 219-225. DOI:10.1016/j.amjmed.2007.10.033 |
| [12] | Freiwald T, Büttner S, Cheru NT, et al. CD4+ T cell lymphopenia predicts mortality from Pneumocystis pneumonia in kidney transplant patients[J]. Clin Transplant, 2020, 34(9): e13877. DOI:10.1111/ctr.13877 |
| [13] | 邓医宇, 申凤彩, 林琼瑜, 等. 重症监护病房内血流感染危险因素及预后分析[J]. 中华急诊医学杂志, 2015, 24(12): 1425-1429. DOI:10.3760/cma.j.issn.1671-0282.2015.12.022 |
| [14] | 李爱新, 黄春洋, 张宏伟, 等. 艾滋病合并肺孢子菌肺炎患者近期预后危险因素分析[J]. 中华医学杂志, 2017, 97(11): 833-837. DOI:10.3760/cma.j.issn.0376-2491.2017.11.008 |
| [15] | Ko RE, Na SJ, Huh K, et al. Association of time-to-treatment with outcomes of Pneumocystis pneumonia with respiratory failure in HIV-negative patients[J]. Respir Res, 2019, 20(1): 213. DOI:10.1186/s12931-019-1188-6 |
| [16] | Moon SM, Kim T, Sung H, et al. Outcomes of moderate-to-severe Pneumocystis pneumonia treated with adjunctive steroid in non-HIV-infected patients[J]. Antimicrob Agents Chemother, 2011, 55(10): 4613-4618. DOI:10.1128/AAC.00669-11 |
| [17] | Fujikura Y, Manabe T, Kawana A, et al. Adjunctive corticosteroids for Pneumocystis jirovecii pneumonia in non-HIV-infected patients: a systematic review and Meta-analysis of observational studies[J]. Arch Bronconeumol, 2017, 53(2): 55-61. DOI:10.1016/j.arbres.2016.06.016 |
| [18] | Lemiale V, Debrumetz A, Delannoy A, et al. Adjunctive steroid in HIV-negative patients with severe Pneumocystis pneumonia[J]. Respir Res, 2013, 14(1): 87. DOI:10.1186/1465-9921-14-87 |
 2022, Vol. 31
2022, Vol. 31




