2. 温州市急危重病与救援医学重点实验室,温州 325000;
3. 中国科学院宁波华美医院急诊科,宁波 315000
2. Wenzhou Key Laboratory of Emergency and Disaster Medicine, Wenzhou 325000, China;
3. Emergency Department, Hwa Mei Hospital, University of Chinese Academy of Sciences, Ningbo 315000, China
脓毒性休克(septic shock)是指脓毒症合并高乳酸血症或液体复苏后难以恢复的低血压,且其中潜在循环、细胞及代谢异常显著的增加死亡风险[1],是最常见的循环衰竭类型之一[2],有许多研究表明,微循环灌注改变的严重程度与脓毒性休克患者的预后相关[3-5]。液体复苏可以改善微血管灌注,但效果差异很大[6]。临床上关于液体复苏是否充分最常用的判断指标是尿量和血压正常与否[7],但这已被人证明即上述两项指标正常也存在使液体超负荷及病死率增加的风险[8]。故而,寻找脓毒性休克患者液体复苏治疗的临床快速评估指标具有重要的临床意义。临床研究表明,红细胞比容可作为胰腺炎患者液体治疗的目标及指南的一项实验室标志物[9]。然而目前临床上关于红细胞比容在脓毒性休克中的研究较少,本研究旨在通过对脓毒性休克患者前3天红细胞比容的动态检测来评估其与脓毒性休克患者前3 d液体净入量及预后的关系,为临床脓毒性休克患者的液体复苏及预后评估提供依据。
1 资料与方法 1.1 一般资料回顾性分析2018年1月1日至2020年12月31日温州医科大学附属第一医院急诊重症监护室(emergency intensive care unit,EICU)住院治疗的308例确诊为脓毒性休克患者的临床资料。入选标准:入组的脓毒症休克患者均符合以下sepsis3.0版诊断流程:①可疑感染患者;②脓毒症相关的快速序贯器官衰竭评分≥2;③充足液体复苏下:需血管活性药物维持平均动脉压(mean arterial pressure, MAP)≥65 mmHg(1 mmHg=0.133 kPa)且血乳酸>2 mmol/L;排除标准:①入院后3 d内死亡患者或未规范治疗自动离院患者;②EICU住院时间超过30 d;③因其他原因导致数据不完整、丢失患者。本研究已得知患者知情同意,并通过医院伦理委员会审批[伦理审批编号:2022第(R076)号]。
1.2 研究方法 1.2.1 资料收集① 一般项目:收集患者住院号、性别、年龄、EICU住院天数、出院情况等;②既往史:高血压史、糖尿病史、肿瘤病史、肝肾功能不全史、肺结核病史、心脏病史、血液疾病史、神经系统病史、精神系统病史、免疫疾病史;③入院后情况:首发感染部位、体温、心率、呼吸、吸入气中的氧体积分数分数(fraction of inspiration O2, FiO2)、每日出入量等;④实验室指标:入院后第1个24 h血化验项目最差值(白细胞计数(white blood cell, WBC)、血红蛋白(hemoglobin, Hb)、血小板(platelet, PLT)、红细胞分布宽度(red cell volume distribution width, RDW)、血液酸碱度(pH)、血清肌酐(serum creatinine, Scr)等,入院后每天红细胞比容(hematocrit,HCT)平均值,入院3 d后白蛋白(albumin,ALB)最低值。⑤计算评分:根据相关公式及评分表计算急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)及序贯器官衰竭评分(sequential organ failure assessment, SOFA),MAP。
1.2.2 分组以入院后28 d患者存活或死亡作为临床研究终点,分为存活组及死亡组。
1.3 统计学方法使用SPSS Statistics 20.0统计软件及易侕软件进行统计分析。对计量资料进行正态性检验,符合正态分布的采用均数±标准差(x±s)来表示,非正态分布的资料以中位数及四分位数间距(M,Q1, Q3)表示,采用两独立样本非参数检验(Mann-Whitney U test)分析。对计数资料用百分率来表示,采用χ2检验分析。采用倾向性评分匹配法消除混杂因素。采用单因素及多因素COX回归分析影响预后的各类观测指标。用易侕软件对多因素COX回归分析筛选出来的独立危险因素绘出KM(Kaplan-Meier)生存曲线及平滑拟合曲线。在非参数检验、χ2检验及单因素COX回归分析、多因素COX回归,以P<0.05为差异有统计学意义。
2 结果 2.1 入选患者的基本情况本研究共收集入住EICU的脓毒性休克患者有308例,住院期间死亡的患者共67(21.75%)例,年龄(66.04±13.37)岁;其中男性45(67.16%)例,女性22(32.84%)例,男女比例2.05∶1。存活的患者共241(78.25%)例,年龄(60.92±14.59)岁;男性127(52.7%)例,女性114(47.3%)例,男女比例1.11:1。在308例患者中既往患有高血压疾病149例,糖尿病92例,神经系统疾病35例,冠心病20例,慢性肝病33例,慢性肾病26例,实体肿瘤43例,其他疾病74例。另外308例患者中包括颅内感染4例,腹腔感染12例,肠道感染67例,胰腺炎2例,肺部感染38例,泌尿道感染74例,肝脓肿16例,胆道感染17例,肢体感染35例,皮肤感染7例,导管相关性感染3例,其他感染55例。
2.2 一般情况及实验室检查两组之中SOFA评分、APACHEⅡ评分、每日出入量平均值、HCT平均值、RDW、WBC、Scr、pH、ALB、FIO2、心率差异有统计学意义(P<0.05);其中死亡组中SOFA评分、APACHEⅡ评分、每日出入量平均值、RDW、Scr、心率、FiO2均高于存活组,差异有统计学意义(P<0.05);死亡组中HCT平均值、WBC、pH、ALB均低于存活组,差异有统计学意义(P<0.05), 见表 1。
| 指标 | 总体(n=308) | 死亡组(n=67) | 存活组(n=241) | Z值 | P值 |
| SOFA | 9(7,12) | 11(9,13) | 9(7,11) | -3.986 | < 0.001 |
| APACHⅡ | 13(10,18) | 19(14,23) | 13(10,16) | -6.392 | < 0.001 |
| HCT平均值(%) | 29.255(25.028,32.894) | 26.450(22.493,29.900) | 29.684(25.925,33.355) | -4.110 | < 0.001 |
| 每日出入量平均值 | 96.497(-312.739,486.019) | 484.875(48.333,989.667) | 0.525(-426.104,379.038) | -6.271 | < 0.001 |
| ΔHCTd3-d1(%) | -2.225(-4.288,-0.163) | -2.200(-4.500,0.900) | -2.250(-4.275,-0.300) | -0.584 | 0.559 |
| ΔHCTd2-d1(%) | -1.150(-2.700,0.538) | -1.100(-2.850,1.100) | -1.150(-2.600,0.500) | -0.175 | 0.861 |
| RDW(%) | 14.200(13.400,15.600) | 14.900(13.600,16.700) | 14.000(13.400,15.400) | -2.919 | 0.004 |
| PLT(×109/L) | 95.000(44.750,147.750) | 90.000(25.000,163.000) | 97.000(56.000,143.500) | -1.064 | 0.287 |
| WBC(×109/L) | 13.705(8.253,23.030) | 10.800(5.070,17.970) | 14.410(9.265,23.975) | -3.313 | < 0.001 |
| Scr(μmol/L) | 152.000(96.000,239.000) | 188.000(125.000,254.000) | 143.000(86.500,235.500) | -2.114 | 0.035 |
| pH | 7.360(7.304, 7.410) | 7.320(7.259, 7.386) | 7.371(7.312, 7.416) | -3.275 | 0.001 |
| ALB(g/L) | 27.500(24.525, 30.200) | 25.900(23.025, 28.750) | 28.100(24.850, 30.600) | -3.726 | 0.001 |
| MAP(mmHg) | 77.000(68.400,90.300) | 77.300(67.700,92.000) | 77.000(68.700,90.150) | -0.051 | 0.959 |
| FiO2 | 0.330(0.330,0.410) | 0.400(0.330, 0.500) | 0.330(0.300, 0.400) | -4.152 | < 0.001 |
| 血清钾(mmol/L) | 3.600(3.240,4.120) | 3.690(3.300,4.260) | 3.580(3.225,4.060) | -1.078 | 0.281 |
| 心率(次/min) | 106.000(93.250,120.000) | 115.000(99.000, 127.000) | 104.000(92.000, 118.000) | -3.274 | 0.001 |
| 呼吸(次/min) | 25.000(20.000,30.000) | 25.000(18.000, 31.000) | 25.000(20.000, 30.000) | -0.398 | 0.690 |
| 体温(℃) | 37.600(37.000,38.300) | 37.500(36.900, 38.300) | 37.600(37.000, 38.400) | -0.251 | 0.802 |
| 注:Scr为血清肌酐,MAP为平均动脉压,FiO2为吸入气中的氧体积分数分数,WBC为白细胞,PLT为血小板,RDW为红细胞体积分布宽度,HCT为红细胞比容,APACHE Ⅱ为急性生理与慢性健康评分Ⅱ,SOFA为序贯器官衰竭的检测评分,pH为血液酸碱度,ALB为白蛋白,ΔHCTd3-d1为第3天与第1天的红细胞比容差值,ΔHCTd2-d1为第2天与第1天的红细胞比容差值1 mmHg=0.133 kpa | |||||
通过对SOFA评分、APACHE Ⅱ评分、每日出入量平均值、HCT平均值、ΔHCTd3-d1、RDW、PLT、WBC、Scr、K、MAP、FIO2、心率、呼吸、体温、年龄及性别进行单因素COX回归分析,可以得出APACHEⅡ、RDW、Age、ΔHCTd2-d1、ΔHCTd3-d1、WBC在脓毒性休克患者死亡组与存活组之间的差异有统计学意义(P<0.05),见表 2。
| 指标 | HR | 95%CI下限 | 95%CI上限 | P值 |
| APACHEⅡ | 1.06 | 1.03 | 1.1 | 0.0006 |
| SOFA | 1.08 | 0.99 | 1.16 | 0.0687 |
| RDW | 1.12 | 1.04 | 1.21 | 0.0043 |
| HCT平均值 | 0.96 | 0.91 | 1.00 | 0.0723 |
| Age | 1.02 | 1.00 | 1.04 | 0.0184 |
| ΔHCTd3-d1 | 1.08 | 1.01 | 1.15 | 0.0204 |
| ΔHCTd2-d1 | 1.12 | 1.02 | 1.22 | 0.0136 |
| 每日出入量平均值 | 1.00 | 1.00 | 1.00 | < 0.0001 |
| 性别 | 0.74 | 0.44 | 1.24 | 0.2602 |
| PLT | 1.00 | 1.00 | 1.00 | 0.8818 |
| WBC | 0.97 | 0.95 | 1.00 | 0.0444 |
| Scr | 1.00 | 1.00 | 1.00 | 0.5523 |
| ALB | 0.97 | 0.92 | 1.02 | 0.1878 |
| pH | 1.00 | 1.00 | 1.00 | 0.3054 |
| MAP | 1.00 | 0.99 | 1.02 | 0.7108 |
| FiO2 | 0.96 | 0.68 | 1.36 | 0.8325 |
| 血清钾 | 0.99 | 0.91 | 1.07 | 0.7180 |
| 心率 | 1.01 | 1.00 | 1.02 | 0.2431 |
| 呼吸 | 0.97 | 0.94 | 1.00 | 0.0907 |
| 体温 | 0.90 | 0.71 | 1.14 | 0.3769 |
通过对ΔHCTd2-d1进行基线调整后,可以得出在仅调整APACHEⅡ及SOFA评分,以及完全调整APACHEII评分、SOFA评分、年龄、性别、既往病史、Scr、WBC、RDW、ALB、前2 d有无输血、PLT、pH、K、FIO2、MAP、心率、呼吸、体温及前两天的补液总量,ΔHCTd2-d1差异均有统计学意义(P<0.05),是脓毒性休克患者死亡的影响因素(表 3)。
| COX模型 | HR | 95%CI下限 | 95%CI上限 | P值 |
| 模型Ⅰa | 1.12 | 1.03 | 1.22 | 0.0075 |
| 模型Ⅱb | 1.14 | 1.03 | 1.27 | 0.0155 |
| 注:a模型Ⅰ(微调整模型):调整APACHEⅡ及SOFA评分;b模型II(完全调整模型):调整APACHEII评分、SOFA评分、年龄、性别、既往病史、Scr、WBC、RDW、ALB、前2 d有无输血、PLT、pH、K、FIO2、MAP、心率、呼吸、体温及前2 d的补液总量 | ||||
将ΔHCTd2-d1按三位法分为高(≥-0.05%)、中(-2%~-0.1%)、低(≤-2.05%)三组,虽然可以得出低ΔHCTd2-d1组、中ΔHCTd2-d1组其生存率要高于高ΔHCTd2-d1组,但差异无统计学意义(P>0.05)(图 1)。
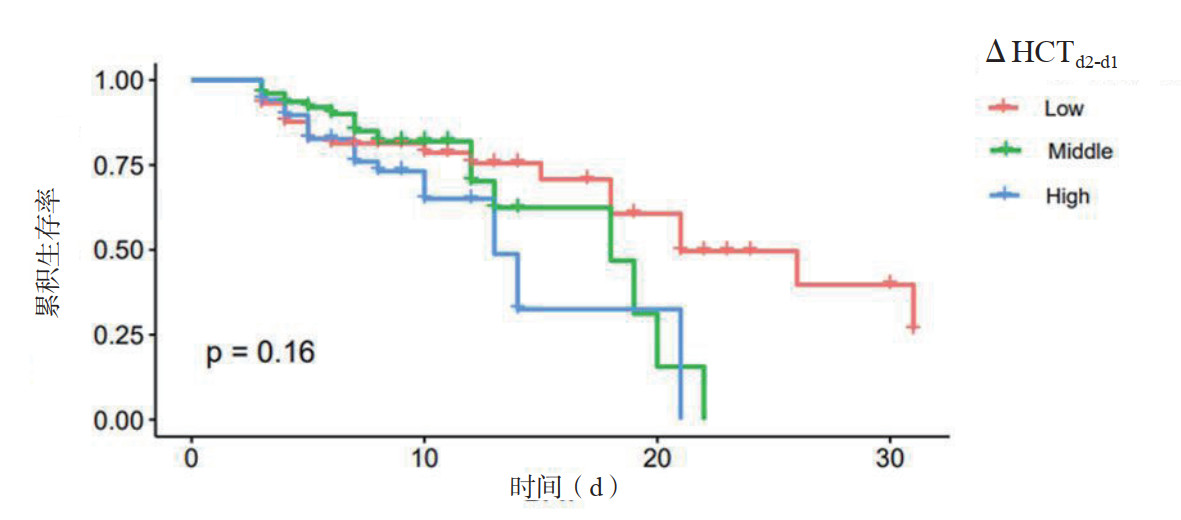
|
| 图 1 ΔHCTd2-d1KM生存曲线 Fig 1 Kaplan-Meier survival curve of ΔHCTd2-d1 |
|
|
通过对ΔHCTd3-d1进行基线调整后,可以得出在仅调整APACHEⅡ及SOFA评分,以及完全调整APACHEⅡ评分、SOFA评分、年龄、性别、既往病史、Scr、WBC、RDW、ALB、前3 d有无输血、PLT、pH、K、FIO2、MAP、心率、呼吸、体温及前3 d的补液总量,ΔHCTd3-d1差异均有统计学意义(P<0.05),是脓毒性休克患者死亡的影响因素(表 4)。
| COX模型 | HR | 95%CI下限 | 95%CI上限 | P值 |
| a模型Ⅰ | 1.09 | 1.03 | 1.16 | 0.0042 |
| b模型Ⅱ | 1.14 | 1.05 | 1.24 | 0.0029 |
| 注:a 模型Ⅰ(微调整模型):调整APACHEⅡ及SOFA评分;b 模型Ⅱ(完全调整模型):调整APACHEII评分、SOFA评分、年龄、性别、既往病史、Scr、WBC、RDW、ALB、前3 d有无输血、PLT、pH、K、FIO2、MAP、心率、呼吸、体温及前3 d的补液总量 | ||||
将ΔHCTd3-d1按三位法分为高(>-1%)、中(-3%~-1%)、低(<-3%)3组,可以得出低ΔHCTd3-d1组、中ΔHCTd3-d1组其生存率要明显高于高ΔHCTd3-d1组,差异有统计学意义(P<0.05)(图 2)。
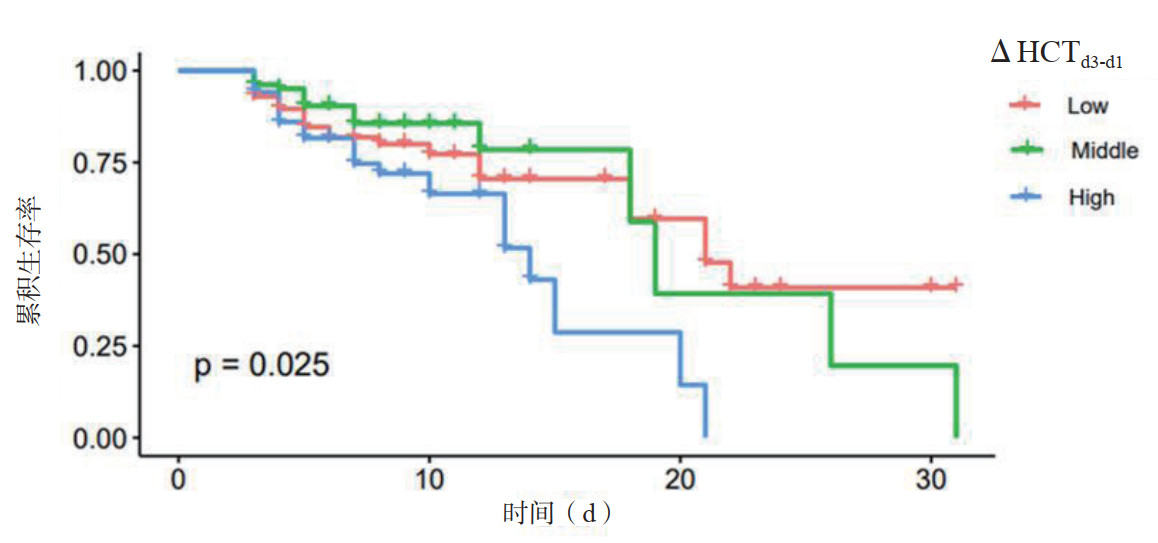
|
| 图 2 ΔHCTd3-d1KM生存曲线 Fig 2 Kaplan-Meier survival curve of ΔHCTd3-d1 |
|
|
将ΔHCTd3-d1按三位法分为高、中、低3组, 可以发现ΔHCTd3-d1与净液体入量呈负相关,高ΔHCTd3-d1组,净液体入量最少(216.2-1171.8 mL),低ΔHCTd3-d1组,净液体入量最高(1988.6-2923.7 mL);而中ΔHCTd3-d1组预后最好,高ΔHCTd3-d1组及低ΔHCTd3-d1组预后均不佳(图 3、图 4)。
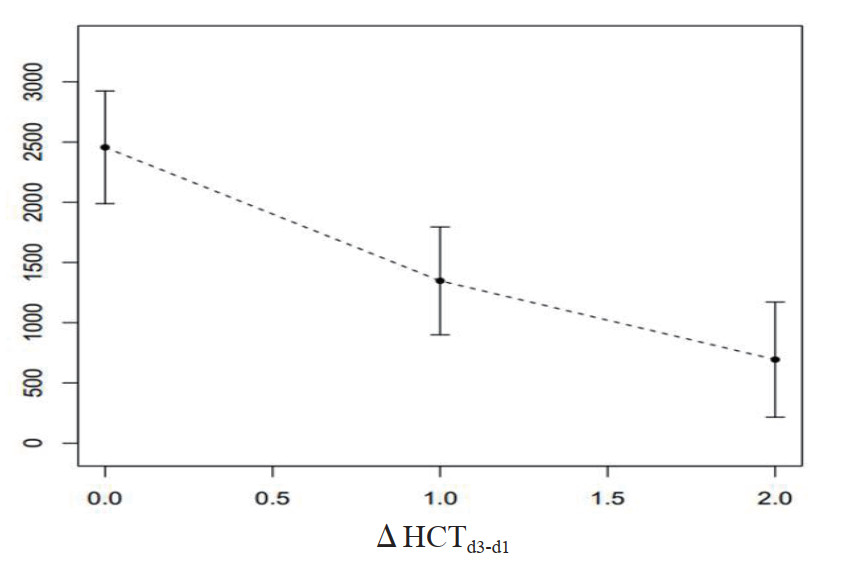
|
| 图 3 ΔHCTd3-d1分组后与前三天液体净入量的关系 Fig 3 Relationship between ΔHCTd3-d1 grouping and net fluid intake in the first three days |
|
|
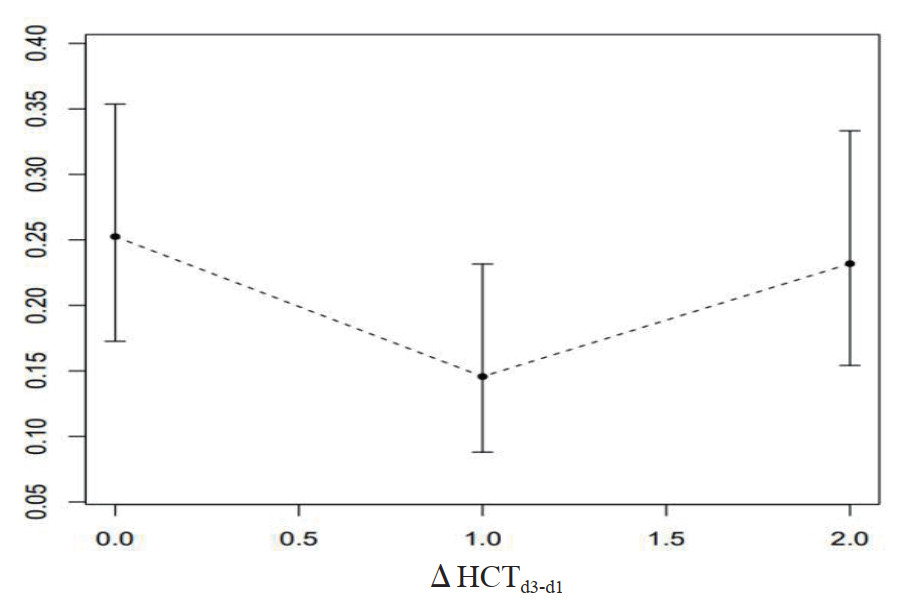
|
| 图 4 ΔHCTd3-d1分组后与预后的关系 Fig 4 The relationship between ΔHCTd3-d1 grouping and prognosis |
|
|
对于脓毒性休克而言液体复苏是一项重要的第一线干预措施[10],尽管液体复苏在指南中为低推荐治疗方案[11]。但是目前,在脓毒症与脓毒症休克的液体治疗中,就液体种类、治疗或复苏时机的确定以及复苏目标等都还存在认识上的差异[12]。许多临床医生倾向于试图通过患者对液体治疗的血流动力学反应来指导液体复苏。曾经被认为可以预测患者对输液的血流动力学反应的静态参数,如中心静脉压[13]、混合静脉血氧饱和度[14],已越来越多地被所谓的动态变量所取代。动态变量是指在机械通气、少量液体复苏可测量的血流动力学的变化,它们能更准确地识别出那些会增加心输出量或每搏输出量的患者[15],如脉压变化[16]、每搏输出量变化[17]、容积图变异指数[17]、多普勒峰值动脉速度变化[17]、下腔静脉扩张[18]以及心输出量监测[19]。尽管上述动态变量越来越能够识别出通过液体复苏将会增加心输出量或每搏输出量的患者,但在许多偏远地区,他们没有常规重症监护病房床位,在有限的资源条件下,他们可能无法做到对上述变量进行动态监测,此时,发现一项简便又有价格低廉的临床快速评估指标就极为重要。
红细胞比容又被称为红细胞压积,是血液中红细胞的体积百分比,通常女性约为40%,男性约为45%[20],它是血液浓缩或稀释的标志物,对于脓毒性休克而言,有研究在实验性内毒素休克的犬模型中发现,其红细胞比容增加(6 h后增加30%)[21],考虑是由于红细胞在脓毒性休克期间渗漏少,而血浆可以排出,因此会留下更高浓度的血液。
但在临床上,脓毒性休克患者红细胞比容通常以下降为主,这是因为患者在复苏过程中及复苏后其红细胞比容的变化情况受到许多与复苏相关因素的影响,这些因素包括输注晶体和胶体的量、细胞成分输注和输血[22]。Aiwei等[23]通过比较不同静脉输液方案中登革热患者红细胞比容的变化,也可以证明液体疗法在降低红细胞比容水平方面是有效的。也就是说脓毒症患者复苏后红细胞比容降低并不一定意味着红细胞质量减少。故检测红细胞比容的变化,不仅对诊断很重要,而且其对包括输血及液体复苏在内的治疗也很重要[24]。本研究结果显示,在调整输血因素后,ΔHCTd3-d1的三组与净液体入量之间有明显的关系,前3 d红细胞比容下降得越快,其净液体入量越多。
对于液体复苏在脓毒症中的作用,传统解释认为,在早期脓毒症期间,大多数患者都经历了“相对低容量血症”。Hernández等[25]对于脓毒性休克患者循环衰竭提出了一个假设,他们认为在脓毒性休克早期,低血容量及血管张力抑制占主导地位,从而导致了低血压及低心输出量,因此早期使用液体灌注,可能不仅会改善大循环,也会改善微循环流量。但目前研究发现脓毒性休克的发生机制主要是血管麻痹,动脉张力丧失,静脉扩张,血液在非应激性血腔中隔离,心室功能改变,顺应性降低,前负荷反应性降低,而不是低血容量[26-27]。
另外有证据表明脓毒症血管通透性的机制与内皮糖萼的降解有关[28]。而持续输液导致高容量血症可能导致医源性糖萼降解的恶化,并与住院病死率增加有关[29]。Li等[30]的研究便发现,在脓毒性休克儿童患者中,与保守液体摄入相比,大量液体摄入导致的死亡风险更高。Marik等[27]也发现在2001至2015年间进行的早期目标导向疗法研究的对照组中,72 h内液体输注量越少,90 d病死率越低,除此之外,他们也发现在脓毒性休克患者中,几乎所有输注的液体都渗漏至组织中,导致重要器官严重水肿,从而增加了器官功能障碍的风险。Sakr等[31]研究同样发现过多的增加正液体平衡与重症监护室入院第3天的死亡风险增加有关,但与入院后第一个24 h小时关,他们认为可能是由于在最初的复苏阶段过后,随后积聚过多的液体与脓毒性休克患者不良预后有关。
因此有人提出脓毒性休克应采取“Less is more(少即是多)”液体管理策略,提倡脓毒性休克患者复苏的液体应尽可能少,但是,液体“少即是多”不是无限制的少,而是需要在一定条件下实施[32]。这与本实验研究结果相似,在本研究中可以发现通过将308例患者的ΔHCTd3-d1均分三等分,KM生存分析结果显示ΔHCTd3-d1三组之间总体生存率差异有统计学意义(P<0.05),另外通过对ΔHCTd3-d1这三组预后的具体分析,可见中ΔHCTd3-d1组预后最好。
总之,ΔHCTd3-d1值与脓毒性休克患者的净液体入量有关,第3天HCT适当下降可以改善脓毒性休克患者的预后。红细胞比容动态变化可以为脓毒性休克患者的液体复苏及预后评估提供一定的依据。
利益冲突 所有作者声明无利益冲突
作者贡献申明 诸雪琪、赵光举、卢中秋负责选题及研究设计;诸雪琪、叶霖、金拼拼负责采集数据及汇总;诸雪琪、唐亚慧、陈隆望负责数据分析;诸雪琪、吴斌负责起草文章;卢中秋负责对文章的知识性内容作批评性审阅、行政技术支持
| [1] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/S0140-6736(18)30696-2 |
| [2] | Vincent JL, De Backer D. Circulatory shock[J]. N Engl J Med, 2013, 369(18): 1726-1734. DOI:10.1056/NEJMra1208943 |
| [3] | Massey MJ, Hou PC, Filbin M, et al. Microcirculatory perfusion disturbances in septic shock: results from the ProCESS trial[J]. Crit Care, 2018, 22(1): 308. DOI:10.1186/s13054-018-2240-5 |
| [4] | Rovas A, Seidel LM, Vink H, et al. Association of sublingual microcirculation parameters and endothelial glycocalyx dimensions in resuscitated sepsis[J]. Crit Care, 2019, 23(1): 260. DOI:10.1186/s13054-019-2542-2 |
| [5] | Scorcella C, Damiani E, Domizi R, et al. MicroDAIMON study: Microcirculatory DAIly MONitoring in critically ill patients: a prospective observational study[J]. Ann Intensive Care, 2018, 8(1): 64. DOI:10.1186/s13613-018-0411-9 |
| [6] | Ospina-Tascon G, Neves AP, Occhipinti G, et al. Effects of fluids on microvascular perfusion in patients with severe sepsis[J]. Intensive Care Med, 2010, 36(6): 949-955. DOI:10.1007/s00134-010-1843-3 |
| [7] | Wilms H, Mittal A, Haydock MD, et al. A systematic review of goal directed fluid therapy: rating of evidence for goals and monitoring methods[J]. J Crit Care, 2014, 29(2): 204-209. DOI:10.1016/j.jcrc.2013.10.019 |
| [8] | Jin T, Jiang K, Deng LH, et al. Response and outcome from fluid resuscitation in acute pancreatitis: a prospective cohort study[J]. HPB (Oxford), 2018, 20(11): 1082-1091. DOI:10.1016/j.hpb.2018.05.018 |
| [9] | Haydock MD, Mittal A, van den Heever M, et al. National survey of fluid therapy in acute pancreatitis: current practice lacks a sound evidence base[J]. World J Surg, 2013, 37(10): 2428-2435. DOI:10.1007/s00268-013-2105-7 |
| [10] | Dellinger RP, Levy MM, Carlet JM, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008[J]. Intensive Care Med, 2008, 34(1): 17-60. DOI:10.1007/s00134-007-0934-2 |
| [11] | 齐文旗, 张斌, 郑忠骏, 等. 拯救脓毒症运动: 2021年国际脓毒症和脓毒性休克管理指南[J]. 中华急诊医学杂志, 2021, 30(11): 1300-1304. DOI:10.3760/cma.j.issn.1671-0282.2021.11.003 |
| [12] | 中华医学会急诊医学分会, 中国医师协会急诊医师分会, 中国人民解放军急救医学专业委员会, 中国医疗保健国际交流促进会急诊急救专业委员会. 脓毒症液体治疗急诊专家共识[J]. 中华急诊医学杂志, 2018, 27(1): 30-38. DOI:10.3760/cma.j.issn.1671-0282.2018.01.007 |
| [13] | Marik PE, Cavallazzi R. Does the central venous pressure predict fluid responsiveness? An updated meta-analysis and a plea for some common sense[J]. Crit Care Med, 2013, 41(7): 1774-1781. DOI:10.1097/CCM.0b013e31828a25fd |
| [14] | Velissaris D, Pierrakos C, Scolletta S, et al. High mixed venous oxygen saturation levels do not exclude fluid responsiveness in critically ill septic patients[J]. Crit Care, 2011, 15(4): R177. DOI:10.1186/cc10326 |
| [15] | Marik PE, Cavallazzi R, Vasu T, et al. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: a systematic review of the literature[J]. Crit Care Med, 2009, 37(9): 2642-2647. DOI:10.1097/CCM.0b013e3181a590da |
| [16] | Yang XB, Du B. Does pulse pressure variation predict fluid responsiveness in critically ill patients? A systematic review and meta-analysis[J]. Crit Care, 2014, 18(6): 650. DOI:10.1186/s13054-014-0650-6 |
| [17] | Lu NF, Xi XM, Jiang L, et al. Exploring the best predictors of fluid responsiveness in patients with septic shock[J]. Am J Emerg Med, 2017, 35(9): 1258-1261. DOI:10.1016/j.ajem.2017.03.052 |
| [18] | Long E, Oakley E, Duke T, et al. Does respiratory variation in inferior vena Cava diameter predict fluid responsiveness: a systematic review and Meta-analysis[J]. Shock, 2017, 47(5): 550-559. DOI:10.1097/SHK.0000000000000801 |
| [19] | Alhashemi JA, Cecconi M, Hofer CK. Cardiac output monitoring: an integrative perspective[J]. Crit Care, 2011, 15(2): 214. DOI:10.1186/cc9996 |
| [20] | Coglianese EE, Qureshi MM, Vasan RS, et al. Usefulness of the blood hematocrit level to predict development of heart failure in a community[J]. Am J Cardiol, 2012, 109(2): 241-245. DOI:10.1016/j.amjcard.2011.08.037 |
| [21] | Hubbard JD, Pugh JL, Berlin SA, et al. Blood volume changes in endotoxin shock[J]. Circ Shock, 1985, 17(4): 339-348. |
| [22] | Scharte M, Fink MP. Red blood cell physiology in critical illness[J]. Crit Care Med, 2003, 31(12 Suppl): S651-S657. DOI:10.1097/01.CCM.0000098036.90796.ED |
| [23] | Ai Wei L, Md Sani S, Bujang MA, et al. Comparison of intravenous fluid regimens in managing dengue patients by evaluating hematocrit levels and hemodynamic parameters[J]. International Medical Journal (1994), 2019, 26: 9-12. |
| [24] | Allen CJ, Tashiro J, Valle EJ, et al. Initial hematocrit predicts the use of blood transfusion in the pediatric trauma patient[J]. J Pediatr Surg, 2014, 49(11): 1678-1682. DOI:10.1016/j.jpedsurg.2014.10.044 |
| [25] | Hernández G, Teboul JL. Is the macrocirculation really dissociated from the microcirculation in septic shock?[J]. Intensive Care Med, 2016, 42(10): 1621-1624. DOI:10.1007/s00134-016-4416-2 |
| [26] | Ravi C, Johnson DW. Optimizing fluid resuscitation and preventing fluid overload in patients with septic shock[J]. Semin Respir Crit Care Med, 2021, 42(5): 698-705. DOI:10.1055/s-0041-1733898 |
| [27] | Marik P, Bellomo R. A rational approach to fluid therapy in sepsis[J]. Br J Anaesth, 2016, 116(3): 339-349. DOI:10.1093/bja/aev349 |
| [28] | Fernández-Sarmiento J, Salazar-Peláez LM, Carcillo JA. The endothelial glycocalyx: a fundamental determinant of vascular permeability in sepsis[J]. Pediatr Crit Care Med, 2020, 21(5): e291-e300. DOI:10.1097/PCC.0000000000002266 |
| [29] | Hippensteel JA, Uchimido R, Tyler PD, et al. Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation[J]. Crit Care, 2019, 23(1): 259. DOI:10.1186/s13054-019-2534-2 |
| [30] | Li DY, Li XY, Cui W, et al. Liberal versus conservative fluid therapy in adults and children with sepsis or septic shock[J]. Cochrane Database Syst Rev, 2018, 12: CD010593. DOI:10.1002/14651858.CD010593.pub2 |
| [31] | Sakr Y, Rubatto Birri PN, Kotfis K, et al. Higher fluid balance increases the risk of death from sepsis: results from a large international audit[J]. Crit Care Med, 2017, 45(3): 386-394. DOI:10.1097/CCM.0000000000002189 |
| [32] | 汪华玲, 陈齐红. 感染性休克液体管理策略: 少即是多[J]. 中华急诊医学杂志, 2020, 29(11): 1502-1504. DOI:10.3760/cma.j.issn.1671-0282.2020.11.026 |
 2022, Vol. 31
2022, Vol. 31




