2. 徐州医科大学研究生院,徐州 221002;
3. 徐州医科大学附属宿迁医院急诊科,宿迁 223800;
4. 江苏省卫生应急研究所,徐州 221002;
5. 睢宁县人民医院急诊医学科,徐州 221299
2. Graduate School of Xuzhou Medical University, Xuzhou 221002, China;
3. Department of Emergency, Suqian Hospital Affiliated to Xuzhou Medical University, Suqian 223800, China;
4. Jiangsu Institute of Health Emergency, Xuzhou 221002, China;
5. Emergency Medicine Department, Suining County People's Hospital, Xuzhou 221299, China
脓毒症(sepsis)是常见的危重病症,尽管在很多发达国家,sepsis及其相关病死率正在逐步减少,但若患者出现多器官功能障碍综合征,病死率依旧居高不下[1]。另外,sepsis的致残率也很高,即便患者可以侥幸存活,其今后的生活质量也会造成非常严重的影响,并且会给其个人、家庭及社会带来极大的经济负担[2-3]。研究表明,检测患者凝血功能状态有助于病情严重程度的评估和预后的判断,血栓弹力图(thromboela-stogram,TEG)是整体评价患者凝血和纤溶过程的方法,在凝血功能障碍患者的预后评价中具有重要的价值。一些研究人员认为,平均血小板体积(mean platelet volume,MPV)应始终与血小板计数(platelet count,PLT)一起评估,因为PLT和MPV之间存在非线性反比关系,这意味着PLT的减少会伴随着其平均体积的增加,这与维持止血和保持恒定的PLT质量有关[4], 但该比值用于sepsis的诊断及评估研究较少且价值尚存在争议。在TEG和凝血功能的基础上联合MPV/PLT比值是否能提高对sepsis患者凝血状态评估的准确率尚不清楚,鉴于此本研究检测sepsis患者的TEG、凝血功能和MPV/PLT比值,探讨其对sepsis患者预后的评估价值。
1 资料与方法 1.1 一般资料选取徐州医科大学附属医院2020年1月至2021年9月间收治的sepsis患者271例作为研究对象,纳入标准:①患者符合2016版sepsis诊断标准[5];②年龄≥18岁;③根据2016版sepsis诊治指南推荐的方案完成救治过程。排除标准:①有恶性肿瘤,原发心、肺、肝、肾等器官功能障碍的患者;②有自身免疫性疾病、代谢性疾病、血液系统疾病者;③近期有输血、服用抗凝、抗PLT等药物者;④资料不全者;⑤中途放弃治疗或跟踪随访失败者。本研究通过徐州医科大学附属医院伦理委员会批准(批文号XYFY2021-KL195-01),并在中国临床试验注册中心注册(注册号ChiCTR2100052736)。
1.2 方法所有患者均根据指南推荐完成救治过程,并在入院24 h内抽取静脉血行血常规及生化检测,并由TEG5000型TEG仪(美国Haemonetics公司)检测TEG相关指标。收集相关临床资料:患者姓名、住院号、性别、年龄、入院时间、住院天数、感染部位及原发病,白细胞计数、C反应蛋白、降钙素原、血糖、血乳酸、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、尿素氮、血肌酐、TEG、凝血功能、MPV、PLT、血压、是否应用血管活性药物、28 d内是否死亡及死亡时间,并计算患者入院当天的急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluationⅡ,APACHE Ⅱ)评分及SOFA评分。本研究共入选了280例sepsis需行液体复苏治疗的患者,9例患者入院后24 h内放弃治疗或死亡被排除,剩余271例患者作为本次研究的对象。根据其入院28 d内预后进行分组,分为死亡组和生存组,其中死亡组为28 d内院内死亡或因不可避免的死亡而放弃抢救自动出院的患者(n=115),存活组为ICU住院天数超过28 d的患者或好转后转入普通病房或好转后出院存活超过28 d者(n= 156)。
1.3 观察指标比较存活组与死亡组一般资料、TEG、凝血功能、MPV/PLT比值的差异。通过多因素Logistic回归分析,筛选能够影响sepsis患者预后的独立预测因素。通过绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算能够影响sepsis患者预后的独立预测因素的曲线下面积(area under curve roc,AUC),比较几项指标对于sepsis患者预后评估价值的优劣。
1.4 统计学方法采用SPSS 26.0对数据进行统计分析。计量资料经正态性检验,符合正态分布的资料均采用均数±标准差(x±s)表示,两组间比较采用独立样本t检验;不符合正态分布的资料均采用中位数(四分位数)表示,即M(P25, P75),两组间比较采用Mann-Whitney U检验。分类计数资料均采用例数(百分比)表示,组间比较采用χ2检验。采用Logistic回归分析影响sepsis患者28 d死亡的相关因素, 采用条件向前法建立二元Logistic回归模型。采用ROC曲线评价各指标诊断sepsis患者28 d内死亡的价值,采用Z检验对各指标曲线下面积进行比较。以P<0.05为差异有统计学意义。
2 结果 2.1 两组患者基线资料比较死亡组115例患者中男性74例,女性41例,年龄范围18~90岁,平均年龄63.1岁,其中有1例为中枢系统感染,5例为软组织感染,10例为泌尿系统感染,45例为腹腔感染,54例为呼吸系统感染;存活组156例患者中男性90例,女性66例,年龄范围18~90岁,平均年龄62.7岁,其中有2例为中枢系统感染,11例为软组织感染,22例为泌尿系统感染,52例为腹腔感染,69例为呼吸系统感染。两组患者性别比例经χ2检验,差异无统计学意义(P > 0.05)。两组患者年龄、血糖水平经独立样本t检验结果显示,两组患者年龄、血糖水平差异均无统计学意义(P > 0.05)。两组患者住院天数、白细胞计数、C反应蛋白、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、尿素氮、血肌酐、APACHEⅡ评分、SOFA评分、降钙素原、乳酸水平等经Mann-Whitney U检验结果显示,两组患者住院天数、白细胞计数、C反应蛋白、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、尿素氮、血肌酐水平差异均无统计学意义(P > 0.05),死亡组APACHEⅡ评分、SOFA评分、降钙素原、乳酸水平均明显高于存活组,差异均有统计学意义(P < 0.05),见表 1。
| 基线资料 | 存活组(n=156) | 死亡组(n=115) | t/Z/χ2值 | P值 |
| 性别(男/女) | 90/66 | 74/41 | 1.227 | 0.268 |
| 年龄(岁) | 63±18 | 63±15 | 0.213 | 0.831 |
| 住院天数(d) | 10.00(6.00, 16.75) | 8.00(4.00, 16.00) | -1.589 | 0.112 |
| 白细胞计数(×109/L) | 11.85(6.95, 16.18) | 11.90(8.00, 16.80) | -0.471 | 0.637 |
| C反应蛋白(mg/L) | 101.50(51.30, 168.95) | 90.70(37.60, 178.30) | -0.764 | 0.445 |
| 血糖(mmol/L) | 9.02±4.81 | 9.34±4.80 | 0.536 | 0.592 |
| 天门冬氨酸氨基转移酶(U/L) | 33.00(20.00, 68.75) | 39.00(23.00, 92.00) | -1.293 | 0.196 |
| 丙氨酸氨基转移酶(U/L) | 34.00(17.25, 78.00) | 34.00(15.00, 82.00) | -0.207 | 0.836 |
| 尿素氮(mmol/L) | 11.09(6.01, 18.37) | 9.20(5.23, 18.00) | -1.211 | 0.226 |
| 血肌酐(μmol/L) | 80.00(53.25, 162.75) | 70.00(51.00, 156.00) | -1.231 | 0.218 |
| APACHEⅡ评分 | 13.00(9.00, 19.00) | 20.00(16.00, 26.00) | -6.294 | < 0.001 |
| SOFA评分 | 4.00(2.00, 8.00) | 11.00(8.00, 14.00) | -9.547 | < 0.001 |
| 降钙素原(ng/mL) | 2.46(0.59, 10.51) | 6.78(2.00, 23.39) | -3.761 | < 0.001 |
| 乳酸(mmol/L) | 1.70(1.10, 2.90) | 2.80(1.30, 5.60) | -3.502 | < 0.001 |
比较两组患者凝固角(coagulation angle, Angle)、血栓最大振幅(maximum thrombus amplitude, MA),两组患者MA水平差异无统计学意义(P > 0.05),死亡组Angle水平明显低于存活组(P < 0.05)。两组患者R值、K值、30 min内估计溶解百分数(Estimated Percentage Lysis,EPL)、30 min时溶解百分比(Percent Lysis at 30 min,LY30)、综合凝血指数(comprehensive coagulation index,CI)水平经Mann-Whitney U检验结果显示,两组患者K值、EPL、LY30水平差异无统计学意义(P > 0.05),死亡组R值明显高于存活组,CI明显低于存活组(P < 0.05),见表 2。
| 血栓弹力图 | 存活组(n=156) | 死亡组(n=115) | t/Z值 | P值 |
| R(min) | 4.45(3.50, 6.65) | 7.80(4.80, 10.10) | -5.847 | < 0.001 |
| K(min) | 1.80(1.30, 3.45) | 2.20(1.30, 4.00) | -1.220 | 0.222 |
| Angle(°) | 62.70±10.79 | 50.25±14.81 | 7.644 | < 0.001 |
| MA(mm) | 55.44±12.45 | 53.95±13.31 | 0.944 | 0.346 |
| EPL(%) | 0.12±0.51 | 0.06±0.43 | -1.363 | 0.173 |
| LY30(%) | 0.07±0.24 | 0.05±0.24 | -0.566 | 0.571 |
| CI | 1.00(-0.40, 1.78) | -3.60(-6.60, -0.90) | -8.162 | < 0.001 |
比较两组患者抗凝血酶原Ⅲ活性(antithrombin Ⅲ,AT-Ⅲ)、百分活动度(percent activity,PT-ACT)、凝血酶时间(thrombin time,TT),其PT-ACT、TT水平差异无统计学意义(P > 0.05),死亡组AT-Ⅲ水平明显低于存活组(P < 0.05)。两组患者凝血酶原时间(prothrombin time,PT)、凝血酶原时间比值(prothrombin time ratio, PT-Ratio)、国际标准化比值(international normalized ratio,PT-INR)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、D-二聚体(D-Dimer,D-Di)、纤维蛋白原降解产物(fibrinogen degradation products,FDP)水平经Mann-Whitney U检验结果显示,两组患者PT、PT-Ratio、PT-INR、APTT、FIB、FDP水平差异无统计学意义(P > 0.05),死亡组D-Di水平明显高于存活组(P < 0.05),见表 3。
| 凝血功能 | 存活组(n=156) | 死亡组(n=115) | t/Z值 | P值 |
| AT-Ⅲ(%) | 76.88±17.03 | 55.02±21.90 | 8.902 | < 0.001 |
| PT(s) | 13.05(12.00, 15.50) | 13.70(12.00, 17.90) | -1.192 | 0.233 |
| PT-ACT(%) | 70.23±27.38 | 66.77±26.52 | 1.043 | 0.298 |
| PT-Ratio | 1.15(1.04, 1.37) | 1.21(1.06, 1.61) | -1.307 | 0.191 |
| PT-INR | 1.17(1.04, 1.42) | 1.22(1.09, 1.47) | -1.448 | 0.148 |
| APTT(s) | 30.60(26.80, 37.15) | 32.20(28.00, 38.80) | -1.801 | 0.072 |
| FIB(g/L) | 4.04(2.53, 5.09) | 3.73(2.53, 4.90) | -1.251 | 0.211 |
| TT(s) | 16.58±2.72 | 17.12±4.29 | 1.190 | 0.236 |
| D-Di(μg/mL) | 1.70(0.85, 3.55) | 5.08(2.09, 10.00) | -6.472 | < 0.001 |
| FDP(mg/L) | 9.10(5.30, 20.33) | 11.00(6.00, 23.81) | -1.302 | 0.193 |
死亡组MPV水平明显高于存活组(P < 0.05)。两组患者PLT、MPV/PLT水平经Mann-Whitney U检验结果显示,死亡组MPV/PLT水平明显高于存活组,PLT明显低于存活组(P < 0.05),见表 4。
| 指标 | 存活组(n=156) | 死亡组(n=115) | t/Z/χ2值 | P值 |
| MPV(fl) | 10.40±1.55 | 11.56±1.78 | 5.709 | < 0.001 |
| PLT(109/L) | 160.00(111.00, 211.00) | 81.00(37.00, 156.00) | -6.075 | < 0.001 |
| MPV/PLT | 0.07(0.05, 0.10) | 0.14(0.07, 0.32) | -6.930 | < 0.001 |
以sepsis患者28 d内是否发生死亡(是=1,否=0)为因变量,以单因素分析中有统计学意义的指标为自变量(包括APACHEⅡ评分、SOFA评分、降钙素原、乳酸、R、Angle、CI、AT-Ⅲ、D-Di、MPV/PLT),采用条件向前法建立二元Logistic回归模型。结果显示SOFA评分、Angle、CI、AT-Ⅲ、D-Di、MPV/PLT在模型中均有统计学意义(P < 0.05),其中SOFA评分、D-Di、MPV/PLT均为影响患者28 d死亡的危险因素(OR > 1,P < 0.05),Angle、CI、AT-III均为影响患者28 d死亡的保护因素(OR < 1,P < 0.05)。构建Logistic回归模型公式为:
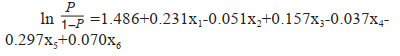
|
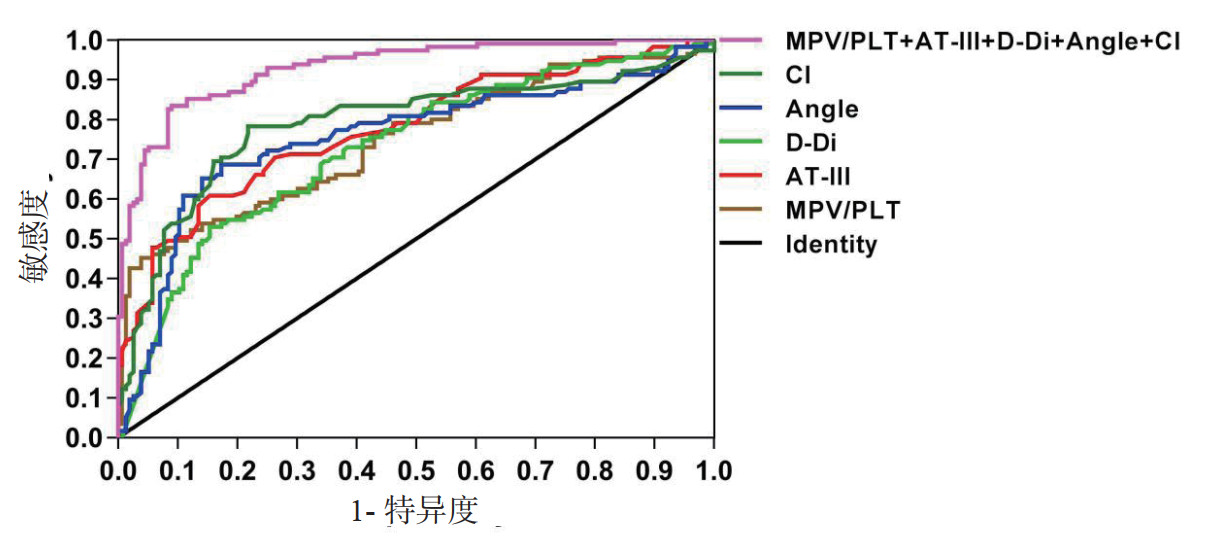
由ROC曲线可知,Angle、CI、AT-Ⅲ、D-Di、MPV/PLT及五指标联合预测sepsis患者28 d内死亡的AUC分别为0.755、0.790、0.776、0.729、0.746、0.931,对应P值均小于0.05,说明五指标预测sepsis患者28 d预后方面具有一定价值。根据观察,以Angle =58.05 °为界值,敏感度和特异度分别为68.7%和82.7%;以CI= -0.65为界值,敏感度和特异度分别为78.3%和78.2%;以AT-Ⅲ= 60.5%为界值,敏感度和特异度分别为60.9%和84.6%;D-Di =4.995 μg/mL为界值,敏感度和特异度分别为53.0%和84.6%;MPV/PLT =0.1801为界值,敏感度和特异度分别为45.2%和96.2%;Angle、CI、AT-Ⅲ、D-Di、MPV/PLT联合检测敏感度和特异度分别为83.5%和91.0%。各指标曲线下面积经Z检验结果显示,五指标联合预测sepsis患者28 d内死亡的曲线下面积均明显高于Angle、CI、AT-III、D-Di、MPV/PLT单独预测曲线下面积(P < 0.05),见图 1。
|
| 图 1 Angle、CI、AT-Ⅲ、D-Di、MPV/PLT及五指标联合检测的ROC曲线 Fig 1 ROC curve of Angle, CI, AT-Ⅲ, D-Di, MPV/PLT ratio and five indexes combined detection |
|
|
Sepsis是患者入住重症监护室乃至死亡的主要原因。国外的一项流行病学调查显示,sepsis的病死率已经超过心肌梗死,也是ICU内非心脏患者死亡的主要原因。在美国,20%~50%的sepsis患者会因为严重的感染而致命[6],国内数据显示,sepsis的病死率也在逐年上升[7]。造成sepsis的原因也是多种多样,常见原因有肺部感染、腹膜炎、泌尿系统感染、胆管炎、蜂窝织炎、脑膜炎、皮肤脓肿等。细菌、真菌、病毒以及寄生虫等都可能是其致病微生物,但并非所有的sepsis患者都有血培养阳性结果,仅45%的sepsis患者可有血培养阳性结果。在sepsis患者体内由于炎症失衡释放大量炎症因子,例如肿瘤坏死因子-α、白细胞介素和前列腺素等,这些炎症因子将会激活外源性凝血机制,抑制纤维蛋白溶解,这些将会导致机体凝血和抗凝血的失衡[8]。另外,sepsis也会导致患者血管内皮的损伤,使得PLT快速黏附,从而引起微血栓的形成,最终可诱导弥散性血管内凝血(disseminated ntravascular coagulation,DIC)的发生[9],而凝血功能障碍又和sepsis的发生发展密切相关[10],整个发病过程快速又隐蔽[11],给临床整治带来重重困难,因此评估sepsis患者严重程度和预后具有重要的意义。
在本研究确定了Angle、CI和AT-Ⅲ是sepsis患者28 d死亡的独立保护因素,而D-Di和MPV/PLT是sepsis患者28 d内死亡的独立危险因素。ROC曲线分析出这5种指标在预测sepsis患者的28 d内全因死亡风险方面具有较高的AUC值,并且在同时联合这5种指标时,AUC价值将大大增加。因此推测Angle、CI和AT-Ⅲ这三种指标水平越低和D-Di和MPV/PLT这2种指标水平越高,sepsis患者入院28 d内全因死亡风险越大,并且在同时联合这五种指标时诊断价值将会大大增加。
TEG是血液凝固动态变化的指标,既往研究表明TEG参数可被用于检测sepsis患者凝血功能的变化[12],及时纠正凝血功能障碍可以改善sepsis患者的预后[13-14]。在TEG指标方面,Angel角反映了PLT的凝聚能力,当Angel角减小时,提示患者血液呈低凝状态,有出血倾向。本研究中sepsis死亡组患者的Angle值低于sepsis存活组患者,而有研究也发现[15],处于低凝状态的sepsis患者发生器官衰竭的概率明显升高,这表明低凝状态在sepsis死亡患者中很常见。Luo等[16]为了进一步确定TEG与sepsis患者长期存活的关系,对sepsis患者进行了2年的随访,并进行ROC曲线生存分析。分析显示,Angel角可以预测sepsis患者的2年生存率。CI体现了样本在各个条件下凝血的综合状态,本研究发现sepsis死亡组患者的CI较sepsis生存组患者明显降低。此外,sepsis通过激活炎症介质和血管内皮细胞损伤导致凝血功能障碍。大量证据表明,炎症不仅可以启动凝血系统,而且凝血也可以显著影响炎症[17]。本研究对比了sepsis死亡患者与存活患者的常规凝血指标,结果发现仅AT-Ⅲ和D-Di是sepsis死亡发生的危险因素。AT-Ⅲ是一种丝氨酸蛋白酶抑制物,可抑制凝血酶生成,其水平降低可发生血栓[18]。Matsubara等[19]研究发现AT-Ⅲ水平的降低与sepsis患者的病死率的增加显著相关。D-Di是一种可溶性纤维蛋白降解产物,它是血栓分解所产生的。以往的研究已经表明D-Di作为凝血和抗凝血失衡的重要标志物,可被用于检测DIC的发生[20]。Sepsis患者在早期即可出现PLT及相关参数的变化[21]。Oh等[22]研究表明,严重sepsis急性期较高的MPV/PLT与28天病死率相关。MPV/PLT可能是sepsis早期的有效“警报系统”。黄鑫等[23]发现与存活组和健康组患者相比,尿源性sepsis患者的MPV/PLT水平明显升高。本研究结果也显示MPV/PLT越高,患者病死率越高,这表明MPV/PLT水平能够反映sepsis患者病情的严重程度并有益于预后的判断。本研究中TEG指标中Angel角和CI反应sepsis死亡组患者处于低凝状态,而常规凝血功能中AT-Ⅲ和D-Di仅可以看出血栓形成的风险,因此在评估sepsis患者发生凝血功能障碍时不能单纯依靠常规凝血功能检测,多指标联合监测明显提高了预测sepsis患者预后的特异度。此外,还发现凝血功能异常与SOFA评分密切相关,提示凝血功能异常和器官功能障碍在sepsis患者中相互作用。
利益冲突 所有作者声明无利益冲突
作者贡献声明 印明珠:研究设计、数据收集及整理、统计学分析、论文撰写;燕宪亮、孙明:研究设计、论文修改
| [1] | Eisen DP, Leder K, Woods RL, et al. Effect of aspirin on deaths associated with sepsis in healthy older people (ANTISEPSIS): a randomised, double-blind, placebo-controlled primary prevention trial[J]. Lancet Respir Med, 2021, 9(2): 186-195. DOI:10.1016/S2213-2600(20)30411-2 |
| [2] | Sônego F, Castanheira FV, Ferreira RG, et al. Paradoxical roles of the neutrophil in sepsis: protective and deleterious[J]. Front Immunol, 2016, 7: 155. DOI:10.3389/fimmu.2016.00155 |
| [3] | 庄天时, 燕宪亮. 胱抑素C联合降钙素原对脓毒症预后的预测价值[J]. 中国医刊, 2021, 56(2): 147-149. DOI:10.3969/j.issn.1008-1070.2021.02.010 |
| [4] | Butkiewicz AM, Kemona H, Dymicka-Piekarska V, et al. Platelet count, mean platelet volume and thrombocytopoietic indices in healthy women and men[J]. Thromb Res, 2006, 118(2): 199-204. DOI:10.1016/j.thromres.2005.06.021 |
| [5] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [6] | Martin GS, Mannino DM, Eaton S, et al. The epidemiology of sepsis in the United States from 1979 through 2000[J]. N Engl J Med, 2003, 348(16): 1546-1554. DOI:10.1056/NEJMoa022139 |
| [7] | Liao XL, Du B, Lu MZ, et al. Current epidemiology of sepsis in mainland China[J]. Ann Transl Med, 2016, 4(17): 324. DOI:10.21037/atm.2016.08.51 |
| [8] | Huang M, Cai S, Su J. The pathogenesis of sepsis and potential therapeutic targets[J]. Int J Mol Sci, 2019, 20(21): E5376. DOI:10.3390/ijms20215376 |
| [9] | Iba T, Levy JH. Inflammation and thrombosis: roles of neutrophils, platelets and endothelial cells and their interactions in thrombus formation during sepsis[J]. J Thromb Haemost, 2018, 16(2): 231-241. DOI:10.1111/jth.13911 |
| [10] | Yao RQ, Ren C, Ren D, et al. Development of septic shock and prognostic assessment in critically ill patients with coronavirus disease outside Wuhan, China[J]. World J Emerg Med, 2021, 12(4): 293-298. DOI:10.5847/wjem.j.1920-8642.2021.04.007 |
| [11] | 陈培莉, 宁宁, 马丽, 等. 不同严重程度脓毒症患者血栓弹力图特点及预测价值[J]. 中华急诊医学杂志, 2022, 31(8): 1066-1070. DOI:10.3760/cma.j.issn.1671-0282.2022.08.009 |
| [12] | Müller MC, Meijers JC, Vroom MB, et al. Utility of thromboelastography and/or thromboelastometry in adults with sepsis: a systematic review[J]. Crit Care, 2014, 18(1): R30. DOI:10.1186/cc13721 |
| [13] | Velik-Salchner C, Streif W, Innerhofer P, et al. Endotoxinemia-induced changes in coagulation as measured by rotation thrombelastometry technique and conventional laboratory tests: results of a pilot study on pigs[J]. Blood Coagulation Fibrinolysis, 2009, 20(1): 41-46. DOI:10.1097/MBC.0b013e32831be9ad |
| [14] | Baratto F, Michielan F, Meroni M, et al. Protein C concentrate to restore physiological values in adult septic patients[J]. Intensive Care Med, 2008, 34(9): 1707-1712. DOI:10.1007/s00134-008-1140-6 |
| [15] | Yin J, Chen Y, Huang JL, et al. Prognosis-related classifification and dynamic monitoring of immune status in patients with sepsis: a prospective observational study[J]. World J Emerg Med, 2021, 12(3): 185-191. DOI:10.5847/wjem.j.1920-8642.2021.03.004 |
| [16] | Luo CZ, Hu HB, Gong J, et al. The value of thromboelastography in the diagnosis of sepsis-induced coagulopathy[J]. Clin Appl Thromb Hemost, 2020, 26: 107602962095184. DOI:10.1177/1076029620951847 |
| [17] | Levi M, van der Poll T. Coagulation and sepsis[J]. Thromb Res, 2017, 149: 38-44. DOI:10.1016/j.thromres.2016.11.007 |
| [18] | Sakuragawa N. Regulation of thrombosis and hemostasis by antithrombin[J]. Semin Thromb Hemost, 1997, 23(6): 557-562. DOI:10.1055/s-2007-996136 |
| [19] | Matsubara T, Yamakawa K, Umemura Y, et al. Significance of plasma fibrinogen level and antithrombin activity in sepsis: a multicenter cohort study using a cubic spline model[J]. Thromb Res, 2019, 181: 17-23. DOI:10.1016/j.thromres.2019.07.002 |
| [20] | Weitz JI, Fredenburgh JC, Eikelboom JW. A test in context: d-dimer[J]. J Am Coll Cardiol, 2017, 70(19): 2411-2420. DOI:10.1016/j.jacc.2017.09.024 |
| [21] | 陈晨松, 方俊杰, 陈乾峰, 等. 早期血小板计数动态变化对脓毒症患者预后的预测价值[J]. 中华急诊医学杂志, 2022, 31(5): 665-671. DOI:10.3760/cma.j.issn.1671-0282.2022.05.017 |
| [22] | Oh GH, Chung SP, Park YS, et al. Mean platelet volume to platelet count ratio as a promising predictor of early mortality in severe Sepsis[J]. Shock, 2017, 47(3): 323-330. DOI:10.1097/SHK.0000000000000718 |
| [23] | 黄鑫, 张泓, 翁云龙, 等. 平均血小板体积血小板计数及两者比值对尿源性脓毒症预后的预测价值[J]. 中国急救医学, 2020, 40(11): 1081-1085. DOI:10.3969/j.issn.1002-1949.2020.11.010 |
 2022, Vol. 31
2022, Vol. 31




