2. 福州市第二医院检验科,福州 350007
2. Department of Laboratory Medicine, Fuzhou Second Hospital, Fuzhou 350007, China
脓毒症是机体对感染做出的失调反应并引起威胁生命的器官功能障碍的一种综合征[1]。脓毒症和脓毒症休克仍是目前全球面临的主要问题,它影响着数百万人,世界各地每年都会有1/6~1/3的患者因此而死亡[1-2]。有证据显示肝脏作为人体最大的腺体,它在宿主防御病原体中起着重要的作用[3]。脓毒症引起的肝功能不全和肝功能衰竭的发生率分别为46%和22%[4]。肝功能不全和肝衰竭与脓毒症的严重并发症有关,伴有肝功能不全或衰竭的脓毒症患者的病死率在54%~68%之间,这一比例明显高于脓毒症伴有肺功能不全或衰竭(最常见的受累器官)[5]。目前脓毒症的治疗策略仍是早期抗感染联合器官支持,这有助于改善脓毒症的预后,但也因此耗费了大量的医疗资源。中药复方在临床中应用取得一定效果,可降低APACHEⅡ评分、降低脓毒症患者急性胃肠道损伤风险,缩短机械通气时间,改善28 d总病死率[6]。
热毒内蕴是脓毒症的基本病机,清热解毒作为主要的治则之一,对脓毒性肺损伤有重要的改善作用。犀角地黄汤其方由犀角(水牛角代替),生地黄,芍药,牡丹皮组成,具有清热解毒、凉血散瘀之功效。犀角地黄汤在脓毒症治疗中首次以指南形式出现在2014年,当时脓毒症指南中医部分明确犀角地黄汤的适应证[7]。本研究团队前期研究也发现犀角地黄汤可改善脓毒症大鼠肝组织病理学改变, 其机制可能与犀角地黄汤调节Th1和Th2分化、B细胞受体通路及TLR信号通路相关mRNA的表达有关[8]。但关于犀角地黄汤如何调节mRNA表达的上游机制仍未明确,本文拟从microRNA靶向mRNA角度阐述其可能的机制。
1 材料与方法 1.1 实验动物SPF级C57BL/6小鼠60只,体重(25±5.0)g,购自上海斯莱克实验动物有限公司,动物合格证号:20170012003850。
1.2 伦理学本研究符合动物伦理学标准,并经福建省中医药科学院动物伦理委员会审批通过(审批号:FJATCM-IAEC2020017)。
1.3 主要试剂与仪器主要试剂:脂多糖(LPS, L2630, Escherichia coli serotype O111:B4),美国sigma公司。主要仪器:Illumina HiSeqxTen测序仪,美国Illumina公司。
1.4 实验药物犀角地黄汤中药全成份(犀角地黄汤中犀角以水牛角代替,组成: 水牛角30 g,生地黄24 g,赤芍12 g,牡丹皮9 g)购自福建中医药大学附属人民医院中药房,每剂用蒸馏水配至120 mL备用,每毫升含生药0.625 g。
1.5 动物模型制备与分组SPF级C57BL/6小鼠60只。随机(随机数字法)等分成3组,即对照组(CL),脓毒症组(SL),脓毒症犀角地黄汤治疗组(XL)。实验前正常饮食、饮水。脓毒症组、脓毒症犀角地黄汤治疗组小鼠按LPS 25 mg/kg腹腔注射构建脓毒症小鼠模型[9];对照组予等量生理盐水腹腔注射。术后正常饮食、饮水。犀角地黄汤组,于小鼠LPS干预前2 d开始予犀角地黄汤药液0.3 mL(即生药187.5 mg)灌胃,术后继续胃饲,2次/1 d,持续2 d,对照组及脓毒症组小鼠予等量生理盐水胃饲。
1.6 肝组织标本的采集LPS干预后72 h每组随机取9只,麻醉后取部分肝脏标本(每组取3只,做病理检查),部分标本液氮速冻后转-80 ℃冰箱保存备用。待做Small RNA及RNA-seq测序。
1.7 转录组学测序每组小鼠取相同质量肝组织标本进行3个一混,共形成3个混合样本,提取总RNA后,待做Small RNA测序及RNA-seq测序。
Small RNA测序:(1)3’接头连接;(2)5’接头连接;(3)反转录;(4)PCR扩增,PCR后Agilent 2100质控;(5)切胶回收;(6)文库质控;(7)混合文库;(8)上机测序。
RNA-seq测序:(1)mRNA的富集;(2)随机打断mRNA;(3)以mRNA为模板合成cDNA第一链;(4)合成cDNA第二链;5)纯化双链cDNA;(6)末端修复、加A尾;(7)PCR富集得到最终的cDNA文库;(8)文库质控,上机测序。
1.8 数据生物信息学分析(1)Small RNA测序数据的生物信息学分析:①测序所得的数据进行质控(QC),合并重复序列、数据过滤、筛选miRNA中的Known miRNA;②对Known miRNA进行差异分析,聚类分析、靶基因预测。(2)RNA-seq测序数据分析:数据质控,差异表达基因分析。(3)将SL vs CL与XL vs SL的差异miRNA取交集,找到表达方向相反的差异miRNA,得出犀角地黄汤可能作用的miRNA。并根据miRNA靶向mRNA与RNA-seq结果的差异基因取交集,得出犀角地黄汤可能作用的mRNA。
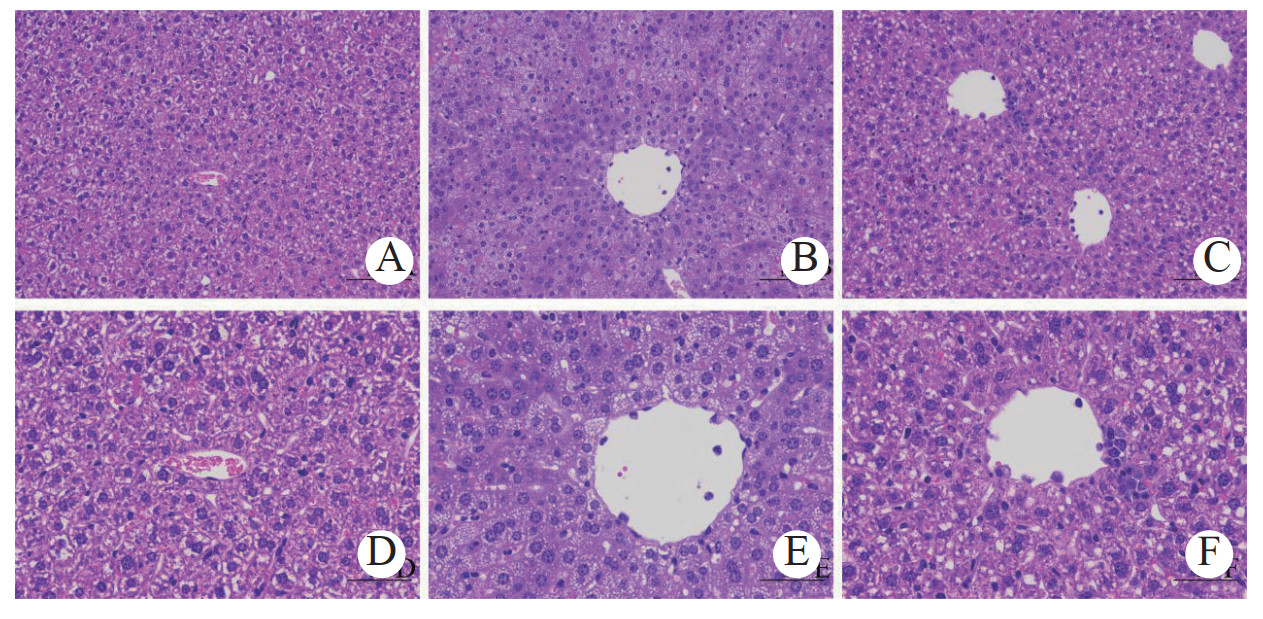
2 结果 2.1 各组小鼠病理切片HE染色结果对照组:肝组织结构(见图 1 A、D)以P < 0.05为差异有统计学意义。脓毒症组:视野中可见广泛肝细胞肿胀,胞质疏松或呈空泡状,少量肝细胞伴有空泡变性,胞质内可见微小的圆形空泡(见图 1 B、E)。脓毒症清犀角地黄汤干预组小鼠肝组织紊乱结构较前稍改善。视野中肝细胞肿胀、胞质疏松较前缓解。(见图 1C、F)
|
| A-C:HE 染色 × 200;D-F:HE 染色 × 400 图 1 对照组、脓毒症组、脓毒症犀角地黄汤干预组小鼠肝组织病理变化情况 Fig 1 Pathological changes of liver tissue in the control group, sepsis group and sepsis treatment with XJDHT group under light microscopy |
|
|
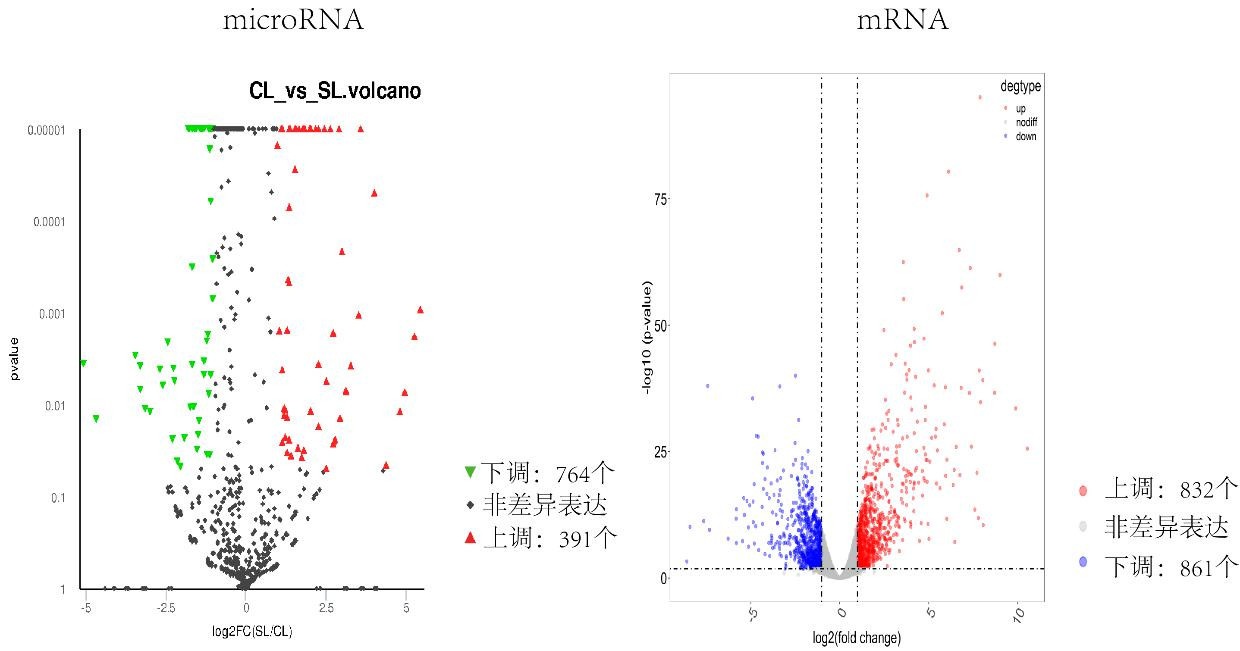
LPS干预后小鼠肝组织无论是从microRNA角度还是从mRNA角度看都出现了差异表达。其中microRNA表达上调的有391个,下调的有764个,mRNA表达上调的有832个,下调的有861个。
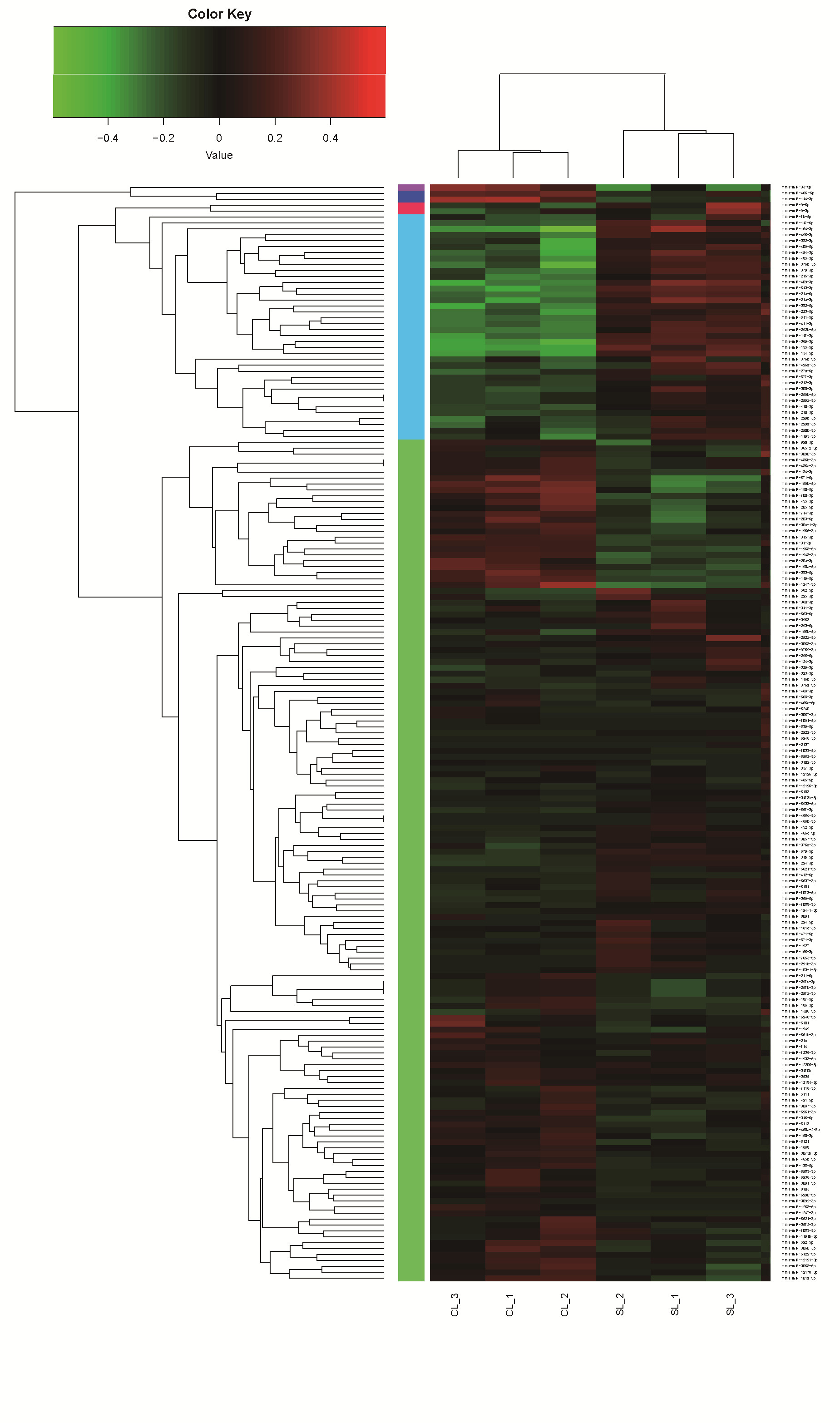
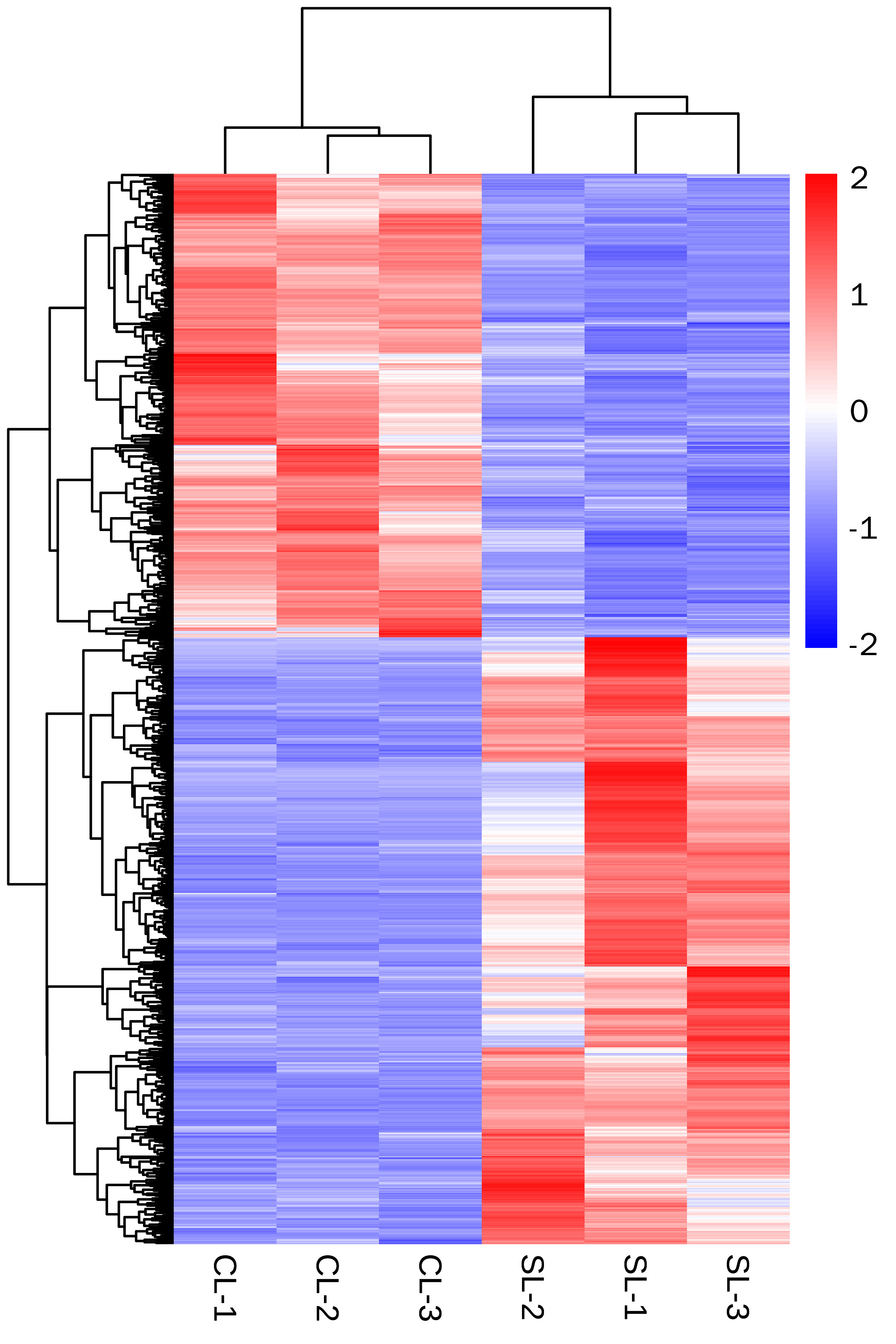
2.3 差异表达的microRNA及mRNA聚类情况LPS诱导的脓毒症小鼠肝组织差异microRNA及mRNA聚类情况分别见图 3, 4。脓毒症组小鼠肝组织microRNA及mRNA表达情况明显区别与对照组小鼠,两组界限清楚。
|
| 图 2 对照组,脓毒症组小鼠差异基因表达情况 Fig 2 Differential gene expression of mice in the control and sepsis groups |
|
|
|
| 图 3 对照组,脓毒症组小鼠差异microRNA聚类情况 Fig 3 Differential microRNA clustering of mice in the control and sepsis groups |
|
|
|
| 图 4 对照组,脓毒症组小鼠差异mRNA聚类情况 Fig 4 Differential mRNA clustering of mice in the control and sepsis groups |
|
|
脓毒症组小鼠相对于对照组小鼠肝组织中上调microRNA:mmu-miR-292a-5p、mmu-miR-871-3p、mmu-miR-653-5p、mmu-miR-293-5p、mmu-miR-155-3p,在犀角地黄汤治疗组小鼠相对于脓毒症组小鼠肝组织中却出现表达下调。同样,前者出现下调的microRNA:mmu-miR-346-5p、mmu-miR-187-5p、mmu-miR-3090-3p,在后者中出现表达上调(见表 1)。
| microRNA | SL组/CL组比值 | P值 | 上调下调 | XL组/SL组比值 | P值 | 上调下调 |
| mmu-miR-292a-5p | 3.01 | < 0.001 | ↑ | -2.7 | < 0.001 | ↓ |
| mmu-miR-871-3p | 5.45 | < 0.001 | ↑ | -4.11 | < 0.001 | ↓ |
| mmu-miR-293-5p | 5.27 | 0.002 | ↑ | -3.54 | < 0.001 | ↓ |
| mmu-miR-155-3p | 3.27 | 0.004 | ↑ | -4.82 | 0.004 | ↓ |
| mmu-miR-346-5p | -2.44 | 0.002 | ↓ | 2.49 | 0.001 | ↑ |
| mmu-miR-187-5p | -1.68 | 0.004 | ↓ | 1.72 | 0.002 | ↑ |
| mmu-miR-3090-3p | -1.73 | 0.011 | ↓ | 2.01 | 0.006 | ↑ |
microRNA靶向差异表达mRNA的情况mmu-miR在相当于对照组而言,脓毒症组则出现差异表达,进而引起靶向基因mRNA的表达量的改变,而在犀角地黄汤治疗组小鼠的肝组织则出现缓解(如:mmu-miR-292a-5p、mmu-miR-871-3p、mmu-miR-293-5p、mmu-miR-155-3p、mmu-miR-346-5p、mmu-miR-187-5p、mmu-miR-3090-3p)。其对应的差异mRNA也出现相应的缓解(见图 5)。
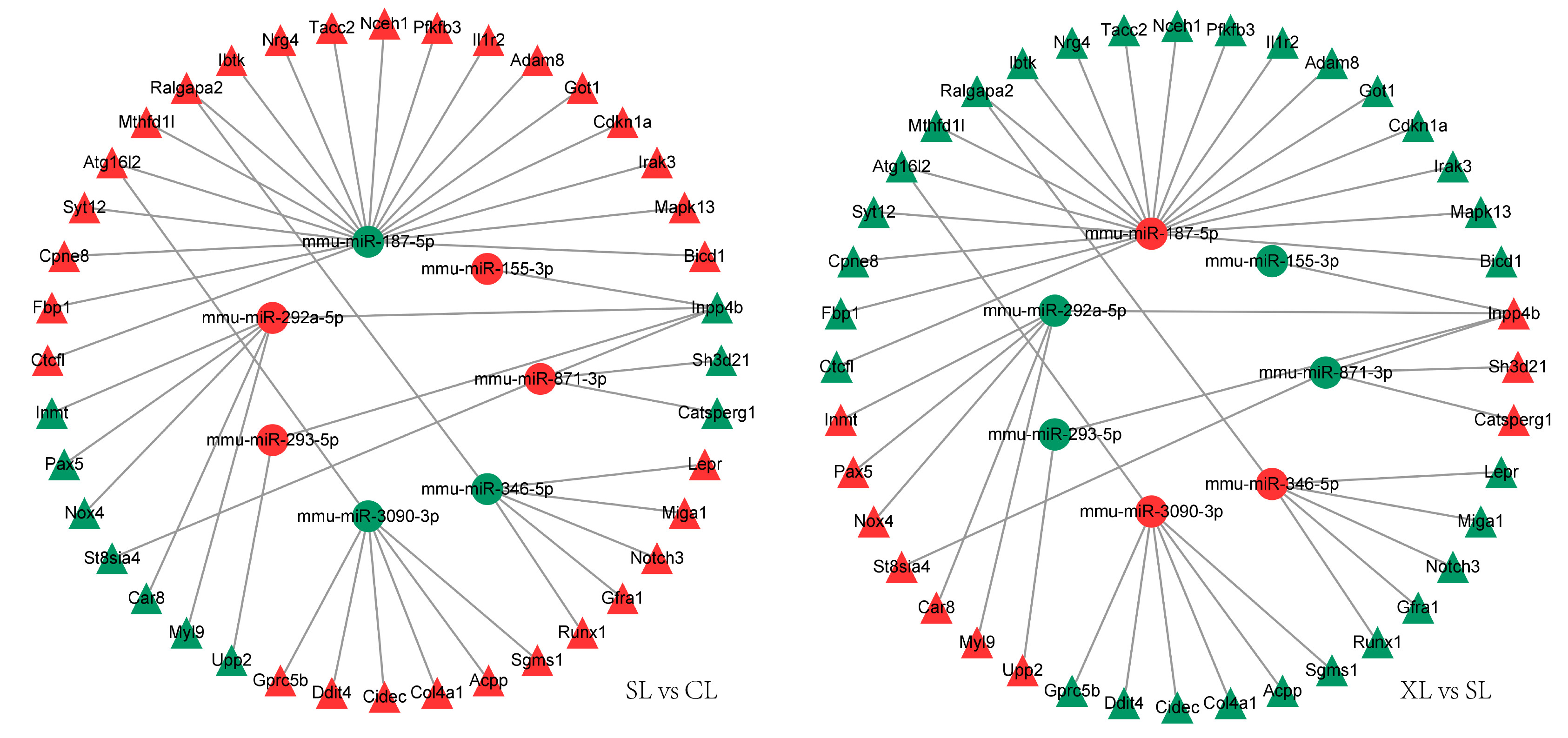
|
| 图 5 靶基因microRNA靶向差异表达的mRNA情况 Fig 5 MicroRNAs of target genes targeting differentially expressed mRNAs |
|
|
脓毒症的高发病率,高病死率,引起学者的重视。脓毒症作为一种常见病,是以感染为基础的一种综合征,临床可表现为过度炎症反应和免疫抑制共存[10]。临床观察[11]前期研究也发现犀角地黄汤对脓毒症有治疗作用[8]。犀角地黄汤作为清热解毒凉血散瘀的代表方,对脓毒性肝损伤的保护作用在本实验中也得以体现。通过对LPS诱导的脓毒症小鼠及犀角地黄汤干预的脓毒症小鼠的肝组织进行病理分析发现,犀角地黄汤可缓解肝组织结构的肿胀和空泡样变性。为了揭示其可能的机制,本研究采用microRNA联合mRNA联合分析发现:脓毒症小鼠肝组织microRNA及mRNA的表达出现明显的紊乱。经过犀角地黄汤治疗后,7个差异表达的microRNA得以纠正或缓解。即:相对于对照组,脓毒症小鼠肝组织中的上调microRNA:mmu-miR-292a-5p、mmu-miR-293-5p、mmu-miR-155-3p、mmu-miR-871-3p,在相对于脓毒症组,脓毒症犀角地黄汤治疗组小鼠肝组织中则表现为表达下调。同样,前者表达下调:mmu-miR-3090-3p、mmu-miR-346-5p、mmu-miR-187-5p,在后者中出现了表达上调的改变。说明犀角地黄汤干预后,有调节microRNA的紊乱表达。为了更进一步说明这些差异表达的microRNA是否引起靶基因表达量的改变。本研究采用microRNA联合mRNA做关联分析,发现mmu-miR-187-5p、mmu-miR-292a-5p、mmu-miR-293-5p、mmu-miR-155-3p,mmu-miR-871-3p、mmu-miR-346-5p、mmu-miR-3090-3p的差异表达,引起靶基因mRNA的差异表达,同样表现为犀角地黄汤治疗后,得到明显地缓解或纠正。
既往研究显示:miR-187的异位持续表达可减少TNF-α、IL-6和IL-12p40的产生。其作为一种IL-10依赖性miRNA,在IL-10介导的抑制因Toll样受体4激活的人单核细胞而至TNF-α、IL-6和IL-12的p40亚单位的表达[12]。miR-187通过下调IκBζ直接靶向TNF-α mRNA的稳定性和翻译,并间接降低IL-6和IL-12p40表达水平[12]。miR-187-5p作为miR-187的成熟序列,具有相类似的功能。本实验发现,脂多糖诱导的脓毒症小鼠肝组织出现mmu-miR-187-5p表达下调,在犀角地黄汤治疗后,出现明显缓解,差异有统计学意义,进而引起靶基因Adam8、Pfkfb3、Irak3、Il1r2、Bicd1、Mapk13、Cdkn1a、Got1、Nceh1、Tacc2、Nrg4、Ibtk、Ralgapa2、Mthfd1l、Atg16l2、Syt12、Cpne8、Fbp1、Ctcfl紊乱表达的缓解。
犀角地黄汤可能通过调节mmu-miR-187-5p靶向Adam8的差异表达起到抗脓毒性肝损伤的作用。
既往研究发现,在慢性阻塞性急性加重的患者研究显示血浆Adam8水平与炎症相关指标(血浆白细胞、中性粒细胞、嗜酸性粒细胞计数、急性时相蛋白)呈正相关。即患者血浆ADAM8水平越高全身炎症反应越明显[13]。同样在哮喘患者中也得到类似的结果,即患者血中的sADAM8表达水平与哮喘严重度密切相关[14]。本次实验中也发现LPS干预后,小鼠肝组织Adam8呈现表达上调,但在犀角地黄汤治疗组小鼠的肝组织得以缓解,呈现表达下调,说明犀角地黄汤可能具有抑制脓毒症小鼠肝组织ADAM8表达而起到抗脓毒性肝损伤的作用。
犀角地黄汤可能通过调节mmu-miR-187-5p靶向Pfkfb3的差异表达起到抗脓毒性肝损伤的作用。LPS刺激巨噬细胞中的糖酵解基因中,Pfkfb3(6-磷酸果糖-2-激酶/果糖-2, 6-双磷酸酶(2, 6-3)是最常见的表达上调的基因之一[15]。Pfkfb3在脂多糖(LPS)诱导的小鼠内毒素血症中的起着关键作用,抑制Pfkfb3表达可以减少巨噬细胞糖酵解和促炎因子的产生,从而改善LPS诱导的脏器损伤[16]。此外,Pfkfb3的过表达可引起巨噬细胞糖酵解的增加,表现为细胞外酸化率和乳酸生成增多,也破坏了小鼠对LPS诱导脓毒症的抵抗力[17]。另有研究显示,LPS可刺激人肺成纤维MRC-5细胞系,激活PI3K-Akt-mTOR途径,显著增加PFKFB3的表达,促进有氧糖酵解,促进胶原合成,而腹腔注射PFKFB3抑制剂可逆转LPS诱导的肺纤维化[18]。本研究发现,LPS诱导的脓毒症小鼠肝组织PFKFB3在脓毒症组显著上调,而在犀角地黄汤干预后,明显恢复。犀角地黄汤可能具有抑制脓毒症小鼠肝组织PFKFB3表达,进而起到抗脓毒性肝损伤的作用。
犀角地黄汤可能通过调节mmu-miR-187-5p靶向Irak3的差异表达起到抗脓毒性肝损伤的作用。
IRAK3(也称为IRAK-M)位于染色体12q14.3上,编码IRAK-M蛋白[19]。IRAK-3抑制NF-κB激活并负调节TLR信号[20]它是LPS诱导的经典和非经典NF-κB途径选择性抑制剂的介质[21-22]。在LPS处理的人类白细胞中,IRAK3的表达在早期反应期间增加,在LPS刺激下达到高峰且更快,这在脓毒症患者的细胞中得到证实[23]。同时研究显示IRAK3表达的增加与释放促炎细胞因子及降低脓毒症患者经LPS刺激后产生的单核细胞的能力相关,也提示预后不良[24]。此外,在脓毒性肺损伤的动物研究中发现IRAK3的上调与细胞凋亡呈正相关[25]。另有研究显示IRAK3过度表达减弱LPS诱导情况下miR-539-5p模拟物对H9c2细胞产生炎症反应及出现增殖和凋亡的影响[26]。在本研究中发现LPS干预后,IRAK3表达显著升高,经犀角地黄汤干预后显著下降。犀角地黄汤可能具有促进NF-κB激活并正调控TLR信号的作用。
脓毒症时机体不仅有过度炎症反应,也有免疫的抑制,如何达到这种平衡,仍是难题[10]。犀角地黄汤作为中药制剂,具有多靶点作用,可能在维持脓毒症小鼠恢复机体的稳态中有重要的作用。
利益冲突 所有作者声明无利益冲突
作者贡献声明 林名瑞:动物实验,实验设计,论文撰写;张翠芳、郑碧清:标本采集,数据收集;陈怀宇:动物造模;郭小艳:数据统计学分析;李玮:研究设计,论文修改
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Fleischmann-Struzek C, Mellhammar L, Rose N, et al. Incidence and mortality of hospital- and ICU-treated sepsis: results from an updated and expanded systematic review and meta-analysis[J]. Intensive Care Med, 2020, 46(8): 1552-1562. DOI:10.1007/s00134-020-06151-x |
| [3] | Savio LEB, de Andrade Mello P, Figliuolo VR, et al. CD39 limits P2X7 receptor inflammatory signaling and attenuates sepsis-induced liver injury[J]. J Hepatol, 2017, 67(4): 716-726. DOI:10.1016/j.jhep.2017.05.021 |
| [4] | Yan J, Li S, Li SL. The role of the liver in sepsis[J]. Int Rev Immunol, 2014, 33(6): 498-510. DOI:10.3109/08830185.2014.889129 |
| [5] | Strnad P, Tacke F, Koch A, et al. Liver-guardian, modifier and target of sepsis[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(1): 55-66. DOI:10.1038/nrgastro.2016.168 |
| [6] | Wang YF, Zhang YH, Jiang RL. Early traditional Chinese medicine bundle therapy for the prevention of sepsis acute gastrointestinal injury in elderly patients with severe sepsis[J]. Sci Rep, 2017, 7: 46015. DOI:10.1038/srep46015 |
| [7] | 智屹惠, 王坤根, 王灵聪. 《中国严重脓毒症/脓毒性休克治疗指南(2014)》中医药部分解读[J]. 中华危重病急救医学, 2015(6): 429-434. DOI:10.3760/cma.j.issn.2095-4352.2015.06.003 |
| [8] | 林名瑞, 文丹, 陈怀宇, 等. 犀角地黄汤对脓毒症大鼠肝组织mRNA表达的影响[J]. 中国中西医结合急救杂志, 2020, 27(6): 749-756. DOI:10.3969/j.issn.1008-9691.2020.06.028 |
| [9] | Rathkey J, Zhao J, Liu Z, et al. Chemical disruption of the pyroptotic pore-forming protein gasdermin D inhibits inflammatory cell death and sepsis[J]. Sci Immunol, 2018, Aug 24;3(26): eaat2738. DOI: 10.1126/sciimmunol.aat2738. |
| [10] | van der Poll T, Shankar-Hari M, Wiersinga WJ. The immunology of sepsis[J]. Immunity, 2021, 54(11): 2450-2464. DOI:10.1016/j.immuni.2021.10.012 |
| [11] | Wang Y, Zhang Y, Jiang R. Early traditional Chinese medicine bundle therapy for the prevention of sepsis acute gastrointestinal injury in elderly patients with severe sepsis[J]. Rep, 2017, 7: 46015. DOI:10.1038/srep46015 |
| [12] | Rossato M, Curtale G, Tamassia N, et al. IL-10-induced microRNA-187 negatively regulates TNF-α, IL-6, and IL-12p40 production in TLR4-stimulated monocytes[J]. Proc Natl Acad Sci USA, 2012, 109(45): E3101-E3110. DOI:10.1073/pnas.1209100109 |
| [13] | 宋鹏飞. 血浆ADAM8水平在COPD分期及严重度评估中临床意义[D]. 苏州: 苏州大学, 2018. |
| [14] | 林琳. 支气管哮喘患者外周血ADAM8的检测及其临床意义分析[D]. 广州: 南方医科大学, 2010. |
| [15] | Rodriguez AE, Ducker GS, Billingham LK, et al. Serine metabolism supports macrophage IL-1β production[J]. Cell Metab, 2019, 29(4): 1003-1011.e4. DOI:10.1016/j.cmet.2019.01.014 |
| [16] | Xu JA, Wang LN, Yang QH, et al. Deficiency of myeloid Pfkfb3 protects mice from lung edema and cardiac dysfunction in LPS-induced endotoxemia[J]. Front Cardiovasc Med, 2021, 8: 745810. DOI:10.3389/fcvm.2021.745810 |
| [17] | Wang ZH, Kong L, Tan SY, et al. Zhx2 accelerates sepsis by promoting macrophage glycolysis via Pfkfb3[J]. J Immunol, 2020, 204(8): 2232-2241. DOI:10.4049/jimmunol.1901246 |
| [18] | Hu XT, Xu QY, Wan HX, et al. PI3K-Akt-mTOR/PFKFB3 pathway mediated lung fibroblast aerobic glycolysis and collagen synthesis in lipopolysaccharide-induced pulmonary fibrosis[J]. Lab Invest, 2020, 100(6): 801-811. DOI:10.1038/s41374-020-0404-9 |
| [19] | Freihat LA, Wheeler JI, Wong A, et al. IRAK3 modulates downstream innate immune signalling through its guanylate cyclase activity[J]. Sci Rep, 2019, 9(1): 15468. DOI:10.1038/s41598-019-51913-3 |
| [20] | Kobayashi K, Hernandez LD, Galán JE, et al. IRAK-M is a negative regulator of Toll-like receptor signaling[J]. Cell, 2002, 110(2): 191-202. DOI:10.1016/s0092-8674(02)00827-9 |
| [21] | Escoll P, del Fresno C, García L, et al. Rapid up-regulation of IRAK-M expression following a second endotoxin challenge in human monocytes and in monocytes isolated from septic patients[J]. Biochem Biophys Res Commun, 2003, 311(2): 465-472. DOI:10.1016/j.bbrc.2003.10.019 |
| [22] | Su JM, Zhang TL, Tyson J, et al. The interleukin-1 receptor-associated kinase M selectively inhibits the alternative, instead of the classical NFkappaB pathway[J]. J Innate Immun, 2009, 1(2): 164-174. DOI:10.1159/000158541 |
| [23] | Asmussen A, Fink K, Busch HJ, et al. Inflammasome and toll-like receptor signaling in human monocytes after successful cardiopulmonary resuscitation[J]. Crit Care, 2016, 20(1): 170. DOI:10.1186/s13054-016-1340-3 |
| [24] | Lu X, Xue L, Sun W, et al. Identification of key pathogenic genes of sepsis based on the Gene Expression Omnibus database[J]. Mol Med Rep, 2018, 17(2): 3042-3054. DOI:10.3892/mmr.2017.8258 |
| [25] | Pino-Yanes M, Ma SF, Sun XG, et al. Interleukin-1 receptor-associated kinase 3 gene associates with susceptibility to acute lung injury[J]. Am J Respir Cell Mol Biol, 2011, 45(4): 740-745. DOI:10.1165/rcmb.2010-0292OC |
| [26] | Hu XC, Miao HJ. miR-539-5p inhibits the inflammatory injury in septic H9c2 cells by regulating IRAK3[J]. Mol Biol Rep, 2022, 49(1): 121-130. DOI:10.1007/s11033-021-06849-1 |
 2022, Vol. 31
2022, Vol. 31




