急性胰腺炎(acute pancreatitis, AP)是胰腺的一种急性炎症性疾病,对临床医生提出了一些挑战,其中最主要的方面包括患者临床表现和疾病过程的可能不断变化。虽然AP患者最初可能表现为轻症疾病,但可能会迅速发展为危重疾病[1]。目前,在为AP患者制定的管理策略中的一个主要不足是缺乏一种被广泛接受的方法来监测疾病活动性,而且大多干预性研究主要针对被预测为重症AP的患者[2-4]。预测疾病严重程度的评分系统在AP领域占主导地位,然而定量评分系统在研究中包含患者的整体生理状态是有局限性的。为改变这一现状,一组国际专家制定胰腺炎活动性评分系统(pancreatitis activity scoring system, PASS),旨在为AP患者的疾病活动性提供一个客观的测量工具[5]。验证任何新的疾病评估工具的关键一步是评估评分系统和临床结果之间的关系。该研究的目的是评估AP患者的PASS与一些重要临床结果之间的关系。此外,本研究试图确定入院时PASS的特定阈值,为在临床实践和研究环境中应用该评分系统提供一个标准。
1 资料与方法 1.1 一般资料前瞻性收集2020年1月至2021年6月安徽医科大学第一附属医院急诊科收治入院且病例资料完整的AP患者,根据美国2012年Atlanta标准[6]分为轻症急性胰腺炎(mild acute pancreatitis, MAP)组、中度重症急性胰腺炎(moderate severe acute pancreatitis, MSAP)和重症急性胰腺炎(severe acute pancreatitis, SAP)组。
纳入标准:所有患者均符合AP相关指南推荐诊断[7]。排除标准:(1)慢性胰腺炎急性发作或复发;(2)年龄≤18岁、妊娠、哺乳期患者;(3)伴有恶性肿瘤或慢性肝、肾、心脏功能衰竭者;(4)已在外院接受治疗或资料不完整者。
本研究通过医院伦理委员会批准(PJ2021-14-36),所有入选患者均知情同意。
1.2 PASS评分工具PASS评分系统是通过系统地分析文献综述来确定潜在的参数,然后由一组国际专家使用先前报道的改进的德尔菲过程来选择参数制定[5]。PASS评分系统的标志物列表确定为与AP评估高度相关的五个参数:器官衰竭、全身炎症反应综合征(systemic inflammatory response syndrome score, SIRS)、腹痛、镇痛需求和口服耐受性,并且PASS评分系统对五个临床上重要的参数应用定量权重。给出PASS评分系统各个组成部分的具体计算方法,见表 1。
| 各项参数 | 权重 | 备注 |
| 器官衰竭 | ×100 | 对于各个系统 |
| SIRS | ×25 | 对于各项指标 |
| 腹痛(0~10) | ×5 | |
| 吗啡当量(mg) | ×5 | |
| 耐受固体饮食(是=0,否=1) | ×40 | |
| 注:SIRS为全身炎症反应综合征;器官衰竭的定义为改良Marshall评分或SOFA评分≥2分 | ||
收集纳入患者一般资料、饮酒史、吸烟史、门诊用药情况、体重指数、胰腺炎病因、生命体征、实验室检查结果、生化参数,收集抗生素的使用情况、全肠外营养的开始、局部并发症的发生情况、住院时间和开始口服饮食的时间,计算入院时SIRS评分、Ranson评分、床旁急性胰腺炎严重度指数(bedside index for severity in acute pancreatitis, BISAP)评分、急性生理与慢性健康(acute physiology and chronic health evaluation, APACHE)Ⅱ评分,及入院及住院期间每12 h的PASS评分。
1.4 统计学方法所有数据采用SPSS 23.0统计学软件进行分析处理。连续性变量采用均数±标准差(x±s)表示,分类变量则通过频数(率)表示。正态分布变量使用独立样本t检验、分类变量使用卡方检验或Fisher确切概率法;偏态分布的变量侧使用Mann-Whitney U检验进行均数比较。通过描述受试者操作特性曲线(receiver operating characteristic, ROC)进一步得出PASS最佳截断值、敏感度和特异度。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者的一般临床资料共348例符合纳入标准,其中11例患者信息不完善,26例由于个人原因无法继续配合治疗,10例患者在院治疗时间 < 48 h而被排除,最终纳入301例患者,其中MAP组157例,MSAP和SAP组144例。其中AP的病因主要为胆道疾病和高甘油三酯血症。
两组患者年龄、性别、体重指数、病因、既往史等基线资料比较差异均无统计学意义(P>0.05),说明两组患者基线资料均衡,具有可比性。与MAP组比较,MSAP和SAP组Ranson评分、BISAP评分、APACHE Ⅱ评分、入院时PASS评分、入院12 h PASS评分、入院24 h PASS评分、入院36 h PASS评分、入院48 h PASS评分差异有统计学意义(P < 0.05),见表 2。
| 指标 | MAP组(n=157) | MSAP和SAP组(n=144) | t/Z/χ2值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 46.11±15.48 | 49.86±18.01 | -1.927 | 0.055 |
| 男性b | 89(56.7) | 81(56.3) | 0.006 | 0.516 |
| 体重指数(kg/m2)a | 24.11±2.21 | 24.64±2.38 | -2.000 | 0.053 |
| 病因b | ||||
| 胆道疾病 | 64(40.5) | 60(41.7) | 0.025 | 0.874 |
| 高甘油三酯血症 | 40(25.3) | 35(24.3) | 0.055 | 0.814 |
| 既往史b | ||||
| 吸烟史 | 16(10.2) | 14(9.8) | 0.018 | 0.892 |
| 饮酒史 | 27(17.1) | 24(16.7) | 0.015 | 0.902 |
| 糖尿病史 | 22(14.0) | 20(13.9) | 0.001 | 0.975 |
| 入院时危险分层a | ||||
| Ranson评分 | 2.31±1.34 | 4.00±2.14 | -8.144 | < 0.001 |
| BISAP评分 | 2.15±0.99 | 3.20±0.98 | -9.223 | < 0.001 |
| APACHEⅡ评分 | 6.51±1.90 | 9.54±3.52 | -9.187 | < 0.001 |
| PASS评分c | ||||
| 入院时 | 100(70, 130) | 160(140, 237) | -10.546 | < 0.001 |
| 入院12 h | 100(70, 130) | 160(140, 230) | -10.124 | < 0.001 |
| 入院24 h | 100(70, 130) | 160(140, 230) | -10.216 | < 0.001 |
| 入院36 h | 100(70, 130) | 165(140, 230) | -10.270 | < 0.001 |
| 入院48 h | 100(70, 130) | 165(140, 230) | -10.313 | < 0.001 |
| 注:BISAP评分为床旁急性胰腺炎严重度指数评分,APACHE Ⅱ评分为急性生理与慢性健康评分,PASS评分为胰腺炎活动性评分系统;a为x±s,b为(例,%),c为M(Q1,Q3) | ||||
在评价指标的比较中,入院时的PASS评分的预测效果最佳,ROC曲线下面积0.851,在140处取得最佳截断值,敏感度为67.4%,特异度为87.3%。入院12 h、24 h、36 h、48 h PASS评分也拥有较好的预测效果,AUC分别为0.837、0.840、0.842、0.843,见表 3。
| 指标 | AUC(95%CI) | 最佳截断值 | 敏感度(%) | 特异度(%) |
| 入院时PASS评分 | 0.851(0.806~0.889) | 140 | 67.4 | 87.3 |
| 入院12 h PASS评分 | 0.837(0.792~0.882) | 140 | 76.4 | 77.1 |
| 入院24 h PASS评分 | 0.840(0.795~0.885) | 140 | 75.4 | 77.5 |
| 入院36 h PASS评分 | 0.842(0.797~0.887) | 135 | 76.3 | 78.2 |
| 入院48 h PASS评分 | 0.843(0.799~0.888) | 130 | 77.8 | 76.3 |
| 注:PASS为胰腺炎活动性评分系统 | ||||
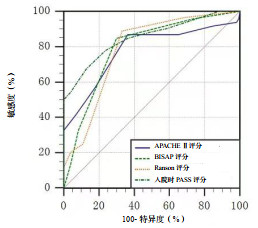
采用ROC曲线分析入院时PASS评分、BISAP评分、Ranson评分、APACHE Ⅱ评分对MSAP和SAP组的诊断价值。入院时PASS评分最佳临界值为140时,AUC为0.851,敏感度为67.4%,特异度为87.3%,与其他指标相比,AUC结果较好且差异有统计学意义(P < 0.05),见表 4、图 1。
| 指标 | AUC(95%CI) | 最佳截断值 | 敏感度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) |
| 入院时PASS评分 | 0.851(0.806~0.889) | 140 | 67.4 | 87.3 | 82.906 | 74.457 |
| 入院时BISAP评分 | 0.792(0.742~0.837) | 3 | 84.7 | 70.1 | 54.331 | 87.234 |
| 入院时Ranson评分 | 0.786(0.735~0.831) | 3 | 88.9 | 66.9 | 56.275 | 90.741 |
| 入院时APACHE Ⅱ评分 | 0.780(0.728~0.825) | 8 | 86.8 | 63.7 | 65.104 | 82.569 |
| 注:PASS为胰腺炎活动性评分系统,BISAP评分为床旁急性胰腺炎严重度指数评分,APACHE Ⅱ评分为急性生理与慢性健康评分 | ||||||
|
| APACHE Ⅱ评分为急性生理与慢性健康评分,BISAP评分为床旁急性胰腺炎严重度指数评分,PASS评分为胰腺炎活动性评分系统 图 1 入院时PASS评分、APACHE Ⅱ评分、Ranson评分、BISAP评分的ROC曲线 |
|
|
AP作为最常见的急性消化系统疾病之一,可根据病情严重程度分为MAP、MSAP或SAP,MAP预后良好,重症则会引起严重生理功能紊乱,同时出现SIRS,并发多器官功能损害,病死率可达30%以上[8]。因此,及时有效地评估AP病情的严重程度,尽早干预,可以降低进展为SIRS的风险,预防严重并发症,并降低胰腺炎的病死率,对疾病转归预后有至关重要的作用[9]。
2012年,美国国立卫生研究院召集的一个国际专家小组得出结论,尽管目前对AP潜在的机制途径的理解有所改善,但在新的临床治疗方法方面仍缺乏进展[10]。除了缺乏新的治疗方法,该领域还缺乏一个标准化的定量系统来衡量AP过程中任何特定时间的疾病活动性。评分系统为目前临床上判断AP严重程度的重要手段,然而一项大数据前瞻性研究显示,现行的AP评分系统在预测持续脏器功能衰竭方面效果相似, 且效能一般[11]。PASS评分系统是通过改进的德尔菲方法由国际专家组推导出来的,该评分系统的出现是基于对监测AP患者病情的客观手段的需求,因此专门纳入了患者临床中使用的参数。改进后的德尔菲方法确定了五个部分(器官衰竭、SIRS、腹痛、阿片类药物需求和口服耐受固体饮食)为AP患者临床评估中使用的常规参数。
自最初的Ranson评分以来,已经开发了许多预后评分系统,但PASS与用于定义AP疾病严重程度的分类系统是有所区别的,PASS是一种用于客观测量AP的实时疾病活动情况,且可用于整个住院治疗期间的评分指标[12-14]。PASS与之前严重性评分的区别是对疾病活动的动态反映。AP中定义的严重程度是固定的状态或结果,一旦患者满足SAP的标准,则为患有SAP。相反,PASS能够反映整个病程中会出现波动。自限性疾病患者(住院天数 < 3 d)的PASS往往会迅速下降,病程较长(住院天数>7 d)的患者PASS在疾病的全程居高不下。由此可见,PASS旨在使临床医生能够动态地监测患者的病程,以帮助指导临床医生是否需要进一步监测或治疗,以便做出适合的决定。
PASS最初是在两项来自美国加州中部和南部地区的研究中进行评估的[5, 15]。因此,需要对来自不同地区的患者进行独立大规模调查,以确定PASS在分布于不同临床环境的异质队列中的适用性。
本研究的AP患者队列中,PASS可以动态预测AP的严重程度、重症监护病房转入、局部并发症和SIRS进展、住院时间和营养耐受情况。MSAP和SAP患者在整个住院期间的PASS分值较高。入院时PASS分值>140分的患者更易进展为MSAP和SAP,敏感度为67.4%,特异度为87.3%,AUC为0.851;入院后12 h、24 h、36 h、48 h的PASS分值也可预测MSAP和SAP进展。
PASS是新的监测系统,基于患者的观察性综合指标(器官衰竭、SIRS、腹痛、镇痛需求和口服耐受性),与既往的评分体系相比,临床医生更易获得,更方便临床评估。鉴于PASS与AP临床病程的多个方面的相关性,PASS是一种很有前途的评估治疗反应以及疾病预后的工具。同时本研究证明,PASS可确定AP的病情严重程度,当入院时PASS评分>140时,应警惕AP发展为SAP的可能。
本研究存在一定的局限性。作为一项单中心前瞻性研究,样本量较小;而且对于PASS中指数存在临床医生的主观性差异。虽然已经进行了良好的统计学分析,但仍需要进行多中心、大样本的前瞻性研究进一步证实。
综上所述,在本研究的AP患者的队列中,PASS在识别多个不良住院结局风险增加的患者方面表现良好,是定量评估AP患者疾病活动性的一个很有前途的评分系统,此外,本研究确定PASS的特定阈值,为在临床实践和研究环境中应用该评分系统提供一个标准。
利益冲突 所有作者声明无利益冲突
作者贡献声明 笪伟、张剑林:实验操作、论文撰写;杨文蓓:数据收集及整理、统计学分析;王兴宇、俞凤、张泓:研究设计、论文修改
| [1] | 中华医学会急诊分会, 京津冀急诊急救联盟, 北京医学会急诊分会, 等. 急性胰腺炎急诊诊断及治疗专家共识[J]. 中华急诊医学杂志, 2021, 30(2): 161-172. DOI:10.3760/cma.j.issn.1671-0282.2021.02.005 |
| [2] | Vege SS, Atwal T, Bi Y, et al. Pentoxifylline treatment in severe acute pancreatitis: a pilot, double-blind, placebo-controlled, randomized trial[J]. Gastroenterology, 2015, 149(2): 318-320.e3. DOI:10.1053/j.gastro.2015.04.019 |
| [3] | Isenmann R, Rünzi M, Kron M, et al. Prophylactic antibiotic treatment in patients with predicted severe acute pancreatitis: a placebo-controlled, double-blind trial[J]. Gastroenterology, 2004, 126(4): 997-1004. DOI:10.1053/j.gastro.2003.12.050 |
| [4] | Bakker OJ, van Brunschot S, van Santvoort HC, et al. Early versus on-demand nasoenteric tube feeding in acute pancreatitis[J]. N Engl J Med, 2014, 371(21): 1983-1993. DOI:10.1056/NEJMoa1404393 |
| [5] | Wu BU, Batech M, Quezada M, et al. Dynamic measurement of disease activity in acute pancreatitis: the pancreatitis activity scoring system[J]. Am J Gastroenterol, 2017, 112(7): 1144-1152. DOI:10.1038/ajg.2017.114 |
| [6] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis - 2012: revision of the Atlanta classification and definitions by international concensus[J]. Ann Clin Biochem, 2013, 50(2): 182. DOI:10.1177/0004563213480712 |
| [7] | Crockett SD, Wani S, Gardner TB, et al. American gastroenterological association institute guideline on initial management of acute pancreatitis[J]. Gastroenterology, 2018, 154(4): 1096-1101. DOI:10.1053/j.gastro.2018.01.032 |
| [8] | van Dijk SM, Hallensleben NDL, van Santvoort HC, et al. Acute pancreatitis: recent advances through randomised trials[J]. Gut, 2017, 66(11): 2024-2032. DOI:10.1136/gutjnl-2016-313595 |
| [9] | Chatila AT, Bilal M, Guturu P. Evaluation and management of acute pancreatitis[J]. World J Clin Cases, 2019, 7(9): 1006-1020. DOI:10.12998/wjcc.v7.i9.1006 |
| [10] | Pasca di Magliano M, Forsmark C, Freedman S, et al. Advances in acute and chronic pancreatitis: from development to inflammation and repair[J]. Gastroenterology, 2013, 144(1): e1-e4. DOI:10.1053/j.gastro.2012.11.018 |
| [11] | Mounzer R, Langmead CJ, Wu BU, et al. Comparison of existing clinical scoring systems to predict persistent organ failure in patients with acute pancreatitis[J]. Gastroenterology, 2012, 142(7) 1476-1482; quize15-6. DOI:10.1053/j.gastro.2012.03.005 |
| [12] | Mounzer R, Langmead CJ, Wu BU, et al. Comparison of existing clinical scoring systems to predict persistent organ failure in patients with acute pancreatitis[J]. Gastroenterology, 2012, 142(7): 1476-1482. DOI:10.1053/j.gastro.2012.03.005 |
| [13] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [14] | Dellinger EP, Forsmark CE, Layer P, et al. Determinant-based classification of acute pancreatitis severity: an international multidisciplinary consultation[J]. Ann Surg, 2012, 256(6): 875-880. DOI:10.1097/SLA.0b013e318256f778 |
| [15] | Buxbaum J, Quezada M, Chong B, et al. The Pancreatitis Activity Scoring System predicts clinical outcomes in acute pancreatitis: findings from a prospective cohort study[J]. Am J Gastroenterol, 2018, 113(5): 755-764. DOI:10.1038/s41395-018-0048-1 |
 2022, Vol. 31
2022, Vol. 31




