创伤性脑外伤(traumatic brain injury,TBI)随着人口增长、老龄化、机动车辆使用增加,战争车祸等大型灾难事件的发生,TBI发病率逐年增加[1],是高致残率和高病死率的一类疾病[2]。通过格拉斯哥昏迷量表[3]将TBI分为轻度(GCS 14~15),中度(GCS 9~13)和重度(GCS 4~8)[4],重度TBI病死率高达30%~40%[5]。TBI最初是原发性机械损伤,导致脑实质受损、血管损伤出血等。继发性损伤每年影响着全球约6 900余万人,导致的认知功能障碍、感觉功能障碍、睡眠中断和癫痫发作等不良后果,大多数在TBI发生后数月或数年由继发性损伤引起[6],涉及的病理生理机制包括兴奋性氨基酸毒性、氧化应激、线粒体功能障碍、血脑屏障破坏、神经炎症以及变性等[7]。TBI的原发损伤难以逆转,深入了解继发性损伤的发生机制对于防治TBI继发性损伤至关重要[6]。
新近研究表明,外泌体是细胞间传递信号的细胞外囊泡[8],星型胶质细胞通过向小胶质细胞分泌外泌体,运输蛋白质(例如细胞因子或生长因子)和非编码RNA(LncRNA, miRNA, ceRNA)[9],对神经炎症起调控作用。小胶质细胞是中枢神经系统常驻免疫细胞,具有吞噬和呈递抗原的能力[10]。在TBI后,小胶质细胞迅速激活,在继发神经免疫炎症反应中起关键作用[11]。经典学说认为小胶质细胞具有两极性,与促炎功能相关的经典激活状态(M1表型)以及与抗炎特性相关的替代状态(M2表型)[12],M1型小胶质细胞分泌多种炎症因子(IL-1β、INF-γ),M2表型释放抗炎细胞因子(IL-10、Arg1),小胶质细胞M1/M2表型同时存在、相互转化。有研究发现,一些miRNA参与小胶质细胞的表型转化,miR-155促进小胶质细胞向M1(促炎)表型转化[13],而miR-124则促进小胶质细胞向M2(抗炎)表型转化[14]。因此,小胶质细胞M1/M2表型转化很可能是改善TBI不良预后的切入点。
本课题组采用TBI小鼠和细胞模型,研究miR-122-5p在TBI小鼠和细胞模型中的表达变化以及对小胶质细胞极化的作用,探究miR-122-5p对小胶质细胞表型转化和细胞凋亡的影响,为未来防治TBI继发损伤提供新的策略靶点。
1 材料与方法 1.1 小鼠TBI模型和实验分组动物实验经武汉大学人民医院实验动物福利与伦理委员会批准(批准号WDRY IACUC 20210510)。实验动物选用C57BL/6成年雄性小鼠(10~12周龄,体重22~25 g),饲养环境温度控制在(23±2)℃,自然照明,自由饮水进食,将50只动物随机(随机数字法)分组:假手术组(n=20)用于提取脑组织总RNA; TBI组(n=30),用于制备脑提取物(n=10)及提取脑组织总RNA(n=20)。采用单盲法进行数据收集和分析。
TBI组用2.5%~3.5%异氟烷(异氟烷由武汉大学人民医院动物房提供)麻醉,将鼠头部固定,正中直切口,分离肌肉和骨膜,在前囟右侧前方距中线2 mm处用颅骨磨钻(廊坊宏兰顺仪器设备有限公司,中国)钻开骨窗, 保证骨窗直径在3 mm,暴露脑膜。使用直径5 mm BW-ZYQ精细颅脑撞击仪(软隆科技公司,上海,中国),对准骨窗以3.5 m/s速度,500 ms的停留时间对小鼠进行2 mm深度的单侧、适度控制的皮质冲击(moderately controlled cortical impact, CCI)。棉球按压止血, 缝合伤口。假手术组麻醉后打开颅骨暴露脑膜,随后缝合伤口。
1.2 制备TBI组脑提取物C57BL/6小鼠TBI造模24 h后用2.5%~3.5%异氟烷麻醉,取小鼠大脑皮层置于玻璃管内,加入4 mL完全培养基(赛维尔生物,武汉,中国),用玻璃研磨棒充分研磨后1000 r/min离心10 min,取上清液分装于1.5 mL EP管,-80 ℃保存以备后续实验使用。
1.3 原代星形胶质细胞培养将出生1~2 d C57BL/6乳鼠的大脑组织取出,切成1 mm3大小并置于预冷的PBS(赛维尔生物,武汉,中国)中。用0.25% 胰蛋白酶(赛维尔生物,武汉,中国)消化10 min,将细胞悬液通过70 mm细胞过滤器,并用含有10% 胎牛血清(FBS)(赛维尔生物,武汉,中国)和1% 青霉素/链霉素(赛维尔生物,武汉,中国)的DMEM培养基(赛维尔生物,武汉,中国)结束消化。通过离心收集细胞并接种到培养瓶中。培养10~14 d后,37 ℃恒温摇床(SHELLAB公司,美国)220 r/min振荡40 min弃上清液,去除星形胶质细胞中的小胶质细胞; 220 r/min振荡18 h去除剩余的少突胶质细胞。使培养瓶中星形胶质细胞纯度 > 90%。星形胶质细胞在DMEM中培养用于后续实验。
1.4 体外TBI模型星形胶质细胞分泌外泌体miRNA微阵列分析miRNA微阵列分析由GeneChem(中国上海)进行。将星形胶质细胞分为TBI组和CON组,TBI组用TBI小鼠的脑提取物刺激24 h,CON组加入等量的DMEM完全培养基。通过超速离心提取星形胶质细胞分泌的外泌体。
文库构建:利用small RNA的3’及5’端特殊结构(5’端有完整的磷酸基团,3’端有羟基),分别在两端连接接头; 经过逆转录合成cDNA,随后进行PCR扩增; 使用PAGE凝胶电泳分离纯化目标DNA片段,通过切胶回收得到特定大小small RNA文库。
文库质检:使用Kapa qPCR定量,精确定量文库浓度; 使用Agilent 4200 TapeStation检测,精确检测文库片段大小。
上机测序:库检合格后,将不同文库按照有效浓度及目标下机数据量的需求集中后进行Illumina测序。
1.5 BV2细胞培养,转染和LPS刺激BV2小胶质细胞在含有10%胎牛血清,1%青霉素和链霉素的DMEM完全培养基中培养,培养箱参数设置为5% CO2,37 ℃。以3×105细胞/孔接种至6孔板。
miR-122-5p抑制剂及其阴性对照物(Negetive Control, NC)购自锐博生物(广州,中国)。根据制造商提供的说明书使用RiboFECT™ CP(锐博生物,广州,中国)将它们溶解和稀释,配置成终浓度为100 nmol/L的miR-122-5p抑制剂或NC抑制剂工作液加入BV2小胶质细胞中。BV2细胞转染后使用脂多糖(赛维尔生物,武汉,中国)刺激(来自大肠杆菌的LPS; 100 ng/mL)24 h。
细胞实验分组:对照组(CON组)、脂多糖组(LPS组)、脂多糖+miR-122-5p抑制剂组(LPS+ miR-122 inhibitor组)、脂多糖+miR-122-5p抑制剂阴性对照组(LPS+miR-122 inhibitor NC组)。
1.6 实时定量PCR使用TRIzol试剂提取TBI造模小鼠坏死区和水肿区的脑组织,以及LPS诱导的小胶质细胞总RNA,根据试剂说明书采用Prime Script TM RT试剂盒(赛默飞,美国)将其逆转录成cDNA。使用SYBR GREEN Mix反应体系(赛维尔生物,武汉,中国)、正向引物、反向引物、cDNA进行实时荧光定量PCR扩增基因产物。U6 snRNA作为miR-122-5p的内参,GAPDH作为其他mRNA的内参,进行半定量分析。数据采用2-ΔΔCt方法进行分析。实验使用引物均由上海生工生物工程有限公司设计合成,引物序列见表 1。
| 基因名称 | 引物序列 |
| miR-122-5p | Forward, GAAAGACCTGGTGACATCACTA |
| Reverse, GTCTTTTGTTGCTGTACTCGTT | |
| NLRP3 | Forward, GCCGTCTACGTCTTCTTCCTTTCC |
| Reverse, CATCCGCAGCCAGTGAACAGAG | |
| GAPDH | Forward, AGGTCGGTGTGAACGGATTTG |
| Reverse, GGGGTCGTTGATGGCAACA | |
| U6 | Forward, CTCGCTTCGGCAGCACATATACT |
| Reverse, ACGCTTCACGAATTTGCGTGTC |
取上述各组小胶质细胞,制作细胞爬片。4%多聚甲醛固定30 min后,0.5%的Triton-X 100进行破膜处理20 min, 再用含0.3%的BSA溶液封闭30 min。按照试剂盒说明书步骤加入TUNEL反应混合液(大连美仑生物,大连,中国),37 ℃下避光孵育1 h,避光洗涤后使用DAPI染色液复染细胞核5 min。使用抗荧光淬灭封片剂封片,在荧光显微镜下进行观察拍照。
1.8 免疫荧光染色将细胞爬片用PBS洗涤,4%多聚甲醛(赛维尔生物,武汉,中国)固定30 min, 使用0.5%的Triton X - 100(赛维尔生物,武汉,中国)进行破膜处理20 min, 再用含3%的牛血清蛋白(BSA)溶液(赛维尔生物,武汉,中国)封闭30 min, 每次步骤间用PBS洗涤3遍。与Iba1、Arg1或iNOS抗体(Affinity,江苏,中国)在4 ℃下孵育过夜,然后与偶联的荧光二抗(赛维尔生物,武汉,中国)在室温下避光孵育1 h。用PBS洗涤3次后,DAPI(赛维尔生物,武汉,中国)孵育3 min,然后用抗荧光淬灭封片剂(赛维尔生物,武汉,中国)固定。用Olympus倒置荧光显微镜(Olympus,东京,日本)拍摄免疫荧光图像,用Image J计数阳性细胞百分比。
1.9 Western蛋白印迹分析使用RIPA裂解缓冲液(上海碧云天生物技术公司,中国)从细胞中提取总蛋白,计算各组蛋白浓度。在10%或12%分离凝胶(赛维尔生物,武汉,中国)中电泳90 min,用PVDF膜转膜,5%BSA室温下封闭1 h。然后,将封闭好的PVDF膜分别与一抗p-NKκB(1∶1000)、ASC(1∶1000)(Cell Signaling,美国)、NKκB(1∶1000)、pro-caspase1+p12(1∶1000)(abcam,英国)、NLRP3(1∶1000)(Affinity,江苏,中国)、β-actin(1∶2000)(赛维尔生物,武汉,中国)在4 ℃孵育过夜。使用TBST(赛维尔生物,武汉,中国)洗涤3次,加入辣根过氧化物酶标记的抗兔或小鼠抗体(1∶2000)(赛维尔生物,武汉,中国)在室温下孵育2 h,TBST再次洗涤后,使用ECL(赛维尔生物,武汉,中国)进行显影。最后使用Image J分析蛋白条带。
1.10 统计学方法使用Prism 7软件(GraphPad, LaJolla, CA, USA) 进行统计分析。符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,多组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 TBI小鼠模型及星形胶质细胞外泌体中miR-122-5p表达量显著下降从体外TBI模型的星形胶质细胞上清液中提取外泌体,采用microRNA微阵列分析,结果提示与对照组相比,TBI组外泌体中有216个miRNA显著改变,其中83个miRNA下调,133个miRNA上调。表 2显示通过差异表达分析,改变最显著的40个miRNA(20个显著上调和20个显著下调)。
| AccID | Log2FC | P-value | FDR | Regulation |
| mmu-miR-2136 | -7.422870806 | 2.33E-11 | 1.85E-09 | down |
| mmu-miR-3535 | -6.872327025 | 1.08E-09 | 6.89E-08 | down |
| mmu-miR-3572-3p | -6.30665677 | 1.74E-09 | 9.24E-08 | down |
| mmu-miR-3473b | -6.02629957 | 8.99E-09 | 3.82E-07 | down |
| mmu-miR-450a-1-3p | -6.001768179 | 5.29E-06 | 9.10E-05 | down |
| mmu-miR-2137 | -4.523875489 | 5.69E-06 | 9.54E-05 | down |
| mmu-miR-3967 | -5.06017921 | 1.36E-05 | 1.89E-04 | down |
| mmu-miR-18a-5p | -4.884512831 | 1.52E-05 | 2.06E-04 | down |
| mmu-miR-122-5p | -4.057926101 | 1.59E-05 | 2.11E-04 | down |
| mmu-miR-208b-5p | -4.408645493 | 1.66E-05 | 2.11E-04 | down |
| mmu-miR-142a-5p | -4.04159107 | 1.83E-05 | 2.28E-04 | down |
| mmu-miR-207 | -4.184573074 | 2.20E-05 | 2.55E-04 | down |
| mmu-miR-144-3p | -3.995520133 | 3.33E-05 | 3.36E-04 | down |
| mmu-miR-17-5p | -3.772076554 | 5.75E-05 | 5.31E-04 | down |
| mmu-miR-223-3p | -3.72105691 | 5.94E-05 | 5.41E-04 | down |
| mmu-miR-10a-3p | -3.768920711 | 6.58E-05 | 5.91E-04 | down |
| mmu-miR-3963 | -3.797793941 | 8.28E-05 | 7.23E-04 | down |
| mmu-miR-494-3p | -3.629728368 | 8.45E-05 | 7.27E-04 | down |
| mmu-miR-15b-5p | -3.563407895 | 1.08E-04 | 8.69E-04 | down |
| mmu-miR-5121 | -3.703471849 | 1.18E-04 | 9.18E-04 | down |
| mmu-miR-124-3p | 10.41682065 | 1.68E-16 | 1.07E-13 | up |
| mmu-miR-137-3p | 10.74405882 | 7.09E-16 | 2.26E-13 | up |
| mmu-miR-124-5p | 8.950523841 | 9.44E-14 | 2.00E-11 | up |
| mmu-miR-873a-3p | 14.1461834 | 2.87E-13 | 4.58E-11 | up |
| mmu-miR-138-5p | 7.994138771 | 4.08E-12 | 5.19E-10 | up |
| mmu-miR-219a-2-3p | 8.467160424 | 6.12E-12 | 6.50E-10 | up |
| mmu-miR-873a-5p | 13.25174977 | 1.32E-11 | 1.20E-09 | up |
| mmu-miR-128-3p | 6.607399496 | 4.27E-10 | 3.02E-08 | up |
| mmu-miR-666-5p | 7.93051656 | 1.72E-09 | 9.24E-08 | up |
| mmu-miR-544-5p | 7.114007919 | 7.40E-09 | 3.44E-07 | up |
| mmu-miR-128-1-5p | 6.79048455 | 7.56E-09 | 3.44E-07 | up |
| mmu-miR-218-5p | 5.83402318 | 1.38E-08 | 5.51E-07 | up |
| mmu-miR-132-3p | 5.712856022 | 1.95E-08 | 7.32E-07 | up |
| mmu-miR-330-5p | 6.317894415 | 2.43E-08 | 8.60E-07 | up |
| mmu-miR-872-3p | 5.539129751 | 6.64E-08 | 2.23E-06 | up |
| mmu-miR-582-3p | 11.19214284 | 7.40E-08 | 2.34E-06 | up |
| mmu-miR-770-3p | 5.557358824 | 7.71E-08 | 2.34E-06 | up |
| mmu-miR-1224-5p | 6.461907342 | 1.10E-07 | 3.19E-06 | up |
| mmu-miR-7689-3p | 6.896600865 | 1.26E-07 | 3.48E-06 | up |
| mmu-miR-132-5p | 6.26476402 | 2.48E-07 | 6.59E-06 | up |
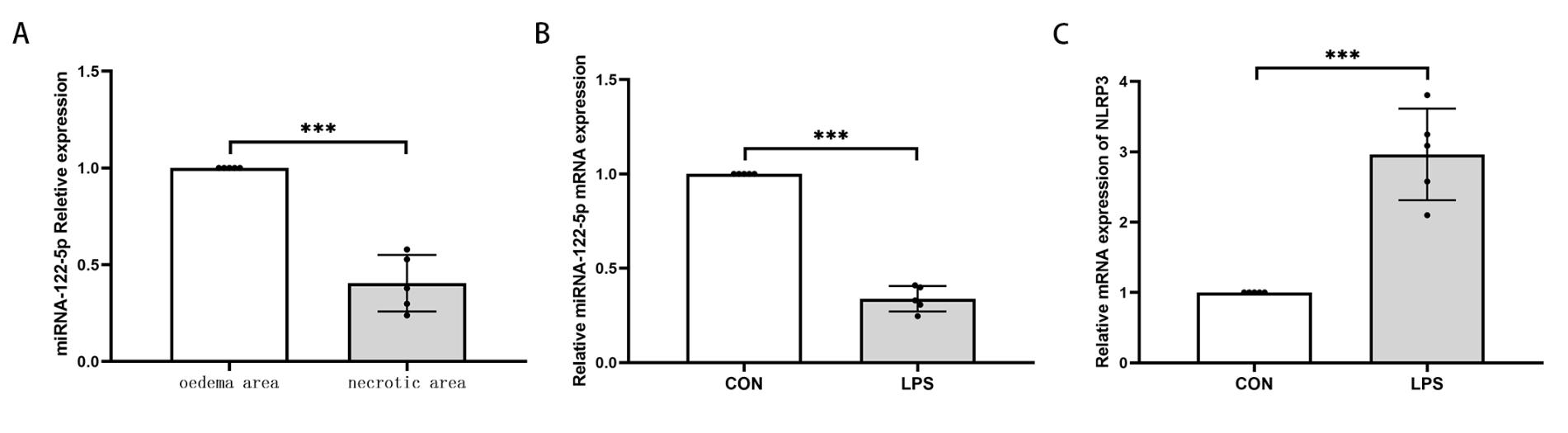
microRNA微阵列分析显示miR-122-5p是位居前10表达下调的miRNA。生物信息学网站的数据(http://starbase.sysu.edu.cn) 表明miR-122-5p可能对NFκB信号通路和NLRP3炎症小体信号通路有影响。为了验证这一推测,课题组在TBI小鼠模型第3天,从坏死区和水肿区收集脑组织样本,通过qRT-PCR检测miR-122-5p的表达,结果表明miR-122-5p在坏死区的表达明显低于水肿区[(1.00±0.00)vs. (0.41±0.15),P<0.001](见图 1A)。
|
| Oedema area为水肿区,necrotic area为坏死区。CON为对照组,LPS为脂多糖组。A:qRT-PCR检测TBI小鼠模型坏死区脑组织和水肿区脑组织中miR-122-5p的表达量B:体外TBI模型小胶质细胞miR-122-5p相对表达量; C:体外TBI模型小胶质细胞NLRP3炎症小体的相对表达量。(aP<0.001, n=5,t检验) 图 1 TBI小鼠模型和体外TBI模型miR-122-5p的表达 Fig 1 The expression of miR-122-5p in the in vivo and in vitro.TBI model |
|
|
为了进一步确定体外TBI模型中miR-122-5p的表达与TBI小鼠模型是否同一趋势,本研究采用LPS(100 ng/mL)刺激小胶质细胞24 h,使用qRT-PCR检测对照组和LPS组miR-122-5p mRNA表达量。与对照组相比,LPS组miR-122-5p表达下调[(1.00±0.00)vs. (0.34±0.07),P<0.001],NLRP3炎症小体的mRNA表达上调[(1.0±0.00)vs. (2.96±0.65),P<0.001](见图 1B, C)。结果显示miRNA-122-5p在小胶质细胞体外TBI模型中表达下调,而NLRP3炎症小体mRNA表达上调。
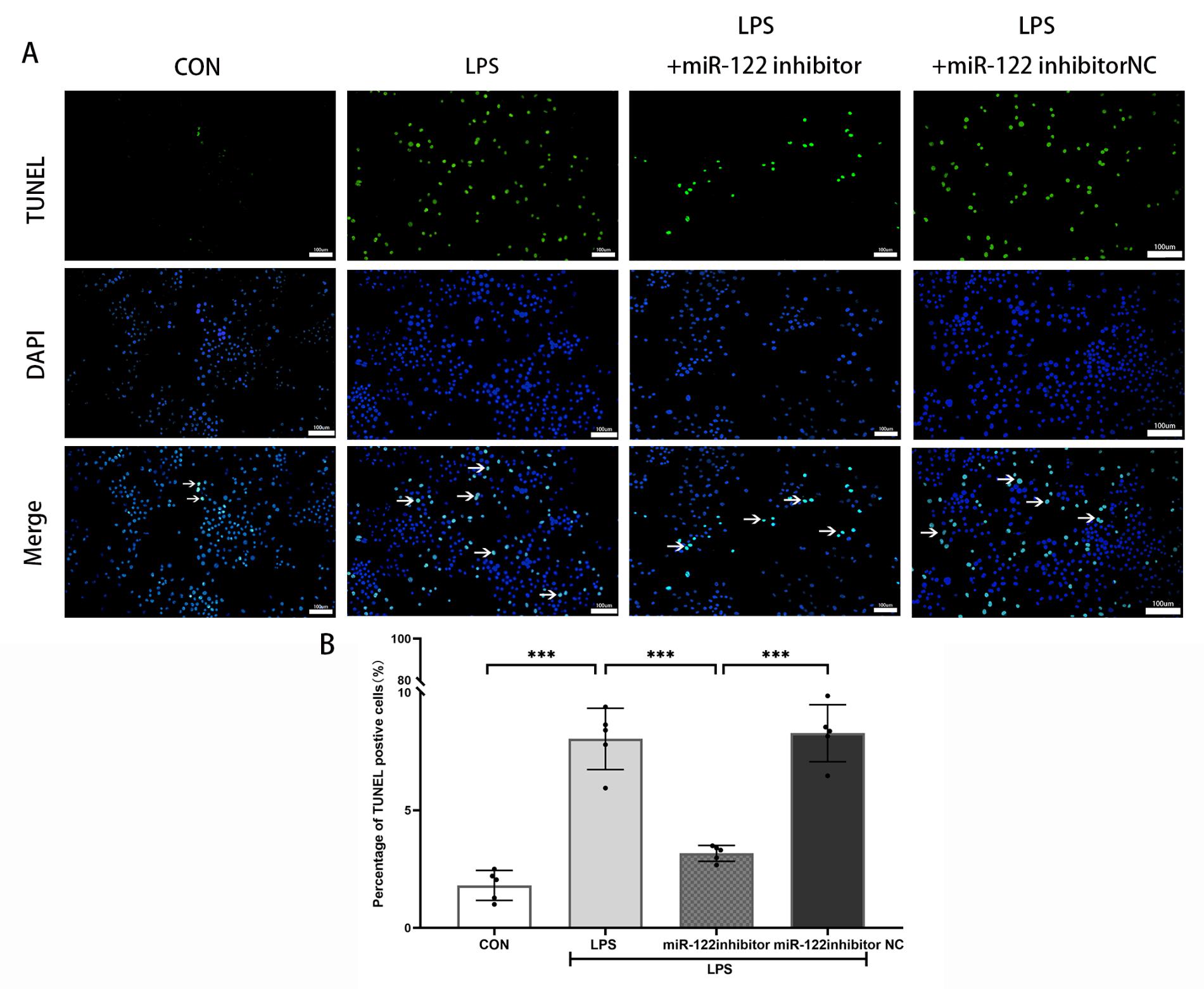
2.3 TUNEL凋亡染色结果LPS组凋亡细胞百分比显著高于对照组[(1.81±0.64)vs. (8.03±1.30),P<0.001]。与LPS组或LPS+miR-122-5p inhibitor NC组相比,LPS+miR-122-5p inhibitor转染组凋亡细胞百分比显著减少[(8.03±1.30)vs. (3.17±0.34),P<0.001;(8.27±1.21)vs. (3.17±0.34),P<0.001]。LPS组和LPS+ miR-122-5p inhibitor NC组,两组之间凋亡细胞百分比差异无统计学意义[(8.03±1.30)vs. (8.27±1.21),P =0.98]。结果提示抑制miR-122-5p表达,可以减轻小胶质细胞在LPS刺激下诱导的细胞凋亡。见图 2。
|
| CON为对照组,LPS为脂多糖组,LPS+miR-122 inhibitor为转染miR-122-5p抑制剂后LPS刺激组, LPS+miR-122inhibitor NC为转染miR-122-5p抑制剂阴性对照物后LPS刺激组。TUNEL标记凋亡细胞,DAPI标记细胞核,Merge为两种染色叠加后荧光图片。A:各处理组小胶质细胞凋亡的代表性荧光图片,B:各处理组凋亡阳性细胞百分比; aP<0.001,n=5。比例尺=100 um。 图 2 抑制miR-122-5p表达,减轻小胶质细胞在LPS刺激下诱导的细胞凋亡 Fig 2 Inhibition of miR-122-5p expression attenuates microglia apoptosis on the stimulation of LPS |
|
|
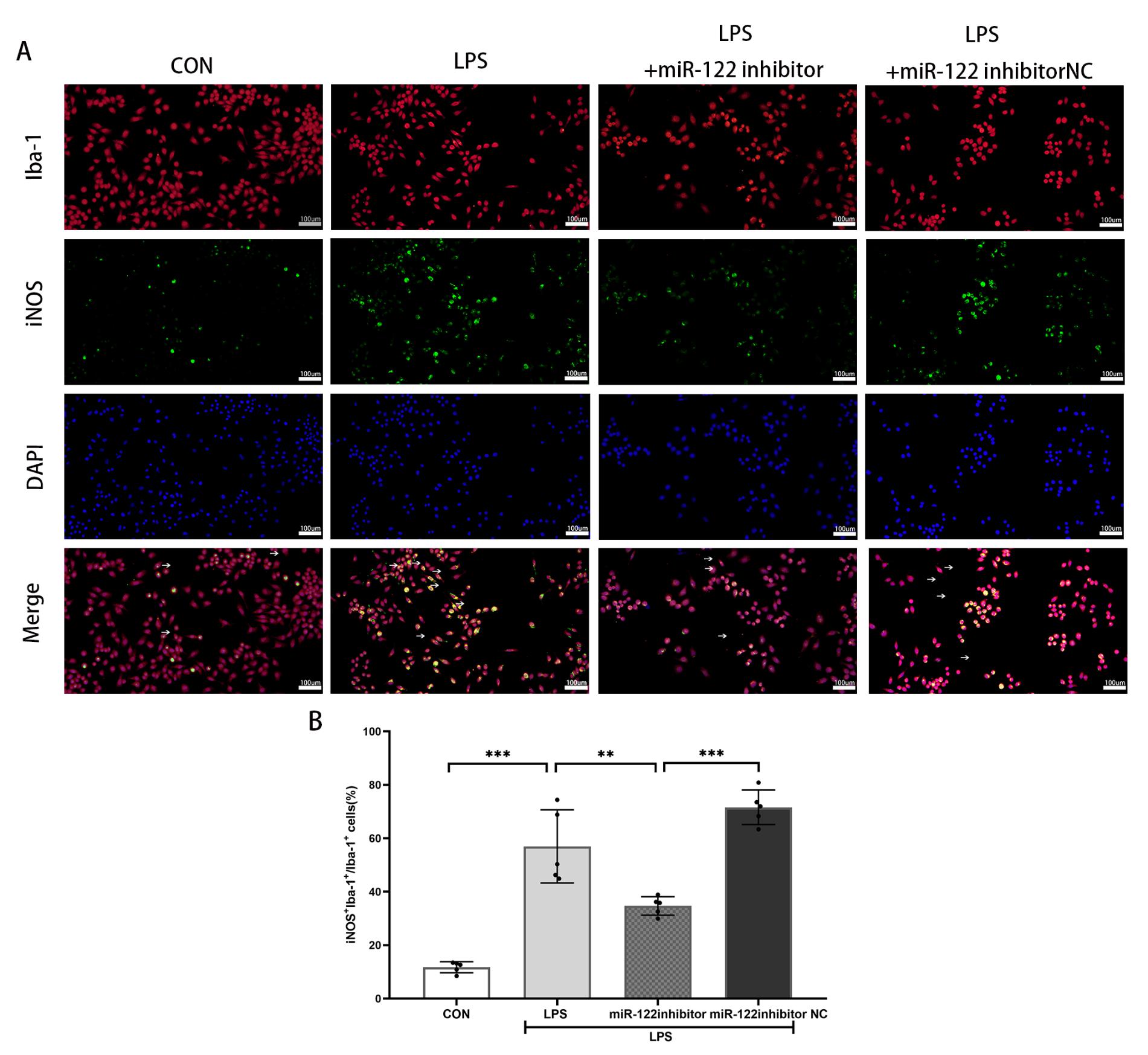
为了探究miR-122-5p对LPS损伤后小胶质细胞极化的影响,对小胶质细胞M1型标志物iNOS,小胶质细胞M2型标志物Arg1和小胶质细胞标记物Iba-1进行双重标记。免疫荧光结果(图 3)表明,与对照组相比,LPS刺激下小胶质细胞iNOS表达阳性细胞百分比显著增加[(11.74±2.06)vs. (56.96±13.70),P<0.001]。抑制miR-122-5p,LPS刺激后的小胶质细胞iNOS表达阳性细胞百分比显著下降[(56.96±13.70)vs. (34.70±3.47),P =0.002],Arg1表达阳性细胞百分比显著增加[(30.46±3.67)vs. (40.74±2.49),P =0.005]。与LPS组相比,LPS+miR-122-5p inhibitor NC组iNOS表达阳性细胞百分比以及Arg1表达阳性细胞百分比均差异无统计学意义[(56.96±13.70)vs.(67.62±5.43),P=0.16;(30.46±3.67)vs. (23.49±6.35),P =0.06]。结果表明,抑制miR-122-5p的表达,可以促进LPS损伤后的小胶质细胞从M1(促炎表型)向M2(抗炎表型)转化。
|
| Iba1(红色荧光)为小胶质细胞,iNOS(绿色荧光)为小胶质细胞M1型,Arg1(绿色荧光)为小胶质细胞M2型,DAPI(蓝色荧光)为细胞核。A:各处理组小胶质细胞M1型标志物iNOS+免疫荧光表达代表性图片; B:iNOS+Iba-1+细胞百分比,与对照组相比,aP<0.001(n=5),与LPS组相比,bP<0.01(n=5),与LPS+miR-122 inhibitor NC组相比,aP<0.001(n=5); C:各处理组小胶质细胞M2型标志物Arg1+免疫荧光表达代表性图片; D.Arg1+Iba-1+细胞百分比,bP<0.01,aP<0.001,n=5。比例尺100 μm。 图 3 抑制miR-122-5p表达,促进LPS损伤后小胶质细胞向M2表型转化 Fig 3 Inhibition of miR-122-5p promotes microglia M2 phenotype transformation after LPS injury |
|
|
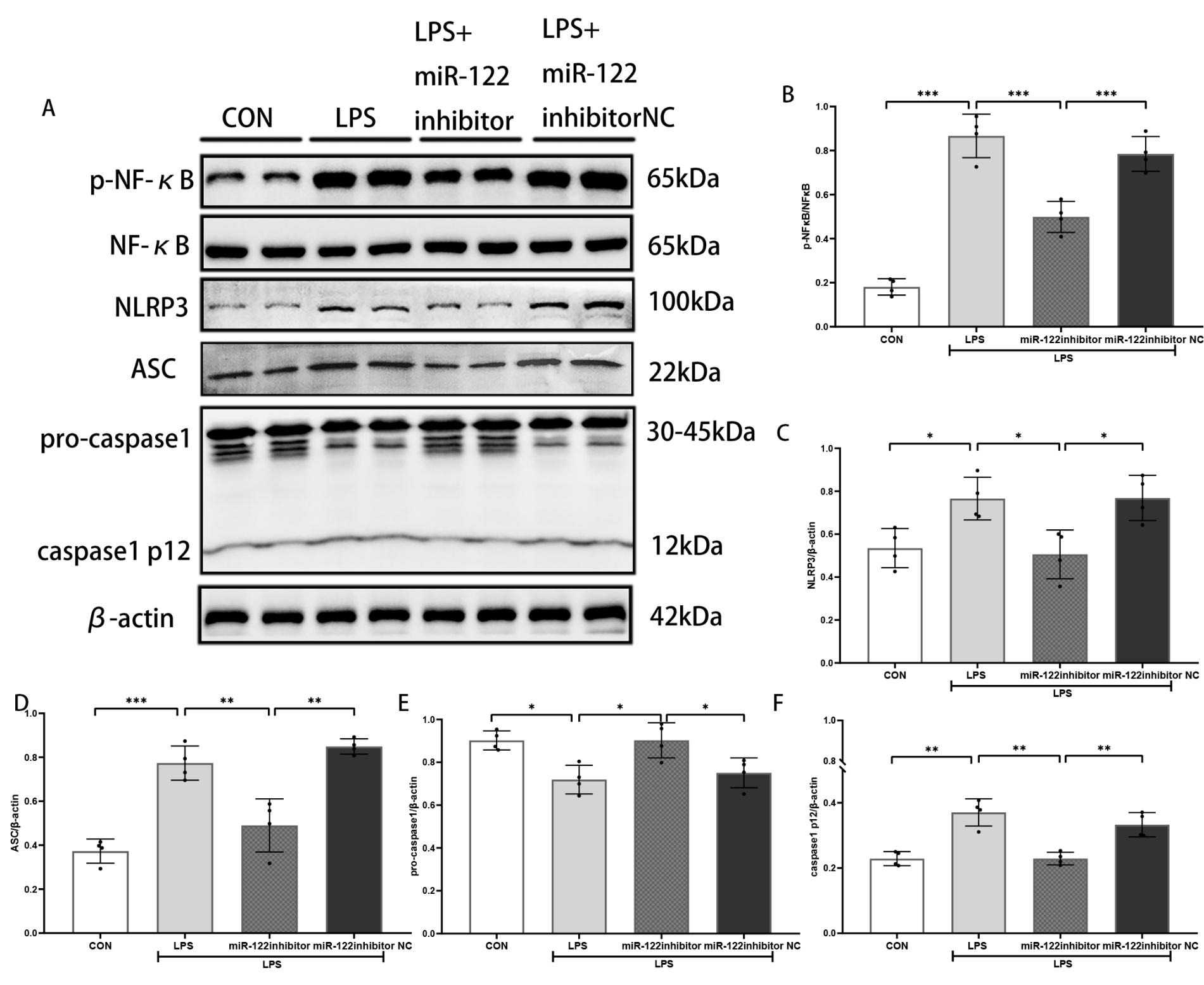
为了探究miRNA-122-5p下游调控机制,课题组采用蛋白印迹检测NLRP3炎症小体通路相关蛋白NLRP3、ASC、pro-caspase1、caspase1 p12的表达,以及另一炎症相关通路NFκB磷酸化表达。与对照组相比,LPS组NLRP3炎症小体、ASC、caspase1 p12、p-NFκB表达水平增加[(0.54±0.09)vs. (0.77±0.10),P =0.03;(0.37±0.05)vs. (0.77±0.08),P<0.001;(0.23±0.02)vs. (0.35±0.05),P =0.002;(0.18±0.03)vs.(0.73±0.08),P<0.001]。与LPS组相比,LPS+miR-122-5p inhibitor组小胶质细胞NLRP3炎症小体、ASC、caspase1 p12、p-NFκB蛋白表达显著降低[(0.77±0.10)vs.(0.51±0.11),P =0.02;(0.77±0.08)vs.(0.50±0.12),P =0.001;(0.35±0.05)vs.(0.23±0.02),P =0.002;(0.73±0.08)vs.(0.50±0.07),P =0.003],见图 4。
|
| A:对照组,LPS处理组,miR-122-5p inhibitor处理组,miR-122-5p inhibitor NC处理组小胶质细胞蛋白印迹图。B-F:各处理组小胶质细胞促炎相关蛋白p-NFκB、NFκB、NLRP3炎症小体、ASC、pro-caspase1、caspase1 p12的蛋白质印迹统计分析。数据以x±s表示,a P<0.05,b P<0.01,c P<0.001,n=4。 图 4 抑制miR-122-5p,减轻LPS损伤后小胶质细胞NLRP3炎症小体活化和NFκB的磷酸化 Fig 4 Inhibition of miR-122-5p attenuates NLRP3 inflammasome activation and NF-κB phosphorylation in microglia after LPS injury |
|
|
TBI的继发性损伤涉及复杂的病理生理机制,大量研究表明炎症反应是继发性损伤的主要机制之一[6]。本研究miRNA微阵列分析显示,在TBI模型星形胶质细胞分泌的外泌体中,miR-122-5p是位居前10表达下调的miRNA。来自生物信息学网站的数据(http://starbase.sysu.edu.cn)表明miR-122-5p可能影响NFκB信号通路和NLRP3炎症小体信号通路的活化[15]。为了验证这一推测,采用qRT-PCR检测TBI小鼠模型坏死区和水肿区的脑组织样本,结果表明miR-122-5p在病灶坏死区的表达显著低于水肿区。在LPS诱导的小胶质细胞体外TBI模型中,qRT-PCR检测结果表明miR-122-5p表达显著下调,NLRP3炎症小体表达显著上调,综合上述结果,笔者推测miR-122-5p在TBI后小胶质细胞炎症反应中起重要作用。
进一步在TBI细胞模型中,miR-122-5p抑制剂可以减轻小胶质细胞凋亡,显著促进小胶质细胞从M1(促炎)向M2(抗炎)表型转化。本研究还发现抑制miR-122-5p表达,可以抑制NLRP3炎症小体激活和NFκB磷酸化。NLRP3炎症小体和NFκB都是典型的炎症信号通路,与神经毒性有关[16-17]。本研究结果表明NLRP3炎症小体活化和NFκB磷酸化可能是miR-122-5p的重要靶标。miR-122-5p抑制NLRP3炎症小体活化和NFκB磷酸化,在体外模拟TBI条件下驱动小胶质细胞极化从M1向M2转化。因此,笔者推测miR-122-5p极有可能成为治疗TBI继发损伤新的治疗靶点。
值得一提的是,在TBI细胞模型预实验中,课题组设立了LPS+miR-122-5p mimic组(miR-122-5p过表达组),可惜的是miR-122-5p mimic组转染BV2小胶质细胞后,使用同样剂量的LPS刺激BV2细胞24 h,可观察到小胶质细胞大量死亡,无法进行后续的免疫荧光染色,提取的蛋白质质量也不佳。这从侧面说明过表达miR-122-5p,严重影响小胶质细胞对LPS炎症刺激的耐受。
本研究表明miR-122-5p在小胶质细胞TBI模型中表达下调,而NLRP3炎症小体表达上调。进一步抑制miR-122-5p表达,可以抑制NLRP3炎症小体活化和NFκB磷酸化,减轻小胶质细胞炎症反应及凋亡; 而过表达miR-122-5p的小胶质细胞无法耐受LPS的炎症刺激。Li等[18]报道miR-122-5p模拟物促进TNF-α、IL-1β、IL-6的表达,抑制miR-122-5p可以减轻LPS诱导的急性肺损伤。另有研究证明miR-122-5p抑制剂有效缓解放疗诱导脑损伤小鼠的神经元损伤和小胶质细胞神经炎症。总之,笔者推测miR-122-5p是一种损伤性miRNA,脑遭受创伤后启动保护机制,抑制miR-122-5p表达,但是不足以达到抑制NLRP3炎症小体活化的程度。人为干预抑制miR-122-5p,可以抑制NLRP3炎症小体活化,从而达到减轻小胶质细胞神经炎症及细胞凋亡的作用。
研究使用富含炎症介质和细胞因子的TBI小鼠脑提取物刺激星形胶质细胞,研究星形胶质细胞分泌的外泌体并对其进行microRNA测序。但是并没有使用同样的方法研究调控miR-122-5p的表达对小胶质细胞凋亡和极化的影响,原因在于不论是星形胶质细胞分泌的外泌体,还是小胶质细胞内吞的外泌体,其成分都极其复杂,携带的非编码RNA包括长非编码RNA(LncRNA)、环状RNA (circRNA)和microRNA(miRNA),其中LncRNA通过与mRNA竞争性结合miRNA,形成LncRNA/miRNA/mRNA轴。外泌体包含无数个LncRNA/miRNA/mRNA轴,他们之间也有相互作用,参与免疫调节。为了研究miR-122-5p对创伤性脑外伤后小胶质细胞的影响,本实验采用LPS(100 ng/mL)刺激BV2小胶质细胞24 h,用于模拟TBI继发神经炎症。LPS是小胶质细胞活化的强刺激剂[20],LPS诱导小胶质细胞活化导致炎症反应,其机制与TBI继发神经炎症类似[21-23],已经被神经学研究广泛应用,成熟地用于模拟TBI后神经炎症。
miRNA可以作为创伤性脑外伤患者诊断以及评估预后的生物学标志物[24]; miRNA与靶基因相互作用影响TBI后细胞氧化应激、炎症、细胞凋亡、血脑屏障、血管生成和神经再生,极有可能成为新的治疗靶点; miRNA模拟物或抑制剂已经在众多实验研究中被证明有神经保护作用。本研究证实miR-122-5p通过调节NLRP3炎症小体活化和NFκB磷酸化,促进小胶质细胞M1向M2极化,减轻炎症反应和凋亡,为未来防治TBI继发损伤提供新的策略靶点。
利益冲突 所有作者声明无利益冲突
作者贡献声明 康璐璐:研究设计、实验操作、论文撰写; 龙小兵:实验操作; 王静:统计学分析; 吕菁君:研究设计、论文修改
| [1] | GBD Traumatic Brain Injury and Spinal Cord Injury Collaborators. Global, regional, and national burden of traumatic brain injury and spinal cord injury, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18(1): 56-87. DOI:10.1016/S1474-4422(18)30415-0 |
| [2] | Ganti L, Bodhit AN, Daneshvar Y, et al. Effectiveness of seatbelts in mitigating traumatic brain injury severity[J]. World J Emerg Med, 2021, 12(1): 68-72. DOI:10.5847/wjem.j.1920-8642.2021.01.011 |
| [3] | Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale[J]. Lancet, 1974, 2(7872): 81-84. DOI:10.1016/s0140-6736(74)91639-0 |
| [4] | 李民涛, 董健, 崔守永. 神经生物标志物用于轻度创伤性脑损伤诊断的研究进展[J]. 中华急诊医学杂志, 2019, 28(9): 1171-1174. DOI:10.3760/cma.j.issn.1671-0282.2019.09.027 |
| [5] | McGuire JL, Ngwenya LB, McCullumsmith RE. Neurotransmitter changes after traumatic brain injury: an update for new treatment strategies[J]. Mol Psychiatry, 2019, 24(7): 995-1012. DOI:10.1038/s41380-018-0239-6 |
| [6] | Holden SS, Grandi FC, Aboubakr O, et al. Complement factor C1q mediates sleep spindle loss and epileptic spikes after mild brain injury[J]. Science, 2021, 373(6560): eabj2685. DOI:10.1126/science.abj2685 |
| [7] | 李冬冬, 张忠伟, 黄剑吟, 等. 创伤患者炎症因子水平变化的临床意义[J]. 中华急诊医学杂志, 2020, 29(10): 1333-1336. DOI:10.3760/cma.j.issn.1671-0282.2020.10.011 |
| [8] | Born LJ, Harmon JW, Jay SM. Therapeutic potential of extracellular vesicle-associated long noncoding RNA[J]. Bioeng Transl Med, 2020, 5(3): e10172. DOI:10.1002/btm2.10172 |
| [9] | 朱亚婕, 王杨, 唐嘉隆, 等. 外泌体的体内代谢进展[J]. 中华急诊医学杂志, 2019, 28(5): 652-654. DOI:10.3760/cma.j.issn.1671-0282.2019.05.028 |
| [10] | Šimončičová E, Gonçalves de Andrade E, Vecchiarelli HA, et al. Present and future of microglial pharmacology[J]. Trends Pharmacol Sci, 2022, S0165-S6147(21): 00223-6. DOI:10.1016/j.tips.2021.11.006 |
| [11] | Loane DJ, Byrnes KR. Role of microglia in neurotrauma[J]. Neurotherapeutics, 2010, 7(4): 366-377. DOI:10.1016/j.nurt.2010.07.002 |
| [12] | Karve IP, Taylor JM, Crack PJ. The contribution of astrocytes and microglia to traumatic brain injury[J]. Br J Pharmacol, 2016, 173(4): 692-702. DOI:10.1111/bph.13125 |
| [13] | Henry RJ, Doran SJ, Barrett JP, et al. Inhibition of miR-155 limits neuroinflammation and improves functional recovery after experimental traumatic brain injury in mice[J]. Neurotherapeutics, 2019, 16(1): 216-230. DOI:10.1007/s13311-018-0665-9 |
| [14] | Yang YX, Ye YQ, Kong CG, et al. miR-124 enriched exosomes promoted the M2 polarization of microglia and enhanced Hippocampus neurogenesis after traumatic brain injury by inhibiting TLR4 pathway[J]. Neurochem Res, 2019, 44(4): 811-828. DOI:10.1007/s11064-018-02714-z |
| [15] | Milner MT, Maddugoda M, Götz J, et al. The NLRP3 inflammasome triggers sterile neuroinflammation and Alzheimer's disease[J]. Curr Opin Immunol, 2021, 68: 116-124. DOI:10.1016/j.coi.2020.10.011 |
| [16] | Jiang MR, Li R, Lyu JJ, et al. MCC950, a selective NLPR3 inflammasome inhibitor, improves neurologic function and survival after cardiac arrest and resuscitation[J]. J Neuroinflammation, 2020, 17(1): 256. DOI:10.1186/s12974-020-01933-y |
| [17] | Lyu JJ, Mehta JL, Li Y, et al. Mitochondrial autophagy and NLRP3 inflammasome in pulmonary tissues from severe combined immunodeficient mice after cardiac arrest and cardiopulmonary resuscitation[J]. Chin Med J (Engl), 2018, 131(10): 1174-1184. DOI:10.4103/0366-6999.231519 |
| [18] | Li J, Zeng XX, Wang WQ. miR-122-5p downregulation attenuates lipopolysaccharide-induced acute lung injury by targeting IL1RN[J]. Exp Ther Med, 2021, 22(5): 1278. DOI:10.3892/etm.2021.10713 |
| [19] | Zhou HH, Sun FR, Ou MQ, et al. Prior nasal delivery of antagomiR-122 prevents radiation-induced brain injury[J]. Mol Ther, 2021, 29(12): 3465-3483. DOI:10.1016/j.ymthe.2021.06.019 |
| [20] | Fourrier C, Remus-Borel J, Greenhalgh AD, et al. Docosahexaenoic acid-containing choline phospholipid modulates LPS-induced neuroinflammation in vivo and in microglia in vitro[J]. J Neuroinflammation, 2017, 14(1): 170. DOI:10.1186/s12974-017-0939-x |
| [21] | Yuan YM, Zhu F, Pu YY, et al. Neuroprotective effects of nitidine against traumatic CNS injury via inhibiting microglia activation[J]. Brain Behav Immun, 2015, 48: 287-300. DOI:10.1016/j.bbi.2015.04.008 |
| [22] | Nam HY, Nam JH, Yoon G, et al. Ibrutinib suppresses LPS-induced neuroinflammatory responses in BV2 microglial cells and wild-type mice[J]. J Neuroinflammation, 2018, 15(1): 271. DOI:10.1186/s12974-018-1308-0 |
| [23] | Liao S, Wu JN, Liu RM, et al. A novel compound DBZ ameliorates neuroinflammation in LPS-stimulated microglia and ischemic stroke rats: role of Akt(Ser473)/GSK3β(Ser9)-mediated Nrf2 activation[J]. Redox Biol, 2020, 36: 101644. DOI:10.1016/j.redox.2020.101644 |
| [24] | di Pietro V, Ragusa M, Davies D, et al. microRNAs as novel biomarkers for the diagnosis and prognosis of mild and severe traumatic brain injury[J]. J Neurotrauma, 2017, 34(11): 1948-1956. DOI:10.1089/neu.2016.4857 |
 2022, Vol. 31
2022, Vol. 31




