2. 郑州大学第一附属医院心内科重症监护室(CCU),郑州 450000
2. CCU, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
急性肺损伤(ALI)是一种以肺部炎症和肺血管通透性增加为特征,急性发作伴有双肺弥漫性渗出,导致呼吸窘迫和低氧血症的复杂疾病[1]。ALI是一种渐进性、破坏性的呼吸系统疾病。在ICU患者中,ALI的发病率和病死率都很高[2]。ALI可以继发于肺炎、脓毒症、创伤、胰腺炎及大量输血等多种损害引起的过度炎症反应[3-4]。
西维来司他钠,是一种选择性、可逆性和竞争性中性粒细胞弹性蛋白酶抑制剂[5-6],它不影响体内其他蛋白酶的功能[7]。2002年,日本批准西维来司他钠用于治疗全身炎症反应综合征(SIRS)相关的ALI。2020年2月,西维来司他钠在中国被批准用于新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)引起的ALI治疗,并被逐渐用于治疗各种原因引起的ALI/ARDS。但是,国内关于西维来司他钠的研究以及使用西维来司他钠治疗ICU中ALI的临床经验还非常少。本文拟评价西维来司他钠治疗ICU中ALI的临床有效性和安全性。
1 资料与方法 1.1 一般资料本研究采用回顾性研究的方法,选择2020年6月至2021年6月在郑州大学第一附属医院ICU内被诊断为ALI/ARDS并接受呼吸机治疗48 h以上的患者。采用2012年“柏林标准”对ALI/ARDS作出诊断:①起病时间:已知临床病因后1周内新发/原有呼吸症状加重; ②胸部影像:胸片或CT扫描可见双侧肺部阴影,且不能完全用胸腔积液、肺/肺叶萎陷、肺结节解释; ③肺水肿:不能通过心衰或液体负荷增多来解释的呼吸衰竭,如果没有危险因素,则需要客观评估(如心脏超声检查)排除静水压升高的肺水肿; ④缺氧程度:轻度:200 mmHg < PaO2/FiO2≤300 mmHg(1 mmHg=0.133 kPa),PEEP或CPAP≥5 cmH2O(1 cmH2O=0.098 kPa); 中度:100 mmHg < PaO2/FiO2≤200 mmHg,PEEP≥5 cmH2O; 重度:PaO2/FiO2≤100 mmHg,PEEP≥5 cmH2O[8]。
排除标准:该研究排除了年龄18岁以下的患者,孕妇或哺乳期妇女,恶性肿瘤患者,可引起通气受损的神经肌肉疾病和存在严重慢性呼吸道疾病的患者,研究资料不齐全、缺失的患者。
患者分为两组:西维来司他钠组(n=77)与常规治疗组(n = 94)。本研究已通过郑州大学第一附属医院伦理委员会审查(伦理批号:2021-KY-189)。因本研究为回顾性研究,知情同意得以豁免。
1.2 治疗方法所有患者均接受呼吸机治疗48 h以上,自ALI诊断开始给予常规治疗,或加用西维来司他[0.2 mg/(kg·h)]持续泵入7~14 d,直至转出ICU(少于14 d)。
1.3 观察指标(1)患者基本数据从电子病历系统中收集,记录性别、年龄、基础疾病、ALI的病因、使用西维来司他钠时间、影像学检查、APACHE Ⅱ评分、Murray肺损伤评分。
(2)诊断ALI时(D0)患者的生命体征如心率、血压、呼吸频率、动脉血气分析、血常规、肝肾功等化验指标和炎症因子(IL-6、IL-10、TNF-α)。
(3)使用西维来司他钠或常规治疗7 d内的氧合指数,治疗7 d后炎症因子(IL-6、IL-10、TNF-α),无呼吸机天数(VFD),ICU住院天数及28 d生存率来评价西维来司他钠的疗效。VFD定义为从第1天至第28天患者在无呼吸机辅助的情况下自主呼吸的天数。
(4)使用西维来司他钠或常规治疗后30 d内患者的血常规、肝肾功、凝血功能等化验指标及有无皮疹、呼吸困难、注射部位静脉炎等不良反应。
1.4 统计学方法采用SPSS 19.0软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,非正态分布数据用中位数(四分位间距)表示,行u检验; 两组定量数据比较采用成组t检验或t'检验,计数资料以百分数表示,采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果 2.1 患者基本资料基本数据从患者病例中收集,临床资料包括患者基本资料、APACHE Ⅱ评分等。ALI诊断时(D0),西维来司他钠组(n=77)与常规治疗组(n=94)临床资料差异无统计学意义,见表 1。ALI诊断时两组患者组炎症因子IL-6、IL-10、TNF-α差异无统计学意义,见表 2。
| 临床资料 | 西维来司他钠组 | 常规治疗组 | P值 |
| 患者 | 77 | 94 | |
| 性别(男性/女性) | 44/33 | 57/37 | 0.6437 |
| 年龄(岁) | 51.05±11.70 | 49.18±10.79 | 0.2791 |
| APACHE Ⅱ评分 | 19.40±4.90 | 18.43±4.50 | 0.1764 |
| Murray肺损伤评分 | 2.56±0.55 | 2.35±0.58 | 0.1092 |
| WBC(×109/L) | 16.49±4.12 | 15.45±3.60 | 0.0782 |
| Plt(×109/L) | 147.4±21.41 | 158.6±19.14 | 0.0710 |
| ALT(U/L) | 66.79±13.88 | 69.68±11.24 | 0.6585 |
| AST(U/L) | 68.91±12.42 | 73.12±15.72 | 0.5371 |
| TBIL (μmol/L) | 18.12±8.69 | 16.62±7.35 | 0.2238 |
| Cr (μmol/L) | 112.34±19.98 | 117.87±21.99 | 0.4819 |
| PaO2/FiO2(mmHg) | 197.6±23.8 | 206.7±19.74 | 0.1137 |
| PaCO2(mmHg) | 39.40±4.18 | 40.39±5.41 | 0.1899 |
| MAP(mmHg) | 90.87±12.09 | 92.81±9.63 | 0.2449 |
| HR (次/min) | 96.21±13.75 | 97.03±12.72 | 0.6850 |
| RR(次/min) | 20.83±3.56 | 19.90±3.10 | 0.0705 |
| 炎症因子 | 西维来司他钠组 | 常规治疗组 | P值 |
| IL-6 (pg/mL) | 219.4±70.4 | 205.8±47.7 | 0.2215 |
| IL-10 (pg/mL) | 198.6±60.2 | 202.8±48.0 | 0.6777 |
| TNF-α(pg/mL) | 203.5±84.2 | 194.8±74.7 | 0.5532 |
根据两组患者28 d内存活与否,将两组分别分为存活和死亡亚组。分析存活和死亡亚组ALI诊断时的临床参数与预后之间的关系,亚组间APACHE Ⅱ评分、RR和PaO2/FiO2差异具有统计学意义,年龄、WBC和PaCO2差异无统计学意义,见表 3。
| 指标 | 西维来司他钠组 | 常规治疗组 | ||
| 存活(n=66) | 死亡(n=11) | 存活(n=73) | 死亡(n=21) | |
| 年龄 | 51.32±11.85 | 49.45±11.18 | 48.85±10.35 | 50.33±12.43 |
| APACHE Ⅱ评分 | 18.97±4.63 | 22.91±6.11 (P = 0.0149) |
20.43±5.19 | 17.85±4.14 (P = 0.0198) |
| RR(次/min) | 20.47±3.37 | 23.00±4.05 (P = 0.0279) |
19.52±2.99 | 21.24±3.18 (P = 0.0245) |
| WBC(×109/L) | 16.15±4.03 | 18.27±4.00 | 15.08±3.55 | 16.71±3.58 |
| PaCO2 (mmHg) | 39.21±4.03 | 40.55±5.07 | 39.86±5.35 | 42.24±5.37 |
| PaO2/FiO2(mmHg) | 200.0±13.64 | 173.0±18.47 (P = 0.0140) |
211.9±21.73 | 188.7±15.14 (P = 0.0173) |
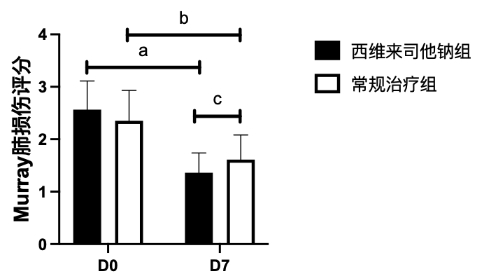
治疗7 d后,两组患者Murray肺损伤评分均改善,差异具有统计学意义。西维来司他钠组Murray肺损伤评分改善更明显,与常规治疗组比较差异具有统计学意义,见图 1。治疗第1、2、3天,两组患者氧合指数比较差异无统计学意义。治疗第4天(P = 0.0348),第5天(P = 0.0342)、第6天(P = 0.0303)和第7天(P = 0.0450)西维来司他钠组与常规治疗组氧合指数均有改善,西维来司他钠组改善更明显,差异具有统计学意义,见图 2。
|
| 治疗7 d后的Murray肺损伤评分,西维来司他钠组与治疗前比较,aP<0.0001;常规治疗组与治疗前比较,bP<0.0001;西维来司他钠组与常规治疗组比较,cP<0.05 图 1 ALI治疗7 d后的Murray肺损伤评分 Fig 1 Murray lung injury score after 7 days of ALI treatments |
|
|

|
| 西维来司他钠组与常规治疗组氧合指数比较,治疗第1、2、3天,aP>0.05;治疗第4、5、6、7天,bP<0.05 图 2 ALI治疗7 d内的氧合指数(PaO2/FiO2) Fig 2 Oxygenation index (PaO2/FiO2) within 7 days of ALI treatments |
|
|
治疗7 d后,两组患者组炎症因子IL-6、IL-10、TNF-α均有改善,差异具有统计学意义。西维来司他钠组炎症因子IL-6、IL-10、TNF-α改善更明显,与常规治疗组比较差异具有统计学意义,见图 3。基于VFD及ICU住院天数的临床疗效评估,与常规治疗组比较,西维来司他钠组VFD增加,P = 0.0119,差异具有统计学意义。与常规治疗组比较,西维来司他钠组ICU住院天数减少,P = 0.0269,差异具有统计学意义,见图 4。

|
| 治疗7 d后,西维来司他钠组和常规治疗组炎症因子比较,A:IL-6与治疗前比较,aP<0.05,bP<0.05;两组间IL-6比较,cP<0.05;B:IL-10与治疗前比较,aP<0.05,bP<0.05;两组间IL-10比较,cP<0.05;C:TNF-α与治疗前比较,aP<0.05,bP<0.05;两组间TNF-α比较,cP<0.05 图 3 ALI治疗7 d后炎症因子 Fig 3 Inflammatory cytokines after 7 days of ALI treatments |
|
|

|
| 西维来司他钠组与常规治疗组比较,A: VFD更长,aP<0.05; B: ICU住院天数更少,aP<0.05 图 4 ICU收治期内无呼吸机天数(VFD)及ICU住院天数 Fig 4 Ventilator-free days (VFD) and ICU stay days during ICU admission |
|
|
在171例患者中,32人死亡,总体病死率为18.71%。西维来司他钠组77人,死亡11人,病死率为14.29%。常规治疗组94例,死亡21例,病死率为22.34%。西维来司他钠组病死率呈下降趋势,但是两组间病死率差异无统计学意义(P = 0.1791),见图 5。

|
| 与常规治疗组比较,西维来司他钠组ALI患者病死率呈下降趋势,但两组间病死率差异无统计学意义 图 5 两组间28 d生存率比较 Fig 5 Comparison of 28-day survival rates between the two groups |
|
|
因症状改善终止给药48例; 因不良反应终止给药0例; 因死亡终止给药3例; 西维来司他钠平均用药时间为(8.7±3.8)d。
2.3.2 严重不良事件171例中有32例死亡,其中28 d内死亡14例,28 d后死亡18例。1例与西维来司他钠的关系判定为“关系不明”,其他病例均因基础疾病、并发症死亡,从开始给药到死亡的过程判断为与西维来司他钠无关。
2.3.3 不良反应不能否认与西维来司他钠相关的不良事件,即不良反应的发生率。不良反应发生率为7.8%。不良反应共6例,主要为肝功能异常,包括ALT升高(5.19%)、AST升高(3.89%)、TBIL升高(1.30%),还有WBC减少(1.30%)。
3 讨论ALI是一种急性炎症,可导致肺内皮和上皮屏障破坏[2]。ALI的发病机制非常复杂,与肺部中性粒细胞浸润引起的炎症反应密切相关[9]。ALI的细胞特征包括肺泡-毛细血管膜完整性丧失、中性粒细胞过度跨上皮迁移以及促炎介质、细胞毒性因子的释放[10]。当损害发生时,中性粒细胞在肺微血管中积聚并被激活,然后释放出多种细胞毒性介质,包括蛋白酶、活性氧、促炎因子和促凝分子等。中性粒细胞释放的弹性蛋白酶,可以降解上皮连接蛋白,具有促凋亡特性,并可能对上皮细胞有直接毒性[11-15],从而引起了SIRS患者的急性肺损伤[16]。
上皮细胞和内皮细胞参与炎症的生物标志物可预测ALI的发病率和病死率[2]。急性应激后,促炎细胞因子增加,可作为生理损伤程度和持续性细胞损伤的标志物。促炎细胞因子TNF-α、IL-1β、IL-6、IL-8和IL-18是研究最多的,与急性肺损伤的发病率和病死率关系最密切[17]。Parsons等人研究表明,在对疾病严重程度和器官功能障碍进行调整后,血浆IL-6和IL-8水平升高与器官功能衰竭和呼吸机使用天数升高相关,而且升高的IL-6和IL-8是病死率高的独立预测因素[17]。
西维来司他钠可以有效的抑制中性粒细胞弹性蛋白酶活性,并阻止其迁移,从而减少炎症反应。中性粒细胞清除可以阻止ALI的发生[18]。日本的两项临床研究也证实了西维来司他钠可以减少患者机械通气时间,缩短重症监护室住院时间,延长ALI患者生存时间[4, 19]。日本呼吸学会ALI / ARDS指南建议使用西维来司他钠治疗ALI[20]。本研究表明,西维来司他钠可以改善重症监护室ALI患者肺损伤评分,缩短机械通气时间,减少ICU住院天数。Tamakuma等[19]的研究也发现,西维来司他钠治疗合并SIRS的ALI患者可以更早的结束机械通气。
利益冲突 所有作者声明无利益冲突
作者贡献声明 谷玉雷:研究设计、数据整理、统计分析、论文撰写; 肖莉丽:研究设计、论文修改; 裴辉、徐东、姜毓敏:数据收集、统计分析; 谢佳丰、张晓凡、毛宇径:论文修改; 朱志强:论文审阅
| [1] | 张磊, 周成杰, 姚滔, 等. 肺部超声评估急性呼吸窘迫综合征临床应用价值[J]. 中华急诊医学杂志, 2020, 29(3): 392-397. DOI:10.3760/cma.j.issn.1671-0282.2020.03.017 |
| [2] | Cui YQ, Ding XF, Liang HY, et al. Efficacy and safety of low-dose corticosteroids for acute respiratory distress syndrome: a systematic review and meta-analysis[J]. World J Emerg Med, 2021, 12(3): 207-213. DOI:10.5847/wjem.j.1920-8642.2021.03.008 |
| [3] | Mowery NT, Terzian WTH, Nelson AC. Acute lung injury[J]. Curr Probl Surg, 2020, 57(5): 100777. DOI:10.1016/j.cpsurg.2020.100777 |
| [4] | Aikawa N, Ishizaka A, Hirasawa H, et al. Reevaluation of the efficacy and safety of the neutrophil elastase inhibitor, Sivelestat, for the treatment of acute lung injury associated with systemic inflammatory response syndrome; a phase IV study[J]. Pulm Pharmacol Ther, 2011, 24(5): 549-554. DOI:10.1016/j.pupt.2011.03.001 |
| [5] | Kawabata K, Suzuki M, Sugitani M, et al. ONO-5046, a novel inhibitor of human neutrophil elastase[J]. Biochem Biophys Res Commun, 1991, 177(2): 814-820. DOI:10.1016/0006-291X(91)91862-7 |
| [6] | Sahebnasagh A, Saghafi F, Safdari M, et al. Neutrophil elastase inhibitor (sivelestat) may be a promising therapeutic option for management of acute lung injury/acute respiratory distress syndrome or disseminated intravascular coagulation in COVID-19[J]. J Clin Pharm Ther, 2020, 45(6): 1515-1519. DOI:10.1111/jcpt.13251 |
| [7] | Pu S, Wang D, Liu D, et al. Effect of sivelestat sodium in patients with acute lung injury or acute respiratory distress syndrome: a meta-analysis of randomized controlled trials[J]. BMC Pulm Med, 2017, 17(1): 148. DOI:10.1186/s12890-017-0498-z |
| [8] | ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [9] | Miyoshi S, Hamada H, Ito R, et al. Usefulness of a selective neutrophil elastase inhibitor, sivelestat, in acute lung injury patients with sepsis[J]. Drug Des Devel The, 2013, 7: 305-316. DOI:10.2147/DDDT.S42004 |
| [10] | Matthay MA, Zimmerman GA. Acute lung injury and the acute respiratory distress syndrome[J]. Am J Respir Cell Mol Biol, 2005, 33(4): 319-327. DOI:10.1165/rcmb.f305 |
| [11] | 张雪鹏, 张伟韬, 屠国伟, 等. 硫醚环化B螺旋肽对脓毒症小鼠急性肺损伤的保护作用[J]. 中华急诊医学杂志, 2021, 30(7): 831-835. DOI:10.3760/cma.j.issn.1671-0282.2021.07.007 |
| [12] | Ginzberg HH, Shannon PT, Suzuki T, et al. Leukocyte elastase induces epithelial apoptosis: role of mitochondial permeability changes and Akt[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 287(1): G286-G298. DOI:10.1152/ajpgi.00350.2003 |
| [13] | Martin TR, Hagimoto N, Nakamura M, et al. Apoptosis and epithelial injury in the lungs[J]. Proc Am Thorac Soc, 2005, 2(3): 214-220. DOI:10.1513/pats.200504-031AC |
| [14] | Chen HT, Xu JF, Huang XX, et al. Blood eosinophils and mortality in patients with acute respiratory distress syndrome: a propensity score matching analysis[J]. World J Emerg Med, 2021, 12(2): 131-136. DOI:10.5847/wjem.j.1920-8642.2021.02.008 |
| [15] | Matute-Bello G, Martin TR. Science review: apoptosis in acute lung injury[J]. Crit Care, 2003, 7(5): 355-358. DOI:10.1186/cc1861 |
| [16] | Petty TL. Protease mechanisms in the pathogenesis of acute lung injury[J]. Ann N Y Acad Sci, 1991, 624: 267-277. DOI:10.1111/j.1749-6632.1991.tb17025.x |
| [17] | Lower tidal volume ventilation and plasma cytokine markers of inflammation in patients with acute lung injury[J]. Curr Infect Dis Rep, 2005, 7(5): 327-328. DOI: 10.1007/s11908-005-0004-2. |
| [18] | Zemans RL, Colgan SP, Downey GP. Transepithelial migration of neutrophils: mechanisms and implications for acute lung injury[J]. Am J Respir Cell Mol Biol, 2009, 40(5): 519-535. DOI:10.1165/rcmb.2008-0348TR |
| [19] | Tamakuma S, Ogawa M, Aikawa N, et al. Relationship between neutrophil elastase and acute lung injury in humans[J]. Pulm Pharmacol Ther, 2004, 17(5): 271-279. DOI:10.1016/j.pupt.2004.05.003 |
| [20] | Hayakawa M, Katabami K, Wada T, et al. Sivelestat (selective neutrophil elastase inhibitor) improves the mortality rate of sepsis associated with both acute respiratory distress syndrome and disseminated intravascular coagulation patients[J]. Shock, 2010, 33(1): 14-18. DOI:10.1097/SHK.0b013e3181aa95c4 |
 2022, Vol. 31
2022, Vol. 31




