肺水肿(pulmonary edema,PE)急性发作是患者入住ICU的常见原因,约15%的PE患者需机械通气治疗,机械通气可延长ICU住院时间,增加住院费用,并与增高的病死率相关[1]。在国外单侧PE的发生率1.6%~19.9%[2-5],而且病死率是双侧PE的5倍[2]。但目前无ICU的相关研究,本文回顾性研究ICU中单侧PE在ICU的发生率、临床特征及病死率。
1 资料与方法 1.1 一般资料通过病历系统回顾性分析2018年1月至2021年1月因PE入住深圳大学附属第二医院ICU患者。经本院伦理委员会审理(批号:BYL20210351)。
1.1.1 纳入标准① 电子计算机断层扫描(computed tomography,CT)/胸片影像符合PE患者。PE影像学表现为肺血管淤血(血管影宽度 > 53mm,血管密集度下肺 > 上肺,心胸比 > 0.5); 间质性PE(Kerley B线,血管模糊,袖套征,胸腔积液); 肺泡内PE(磨玻璃影,肺实变,胸腔积液),以及心脏增大等[6]。②因为PE发作入住ICU,包括ICU、心脏ICU、急诊ICU及神经外科ICU。③临床符合心源性PE患者,既往有心肌梗死或充血性心衰病史; 有低心排、第3心音、颈静脉充盈、外周水肿表现; 实验室检查有心肌酶升高,脑钠肽(BNP) > 500 pg/mL; 心脏超声有左心室射血分数下降或左心室扩大等证据[7]。
1.1.2 排除标准① 结合临床考虑肺炎、肺出血、急性呼吸窘迫综合征等患者; ②CT/胸片前后24 h内无心脏超声检查患者; ③孕妇; ④年龄小于18岁。
1.2 资料收集① 患者的年龄、性别、基础病因、呼吸频率、心率、血压等基本资料; ②肝肾功能、血气分析、NT-proBNP(氨基端脑钠肽前体)等检测数据; ③CT/胸片前后24 h内的心脏超声数据; ④患者呼吸、循环支持治疗条件及预后。
1.3 病例分组根据影像学表现分为双侧PE组和单侧PE组。单侧PE包括右侧和左侧PE(图 1图 2)。
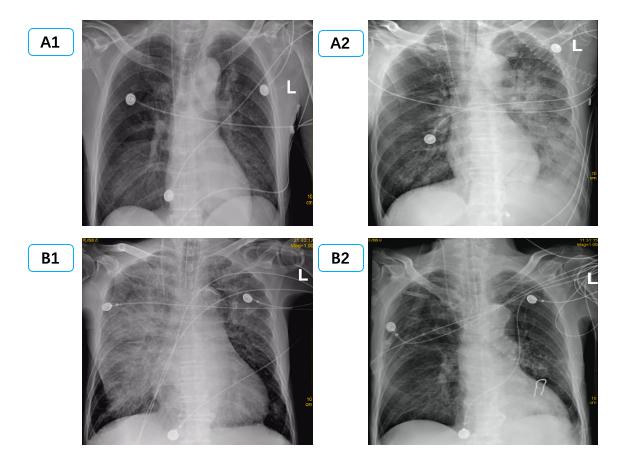
|
| (A1、A2为同一患者,左侧PE,男,65岁,A1为发病前,A2为心脏骤停4 h后。B1、B2为同一患者,右侧PE,男,68岁,B1为心脏骤停后4 h后,B2为治疗3 d后。) 图 1 单侧肺水肿胸片表现 Fig 1 Manifestations of unilateral PE on X-ray |
|
|
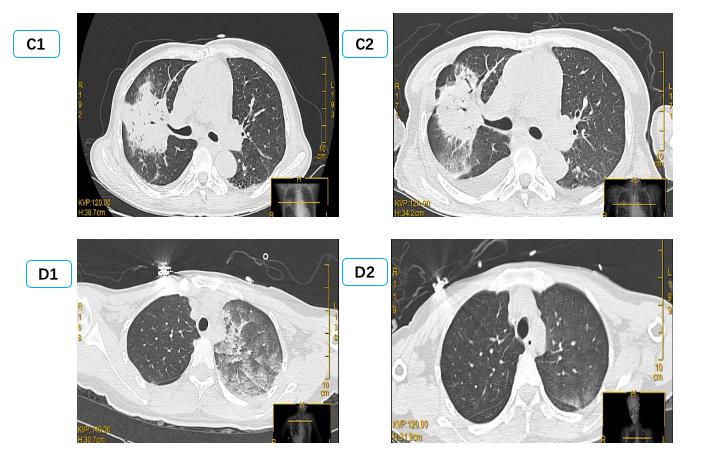
|
| (C1、C2为同一患者,右侧PE,男,56岁,冠状动脉搭桥术后,C1为咳嗽咳痰1周入院时,C2为抗感染治疗14 d后。D1、D2为同一患者,左侧PE,女,32岁,眼眶下局麻后心脏骤停,D1为心脏骤停后3 h,D2为心脏骤停后24 h。) 图 2 单侧肺水肿CT表现 Fig 2 Manifestations of unilateral PE on CT |
|
|
使用SPSS 25.0软件处理数据,采取Kolmogorov-Smirnov方法进行正态分布检验,对于正态分布计量资料采用均数±标准差(x±s)表示,组间比较采用独立t检验; 偏态分布计量资料以中位数[M(Q1,Q3)] 表示,组间比较采用Mann-Whitney U检验。计数资料以百分率表示,计数资料比较采用χ2检验。以患者预后作为因变量,采用二分类Logistic回归分析筛选出患者死亡的相关因素。以双侧P < 0.05为差异有统计学意义。
2 结果通过病历系统回顾性分析2018年1月至2021年1月,共纳入314例患者,其中男性179例,女性135例,年龄18~97岁[(58.8±16.9)岁]。单侧PE患者共14例,发病率4.5%,男性10例,女性4例; 其中以右侧为主单侧PE 11例(78.5%),左侧PE患者3例(21.5%)。1例单侧PE呈右肺上叶局限性分布,(见图患者C),1例单侧PE以左下肺为主(见图患者A),其余单侧PE分布无明显肺段特点。
单侧PE组平均年龄56岁[(33.7~66.5)岁],对比双侧PE组差异无统计学意义。病史方面两组间糖尿病病史、心衰病史、冠心病病史、房颤病史等差异无统计学意义,但单侧PE组心脏骤停及室颤/室速发生率显著高于双侧PE组,分别为28.6% vs.8.0%,28.6% vs. 6.7%,P < 0.05。
临床表现上,相比双侧PE组,单侧PE组血压更低,其中收缩压128(102.7~138)mmHg vs. 135(116~166)mmHg,舒张压72(54~88.2)mmHg vs. 82(69~97.7)mmHg,P均为0.02。实验室检测方面,两组在血气分析、心脏损伤标志物、肝肾功能等方面均差异无统计学意义; 但单侧PE组血常规中白细胞、血红蛋白更低,分别为6.05×109/L(5.0~11.05)vs. 9.0×109/L(6.0~12.25),97 g/L(85.2~119.7)vs. 118 g/L(92.75~136.25),可能与单侧PE组中有两例患者因严重失血导致心脏骤停有关。支持治疗上,两组间药物治疗、呼吸及循环支持、床边血液净化治疗等均差异无统计学意义。最终两组住院病死率对比42.9% vs. 10.0%,P < 0.01。
对比两组心脏超声,左心房、左心室舒张末内径、左心室射血分数、舒张早期二尖瓣峰流速、二尖瓣狭窄、三尖瓣反流等方面均差异无统计学意义。两组间二尖瓣无反流与轻度反流差异无统计学意义,而单侧PE组重度二尖瓣反流更多,无轻度二尖瓣反流(表 2)。
| 指标 | 双侧PE组(n=300) | 单侧PE组(n=14) | χ2或z值 | P值 |
| 男性(n,%) | 169 (56.3) | 10 (71.4) | 1.244 | 0.265 |
| 年龄(岁)a | 58(48-74) | 56(33.7-66.5) | -1.164 | 0.244 |
| 糖尿病病史(n,%) | 95(31.7) | 2(14.3) | 0.1893 | 0.169 |
| 心衰病史(n,%) | 144(48.0) | 6(42.9) | 0.142 | 0.707 |
| 冠心病病史(n,%) | 125(41.7) | 8(57.1) | 1.312 | 0.252 |
| 房颤病史(n,%) | 47(15.7) | 1(7.1) | 0.750 | 0.386 |
| 慢性肾脏病史(n,%) | 79(26.3) | 4(28.6) | 0.034 | 0.853 |
| 心脏骤停(n,%) | 24(8.0) | 4(28.6) | 6.969 | 0.008 |
| 室颤/室速(n,%) | 20(6.7) | 4(28.6) | 9.092 | 0.003 |
| 心率(次/min)a | 94(78.2~112) | 97(87.5~117.3) | -0.845 | 0.398 |
| 呼吸(次/min)a | 23(21~26) | 23.5(20.7~25.5) | -0.059 | 0.953 |
| 收缩压(mmHg)a | 135(116~166) | 128(102.7~138) | -2.242 | 0.025 |
| 舒张压(mmHg)a | 82(69~97.7) | 72(54~88.2) | -2.225 | 0.026 |
| pHa | 7.41(7.34~7.46) | 7.38(7.22~7.43) | -1.662 | 0.096 |
| PaO2 (mmHg)a | 88(69~123) | 93.5(83.5~145.7) | -0.922 | 0.356 |
| PaO2/FiO2(mmHg)a | 211.28(155.88~292.46) | 197.77(140.05~341) | -0.405 | 0.686 |
| HCO3- (mmol/L)a | 21.9(18~24) | 20.5(16~24.2) | -1.151 | 0.250 |
| 血乳酸(mmol/L)a | 1.7(1.2~2.9) | 2.55(1.3~5.42) | -1.431 | 0.152 |
| 白细胞(×109/L)a | 9.0(6.0~12.25) | 6.05(5.0~11.05) | -2.035 | 0.042 |
| 血红蛋白(g/L)a | 118(92.75~136.25) | 97(85.2~119.7) | -2.197 | 0.028 |
| 肌红蛋白(ng/mL)a | 119.5(57.7~277.2) | 191.5(92.5~498) | -0.918 | 0.358 |
| 肌钙蛋白I(ng/mL)a | 0.10(0.03~1.11) | 0.49(0.04~1.19) | -0.497 | 0.619 |
| NT-pro BNP (pg/mL)a | 1578.5(543~3583.5) | 3741(314~6320) | -0.677 | 0.498 |
| CK-MB (U/L)a | 13(8~21) | 18.5(5.5~66.25) | -0.587 | 0.557 |
| 乳酸脱氢酶(U/L)a | 592.5(451~887) | 636.5(498~1499) | -0.481 | 0.631 |
| 血肌酐(μmol/L)a | 107(72~229.5) | 118.5(69.2~287.7) | -0.587 | 0.557 |
| 总胆红素(μmol/L)a | 13.75(8~21) | 16.5(13.2~25.5) | -1.153 | 0.249 |
| 血白蛋白(g/L)a | 35(32~39) | 37(33.7~40.7) | -0.759 | 0.448 |
| 天冬氨酸氨基转移酶[U/L)a | 38.5(25~70.7) | 49.5(33.5~142.5) | -0.874 | 0.382 |
| 碱性磷酸酶(U/L)a | 85.5(66.75~120) | 74(40.3~80) | -1.930 | 0.054 |
| 阿司匹林(n,%) | 165(55.0) | 7(50.0) | 0.135 | 0.713 |
| 氯吡格雷(n,%) | 127(42.3) | 7 (50.0) | 0.321 | 0.571 |
| β受体阻滞剂(n,%) | 210(70.0) | 9(64.3) | 0.207 | 0.649 |
| 他汀制剂(n,%) | 181(60.5) | 7(50.0) | 0.619 | 0.431 |
| 利尿剂(n,%) | 274(91.3) | 12(85.7) | 0.520 | 0.471 |
| 连续性血液净化(n,%) | 78(26.0) | 5(35.7) | 0.649 | 0.420 |
| 呼吸支持(n,%) | 6.075 | 0.108 | ||
| 鼻导管吸氧 | 140(46.7) | 2(14.3) | ||
| 高流量吸氧 | 36(12.0) | 2(14.3) | ||
| 无创呼吸机 | 54(18.0) | 4(28.6) | ||
| 有创呼吸机 | 70(23.3) | 6(42.9) | ||
| 升压药物(n,%) | 2.927 | 0.231 | ||
| 无 | 230(76.7) | 8(57.1) | ||
| 去甲肾上腺素 | 70(23.3) | 6(42.9) | ||
| 主动脉球囊反博(n,%) | 24(8.0) | 3(21.4) | 3.069 | 0.080 |
| 死亡(n,%) | 30(10.0) | 6(42.9) | 14.226 | < 0.001 |
| 注:a为M(Q1,P3); pH为动脉血气pH值; PaO2为动脉血氧分压; PaO2/FiO2为氧合指数; HCO3-为碳酸氢根离子浓度; NT-pro BNP为氨基端脑钠肽前体; CK-MB为肌酸激酶同工酶。 | ||||
| 心脏超声 | 双侧PE组(n=300) | 单侧PE组(n=14) | χ2或z值 | P值 |
| 左心房前后径(mm)a | 40(35-46) | 38.5(29.7-50.5) | -0.792 | 0.428 |
| 左心室舒张末内径(mm)a | 52(46-59) | 55(45-61.75) | -0.272 | 0.786 |
| 左心室射血分数(%)a | 47(40-58) | 51.5(42.75-63.25) | -1.598 | 0.110 |
| E峰(cm)a | 92(70-120) | 94(71.5-118.25) | -0.067 | 0.946 |
| 二尖瓣反流(n, %) | 11.307 | 0.010 | ||
| 无 | 80(26.7) | 4(28.6) | ||
| 轻度 | 118(39.5) | 0(0) | ||
| 中度 | 60(20.1) | 5(35.7) | ||
| 重度 | 42(14.0) | 5(35.7) | ||
| 二尖瓣狭窄(n, %) | 27(9.0) | 1(7.1) | 0.057 | 0.812 |
| 三尖瓣反流(n, %) | 3.174 | 0.366 | ||
| 无 | 128(42.7) | 5(35.7) | ||
| 轻度 | 102(34.0) | 3(21.4) | ||
| 中度 | 52(17.3) | 4(28.6) | ||
| 重度 | 18(6.0) | 2(14.3) | ||
| a为M(Q1,P3) | ||||
以患者预后作为因变量,采用二分类Logistic回归分析筛选出患者死亡的相关危险因素,其中单侧PE表现、使用升压药物、年龄、呼吸支持与患者预后不佳相关; 其中单侧PE表现、使用升压药物优势比分别为17.78、11.67,无心脏骤停病史优势比为0.19(表 3)。
| 变量 | 回归系数 | 标准误 | Wals χ2值 | OR值 | 95%CI | P值 | |
| 单侧肺水肿 | 2.88 | 0.02 | 7.87 | 17.78 | 2.38 | 132.80 | 0.005 |
| 年龄 | 0.07 | 0.02 | 13.89 | 1.07 | 1.03 | 1.10 | < 0.001 |
| 无心脏骤停 | -1.68 | 0.59 | 8.06 | 0.19 | 0.06 | 0.59 | 0.005 |
| 呼吸支持 | 0.69 | 0.31 | 5.21 | 2.01 | 1.10 | 3.65 | 0.022 |
| 升压药物 | 2.45 | 0.67 | 13.46 | 11.67 | 3.14 | 43.36 | < 0.001 |
| 常量 | -12.33 | 2.72 | 20.49 | 0.00 | < 0.001 | ||
根据改良Starling定律,PE是血管外肺水聚集过多的表现,由于肺循环液体滤过和淋巴系统重吸收不平衡导致[1-8]。导致单侧PE发病机制仍然符合改良Starling定律:①单侧毛细血管静水压明显升高,如二尖瓣偏心反流导致单侧肺静脉压明显升高等[9-11],其中二尖瓣后叶脱垂更容易导致右肺上叶受累[10]。单侧肺静脉受压、狭窄、堵塞、解剖变异、手术缝合、血栓形成等回流受阻导致同侧PE[12-15]; 一侧肺动脉因栓塞或张力性气胸导致对侧血流快速增加诱发对侧PE[16-17]; 长时间单侧卧位[18]。②单侧毛细血管间质静水压下降,如单侧气胸及胸腔积液的快速引流后复张性PE[19-20]。③单侧毛细血管滤过系数显著增加,如微创二尖瓣术后发生严重单侧PE,可能与缺血-再灌注损伤、炎症反应有关[21]; ④单侧淋巴回流功能发生障碍,单侧肺移植术后[22]。单侧PE也可有不同机制共同参与,如在气胸引流发生双侧复张性PE,尸检病理显示对侧PE的发生炎症反应有重要作用[23]。在本次研究中,14例单侧PE中13例有心脏病因(5例心脏骤停,5例冠心病患者,1例风湿性心脏病,1例甲亢性心脏病,1例二尖瓣脱垂,1例药物中毒),无复张性和毛细血管通透性改变等因素,因此各种原因导致单侧肺静脉静水压增高仍是本研究中单侧PE的主要机制。心脏骤停、使用血管活性药物等是心源性休克患者院内死亡的独立危险因素[24]。本研究中单侧PE患者心脏骤停发生率、血管活性药物使用率均显著高于双侧PE患者,因此预后更差。
在本次试验中单侧PE发生率为4.5%,高于国外心内科单侧PE 2.1%发病率[2]。同时本次14例单侧PE中,主要(11例,78.5%)为右侧PE,与国外研究类似(16例,89%)[2]。本研究中,两组间左心室射血分数、左心房前后径、左心室舒张末内径等心脏超声参数均差异无统计学意义,与既往研究类似。同时该研究发现单侧PE患者重度二尖瓣反流比例高达100%[2]; 提示二尖瓣反流是导致单侧PE的主要原因。本研究中重度二尖瓣反流在单侧PE组发生率显著高于双侧PE组,35.7% vs 14.0%,但显著低于前述研究,可能与患者纳入标准有关,有5例(35.7%)因心室颤动等原因导致心脏骤停。其中如图 2中D患者,女,32岁,眼眶下局麻后心脏骤停。心脏骤停后3 hCT提示左肺弥漫渗出,但复苏8 h后查心脏超声无明显二尖瓣反流,考虑与心脏骤停冠脉缺血导致暂时性二尖瓣反流有关[25-26],因此24 h后复查CT左肺单侧PE完全消失。
除考虑二尖瓣偏心反流导致单侧或单支肺静脉压力升高,回流受阻,还可能与双侧肺静脉回流角度、大小有关。研究显示左心房入口处,右侧肺静脉相比左侧肺静脉其内径、横截面积均更大[27],同时右肺静脉与二尖瓣反流的角度更小,因此在二尖瓣导致的单侧PE以右侧为主[2],尤其是右上叶为主[9, 11],部分患者PE表现非常局限,常常误诊为肺部感染[9, 28],如图 2中C患者。但本研究中心脏骤停患者,心肺复苏按压时双侧肺静脉回流阻力是否有影响目前尚不明确。
由于单侧PE病情轻重不一,影像表现可以为间质B线、毛玻璃影,严重可表现为肺实变,因此常误诊为肺部感染、肺出血、支气管扩张、肺实变等[29-31]导致病情延误。本研究中有12例单侧PE患者初次影像报告未准确识别; 因此建立重复可量化的单侧PE影像定义及分级标准有组于单侧PE诊断[32]。有心脏病史,心脏超声提示长期二尖瓣反流,长期有右侧胸腔积液,结合入院后床边BNP及肺部超声可以进行鉴别,尤其是床边重症超声可以及时发现明显二尖瓣反流,及时监测肺部超声表现可予以鉴别诊断。如图 4中B患者,入院前肺部CT正常,因失血性休克导致心脏骤停3 h后胸片提示右侧渗出加重,肺部超声由A线为主逐渐发展为B7线、B3线、融合B线及肺实变,提示患者PE程度逐渐加重; 同时心脏超声提示新发重度二尖瓣反流,综合考虑诊断单侧PE,经呼吸支持,利尿治疗后患者胸片、肺部超声均迅速恢复正常。而长期心衰合并二尖瓣反流患者,联合下腔静脉、颈静脉等超声进行容量评估,可与肺部感染相鉴别[33]。急性胸痛患者肌酸激酶同工酶联合床边及时检测肌钙蛋白,可早期诊断心肌梗死,为诊断心源性PE提供依据,本研究中两组间心肌损伤标志物差异无统计学意义。

|
| 图 3 单侧PE患者胸片及二尖瓣反流 Fig 3 X-ray and mitral regurgitation of Unilateral PE |
|
|
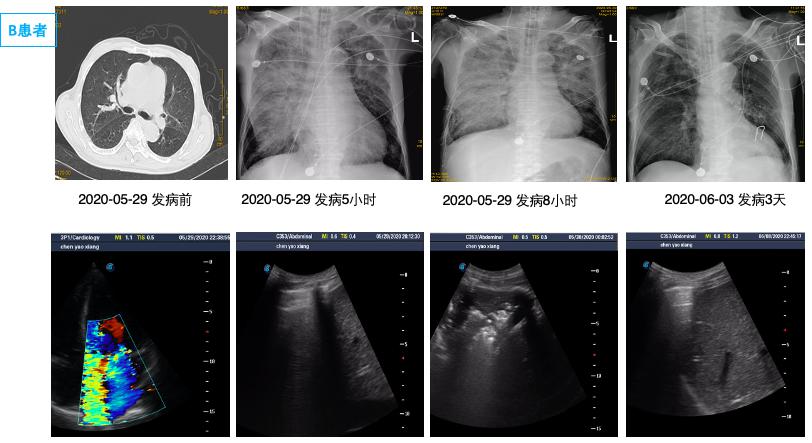
|
| 图 4 患者B胸片及肺部超声改变过程 Fig 4 X-ray and lung ultrasound image of patient B |
|
|
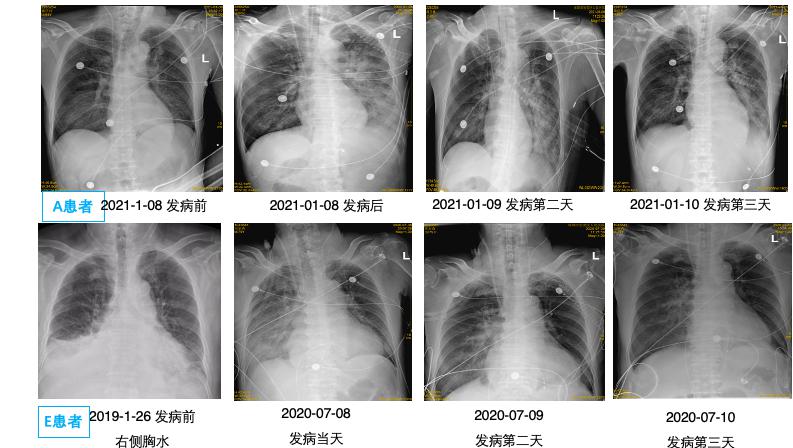
|
| 图 5 单侧PE患者胸片表现 Fig 5 X-ray performance of unilateral PE. |
|
|
单侧PE临床表现差异大,轻者无症状,严重者表现为顽固性低氧血症,需要呼吸机辅助。肺超评分、左心室充盈压和肺动脉收缩压是无创正压通气治疗失败的独立危险因素,尽早识别需要有创辅助通气患者,避免治疗延误[34]。但严重单侧PE由于双侧肺顺应性不一致,为改善氧合提高呼气末正压、增加潮气量,可导致正常一侧肺过度通气,增加肺循环阻力,同时导致更多肺血流进入患侧肺部,全肺通气/血流不一致加重,因此单肺机械通气可能适于单侧PE治疗。研究显示单侧PE分级越高,机械通气时间更长,氧合指数更低[32],但本试验中氧合指数单侧PE和双侧PE组间差异不明显,可能与部分患者症状轻,以及单侧PE组更多使用呼吸机辅助有关。约1.95%~8.3%患者需要体外膜肺支持[4-5],尤其是在心脏术后及心脏骤停后迅速发生的单侧PE。本次研究中无单侧PE行体外膜肺,但有71.4%(10例)患者需要呼吸机支持,其中部分患者病情进展迅速,如图中B患者。呼吸支持是维持单侧PE氧合的关键,但原发病处理如严重二尖瓣脱垂、肺静脉堵塞等手术处理等是单侧PE治疗前提,图中A、B、D、E患者因心脏骤停诱发单侧PE,及时心肺复苏恢复自主循环,全身及冠脉血供稳定后患者单侧PE完全消失; 图中C患者严重器质性二尖瓣反流未处理单侧PE持续无缓解。
随着认识加深及技术改进国外单侧PE的病死率逐渐下降,尤其是在心脏微创术后[30]。但本研究中最终单侧PE住院病死率达到42.9%,且仅有2例患者影像科首次报告中提示单侧PE,提示国内影像科及相关临床科室目前对于单侧PE认识不足; 与影像医师加强沟通,提供心脏骤停、二尖瓣反流等病史对于单侧PE诊断均有提示作用。早期识别诊断、准确针对性治疗是单侧PE处理关键。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王伟:实验操作、论文撰写,研究设计; 余保军,苏盛元,张月辉,王黎,陈锐均:数据收集及整理、统计学分析; 王立军:论文修改。
| [1] | Assaad S, Kratzert WB, Shelley B, et al. Assessment of pulmonary edema: principles and practice[J]. J Cardiothorac Vasc Anesth, 2018, 32(2): 901-914. DOI:10.1053/j.jvca.2017.08.028 |
| [2] | Attias D, Mansencal N, Auvert B, et al. Prevalence, characteristics, and outcomes of patients presenting with cardiogenic unilateral pulmonary edema[J]. Circulation, 2010, 122(11): 1109-1115. DOI:10.1161/CIRCULATIONAHA.109.934950 |
| [3] | Khalil NH, Anders R, Forner AF, et al. Radiological incidence of unilateral pulmonary edema after minimally invasive cardiac surgery[J]. J Cardiothorac Vasc Anesth, 2020, 34(1): 151-156. DOI:10.1053/j.jvca.2019.07.006 |
| [4] | Puehler T, Friedrich C, Lutter G, et al. Outcome of unilateral pulmonary edema after minimal-invasive mitral valve surgery: 10-year follow-up[J]. J Clin Med, 2021, 10(11): 2411. DOI:10.3390/jcm10112411 |
| [5] | Renner J, Lorenzen U, Borzikowsky C, et al. Unilateral pulmonary oedema after minimally invasive mitral valve surgery: a single-centre experience[J]. Eur J Cardiothorac Surg, 2018, 53(4): 764-770. DOI:10.1093/ejcts/ezx399 |
| [6] | Assaad S, Kratzert WB, Shelley B, et al. Assessment of pulmonary edema: principles and practice[J]. J Cardiothorac Vasc Anesth, 2018, 32(2): 901-914. DOI:10.1053/j.jvca.2017.08.028 |
| [7] | Ware LB, Matthay MA. Clinical practice. acute pulmonary edema[J]. N Engl J Med, 2005, 353(26): 2788-2796. DOI:10.1056/NEJMcp052699 |
| [8] | 韩悦, 李文雄. 肺水肿的形成与清除[J]. 中华医学杂志, 2019, 99(25): 1949-1952. DOI:10.3760/cma.j.issn.0376-2491.2019.25.009 |
| [9] | Raman S, Pipavath S. Images in clinical medicine. Asymmetric edema of the upper lung due to mitral valvular dysfunction[J]. N Engl J Med, 2009, 361(5): e6. DOI:10.1056/NEJMicm0801147 |
| [10] | Ravi V, Rodriguez J, Doukky R, et al. Acute mitral regurgitation: the dreaded masquerader[J]. CASE (Phila), 2018, 2(1): 12-15. DOI:10.1016/j.case.2017.10.002 |
| [11] | Valainathan S, Pajot O, Mentec H, et al. Right upper lobe pulmonary edema[J]. Intensive Care Med, 2020, 46(6): 1273-1274. DOI:10.1007/s00134-019-05849-x |
| [12] | Girvin F, Toy D, Escalon J. A unique case of unilateral pulmonary edema from partial anomalous pulmonary venous return in conjunction with superior vena cava stenosis[J]. Clin Imaging, 2021, 79: 110-112. DOI:10.1016/j.clinimag.2021.04.015 |
| [13] | Hirata K, Ishimine T, Nakayama I, et al. Unilateral left pulmonary edema caused by contained rupture of the ascending aortic dissection[J]. Intern Med, 2021, 60(5): 751-753. DOI:10.2169/internalmedicine.5750-20 |
| [14] | Resciniti E, Caso I, Scarfò I, et al. Unilateral pulmonary edema in a patient with worsening tricuspid valve regurgitation: a secret inside pulmonary veins[J]. J Cardiovasc Echogr, 2017, 27(4): 153-155. DOI:10.4103/jcecho.jcecho_26_17 |
| [15] | Tharimena S, R Naidu AV. Post-surgical unilateral left pulmonary edema after mitral valve replacement - A diagnostic challenge[J]. Ann Card Anaesth, 2020, 23(4): 508. DOI:10.4103/aca.aca_180_19 |
| [16] | Kazzaz F, DemLa V, Cherian S. Unilateral pulmonary edema, westermark's sign and palla's sign in pulmonary embolism[J]. QJM, 2017, 110(7): 459-460. DOI:10.1093/qjmed/hcx041 |
| [17] | Koroscil M. Tumbling downhill: unilateral pulmonary edema[J]. Am J Med, 2016, 129(10): 1054-1056. DOI:10.1016/j.amjmed.2016.06.029 |
| [18] | 苏维雪, 钱雪峰, 刘军. 单侧肺水肿一例并文献复习[J]. 中华临床医师杂志(电子版), 2020, 14(11): 944-948. DOI:10.3877/cma.j.issn.1674-0785.2020.11.019 |
| [19] | Kazama S, Hiraiwa H, Kimura Y, et al. A case of reexpansion pulmonary edema and acute pulmonary thromboembolism associated with diffuse large B-cell lymphoma treated with venovenous extracorporeal membrane oxygenation[J]. J Cardiol Cases, 2021, 23(1): 53-56. DOI:10.1016/j.jccase.2020.08.013 |
| [20] | Whitworth K, Mancini M. Reexpansion pulmonary edema[J]. J Am Osteopath Assoc, 2020, 120(1): 49. DOI:10.7556/jaoa.2020.011 |
| [21] | Goyal S, Dashey S, Zlocha V, et al. The successful use of extra-corporeal membrane oxygenation as rescue therapy for unilateral pulmonary edema following minimally invasive mitral valve surgery[J]. Perfusion, 2020, 35(4): 356-359. DOI:10.1177/0267659119874696 |
| [22] | Akindipe O, Fernandez-Bussy S, Staples ED, et al. Late unilateral pulmonary edema in single lung transplant recipients[J]. J Heart Lung Transplant, 2008, 27(9): 1055-1058. DOI:10.1016/j.healun.2008.05.026 |
| [23] | Qu D, Chen N, Qiao DF, et al. Rarely fatal bilateral re-expansion pulmonary edema after inserting a chest tube for unilateral spontaneous pneumothorax: a case report[J]. Forensic Sci Med Pathol, 2021, 17(1): 114-119. DOI:10.1007/s12024-020-00325-1 |
| [24] | 高霏, 张晶, 郑蕾, 等. 心源性休克患者院内死亡危险因素分析[J]. 中华急诊医学杂志, 2021, 30(12): 1470-1475. DOI:10.3760/cma.j.issn.1671-0282.2021.12.011 |
| [25] | Asgar AW, Mack MJ, Stone GW. Secondary mitral regurgitation in heart failure[J]. J Am Coll Cardiol, 2015, 65(12): 1231-1248. DOI:10.1016/j.jacc.2015.02.009 |
| [26] | Chacko J, Brar G, Mundlapudi B, et al. Papillary muscle dysfunction due to coronary slow-flow phenomenon presenting with acute mitral regurgitation and unilateral pulmonary edema[J]. Indian J Crit Care Med, 2018, 22(11): 806-808. DOI:10.4103/ijccm.IJCCM_343_18 |
| [27] | Kim YH, Marom EM, Herndon JE 2nd, et al. Pulmonary vein diameter, cross-sectional area, and shape: CT analysis[J]. Radiology, 2005, 235(1): 43-50. DOI:10.1148/radiol.2351032106 |
| [28] | Stingo FE, Sallam T, Govindu R, et al. It is not pneumonia! A case of unilateral pulmonary edema[J]. Am J Med, 2021, 134(1): e38-e39. DOI:10.1016/j.amjmed.2020.05.050 |
| [29] | Mahdi M, Abbasi F, Mironova M, et al. Acute mitral regurgitation: an unusual cause of unilateral pulmonary consolidation[J]. Cureus, 2021, 13(1): e12707. DOI:10.7759/cureus.12707 |
| [30] | Moss E, Halkos ME, Binongo JN, et al. Prevention of unilateral pulmonary edema complicating robotic mitral valve operations[J]. Ann Thorac Surg, 2017, 103(1): 98-104. DOI:10.1016/j.athoracsur.2016.05.100 |
| [31] | Rahman H, Finnerty J, Somauroo J. Pulmonary oedema mimicking bronchiectasis[J]. BMJ Case Rep, 2013, 2013: bcr2013009720. DOI:10.1136/bcr-2013-009720 |
| [32] | Kesävuori RI, Vento AE, Lundbom NMI, et al. Unilateral pulmonary oedema after minimally invasive and robotically assisted mitral valve surgery[J]. Eur J Cardiothorac Surg, 2020, 57(3): 504-511. DOI:10.1093/ejcts/ezz271 |
| [33] | Pourmand A, Pyle M, Yamane D, et al. The utility of point-of-care ultrasound in the assessment of volume status in acute and critically ill patients[J]. World J Emerg Med, 2019, 10(4): 232-238. DOI:10.5847/wjem.j.1920-8642.2019.04.007 |
| [34] | 朱永城, 江慧琳, 陈晓辉, 等. 床旁心肺超声对急诊室心源性肺水肿无创正压通气的疗效评估[J]. 中华急诊医学杂志, 2020, 29(4): 551-555. DOI:10.3760/cma.j.issn.1671-0282.2020022.009-1 |
 2022, Vol. 31
2022, Vol. 31




