2. 首都医科大学附属北京朝阳医院急诊科,北京 100700;
3. 首都医科大学附属北京友谊医院重症医学科,北京 100050
2. Department of Emergency, Beijing Chaoyang Hospital, Capital Medical University, Beijing 100700, China;
3. Department of Intensive Care Medicine, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China
急性胰腺炎是一种可以发展为全身炎症反应或脓毒症的炎症性疾病[1],发达国家的年发病率为0.034%[2]。大约20%的患者发展为中重度或重症急性胰腺炎(moderately severe or severe acute pancreatitis,MSAP or SAP),伴有或不伴有胰腺或胰周组织坏死或器官衰竭[1, 3]。急性胰腺炎分类提示疾病的2个演变阶段对应2个死亡高峰:(1)早期(7~14 d)全身炎症反应和器官衰竭;(2)晚期持续存在全身炎症、局部并发症或细菌移位[4-5]。晚期仅发生在SAP患者中。胰腺炎相关腹水可能含有胰蛋白酶原和胰蛋白酶等有害物质,可诱发炎症和器官衰竭[6]。由于手术的高风险及并发症[7],开放性坏死组织清创术已逐渐被微创、循序渐进的干预措施所取代[8]。感染坏死性胰腺炎并发临床病情恶化,是进行胰周引流的指征,多项研究表明,胰周引流可以提高SAP治疗的成功率[9-13]。然而,这些大多不是随机对照研究,且在临床实践中,通常没有足够的证据表明胰腺感染和坏死。近一半因持续性器官衰竭而接受手术但无感染性坏死证据的患者,在手术标本中的细菌培养呈阳性[14]。另一方面,早期或过度的有创干预可能对引流无效,却增加创伤和感染的风险[6]。因此,引流时机成为SAP治疗中的关键问题。
APACHEⅡ评分[15]、SOFA评分[16]和CT分级[17]在评估胰腺炎预后方面的价值在既往研究中已经得到肯定。因此,本研究旨在通过APACHE Ⅱ评分、SOFA评分和CT分级,评估早期胰周引流对不同严重程度SAP患者生存结果的影响。
1 资料与方法 1.1 一般资料选择2015年1月至2019年12月福建省立医院、北京朝阳医院住院的所有SAP患者作为研究对象。SAP的标准参照2012年急性胰腺炎分类的国际共识[5]。排除年龄 < 18岁、孕妇、肿瘤、因解剖异常需要手术、接受早期手术干预、入院后72 h内自动出院或死亡、在其他医院治疗超过2周的患者。所有患者接受了常规的抑酸、抑制胰腺分泌、抗休克、早期肠内营养支持、必要时抗菌治疗。对于胆源性胰腺炎患者,在需要时行内镜逆行胰胆管造影或胆道引流。当CT增强平扫提示胰周坏死,或临床考虑有胰腺感染坏死的患者(连续2 d,体温 > 38℃或C反应蛋白或白细胞计数或降钙素原升高),有胰周引流指征。该研究由各机构的机构伦理审查委员会(2019-05-005和Pro 01121)批准。
1.2 研究方法通过书面调查收集数据,记录:性别、年龄、病因、胰腺炎发病后72 h内的CT分级、最高APACHE Ⅱ评分、入院前或入院后48 h内的SOFA评分、胰周导管引流(peripancreatic catheter drainage,PCD)的时间,是否进行血液灌流(perfusion,PF)或持续肾替代治疗(continuous renal replacement therapy,CRRT),随访90 d。根据PCD时间将患者分为早期胰周导管引流组(EPCD)或非早期胰周导管引流组(non-EPCD)。EPCD组为在胰腺炎发病后2周内进行PCD的患者,而non-EPCD组为胰腺炎发病2周后行PCD或未进行PCD的患者。根据腹水的严重程度,分为CTBCD组(小于或等于1个范围的积液)和CTE组。
1.3 统计学方法使用SPSS版本20.0进行统计分析。计量资料以均数±标准差(x±s)或中位数(四分位数)[M(Q1, Q3)]表示,而分类变量用病例数(%)表示。方差分析用于比较正态分布数据,χ2检验用于比较分类数据。使用Cox回归分析存活率。用受试者工作特性(ROC)曲线下面积评估预测值,以最大Youden指数的切点为临界点。以P<0.05为差异具有统计学意义。使用R软件(4.0.2)进行倾向评分模型统计分析。使用最邻近倾向评分匹配(propensity score matching,PSM),1:1匹配,卡钳值为0.04。用协变量间的标准均值误差(standardized mean difference,SMD)评价组间平衡,SMD<0.1提示组间基线平衡。
2 结果 2.1 基线特征在纳入研究的271例患者中,EPCD组70名,其中9名在治疗过程中死亡,non-EPCD组200名,20名在治疗过程中死亡。胆源性胰腺炎100例(36.9%),高脂性胰腺炎81例(29.9%),酒精所致胰腺炎26例(9.6%),其他病因64例(23.6%)。不同病因所致的胰腺炎病死率(χ2=0.371,P=0.946)、APACHE Ⅱ评分(F=7.390,P=0.826)、SOFA评分(F=2.116,P=0.099)和CT分级(χ2=4.283,P=0.892)差无统计学意义。多变量Cox回归分析显示,SOFA评分[1.198, 95%CI: 1.100~1.305(P<0.001)]、APACHE Ⅱ评分[1.081, 95%CI: 1.043~1.120(P < 0.001)]和CT分级E[3.578, 95%CI: 1.321~9.760(P=0.013)]是SAP患者死亡的独立危险因素。
2.2 PCD时机对生存结果影响的倾向评分匹配分析在EPCD组和non-EPCD组之间进行倾向评分匹配。组间性别、年龄、SOFA评分、APACHE Ⅱ评分、CT分级、是否血灌或CRRT的SMD均小于0.1。两组PSM前后协变量和SMD的比较见表 1。
| 指标 | PSM前 | PSM后 | |||||
| 协变量 | EPCD | Non-EPCD | SMD | Non-EPCD | EPCD | SMD | |
| 参与者数量 | 70 | 201 | 55 | 55 | |||
| 女性(%) | 23(32.9) | 49(24.4) | 0.188 | 13(23.6) | 15(27.3) | 0.084 | |
| 年龄 | 44.73±15.8 | 48.08±17.89 | 0.199 | 46.42±17.33 | 45.58±16.40 | 0.050 | |
| APACHE Ⅱ | 6.07±3.99 | 4.68±5.21 | 0.299 | 5.15±5.25 | 5.62±3.51 | 0.091 | |
| SOFA | 2.46±2.68 | 1.86±2.29 | 0.241 | 2.22±2.07 | 2.42±2.56 | 0.086 | |
| CT (E%) | 46(65.7) | 85(42.3) | 0.484 | 30(54.5) | 31(56.4) | 0.037 | |
| PF (%) | 18(25.7) | 20(10.0) | 0.421 | 11(20) | 9(16.4) | 0.093 | |
| CRRT (%) | 18(25.7) | 35(17.4) | 0.203 | 14(25.5) | 12(21.8) | 0.087 | |
| 注:连续变量用x±s表示,分类变量用n(%)表示 | |||||||
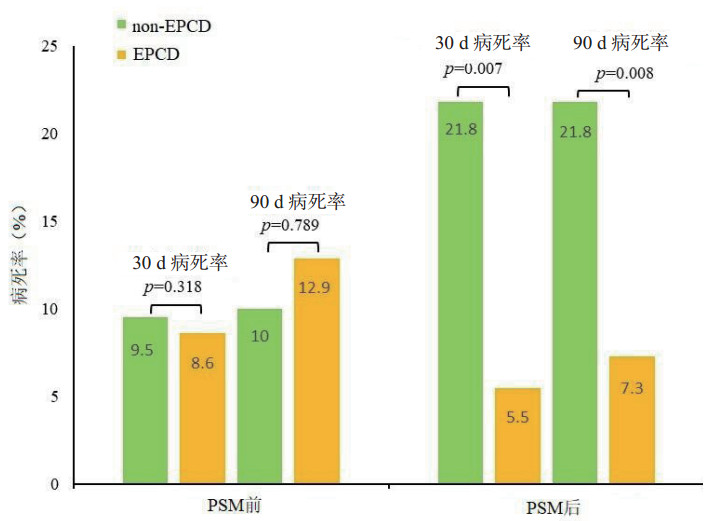
图 1对PSM前后的数据进行Cox回归分析。PSM后,EPCD组和non-EPCD组的30 d和90 d病死率差异有统计学意义。表 2为两组死亡风险的比较。
|
| 柱中的数字代表病死率(%),p值通过多变量Cox回归分析计算 图 1 EPCD和non-EPCD组病死率比较 Fig 1 Comparison of mortality between the EPCD and non-EPCD groups |
|
|
| 组别 | 90 d内死亡病例数 | 30 d内死亡风险 | 90 d内死亡风险 | |||||
| EPCD | Non-EPCD | P值 | HR (95% CI) | P值 | HR (95% CI) | |||
| PSM前 | 9(12.9) | 20(10.0) | 0.318 | 0.602(0.223, 1.629) | 0.789 | 0.889(0.374, 2.110) | ||
| PSM后 | 4(7.3) | 12(21.8) | 0.007 | 0.134(0.029, 0.576) | 0.008 | 0.166(0.044, 0.631) | ||
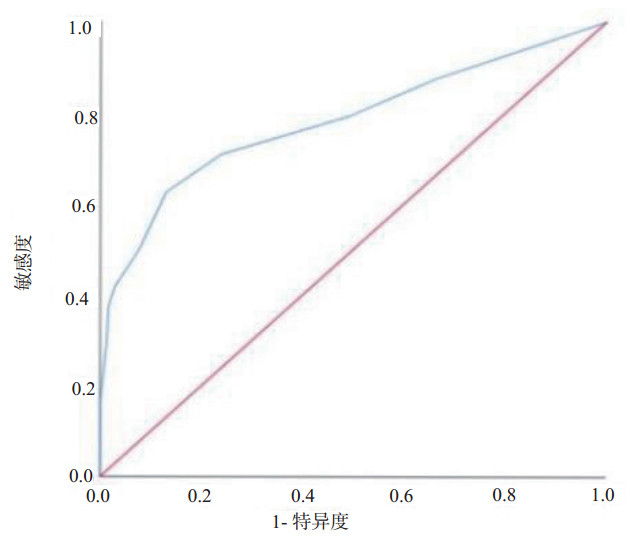
SOFA评分和生存结果的ROC曲线如图 2所示。曲线下面积为(0.713±0.062),P=0.000,最大Youden指数为3.5,敏感度为65.2%,特异度为87.0%。根据Youden指数的最大值、腹水的范围和已知的危险因素,分别将SOFA评分4、CT分级E和APACHE Ⅱ评分8作为分界点进行分层分析。多变量Cox回归分析显示SOFA评分≥4 [3.23, 95%CI:1.26~8.30(P=0.014)],APACHEⅡ评分≥8[2.79, 95%CI: 1.13~6.85(P=0.025)]和CT分级E [4.09, 95%CI: 1.48~11.28(P=0.006)]是SAP患者死亡的独立危险因素。
|
| 图 2 SOFA评分和生存结局的ROC曲线 Fig 2 ROC curve for SOFA score and survival outcome |
|
|
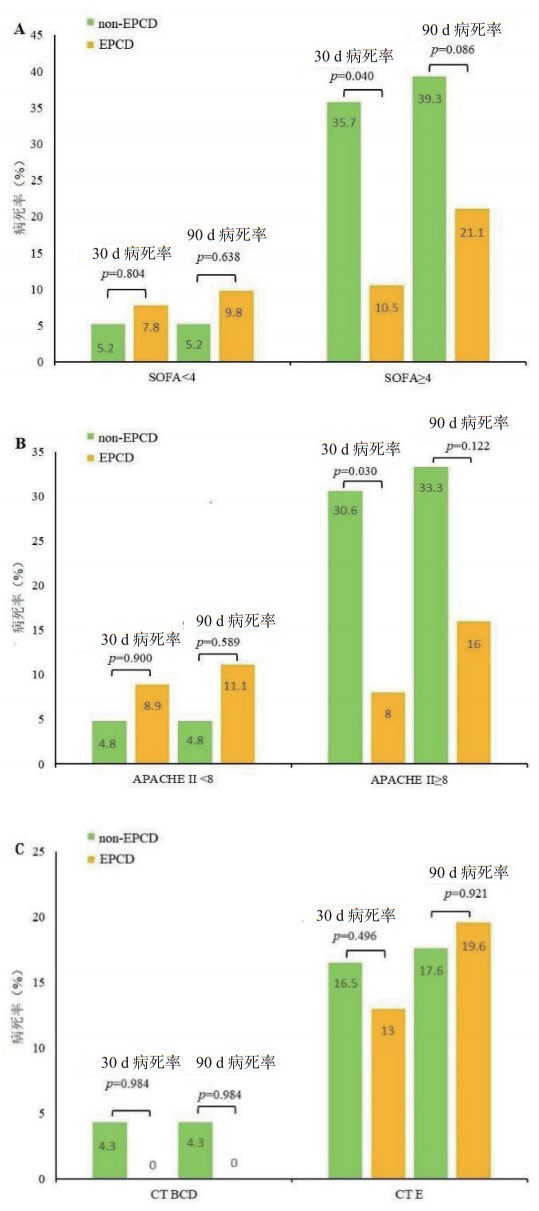
在PSM之前,在不同分层条件下进行多变量Cox回归分析。当SOFA评分 < 4或APACHE Ⅱ评分 < 8时,EPCD组和non-PCD组之间的生存结果差异无统计学意义。然而,当SOFA评分为≥4或APACHE Ⅱ评分为≥8时,两组的30 d病死率差异有统计学意义,但90 d病死率差异无统计学意义。不同CT分级,两组之间的30 d或90 d病死率没差异有统计学意义。EPCD组和non-EPCD组的死亡风险比较见表 3,病死率比较见图 3。
| 分层因素 | 总数 | 90 d内死亡病例数 | 30 d内死亡风险 | 90 d内死亡风险 | |||||
| EPCD | Non-EPCD | P值 | HR (95%CI) | P值 | HR (95%CI) | ||||
| SOFA<4 | 224 | 5(9.8) | 9(5.2) | 0.804 | 0.844(0.220~3.231) | 0.638 | 0.730(0.196~2.711) | ||
| SOFA≥4 | 47 | 4(21.1) | 11(39.3) | 0.040 | 0.161(0.028~0.912) | 0.086 | 0.318(0.080~1.183) | ||
| APACHE Ⅱ<8 | 210 | 5(11.1) | 8(4.8) | 0.900 | 0.918(0.239~3.530) | 0.589 | 0.679(0.163~2.800) | ||
| APACHE Ⅱ≥8 | 61 | 4(16.0) | 12(33.3) | 0.030 | 0.111(0.015~0.814) | 0.122 | 0.297(0.064~1.383) | ||
| CT BCD | 140 | 0(0) | 5(4.3) | 0.984 | 0.000(0.000~ -) | 0.984 | 0.000(0.000~-) | ||
| CT E | 131 | 9(19.6) | 15(16.5) | 0.496 | 0.690(0.238~2.005) | 0.921 | 1.049(0.410~2.683) | ||
|
| A: SOFA<4和≥4时EPCD和non-EPCD组病死率比较;B: APACHE Ⅱ<8和≥8时EPCD和non-EPCD组病死率比较;C: CT BCD级和CTE级时EPCD和non-EPCD组病死率比较。柱中的数字代表病死率(%),P值通过多变量Cox回归分析计算 图 3 EPCD和non-EPCD组在PSM前的病死率比较 Fig 3 Comparison of mortality between the EPCD and non-EPCD groups before PSM |
|
|
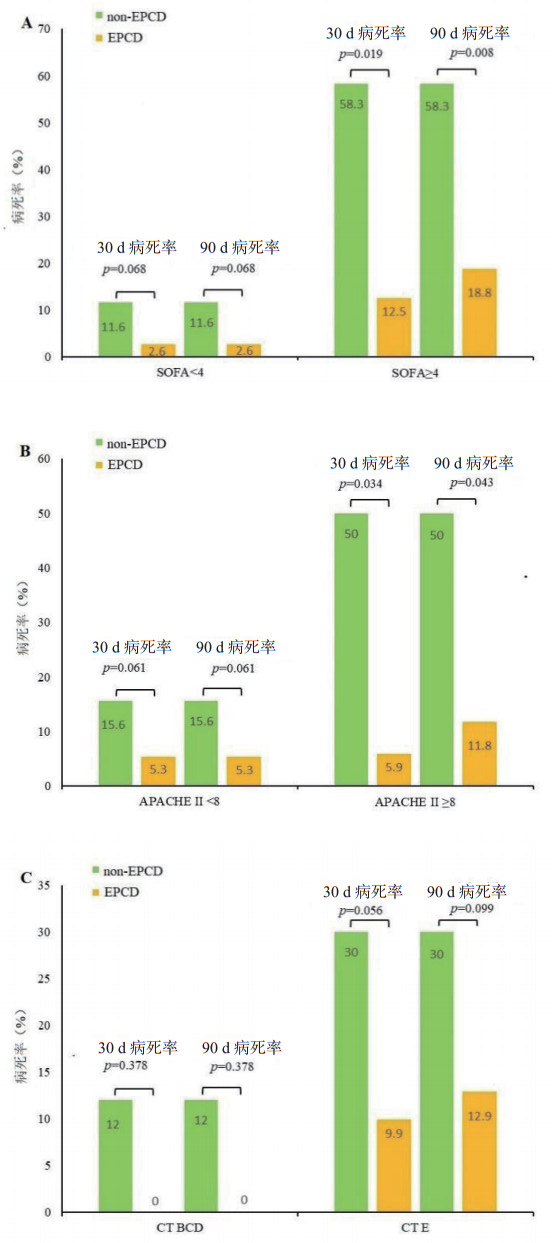
在PSM后的不同分层条件下,进行Cox回归分析。当SOFA评分为≥4或APACHEⅡ ≥8时,EPCD和non-PCD组的30 d和90 d病死率差异有统计学意义,不同CT分级,两组之间的30 d或90 d病死率没差异有统计学意义。EPCD组和non-EPCD组的死亡风险比较见表 4,病死率比较见图 4。
| 分层因素 | 总数 | 90 d内死亡病例数 | 30 d内死亡风险 | 90 d内死亡风险 | |||||
| EPCD | Non-EPCD | P值 | HR (95% CI) | P值 | HR (95% CI) | ||||
| SOFA < 4 | 82 | 1(2.6) | 5(11.6) | 0.068 | 0.104(0.009~1.178) | 0.068 | 0.104(0.009~1.178) | ||
| SOFA≥4 | 28 | 3(18.8) | 7(58.3) | 0.019 | 0.001(0.000~0.036) | 0.008 | 0.004(0.000~0.230) | ||
| APACHE Ⅱ < 8 | 83 | 2(5.3) | 7(15.6) | 0.061 | 0.152(0.021~1.093) | 0.061 | 0.152(0.021~1.093) | ||
| APACHE Ⅱ≥8 | 27 | 2(11.8) | 5(50) | 0.034 | 0.098(0.011~0.841) | 0.043 | 0.183(0.035~0.951) | ||
| CT BCD | 61 | 0(0) | 3(12) | 0.378 | 0.015(0.000~164.707) | 0.378 | 0.015(0.000~164.707) | ||
| CT E | 49 | 4(12.9) | 9(30) | 0.056 | 0.280(0.076~1.036) | 0.099 | 0.370(0.114~1.204) | ||
|
| A: SOFA<4和≥4时EPCD和non-EPCD组病死率比较;B: APACHE Ⅱ<8和≥8时EPCD和non-EPCD组病死率比较;C: CT BCD级和CTE级时EPCD和non-EPCD组病死率比较。柱中的数字代表病死率(%),P值通过多变量Cox回归分析计算。 图 4 EPCD和non-EPCD组在PSM后的病死率比较 Fig 4 Comparison of mortality between the EPCD and non-EPCD groups after PSM |
|
|
急性胰腺炎是一种全身性疾病,疾病的严重程度影响患者的预后。为减少PCD组和non-PCD组之间的偏差,对可能影响预后的危险因素进行倾向性评分匹配。无论是在PSM前或PSM后,SOFA、APACHE Ⅱ和CT分级E均增加了SAP患者的死亡风险;早期胰周置管可降低SAP患者30 d和90 d的病死率。这与之前的研究结果一致,即微创、渐进和分期创伤控制干预可以改善这些患者的预后[8]。本研究中分层分析表明,SOFA和APACHE Ⅱ评分可为SAP患者胰周引流提供早期的决策参考。
2012年急性胰腺炎分类的国际共识[5]认为胰腺炎合并有以下情况之一者:局部并发症、器官衰竭、APACHEⅡ评分≥8、CT分级为D或E级,可诊断为中重症胰腺炎;既往研究肯定了APACHE Ⅱ评分、CT分级对胰腺炎预后评估的价值[15, 17],但对器官衰竭的指标尚无具体标准。SOFA评分作为描述器官衰竭的发生、发展的指标,具有客观、容易获得及可靠的特点[16],多项研究肯定了其对危重患者的器官功能障碍的严重度的评估能力。一项对18万例重症病房中疑似感染患者的回顾性分析提示SOFA评分≥2分时,预测院内病死率的准确性比SIRS标准或qSOFA评分更高[18],且有研究认为SOFA评分可能对重症胰腺炎的预后有更高的预测价值[19-20]。本研究也证实,高SOFA评分、高APACHE Ⅱ评分和CT分级E增加了SAP患者的死亡风险。ROC曲线下的面积证实了SOFA评分对预后的预测价值。结果显示,SOFA评分≥4的患者死亡风险比SOFA评分 < 4的患者高3.23倍。
本研究表明SOFA评分≥4、APACHEⅡ评分≥8级或CT E级有较高的死亡风险。为了减少偏差,根据SOFA评分、APACHEⅡ评分和CT分级,对PCD时机进行分层分析。结果显示对于SOFA评分≥4或APACHEⅡ≥8的患者,早期胰周引流可降低死亡风险。这可能与胰腺炎相关腹水可导致严重的生理功能障碍或器官衰竭[8]有关。早期胰周引流可减少腹水刺激腹部器官,减轻全身炎症反应,降低感染风险和死亡风险。对于SOFA评分 < 4或APACHE Ⅱ评分 < 8的患者,早期胰周引流并不能降低死亡风险,反而可能增加创伤和感染的风险。与最初的假设相反,研究发现CT分级对引流时间的决策没有帮助。积液量不能作为指导早期引流的指标。这可能是因为影像学检查不能直接识别渗出液的来源和性质(即是否合并感染、低蛋白血症、肝硬化、肾功能不全等)。
由于这是一项临床回顾性研究,因此肯定存在一些局限性。首先,由于引流液性质和引流量没差异有统计学意义,因此结果中没有反映。其次,这项研究的样本量,较小,虽然进行了PSM,但仍有一些数据和未知因素未被考虑,这可能导致结果出现偏差。
总之,SOFA评分≥4分或APACHE Ⅱ评分≥8分的急性重症胰腺炎患者,早期胰周引流可降低死亡风险,CT分级对急性重症胰腺炎患者胰周引流时机的决策帮助不大。
利益冲突 所有作者声明无利益冲突
| [1] | Constantinoiu S, Cochior D. Severe acute pancreatitis - determinant factors and current therapeutic conduct[J]. Chirurgia (Bucur), 2018, 113(3): 385-390. DOI:10.21614/chirurgia.113.3.385 |
| [2] | Xiao AY, Tan MLY, Wu LM, et al. Global incidence and mortality of pancreatic diseases: a systematic review, meta-analysis, and meta-regression of population-based cohort studies[J]. Lancet Gastroenterol Hepatol, 2016, 1(1): 45-55. DOI:10.1016/S2468-1253(16)30004-8 |
| [3] | Windsor JA, Petrov MS. Acute pancreatitis reclassified[J]. Gut, 2013, 62(1): 4-5. DOI:10.1136/gutjnl-2012-303725 |
| [4] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis: 2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [5] | Thoeni RF. The revised Atlanta classification of acute pancreatitis: its importance for the radiologist and its effect on treatment[J]. Radiology, 2012, 262(3): 751-764. DOI:10.1148/radiol.11110947 |
| [6] | Trikudanathan G, Arain M, Attam R, et al. Interventions for necrotizing pancreatitis: an overview of current approaches[J]. Expert Rev Gastroenterol Hepatol, 2013, 7(5): 463-475. DOI:10.1586/17474124.2013.811055 |
| [7] | 孙备, 冀亮. 创伤递升式分阶段治疗重症急性胰腺炎的临床实践与思考[J]. 中华外科杂志, 2015, 53(9): 653-56. DOI:10.3760/cma.j.issn.0529-5815.2015.09.004 |
| [8] | Ramudo L, Yubero S, Manso MA, et al. Signal transduction of MCP-1 expression induced by pancreatitis-associated ascitic fluid in pancreatic acinar cells[J]. J Cell Mol Med, 2009, 13(7): 1314-1320. DOI:10.1111/j.1582-4934.2008.00529.x |
| [9] | Jagielski M, Smoczyński M, Studniarek M, et al. Endoscopic drainage combined with percutaneous drainage in treatment of walled-off pancreatic necrosis - a single-center experience[J]. Prz Gastroenterol, 2018, 13(2): 137-142. DOI:10.5114/pg.2018.72604 |
| [10] | Huang Z, Yu SH, Liang HY, et al. Outcome benefit of abdominal paracentesis drainage for severe acute pancreatitis patients with serum triglyceride elevation by decreasing serum lipid metabolites[J]. Lipids Health Dis, 2016, 15: 110. DOI:10.1186/s12944-016-0276-6 |
| [11] | Zhang H, Chen GY, Xiao L, et al. Ultrasonic/CT image fusion guidance facilitating percutaneous catheter drainage in treatment of acute pancreatitis complicated with infected walled-off necrosis[J]. Pancreatology, 2018, 18(6): 635-641. DOI:10.1016/j.pan.2018.06.004 |
| [12] | van Baal MC, van Santvoort HC, Bollen TL, et al. Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis[J]. Br J Surg, 2011, 98(1): 18-27. DOI:10.1002/bjs.7304 |
| [13] | Horvath K, Freeny P, Escallon J, et al. Safety and efficacy of video-assisted retroperitoneal debridement for infected pancreatic collections: a multicenter, prospective, single-arm phase 2 study[J]. Arch Surg, 2010, 145(9): 817-825. DOI:10.1001/archsurg.2010.178 |
| [14] | Rodriguez JR, Razo AO, Targarona J, et al. Debridement and closed packing for sterile or infected necrotizing pancreatitis[J]. Ann Surg, 2008, 247(2): 294-299. DOI:10.1097/sla.0b013e31815b6976 |
| [15] | Mok SRS, Mohan S, Elfant AB, et al. The acute physiology and chronic health evaluation IV, a new scoring system for predicting mortality and complications of severe acute pancreatitis[J]. Pancreas, 2015, 44(8): 1314-1319. DOI:10.1097/MPA.0000000000000432 |
| [16] | Vincent JL, Moreno R, Takala J, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure[J]. Intensive Care Med, 1996, 22(7): 707-710. DOI:10.1007/BF01709751 |
| [17] | Balthazar EJ, Robinson DL, Megibow AJ, et al. Acute pancreatitis: value of CT in establishing prognosis[J]. Radiology, 1990, 174(2): 331-336. DOI:10.1148/radiology.174.2.2296641 |
| [18] | Raith EP, Udy AA, Bailey M, et al. Prognostic accuracy of the SOFA score, SIRS criteria, and qSOFA score for in-hospital mortality among adults with suspected infection admitted to the intensive care unit[J]. JAMA, 2017, 317(3): 290. DOI:10.1001/jama.2016.20328 |
| [19] | Adam F, Bor C, Uyar M, et al. Severe acute pancreatitis admitted to intensive care unit: SOFA is superior to Ranson's criteria and APACHE Ⅱ in determining prognosis[J]. Turk J Gastroenterol, 2013, 24: 430-435. DOI:10.4318/tjg.2013.0761 |
| [20] | 张东, 杨艺敏, 段奥凇, 等. AGI分级系统引入SOFA评分对重症急性胰腺炎患者预后预测价值的研究[J]. 中华急诊医学杂志, 2015, 24(10): 1118-1121. DOI:10.3760/CMA.J.ISSN.1671-0282.2015.10.017 |
 2022, Vol. 31
2022, Vol. 31




