2. 浙江大学医学院附属第一医院麻醉科,杭州 310003
2. Department of Anesthesiology, the First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China
脓毒症(sepsis)是感染引起的机体反应失调导致危及生命的器官功能障碍,是感染、严重烧创伤和外科大手术后常见的并发症。据报道,全球每年有4 890万人罹患脓毒症,脓毒症相关死亡病例超过1 100万人[1-2]。脓毒症目前缺乏特异、有效的治疗手段,究其根本原因与脓毒症过程中机体重要组织器官的损伤和稳态失衡机制尚未完全阐明密切相关[3-4]。
脓毒症重要的致死原因之一是凝血功能紊乱,尤其是并发弥散性血管内凝血时病死率将大大增加[5]。活化蛋白C(activated protein C, APC)途径是机体重要的天然抗凝途径之一[6-7]。在脓毒症发生发展中,由于蛋白合成受损、持续消耗和蛋白降解作用,使得APC浓度显著降低,出现病理性的血栓形成,进而影响脓毒症的预后[8-11]。研究报道蛋白C水平受人群遗传变异的影响[12-14]。在中国汉族人群中,蛋白C基因的单倍型-1641A/-1654C与脓毒症患者的器官功能损伤严重程度和不良预后密切相关,而且这一单倍型是中国汉族人特有的脓毒症重要遗传标志,但是该单倍型如何影响脓毒症的病理生理进展仍不清楚[15]。因此,本前瞻性队列研究将探究蛋白C -1641A/-1654C单倍型与脓毒症患者活化蛋白C水平和凝血功能的相关性。
1 资料与方法 1.1 一般资料脓毒症患者根据美国危重病学协会制定的脓毒症诊断标准(sepsis-3)[1]纳入,急性器官功能障碍为序贯器官衰竭评估(sequential organ failure assessment, SOFA)评分≥2,患者均为汉族人群。排除标准包括:(1)获得性免疫缺陷综合征患者;(2)8周内接受过化疗、急性中毒等患者;(3)器官移植后接受过免疫抑制剂治疗的患者;(4)近4周内使用过皮质类固醇的患者。记录患者的临床资料,包括入院24 h内的急性生理与慢性健康评估评分Ⅱ (acute physiology and chronic health evaluation, APACHE Ⅱ)和SOFA评分,实验室检验数据等。本研究经浙江大学伦理委员会批准(伦审研第(实2019-003)号),并获得患者或患者近亲属的知情书面同意。
1.2 方法 1.2.1 基因组DNA的提取采集患者2 mL外周血至2%乙二胺四乙酸二钠抗凝管,采用全血DNA提取试剂盒(QIAamp DNA Blood Mini Kit,德国QIAGEN公司),严格按照说明书提取样本基因组DNA。用分光光度计测定DNA的浓度和纯度,保存在-80 ℃冰箱中待用。
1.2.2 SNP的基因组分型采用直接测序法检测位点-1641A > G(rs1799809)和-1654C > T(rs1799808)的基因型。根据数据库已公布的蛋白C基因序列(GenBank:AF378903)设计PCR扩增引物,两个SNPs位点被扩增到一个PCR片段中,引物序列为:上游引物5’-TCTGAAAAACAGGGACAACG-3’,下游引物5’-CGGGTCGTGGAGATACTGC-3’,PCR反应体系总体积为25 µL,其中包括50 ng基因组DNA,1.5 mmol/L MgCl2,上、下游引物分别0.5 mmol/L,200 mmol/L dNTP,1 U TaKaRa热启动Taq聚合酶,1×PCR缓冲液,以及适量无菌去离子水(DEPC水)。PCR扩增条件为:95℃预变性10 min;95℃变性10 s,56℃退火10 s,72℃延伸15 s,共进行35次循环;之后72℃再延伸10 min,最后4℃储存。PCR产物采用QIAquick 96 PCR Purification Kit(QIAGEN, Hilden, Germany)进行纯化后,将1 µL纯化的PCR产物,与2 µL BigDye 3.1混悬液(Applied Biosystems, Foster City, CA, USA),再加入0.4 µmol/L上述下游引物进行反应,扩增条件为96 ℃变性1 min;96℃变性10 s,50℃退火5 s,60℃延伸4 min,共进行28次循环;再使用酒精纯化产物,放入ABI3730基因分析仪(Applied Biosystems, Foster City, CA, USA)中,基于ABI3730 DNA测序工具和Polyphred (http://droog.mbt.washington.edu/poly_get.html)数据库进行分析。将样本的测序结果与GenBank序列进行比较,鉴定出基因型。
1.2.3 血浆APC浓度测定血浆中的APC浓度,采用STA®-Stachrom® Protein C试剂盒,严格按照说明书进行样本APC浓度测定。
1.3 统计学方法计量资料采用均数±标准差(x±s)或中位数(四分位数)[M(Q1, Q3)]表示,计数资料用百分率表示。计量资料采用非配对t检验或Mann-Whitney U检验进行分析,计数资料采用Fisher精确检验或χ2检验进行分析。所有统计分析均使用SPSS24.0统计学软件和GraphPad Prism 9.0软件进行分析,以P < 0.05为差异有统计学意义。
2 结果共有174例脓毒症患者进行了基因分型,并根据单倍型分为两组,其中60例患者携带-1641A/-1654C(简称AC)单倍型,其余114例患者为非AC携带者。患者的临床特征见表 1。
| 临床特征 | AC携带者(n = 60) | 非AC携带者(n = 114) | P值 |
| 年龄(x±s) | 60.3 ± 15.6 | 61.4 ± 16.3 | P > 0.05 |
| 男性(n, %) | 49 (81.7) | 77 (67.5) | P > 0.05 |
| APACHE Ⅱ评分(x±s) | 15.7 ± 6.5 | 17.2 ± 7.4 | P > 0.05 |
| SOFA评分(x±s) | 8.7 ± 4.5 | 7.8 ± 4.2 | P > 0.05 |
| 白细胞计数[M(Q1, Q3)] | 10.8 (6.0-16.4) | 10.8 (6.6-19.2) | P > 0.05 |
| C反应蛋白水平[M(Q1, Q3)] | 135.6 (67.7-227.8) | 134.2 (83.1-201.2) | P > 0.05 |
| 感染部位(n, %) | |||
| 肺 | 37 (61.7) | 59 (51.7) | P > 0.05 |
| 腹腔 | 25 (41.7) | 42 (36.8) | P > 0.05 |
| 外周血 | 13 (21.6) | 18 (15.8) | P > 0.05 |
| 泌尿系统 | 2 (3.3) | 4 (3.5) | P > 0.05 |
| 其他部位 | 2 (3.3) | 10 (8.7) | P > 0.05 |
| 感染菌群种类(n%) | |||
| 革兰氏阳性菌 | 15 (25.0) | 27 (23.7) | P > 0.05 |
| 革兰氏阴性菌 | 37 (61.7) | 62 (54.4) | P > 0.05 |
| 真菌 | 21 (35.0) | 39 (34.2) | P > 0.05 |
| ICU住院时间[M(Q1, Q3)] | 6.5 (3-20) | 10 (5-15) | P > 0.05 |
| 住院时间[M(Q1, Q3)] | 20 (11-31) | 20 (13-29.75) | P > 0.05 |
| 28d存活(n, %) | 48(80.0) | 83 72.8) | P > 0.05 |
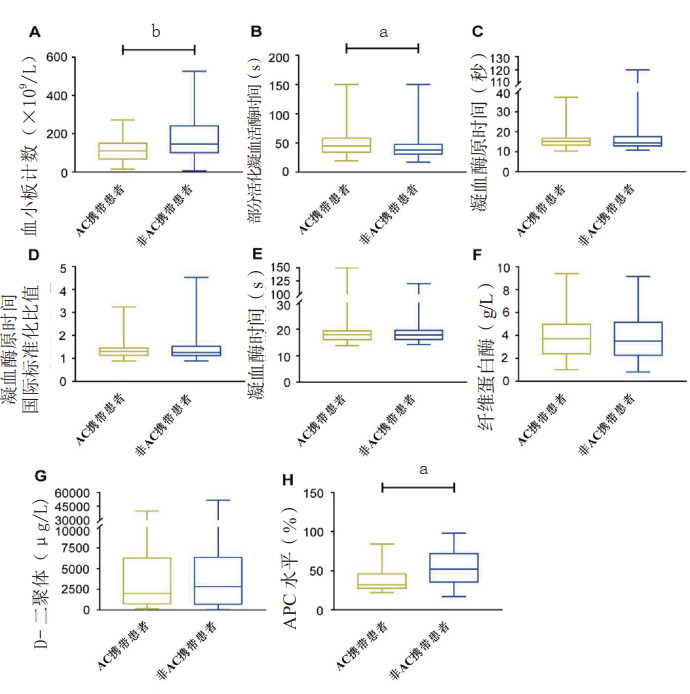
首先分析蛋白C基因AC单倍型对脓毒症患者凝血/纤溶过程的影响,发现蛋白C的AC携带患者血小板计数[M(Q1, Q3)](110.5, 67.5~150.8)明显低于非AC携带患者[M(Q1, Q3)](146.0, 100.5~241.0;P < 0.001;图 1A )。
|
| 数据以中位数表示、箱形图展示,组间比较用Mann-Whitney U检验,aP < 0.05, bP < 0.001。APTT:延长活化部分凝血活酶时间;PT:凝血酶原时间;PT-INR:凝血酶原时间国际标准化比值;TT:凝血酶时间;APC:活化蛋白C 图 1 脓毒症患者蛋白C基因AC单倍型携带者和非AC携带者的常规凝血/纤溶功能检测和APC水平 Fig 1 Routine coagulation/fibrinolysis tests and APC levels in septic patients with protein C gene between AC haplotype carriers and non-AC haplotype carriers |
|
|
相比非AC携带患者,AC携带患者的部分活化凝血活酶时间明显延长(44.7 s vs. 37.9 s,P < 0.05;图 1B)。其他凝血/纤溶参数,包括凝血酶原时间、凝血酶原时间国际标准化比值、凝血酶时间、纤维蛋白原和D-二聚体,在两组患者之间差异无统计学意义(图 1C-G)。
进一步分析蛋白C基因AC单倍型与脓毒症凝血功能紊乱的生物学相关性,共检测34例脓毒症患者血浆的APC水平,其中13例为AC携带患者,21例为非AC携带患者。发现AC携带患者的APC水平明显低于非AC携带患者(32.0 vs. 52.0,P < 0.05;图 1H)。
3 讨论蛋白C是一种内源性抗凝蛋白,具有多种生物活性,其激活形式为APC[6]。蛋白C基因的遗传变异,如单核苷酸多态性(如-1641A > G和-1654C > T)及其相关的单倍型(如-1641G/-1654C)不仅是静脉血栓形成和脓毒症的常见危险因素,而且影响欧洲人群的循环活化蛋白C水平[12, 15]。-1641A/-1654C单倍型是中国汉族人群重症脓毒症的高危因素[15]。本研究进一步证实携带蛋白C基因AC单倍型的脓毒症患者在ICU入院时血浆APC水平明显降低,提示在中国汉族人群中蛋白C基因中的单倍型-1641A/-1654C可能通过直接影响APC水平在脓毒症病理生理过程中发挥重要作用。
蛋白C一旦被激活,APC及其辅酶因子在带负电荷的磷脂膜(如血小板膜)表面降解因子Ⅷa和Ⅴa来抑制凝血[6-7]。当APC水平较低时,其抗凝活性随之降低,而凝血过程产生了大量的凝血酶,从而激活并消耗了血小板和辅酶因子Ⅷa和Ⅴa。辅酶因子Ⅷa和Ⅴa的消耗会导致异常的内源性凝血途径,从而延长部分活化凝血活酶时间[6-7, 16]。因此,携带蛋白C基因AC单倍型的脓毒症患者在ICU住院时血小板计数较非AC携带患者更低、部分活化凝血活酶时间更长。
虽然携带蛋白C基因AC单倍型的脓毒症患者会出现更严重的凝血功能紊乱,但这些患者的病死率、ICU时间/住院时间等与非AC携带者差异无统计学意义,这与之前的报道不一致[15]。其原因可能有:首先,随着脓毒症的支持治疗和目标导向干预的进展,脓毒症的病死率有所下降[2-3]。其次,携带蛋白C基因AC单倍型的脓毒症患者血小板计数较低,APTT时间延长,这些患者将在入院时已经被临床医生列入“高危”名单,临床上已常规开展这些高危患者的凝血、纤溶系统的功能动态监测和精准治疗,因而提高了治疗效果[15]。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张艳:实验操作、论文撰写;叶慧:数据收集及整理;陈齐兴:研究设计、统计学分析、论文修改;舒强:研究设计、论文修改
| [1] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/S0140-6736(18)30696-2 |
| [2] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national Sepsis incidence and mortality, 1990-2017:analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [3] | Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272. DOI:10.1164/rccm.201504-0781OC |
| [4] | 张艳, 吴晓梁, 侯金超, 等. TET2基因单核苷酸多态性与脓毒症易感性和预后的相关性研究[J]. 中华急诊医学杂志, 2019, 28(10): 1261-1265. DOI:10.3760/cma.j.issn.1671-0282.2019.10.016 |
| [5] | Levi M, van der Poll T. Coagulation and sepsis[J]. Thromb Res, 2017, 149: 38-44. DOI:10.1016/j.thromres.2016.11.007 |
| [6] | Griffin JH, Zlokovic BV, Mosnier LO. Activated protein C: biased for translation[J]. Blood, 2015, 125(19): 2898-2907. DOI:10.1182/blood-2015-02-355974 |
| [7] | Marar TT, Matzko CN, Wu J, et al. Thrombin spatial distribution determines protein C activation during hemostasis and thrombosis[J]. Blood, 2022, 139(12): 1892-1902. DOI:10.1182/blood.2021014338 |
| [8] | Ruf W. New players in the Sepsis-protective activated protein C pathway[J]. J Clin Invest, 2010, 120(9): 3084-3087. DOI:10.1172/JCI44266 |
| [9] | Li YP, Wan DY, Luo XY, et al. Circulating histones in sepsis: potential outcome predictors and therapeutic targets[J]. Front Immunol, 2021, 12: 650184. DOI:10.3389/fimmu.2021.650184 |
| [10] | Brunkhorst F, Sakr Y, Hagel S, et al. Protein C concentrations correlate with organ dysfunction and predict outcome independent of the presence of sepsis[J]. Anesthesiology, 2007, 107(1): 15-23. DOI:10.1097/01.anes.0000267531.39410.d3 |
| [11] | 姜洁, 吕菁君, 叶璐, 等. 可溶性血栓调节蛋白及中性粒细胞明胶酶相关脂质运载蛋白早期预测脓毒症相关急性肾损伤的临床研究[J]. 中华急诊医学杂志, 2020, 29(4): 533-540. DOI:10.3760/cma.j.issn.1671-0282.2020022.007-1 |
| [12] | Aiach M, Nicaud V, Alhenc-Gelas M, et al. Complex association of protein C gene promoter polymorphism with circulating protein C levels and thrombotic risk[J]. Arterioscler Thromb Vasc Biol, 1999, 19(6): 1573-1576. DOI:10.1161/01.atv.19.6.1573 |
| [13] | Liang YB, Huang X, Jiang YJ, et al. Endothelial protein C receptor polymorphisms and risk of sepsis in a Chinese population[J]. J Int Med Res, 2017, 45(2): 504-513. DOI:10.1177/0300060516686496 |
| [14] | Vassiliou AG, Maniatis NA, Kotanidou A, et al. Endothelial protein C receptor polymorphisms and risk of severe sepsis in critically ill patients[J]. Intensive Care Med, 2013, 39(10): 1752-1759. DOI:10.1007/s00134-013-3018-5 |
| [15] | Chen QX, Wu SJ, Wang HH, et al. Protein C-1641A /-1654C haplotype is associated with organ dysfunction and the fatal outcome of severe sepsis in Chinese Han population[J]. Hum Genet, 2008, 123(3): 281-287. DOI:10.1007/s00439-008-0476-x |
| [16] | 刘禹赓, 李春盛. 蛋白C、活化蛋白C与脓毒症[J]. 中华急诊医学杂志, 2006, 15(8): 763-764. DOI:10.3760/j.issn:1671-0282.2006.08.032 |
 2022, Vol. 31
2022, Vol. 31




