急性胰腺炎(acute pancreatitis,AP)是由各种病因诱导胰酶激活,从而发生一系列炎症反应(如胰腺自身消化、水肿和出血等),可同时伴有全身其他器官功能障碍的疾病。近些年来,我国AP发病率仍居较高水平,总病死率为3.8%~7%[1],其中重症急性胰腺炎(severe acute pancreatitis, SAP)的病死率更高,为10% ~30%[4]。急性生理学及慢性健康状况评分系统(acute physiology and chronic health evaluation scoring system, APACHE Ⅱ)、Ranson评分以及急性胰腺炎严重程度床边指数(bedside index of severe acute pancreatitis, BISAP)等虽能用于评估AP病情严重程度,但其繁琐复杂等特点限制了其在临床中的使用,因此迫切需要一种更加简单、快速、准确的预测指标来早期发现SAP患者。
载脂蛋白B(apolipoprotein B, Apo B)和载脂蛋白A1(apolipoprotein A1, Apo A1)可作为急性时相蛋白,反应AP患者的炎症状态[3]。自噬的过度激活也参与了炎症的发生及脂肪酶的异常激活[4],而微管相关蛋白1-轻链3 (microtubule-associated protein 1-light chain 3, MAP1-LC3)作为自噬信号通路中不可或缺的蛋白之一,参与了自噬体形成[5],成为反应机体自噬程度的重要指标。内皮细胞受到多种炎症介质的调控后可大量表达细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)来介导白细胞的黏附与迁移[6]。
目前在Apo B/A1联合MAP1-LC3和ICAM-1综合评估SAP方面的文献较为少见。鉴于此,本研究通过检测体检健康者和AP患者以上3项指标水平并进行比较,旨在探讨其在早期评估AP患者病情严重程度中的临床价值。
1 资料与方法 1.1 一般资料收集2019年1月至2020年8月安徽医科大学第二附属医院急诊外科诊治的AP患者资料共413例。纳入标准:①AP诊断符合2012年修订的亚特兰大国际共识[7-8];②包含所需临床参数:性别、身高、体重、血清Apo B、Apo A1水平以及Ranson评分[8]系统所需的入院5项指标(年龄、血糖、天门冬氨基酸转移酶、乳酸脱氢酶、白细胞计数)及入院48 h的6项指标(血钙、氧分压、碱缺失、血尿素氮、红细胞比容、体液丢失量)等;③入院后24 h内进行了血清Apo B、Apo A1(入院时已常规进行了实验室检查)、MAP1-LC3以及ICAM-1等检测;④同意参加本研究并签署知情同意书。排除标准:入院前已经治疗的AP;AP发病距离入院时间 > 48 h;慢性胰腺炎的急性加重期;严重的心、肺、肾疾病,风湿免疫系统疾病,代谢性疾病等基础疾病者;一月内有外伤史;临床资料不完整;排除入院前后一个月需行手术治疗的患者;合并恶性肿瘤等患者;长期服用免疫抑制剂、激素等特殊药物史患者。将入选AP患者分为Non-SAP组和SAP组,其中入选SAP组的患者需同时满足以下条件: 具备AP诊断标准,同时必须伴有持续(>48 h)的器官功能衰竭(一种器官的改良Marshall评分表≥2分)[7]。其余AP患者纳入Non-SAP组。并于同期随机选取60例本院体检健康的志愿者(同意参加本研究并签署知情同意书)为对照组(NC组),NC组志愿者为经询问病史、体格检查、生化及影像检查、胃肠镜检查确认健康者。
本研究通过了安徽医科大学第二附属医院伦理委员会的伦理认证[伦理号为:YX2021-046 (F1)]。
1.2 研究方法收集对照组体检当日和AP患者入院24 h内的空腹外周静脉血,分别抽取4 mL,以离心半径6 cm、3000 r/min的转速离心12 min后收集上层血清,分装于EP管(NEST, Jiangsu, China)后置于-80 ℃超低温冰箱(Thermo Fisher Scientific, Massachusetts, USA)中保存待测。收集了所有参与者血清Apo B和Apo A1水平后计算Apo B/A1值,利用酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)检测血清MAP1-LC3和ICAM-1水平,其中检测MAP1-LC3的ELISA试剂盒由Fine Test公司(Hubei, China),检测ICAM-1的ELISA试剂盒由Abcam公司(Cambridgeshire, UK)提供。检测过程严格按照相关说明书进行操作,并且患者入院后首次Ranson评分在入院后48 h完成。所有AP患者均严格参照诊疗指南进行对症诊疗[9]。
1.3 统计学方法数据采用SPSS 23.0进行统计分析,计量资料以均数±标准差(x±s)表示,多组独立样本比较采取单因素方差分析,两独立样本比较采取成组t检验;计数资料采用百分比(%)表示,采用χ2检验或者Fisher's exact test较两样本的差异性;变量间的相关性分析采用Pearson相关性分析进行分析;采取受试者工作特征曲线(receiver operating characteristic curve, ROC)评价Apo B/A1、MAP1-LC3和ICAM-1水平对AP病情严重程度的诊断价值,以P < 0.05为差异有统计学意义。
2 结果 2.1 患者基本情况比较收集413例AP患者,按病情严重程度分为两组: Non-SAP组共315例,其中男191例,女124例,年龄(40.25±17.73)岁,身体质量指数为(24.87±3.09) kg/m2; SAP组共98例,男53例,女45例,年龄(42.65±18.02)岁,身体质量指数为(24.74±2.75) kg/m2; 对照组60例,其中男28例,女32例,年龄(42.81±17.65)岁,身体质量指数为(24.21±2.85) kg/m2。三组研究对象在年龄、性别和身体质量指数等方面差异均无统计学意义(P>0.05)。见表 1。
| 组别 | 例数(例) | 年龄(岁) | 性别(男/女) | BMI(kg/m2) |
| NC | 60 | 42.81±17.65 | 28/32 | 24.21±2.85 |
| Non-SAP | 315 | 40.25±17.73 | 191/124 | 24.87±3.09 |
| SAP | 98 | 42.65±18.02 | 53/45 | 24.74±2.75 |
| F值/χ2 | - | 1.010 | 4.617 | 1.194 |
| P值 | - | 0.365a | 0.099b | 0.304a |
| 注:BMI: 身体质量指数。P值得获得是通过以下检验方法获得的:a单因素方差分析;bχ2检验 | ||||
NC组、Non-SAP组以及SAP组患者血清中Apo B/A1水平分别为(0.61±0.27)、(0.96±0.34)和(2.21±1.40), 差异有统计学意义(F =142.29, P < 0.01);MAP1-LC3水平分别为(0.26±0.15) ng/mL、(0.48±0.24) ng/mL和(0.92±0.29) ng/mL, 差异有统计学意义(F =171.72, P < 0.01);ICAM-1水平分别为(19.25±5.12) ng/mL、(120.28±61.69) ng/mL和(235.57±54.50) ng/mL, 差异有统计学意义(F=293.95, P < 0.01)。见图 1。
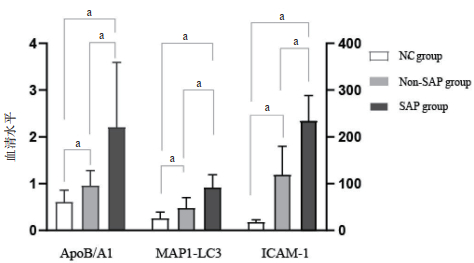
|
| 与相应对照组比较,aP < 0.01 图 1 分组血清Apo B/A1、MAP1-LC3和ICAM-1水平比较 Fig 1 Serum levels of Apo B/A1, MAP1-LC3 and ICAM-1 were compared among groups |
|
|
SAP组与Non-SAP组入院后首次Ranson评分分别为(5.91±1.51)分和(2.27±0.73)分, 差异有统计学意义(t=23.097, P < 0.01)。见图 2。
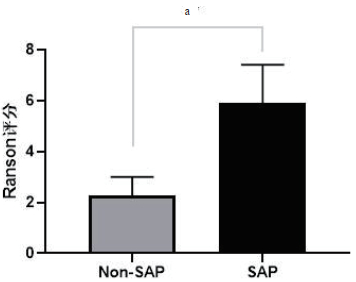
|
| 与相应对照组比较,aP < 0.01 图 2 SAP组与Non-SAP组入院后首次Ranson评分比较 Fig 2 Comparison of the first Ranson score after admission between the SAP group and non-SAP group |
|
|
急性胰腺炎患者血清Apo B/A1、MAP1-LC3和ICAM-1水平与入院后首次Ranson评分均呈正相关。ICAM-1与AP病情严重程度相关性最高(r= 0.519),Apo B/A1与AP病情严重程度相关性最低(r= 0.448),MAP1-LC3与AP病情严重程度相关性为(r=0.487),见表 2。
| 实验室指标 | r值 | P值 |
| Apo B/A1 | 0.448 | < 0.01 |
| MAP1-LC3 | 0.487 | < 0.01 |
| ICAM-1 | 0.519 | < 0.01 |
Apo B/A1、MAP1-LC3、ICAM-1及联合指标对SAP评估价值的ROC曲线分析示受试者工作特征曲线下面积(area under the receiver operating characteristic curve, AUROC)分别为0.769、0.811、0.828和0.938。Apo B/A1、MAP1-LC3、ICAM-1评估SAP的最佳临界值分别为1.53、0.58 ng/mL和178.33 ng/mL; 且联合指标检测的AUROC和灵敏度均高于单一指标,对判断早期SAP病情有更好的价值。见表 3、图 3。
| 指标 | AUG | 灵敏度(χ/%) | 特异度(χ/%) | 最佳阈值 | 95% CI |
| Apo B/A1 | 0.769 | 81.5 | 71.6 | 1.53 | 0.702~0.836 |
| MAP1-LC3 | 0.811 | 61.9 | 87.8 | 0.58 | 0.774~0.848 |
| ICAM-1 | 0.828 | 77.1 | 77.4 | 178.33 | 0.803~0.853 |
| Predicted probability | 0.938 | 89.6 | 87.7 | - | - |
| 注: Predicted probability为Apo B/A1、MAP1-LC3和ICAM-1三者联合的预测概率 | |||||
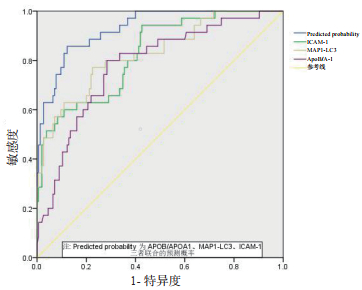
|
| 图 3 血清Apo B/A1、MAP1-LC3、ICAM-1水平及其联合检测对SAP预测的ROC曲线 Fig 3 ROC curve of serum levels of Apo B/A1, MAP1-LC3, ICAM-1 and their combined detection for SAP prediction |
|
|
本研究利用收集到的AP患者血浆对Apo B、Apo A1、MAP1-LC3和ICAM-1水平进行检测。在对指标进行统计学分析发现,NC组、Non-SAP组以及SAP组的Apo B/A1、MAP1-LC3和ICAM-1水平差异有统计学意义,在对该三种指标进一步分析后发现他们与AP患者的病情有很明显的相关性,其中ICAM-1与AP病情严重程度相关性最高(r=0.519)。而且这三种指标在对SAP的预测上都展现了较好的性能。在联合以上三项指标进行预测时,其预测性能更好(AUROC=0.938)。这三种生物标志物不仅在AP病情的早期预测上演绎了重要作用,而且有望为AP发生发展机制的探究提供一个有价值的思路。
由于SAP多表现为胰腺出血坏死,并多伴有感染、休克、多器官功能衰竭等严重并发症,病死率高,预后差。如果能在AP早期予以合理的干预将会更大程度的阻止病情的进一步恶化,同时对于重症患者的预后也有极大的影响。但如何准确、及时的早期识别SAP高危患者仍然是当前应对该疾病的主要挑战之一。虽然在2012年重新修订的亚特兰大国际共识[17]中将AP的分类加以修订,另增加了“中度重症”的类别,但本文考虑到在临床诊疗过程中早期辨别SAP患者对疾病诊治的重要意义,因此将收集到的AP患者划分为SAP和非SAP(为亚特兰大国际共识[7]中的轻症AP、中度重症AP分类的合并)两类。
到目前为止,包括Ranson评分、BISAP评分、MCTSI评分和APACHE II评分在内的几种评分系统已被应用于预测AP的严重程度[10]。但是,鉴于完成这些评分系统的复杂性和耗时性,使其在临床实践过程中有其明显的局限性。例如:Ranson评分应该在入院后48 h内完成,但是一些变量如残余碱和液体丢失量并不是入院后的常规评估内容。BISAP评分是建立在病死率的基础上,并且对AP严重程度的预测能力较差。MCTSI评分在评估胰腺坏死程度方面明显优于其他评分系统,但无法及时评估合并延迟性胰腺坏死的SAP。APACHE II评分最初是为评估ICU的AP患者而设计的,因此包含了许多关于详细病史和用药细节的变量,如果患者有昏迷、插管或者是从没有充分医疗记录的医疗机构转来,那么这些变量可能不易全面获取。故一些合适的检验指标可能有望成为更理想的预测指标。
既往认为AP仅与胰酶激活引起胰腺自身消化有关[11]。近年来发现炎症介质、微循环障碍、自噬过度激活也参与了AP的发病及病情进展过程[4, 12],并且研究表明SAP患者的高病死率多与其出现的全身炎症反应综合征及多器官功能障碍综合征密切相关[9, 13]。因此在AP的发病及进展过程中,机体炎症状态可能是AP患者严重程度预测和临床治疗的关键点[14]。Sue等[15]证实,甘油三酯经胰脂肪酶水解形成游离脂肪酸可诱发酸中毒, 使胰蛋白酶原激活而诱导AP的发生,同时游离脂肪酸的皂化剂样作用能使胰腺间质崩解,进而导致胰腺自溶而将有毒物质释放入血。脂质紊乱既可以是AP的病因,也可作为其临床表现而出现。多数AP患者早期即可发现脂质代谢异常,可能主要是由以下两个原因导致:(1)过度释放炎症细胞因子如白介素-6、肿瘤坏死因子-α等,影响肝脏的脂质合成;(2)毛细血管通透性增加导致脂质分布从血管内到血管外。Apo A1作为高密度脂蛋白的主要成分,同时也是一种重要的急性时相蛋白,具有重要的生理功能包括抑制各种炎症因子的产生,从而限制炎症的“瀑布”效应,发挥其抗氧化作用[16]。Apo B是低密度脂蛋白、中密度脂蛋白和极低密度脂蛋白的主要结构,具有促进脂蛋白进入血管壁,刺激巨噬细胞吞噬,从而诱导炎症[17]。因此,Apo A1和Apo B分别反映了体内抗炎和促炎的变化[3]。本文将Apo B/A1比值作为反映人体脂质代谢平衡和炎症状态的综合指标。自噬是生命的基本现象,存在于真核细胞中,可维持机体的内环境稳态以及抵御病原微生物侵袭。Miao等[4]指出胰脂肪酶异常激活及炎症的发生与自噬的过度活跃有关,Gukovskaya等[18]提出在AP患者和动物模型中均出现明显的自噬功能障碍,并认为溶酶体/自噬功能障碍是AP早期重要启动源。在自噬过程中,作为mAtg8s代谢产物之一的MAP1-LC3Ⅰ与磷脂酰乙醇胺发生脂质化反应生成MAP1-LC3Ⅱ,这是吞噬泡闭合的前提条件,然后形成自噬体[5]。因此自噬的过度激活不仅在胰脂肪酶的异常激活过程中演绎着重要角色,而且介导了疾病所引起的局部和全身炎症反应。MAP1-LC3作为自噬过程中重要的通路蛋白之一,可作为一项反应自噬程度的指标来间接预测AP的病情严重程度。ICAM-1系经典型致炎因子,表达于血管内皮细胞,具有调节白细胞与血管内皮间质细胞黏附的作用。Grover等[19]发现在AP大鼠模型中,血清ICAM-1水平高于对照组,认为ICAM-1参与了AP的发病过程。但未对ICAM-1与AP病情进展的关系进行更深层次的研究。更有学者认为,在胰腺炎早期,局部及全身炎症反应可诱导机体产生包括白介素-6、白介素-8和肿瘤坏死因子-α在内的多种炎症介质和细胞因子[14],继而通过增强ICAM-1的表达[20]来介导白细胞与血管内皮的黏附,同时介导边缘白细胞向其他器官的迁移和浸润[6],最终造成胰腺局部甚至全身其他器官受损。
本研究的目的是探讨AP患者早期血清Apo B/A1、MAP1-LC3和ICAM-1水平对AP病情的早期评估价值。在这项研究中,三组实验对象的年龄、性别和身体质量指数差异无统计学意义,因此,这些因素的干扰基本被排除。根据相关实验结果,不同组别之间血清Apo B/A1、MAP1-LC3和ICAM-1水平差异有统计学意义,并且能从不同角度反应AP的炎症程度,其中AP患者血清Apo B/A1、MAP1-LC3和ICAM-1水平显著高于健康人,且随着病情的加重,其水平逐渐升高。提示以上三项指标参与了AP的发病及进展过程,可作为临床评估AP病情严重程度的指标。Pearson相关性分析显示,血清Apo B/A1、MAP1-LC3和ICAM-1水平与入院后首次Ranson评分呈正相关。且ROC曲线提示此三项指标单独及联合检测对早期AP的病情严重程度均有较好的预测能力。但由于本研究数据是单中心数据,且样本数量有限,尚需多中心大样本的研究来进一步证实。
利益冲突 所有作者声明无利益冲突
作者贡献声明:徐炎松:直接参与研究的设计、实施研究、采集数据、分析数据、制作图表、起草文章、文章修改等;宋凯、尹冉:直接参与研究的设计、采集数据、制作图表;孙远松、姜大同、周鑫:直接参与研究的设计、实施研究、分析数据;李贺:直接参与研究的设计、实施研究,分析数据,文章撰写、修改、审阅,及后期文章处理。
| [1] | Zhang T, Liu H, Wang DY, et al. Predicting the severity of acute pancreatitis with red cell distribution width at early admission stage[J]. Shock, 2018, 49(5): 551-555. DOI:10.1097/SHK.0000000000000982 |
| [2] | Mok SR, Mohan S, Elfant AB, et al. The acute physiology and chronic health evaluation IV, a new scoring system for predicting mortality and complications of severe acute pancreatitis[J]. Pancreas, 2015, 44(8): 1314-1319. DOI:10.1097/MPA.0000000000000432 |
| [3] | Wu JY, Wang YF, Li HY, et al. Serum apolipoprotein B-to-apolipoprotein A1 ratio is independently associated with disease severity in patients with acute pancreatitis[J]. Sci Rep, 2019, 9(1): 7764. DOI:10.1038/s41598-019-44244-w |
| [4] | Miao B, Qi WJ, Zhang SW, et al. miR-148a suppresses autophagy by down-regulation of IL-6/STAT3 signaling in cerulein-induced acute pancreatitis[J]. Pancreatology, 2019, 19(4): 557-565. DOI:10.1016/j.pan.2019.04.014 |
| [5] | 李春云, 刘瑞霞, 阴赪宏. 自噬在急性胰腺炎发生发展中的作用[J]. 临床肝胆病杂志, 2019, 35(5): 1157-1160. DOI:10.3969/j.issn.1001-5256.2019.05.051 |
| [6] | Chen CC, Chow MP, Huang WC, et al. Flavonoids inhibit tumor necrosis factor-alpha-induced up-regulation of intercellular adhesion molecule-1 (ICAM-1) in respiratory epithelial cells through activator protein-1 and nuclear factor-kappaB: structure-activity relationships[J]. Mol Pharmacol, 2004, 66(3): 683-693. DOI:10.1124/mol.66.3 |
| [7] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis: 2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [8] | 闵安, 李贺, 项和平, 等. 急性胰腺炎三种分类标准的比较[J]. 中华急诊医学杂志, 2019, 28(5): 625-629. DOI:10.3760/cma.j.issn.1671-0282.2019.05.018 |
| [9] | 中华医学会消化病学分会胰腺疾病学组, 《中华胰腺病杂志》编辑委员会, 《中华消化杂志》编辑委员会. 中国急性胰腺炎诊治指南(2019, 沈阳)[J]. 中华胰腺病杂志, 2019, 19(5): 321-331. DOI:10.3760/cma.j.issn.1674-1935.2019.05.001 |
| [10] | Wang YC, Attar BM. Comment on "comparison of BISAP, ranson, MCTSI, and APACHE Ⅱ in predicting severity and prognoses of hyperlipidemic acute pancreatitis in Chinese patients"[J]. Gastroenterol Res Pract, 2017, 2017: 1426486. DOI:10.1155/2017/1426486 |
| [11] | Li G, Wu XJ, Yang L, et al. TLR4-mediated NF-κB signaling pathway mediates HMGB1-induced pancreatic injury in mice with severe acute pancreatitis[J]. Int J Mol Med, 2016, 37(1): 99-107. DOI:10.3892/ijmm.2015.2410 |
| [12] | Gukovsky I, Li N, Todoric J, et al. Inflammation, autophagy, and obesity: common features in the pathogenesis of pancreatitis and pancreatic cancer[J]. Gastroenterology, 2013, 144(6): 1199-1209. e4. DOI:10.1053/j.gastro.2013.02.007 |
| [13] | 吴禹岑, 刘岩. 肾素-血管紧张素系统及核因子-κB在急性胰腺炎中的共同作用[J]. 中华急诊医学杂志, 2016, 25(1): 116-121. DOI:10.3760/cma.j.issn.1671-0282.2016.01.031 |
| [14] | 刘燕燕, 程波, 张岩, 等. ISO-1通过抑制NLRP3炎症小体信号通路保护急性胰腺炎[J]. 中华急诊医学杂志, 2021, 30(8): 965-967. DOI:10.3760/cma.j.issn.1671-0282.2021.08.009 |
| [15] | Sue LY, Batech M, Yadav D, et al. Effect of serum triglycerides on clinical outcomes in acute pancreatitis: findings from a regional integrated health care system[J]. Pancreas, 2017, 46(7): 874-879. DOI:10.1097/MPA.0000000000000860 |
| [16] | Gordon EM, Figueroa DM, Barochia AV, et al. High-density lipoproteins and apolipoprotein A-I: potential new players in the prevention and treatment of lung disease[J]. Front Pharmacol, 2016, 7: 323. DOI:10.3389/fphar.2016.00323 |
| [17] | Feng M, Rached F, Kontush A, et al. Impact of lipoproteins on atherobiology: emerging insights[J]. Cardiol Clin, 2018, 36(2): 193-201. DOI:10.1016/j.ccl.2017.10.001 |
| [18] | Gukovskaya AS, Gukovsky I. Autophagy and pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(9): G993-G1003. DOI:10.1152/ajpgi.00122.2012 |
| [19] | Grover AS, Kadiyala V, Banks PA, et al. The utility of the systemic inflammatory respsonse syndrome score on admission in children with acute pancreatitis[J]. Pancreas, 2017, 46(1): 106-109. DOI:10.1097/MPA.0000000000000681 |
| [20] | Zhu HH, Jiang LL. Serum inter-cellular adhesion molecule 1 is an early marker of diagnosis and prediction of severe acute pancreatitis[J]. World J Gastroenterol, 2012, 18(20): 2554-2560. DOI:10.3748/wjg.v18.i20.2554 |
 2022, Vol. 31
2022, Vol. 31




