心脏骤停(cardiac arrest, CA)-心肺复苏(cardiopulmonary resuscitation, CPR)动物模型的成功构建是探究心肺复苏自主循环恢复(return of spontaneous circulation, ROSC)后全身器官功能损害的病理生理机制以及干预措施效果的重要前提[1]。猪作为可获得性较便利的哺乳动物,其心脏解剖结构、侧支循环、血流动力学等特征与人类相似[2-4],培养周期较灵长类动物短,常被用于新型按压仪、药物研发以及器官功能损伤机制探索的临床前研究。现有研究报道中建立CA-CPR猪模型的方式纷繁多样,目前尚无文献总结不同建模方式的规律及特点。本文针对构建CA-CPR猪模型的前期准备、模型的建立与应用及其优缺点进行综述。
1 建模前准备在猪种的选择上,多选择约克郡猪或长白猪作为研究对象[5-6]。在性别年龄和体重等方面,既往文献回顾分析了大动物实验的数据特点,以11~13月龄的雄性猪为主,体重以30 kg多见[7]。建模前准备通常包括麻醉、心电监测、气管插管、机械通气和动静脉置管五大环节。实验猪的麻醉,分诱导麻醉(肌肉注射麻醉)和维持麻醉(气体吸入麻醉或静脉注射麻醉)两阶段。诱导麻醉通常采用戊巴比妥钠30 mg/kg和咪达唑仑0.15 mg/kg肌肉注射[8],或者替来他明和唑拉西泮各5 mg/kg联合赛拉嗪3 mg/kg肌肉注射[9],以实现初步镇静,为后续气管插管、动静脉置管提供可能。维持麻醉期间,予1%~3%异氟烷吸入[9]或8 mg/(kg·h)戊巴比妥钠静脉持续泵入[10-11]。待气管插管成功后连接呼吸机以进行机械通气(潮气量6~7 mL/kg,频率12~20次/min,吸氧浓度21%)。后续操作中可以呼气末二氧化碳维持在35~40 mmHg(1 mmHg=0.133 kPa)作为调节机械通气参数的依据。动静脉置管导管型号的选择依穿刺血管粗细而定,通常选择8.5 F。置管深度(以股静脉置管达右心房为例)通常为40~50 cm。上述准备工作就绪后,即可启动CA-CPR模型构建。
2 模型的建立与应用构建CA-CPR猪模型的方式与其他动物模型相似,主要依据诱导心脏骤停的方式不同而进行分类。根据不同的研究目的,常用的诱导方式有6种,即电刺激诱颤、窒息、高钾、休克、冠脉堵塞、肺栓塞。
2.1 电刺激诱颤电刺激诱颤制备CA-CPR模型是指在动物不同部位施加直流/交流电的方式刺激心脏,以干扰窦房结自主电活动而诱发心室颤动(ventricular fibrillation, VF)。当心电监护显示:①室颤心律;②收缩压下降至25 mmHg[12]时提示诱导心脏骤停成功。根据电刺激输入部位的不同,分为以下几种方法:经右心室诱颤、经胸壁诱颤、经皮心外膜电刺激诱颤和开胸直视下诱颤。
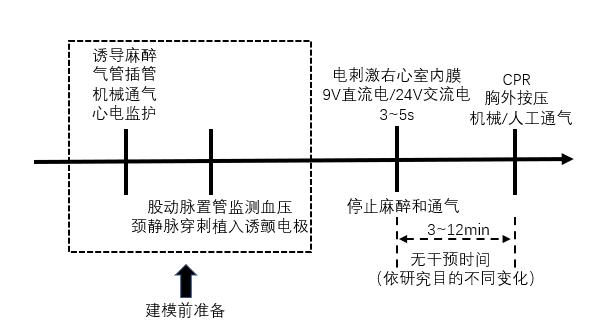
2.1.1 经右心室诱颤经右心室诱颤是经颈内/外静脉将双极起搏电极送入右心室,释放电流以刺激心内膜而诱发心室颤动。当电极置入深度约18~22 cm时,可观察到以下特征:①电极导丝随心脏搏动而规律波动;②心电图示QRS主波方向突然变为与原来相反的方向;或者出现室性期前收缩(室早)、室性心动过速(室速)等心律失常,提示电极位置抵达右心室心内膜[8]。开始予以电流刺激(9 V直流电[10]或24 V/50 Hz交流电[13]),持续3~5 s[9],参照前述评估标准确认成功诱导室颤致心脏骤停后停止机械通气,观察3~12min[10-14],期间不予任何干预,随后启动心肺复苏抢救流程(见图 1)。由于室颤为心脏骤停患者骤停前的主要心律类型,此方法能较好模拟临床实际情况,而且该方法所需电刺激时间较短,制颤成功率较高(见表 1),因此在国内外得到广泛应用。但该方法对心内膜电刺激造成的心肌损伤程度无法评估,可能干扰心脏骤停后心肌缺血再灌注损伤机制及干预措施相关的研究。
|
| 图 1 经右心室诱颤猪模型流程图 |
|
|
| 种类 | CA原理 | 诱发时间 | CA成功标志 | 制颤率(%) | ROSC时间(min) | ROSC成功率(%) | |
| 电刺激诱颤模型 | 经右室诱颤 | 外加电刺激,干扰心脏正常电活动诱颤 | 3~5 s[9] | VF | 98.5[10] | 6~6.9[9-10] | 75~100[5, 9] |
| 经胸壁诱颤 | 4 min[15] | 100[17] | 7[17] | 83[17] | |||
| 经皮电诱颤 | 5~10 s[19] | 100[20] | — | 57.0~87.5[19-20] | |||
| 开胸直视诱颤 | — | 100[23] | 10[23] | 100[23] | |||
| 窒息模型 | 缺氧诱停 | 8.2 min[27] | VF/PEA/停搏[28] | 23[26] | 26[25] | 63.3~87.5[25, 27] | |
| 高钾模型 | 高钾血症抑制心肌电活动 | — | 停搏/VF[30-31] | 100[30] | — | — | |
| 休克模型 | 失血性模型 | 失血性/脓毒症休克继发CA | >1 h[31] | MAP <20 mmHg/动脉压波形消失 | 50[32] | 1~6a[32] | 62.5[31] |
| 脓毒症模型 | 5~6 h[33] | 无脉电活动和(或)MAP <30 mmHg | 0[33] | 2~6[33] | 36~50[33-34] | ||
| 冠脉堵塞模型 | 模拟冠心病心肌缺血诱颤 | 3 minb[11] | VF | 100[11] | 17.5[11] | 67[11] | |
| 肺栓塞模型 | 肺栓塞继发CA | — | MAP <30 mmHg | — | — | 52.6[30] | |
| 注:CA为心脏骤停;ROSC为自主循环恢复;VF为心室颤动;PEA为无脉电活动;MAP为平均动脉压;a为此时间指冠脉阻塞至电致颤所需时间;b为此时间指失血性模型中利用介入手段所需救治时间 | |||||||
随着电生理技术的发展,近年有研究者使用程控电刺激的方式实现经右心室诱颤。程控电刺激是指按照预先设定的程序释放刺激的电生理检查技术。武军元等[14]在探究经右心室程控电刺激致颤建立猪CA-CPR模型最佳电刺激参数的研究中按照以下参数进行电刺激:给予40 V,食道输出模式,时间间隔5 s的电刺激,初始固频脉冲S1(300 ms)与可变脉冲S2(200 ms)比例8∶1,步长设为10 ms(即一次周期后可变脉冲频率缩短10 ms)。结果发现,诱发家猪室颤的S1S2配对间期主要集中在190~170 ms,占所有S1S2诱发成功总例数的75%(12/16)[14]。Wang等[5]也认为程控电刺激致颤成功率高,通常在启动复苏6 min左右即可实现ROSC,ROSC后6 h存活率为50%。程控刺激法的优点在于:在刺激模式上8次起搏周长S1S1刺激后1个S2刺激可有效控制电刺激输出,直至S2刺激诱颤或落入不应期终止刺激。另外程控刺激输出方波直流电,所产生的热效应小于交流电,对心内膜造成的损伤较小。因此该建模方法在开展心脏骤停对心脏的结构和功能影响的研究中具有优势。
关于无干预时间,即从诱颤成功至开始复苏之间的时间,由于各研究目的不同而存在一定差异。大部分研究关注按压措施或复苏方法对复苏效果(脑灌注、复苏成功率等)的影响,选择7~8 min的无干预时间。例如,文才等[9]的研究发现,与无干预观察10 min、11 min、12 min组相比,无干预观察8 min组动物复苏成功率达100%,所需复苏时间6.9±1.3 min,首次除颤成功率70%,复苏后神经功能损害评分较低。但武军元等[14]在探究不同诱颤方式对制颤成功率影响的研究中仅无干预观察3 min即启动心肺复苏。因此,当使用经右心室诱发室颤建立CA-CPR时,需根据不同的实验目的选择不同的无干预时间。
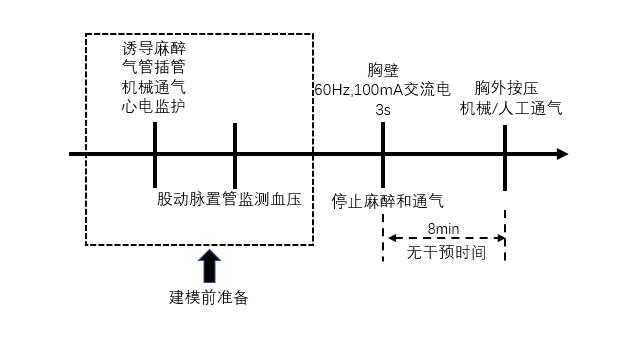
2.1.1.1 经胸壁诱颤经胸壁诱颤是指通过置于胸壁的高电压电极刺激动物而诱发室颤[15-17]。Woodward等[15]经胸壁以60 Hz, 100 mA的交流电持续电刺激3 s诱发室颤。必要时重复电刺激,直至心电图提示诱颤成功或心脏骤停,无干预时间8 min后启动心肺复苏(见图 2)。
|
| 图 2 经胸壁诱颤猪模型流程图 |
|
|
虽然该方法操作简单,可完成度较高,但该方法易受诱颤电极放置位置、胸壁厚度、电压强度等影响导致诱颤成功率和复苏效果存在较大差异,因此模型的稳定性较差。此外,其所需电压/电流高于其他诱颤方式,易干扰心律波形的监测,且易导致皮肤灼伤,骨骼肌痉挛等并发症出现。因此,经胸壁诱颤法较少应用。
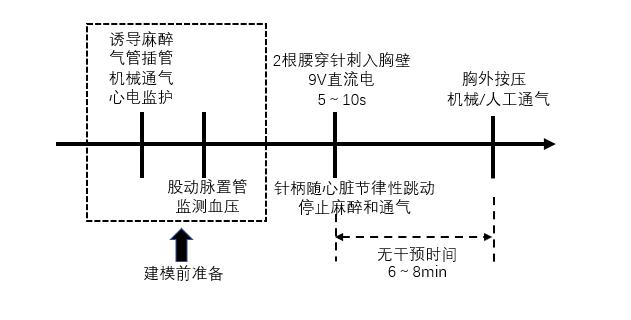
2.1.1.2 经皮电刺激诱颤经皮电刺激诱颤是利用2根穿刺针(腰穿针或针灸针刺)刺入胸壁[18-19],形成电流回路,以刺激心脏或心外膜,从而诱发室颤。现有研究报道关于该方法诱颤电极穿刺位置的选择基本为剑突下和胸骨右缘第四肋间[18]/胸骨左缘二三肋间[20]。剑突下穿刺针插入深度约6.0 cm,胸骨右缘第四肋间[18]/胸骨左缘二三肋间[20]穿刺针则插入3.0~3.25cm,并且可根据需要调整其与胸壁平面成30°~60°角[20]。当心电波形出现室性早搏时,将穿刺针后退0~3 mm,查见针柄随心脏节律性跳动而心电波形无持续显著异常心律时,提示穿刺针安置妥当。该方法通常选择9 V直流电进行刺激,持续时长5~10 s[21]。待心电图显示室颤波型后,无干预时间约6~8 min[22]随即启动心肺复苏(见图 3)。
|
| 图 3 经皮电刺激诱颤猪模型流程图 |
|
|
虽然该方法操作简单,诱颤时间亦较短,但ROSC率低于经颈静脉电刺激诱颤(见表 1)。与经胸壁诱颤法一样易受动物胸壁厚度、穿刺部位和深度难掌握等因素影响,故通常不建议作为构建CA-CPR猪模型的首选方案。
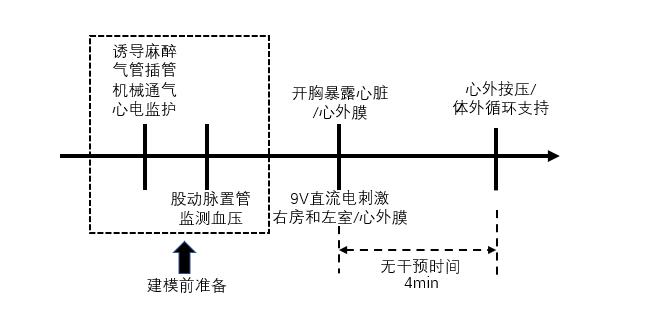
2.1.1.3 开胸直视下诱颤Mehaffey等[23]在进行体外循环复苏猪模型的研究中,直接开胸直视下使用9V直流电刺激右心房和左心室诱导室颤,此研究将无干预时间延长至20 min。另有学者通过电刺激心外膜动态稳步起搏的方法诱导室颤,同时缝合于左心室心外膜的电极可实时记录心脏局部电活动[24]。该方法在原理上与经皮电刺激诱颤方法类似,操作简单,制颤和复苏成功率均较高,适用于体外心肺复苏的相关研究。但由于开胸操作损伤较大,且继发感染、出血等风险较其他方法大,其应用范围较局限(见图 4)。
|
| 图 4 开胸直视下诱颤猪模型流程图 |
|
|
窒息法诱导心脏骤停是在机械通气情况下,于呼气相结束时夹闭气管导管,造成机体缺氧而诱导心脏骤停。该方法在诱导心脏骤停的过程中,动物往往先出现血压下降,再出现心率下降,最终呈现心搏节律的改变。因而,不同研究者定义心脏骤停标准的异质性较大[25-27]:Wollborn等[25]以超声检查显示左心室流出道无血液外流为心脏骤停标准,而吴彩军等[26]则以动脉收缩压 < 30 mmHg为心脏骤停标准。该方法在成功诱导心脏骤停后的无干预时间常设定为4~8 min[25-27](见图 5)。
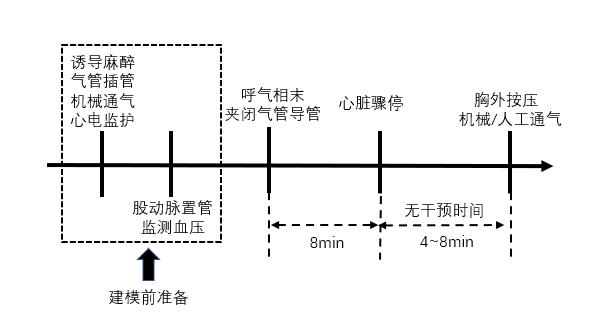
|
| 图 5 窒息法诱导心脏骤停猪模型流程图 |
|
|
与电刺激诱颤不同,窒息法无需电流刺激,对心肌组织影响小,所需设备简单,可操作性和可重复性均较强,故而其应用较广泛,仅次于电刺激诱颤法。同时该方法还可用于模拟小儿窒息、溺水以及低温合并缺氧诱导的心脏骤停和体外心肺复苏等急危重情景。但是,由于窒息可导致严重的高碳酸血症和呼吸性酸中毒,可掩盖心脏骤停病因的病理生理机制,不利于开展呼吸性、代谢性疾病引发心脏骤停的机制探索和干预措施研究[28]。并且该方法缺乏统一的判定心脏骤停标准,导致研究结果存在较大的异质性。因此,研究者需综合评估其利弊后选择窒息法构建CA-CPR模型。
2.3 高钾高钾法诱导心脏骤停主要利用静脉快速推注高浓度氯化钾以抑制心肌电活动,造成心脏节律改变而发生心脏骤停[29]。通常使用20 mg/kg的氯化钾进行静脉推注。当心电监护显示心电节律呈一直线或出现心室颤动时[29-30],即认为诱导心脏骤停成功。无干预时间后启动心肺复苏。虽然该方法操作简单(见图 6),对心脏功能和全身代谢的影响小于电刺激诱颤法和窒息法,但目前国内外仅有1篇使用高钾法构建心脏骤停猪模型的研究报道。其原因可能与高钾不是临床工作中心脏骤停的常见病因,且复苏成功率较低有关。
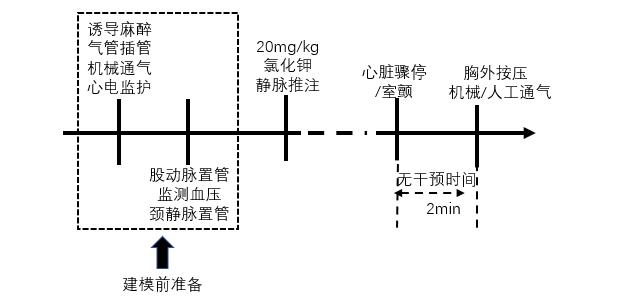
|
| 图 6 高钾法诱导心脏骤停猪模型流程图 |
|
|
休克为心脏骤停的常见病因,因此不少研究通过诱导创伤性心脏骤停(traumatic cardiac arrest,TCA)和脓毒症休克致心脏骤停以探究其导致器官功能损害的可能机制和干预效果。
该方法常在诱导心脏骤停前进行创伤性操作,如大腿螺栓连续枪击[31]或剖腹行肝叶撕裂切除[32]。随后自股动脉以恒定速率[4.5 mL/(kg·min)][31]放血,直至失血量达30%~40%的全血容量(猪的血容量按照70 mL/kg计算)。期间同步补液(0.9%生理盐水200 mL/min),以维持平均动脉压(mean arterial blood pressure, MAP)在40~45 mmHg之间。1 h后继续控制性放血,使得MAP降至20 mmHg或动脉压波形消失[31-32],即认为诱导心脏骤停成功。无干预3~5 min后启动心肺复苏(见图 7)。
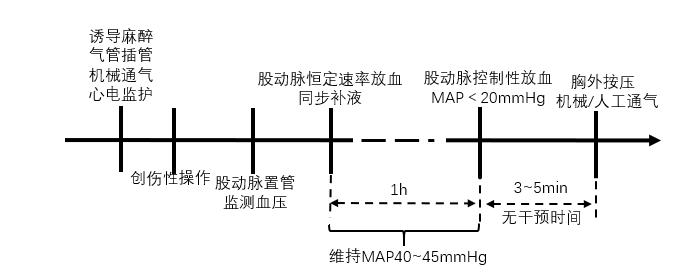
|
| 图 7 创伤性休克诱导心脏骤停猪模型流程图 |
|
|
脓毒性休克致心脏骤停模型[33]通常采用2 min内静脉推注20 mL大肠杆菌悬浮液(1×108 cfu/mL),继之以1 mL/(kg·h)的细菌悬液持续泵入的方式诱导心脏骤停。当心电图显示无脉电活动和(或)血压监测MAP < 30 mmHg时,即视为诱导心脏骤停成功。无干预8 min后启动心肺复苏(见图 8)。
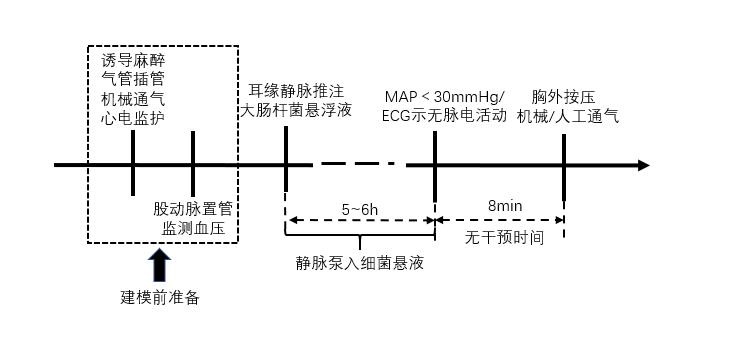
|
| 图 8 脓毒性休克诱导心脏骤停猪模型流程图 |
|
|
休克法可模拟临床中创伤性、脓毒性休克病因导致的心脏骤停,但建模时间较长,通常需5~6 h才能成功诱导心脏骤停。因此,为克服上述缺点,提高诱导心脏骤停的成功率,有学者提出采用休克联合电刺激诱颤的方式建模[34]。
2.5 冠状动脉堵塞冠状动脉堵塞法是利用气囊堵塞冠状动脉以模拟心肌缺血诱导室颤形成。Rysz等[11]自股动脉将高压球囊送入左前降支远端,扩张球囊以堵塞冠脉。继而通过造影确认冠脉无血流通过后维持球囊堵塞3 min,将事先置于主动脉瓣处的起搏电极推入左心室,接通9V直流电以诱发室颤,持续无干预4 min后启动心肺复苏。复苏期间仍维持气囊堵塞冠脉状态,整个复苏过程中保持冠脉气囊堵塞状态,并在堵塞45 min后撤出气囊,恢复冠脉再灌注[11, 35]。另有研究[36]将气囊放至左冠状动脉主干,堵塞12 min,持续无干预时间缩短至2~3 min后启动心肺复苏。该方法符合缺血性心脏病引起心脏骤停的临床实际,且在借助电诱颤的情况下诱导心脏骤停成功率可达100%(见图 9)[11]。但建模过程复杂,需要设备器材较多,还需行动脉造影确认堵塞是否有效,常伴随血管意外事件发生,因而一定程度限制其应用。
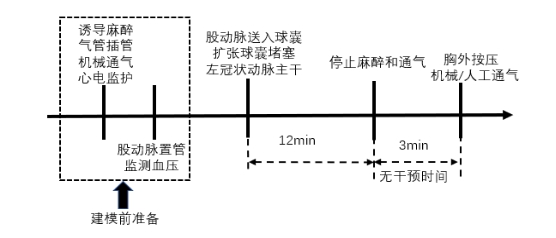
|
| 图 9 冠状动脉堵塞诱导心脏骤停猪模型流程图 |
|
|
肺栓塞法是通过静脉推注体外自凝血栓诱导心脏骤停以模拟肺栓塞致心脏骤停的病理生理过程。其具体操作过程包括:经颈外静脉或股静脉取血100 mL,室温静置2~3 h后形成血块。将1/10~1/9血块切成1.5 cm×1 cm×1 cm大小,用50 mL生理盐水将小血栓块混匀后快速注入颈外静脉(约2 min)。行增强CT扫描确认肺栓塞形成。待心电监护显示MAP < 30 mmHg时,提示诱导心脏骤停成功[30]。立刻启动心肺复苏(见图 10)。虽然该方法符合临床实际,且模型的稳定性尚可,但复苏成功率较低,具体操作流程仍有待改进。
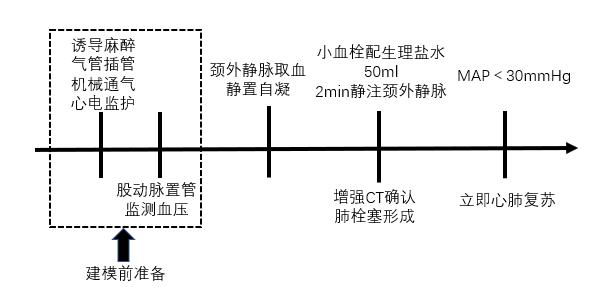
|
| 图 10 肺栓塞诱导心脏骤停猪模型流程图 |
|
|
无干预时间结束后即刻启动心肺复苏。不同方法诱导猪心脏骤停后的心肺复苏过程基本相似,包括胸外心脏按压、机械通气、电除颤、肾上腺素及病因治疗等。
3.1 胸外心脏按压人工或机械按压均可见于猪的CA-CPR模型[5, 13]。按压参数要求基本一致:按压深度通常为胸廓前后径20%~25%,频率100~120次/min,按压部位胸骨左缘4~5肋间(心脏搏动最明显部位)。为保证按压效果并且最大限度减少按压伤,Mader等[37]推荐:在胸外心脏按压启动20 s内,每次按压以最大动脉压达到50~70 mmHg所对应按压深度为最佳按压深度。但有学者[31]在创伤性心脏骤停模型中探究胸外心脏按压对ROSC的影响,结果发现与积极液体复苏相比,胸外心脏按压与死亡率增加和血流动力学受损有关,因而认为针对创伤性心脏骤停猪模型不建议行胸外心脏按压。该观点仍有待进一步开展更大样本研究验证。
3.2 机械通气复苏过程中的机械通气参数通常设置为:吸氧浓度(FiO2=100%)、潮气量(500 mL或7 mL/kg)、通气频率(12~20/min)等[25]。ROSC后吸氧浓度的设置视呼气末二氧化碳水平和血氧饱和度水平进行调节,常维持呼气末二氧化碳在35~45 mmHg之间,血氧饱和度 > 94%。
3.3 除颤通常每按压2 min后分析一次心律,若心电监护提示室颤则尽快进行电除颤。除颤模式和能量通常选择双向波120~150 J[13-14],甚至有研究将初始除颤能量设为200 J[19],也有研究以4 J/kg开始电击除颤[26]。因此建议除颤能量选择视动物体重大小决定(双向波2~4 J/kg)。
3.4 药物肾上腺素是心脏骤停猪模型研究中实施心肺复苏救治过程中最常用的药物,给药剂量和频次通常为20 μg/kg,每2 min注射1次,给药时机稍有差异。有学者在启动心肺复苏时即给予肾上腺素,以补偿因麻药镇静造成内源性应激降低[11],亦有研究者以胸外按压2 min为一循环,在两循环后评估心律变化,若未恢复自主心律,则开始给予首剂肾上腺素。除肾上腺素之外,也有学者将胺碘酮、碳酸氢钠作为常规复苏药物[11, 15, 38]。此外,必要时可针对心脏骤停的病因展开治疗,在TCA猪模型的研究中,Watts等[31]在启动心肺复苏的同时,积极补充全血进行液体复苏。在肺栓塞构建心脏骤停猪模型的研究中,Xiao等[30]认为复苏开始时同时给予尿激酶(15 000 U/kg)进行溶栓可增加ROSC率。
3.5 ROSC标准现有心脏骤停猪模型的研究报道对ROSC标准的定义大致相同:MAP≥60 mmHg,维持时间 > 5 min。但武军元等[14]认为收缩压 > 60 mmHg/MAP > 20 mmHg,维持时间 > 10 min即可视为达到ROSC,而Rysz等[11]则以自主心律恢复且MAP≥60 mmHg,维持时间 > 20 min为ROSC。若心肺复苏启动10~30 min后仍未达到ROSC,则判定为复苏失败[5, 13]。
3.6 脑复苏脑复苏是指为恢复ROSC患者的意识和神经功能所采取的治疗措施。脑复苏质量是影响ROSC患者神经功能及远期生存预后的关键而备受关注。复苏后管理指南推荐脑复苏措施:治疗心脏骤停的原因;将目标温度管理(targeted temperaturemanagement, TTM)维持在32~36℃之间24 h;避免MAP低于65 mmHg[39]。但上述推荐内容证据级别参差不齐,最近一项随机对照试验称,与80~100 mmHg相比,靶向控制ROSC患者的MAP 65~75 mmHg并没有明显的益处[40]。此外,仍有不少研究探索脑复苏措施以降低脑代谢、控制颅内压、改善脑循环、清除自由基、促进神经修复等。在现有猪的心脏骤停模型中,研究主要围绕优化目标性亚低温治疗对神经功能的保护,包括利用体外循环或注射冰盐水等方式将体温维持在目标温度水平。结果发现,复苏早期及时行亚低温治疗可以促进血流动力学和代谢水平的稳定,显著改善ROSC后3~5 d的神经功能评分[41-42]。同时,在围绕复苏后神经保护的动物实验中,也有研究基于心脏骤停猪模型证实吸入性气体(氙气、氩气、一氧化氮、氢气等)可稳定复苏后MAP、减轻神经元变性,减轻神经功能损伤[43]。
在ROSC猪脑功能的评价方面,现有研究主要采用脑灌注、氧合和代谢相关指标进行评估。颈动脉血流(carotid flow, CAF)和脑血流量(cerebral blood flow, CBF)被认为是评估脑灌注压和脑血流关系的重要指标,而压力反应性指数(pressure reactivity index, PRx)可反映颅内压与CBF、MAP之间的关系。脑组织二氧化碳分压和脑微透析技术可反映有关脑代谢、缺血和炎症的信息,其中脑组织微透析液通过细胞外大脑代谢物,例如乳酸、丙酮酸和葡萄糖来评估大脑新陈代谢,在神经危重症管理中已得到很好的证实[44]。颅脑近红外光谱(near-infrared spectroscopy, NIRS)可反映脑氧合情况,复苏过程中较高的区域氧饱和度指数(regional cerebral oxygen saturation, rSO2)与ROSC和更高的生存率有关[6],Nosrati等[45]的研究表明,肾上腺素输液组与安慰剂之间,测量的大脑近红外光谱没有显著差异,这表明大脑NIRS测量可能会受到来自脑外组织的信号的干扰,尚需进一步的研究证实其有效性。
4 结语建立CA-CPR猪模型的方式多种多样,各有特点(表 1)。虽然不同模型建立过程中参数存在一定差异,如诱颤电流/电压、诱颤时长、无干预时长以及ROSC的评判标准等,但总体流程基本一致。研究者可根据所关注的心脏骤停病因,结合Utstein-Style指南[12]要求,综合分析疾病的病理生理机制与各种建模方法的特点后选择适宜的建模方法,以推动心肺复苏后机体器官功能损害的机制和干预措施疗效的研究进展。
利益冲突 所有作者声明无利益冲突
| [1] | Benjamin EJ, Blaha MJ, Chiuve SE, et al. American Heart Association Statistics Committee and Stroke Statistics Subcommittee Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association[J]. Circulation, 2017, 135(10): e146-e603. DOI:10.1161/CIR.0000000000000485 |
| [2] | Dai YD, Yi K, Shimada K, et al. Anatomy of the coronary arteries in fetal pigs: comparison with human anatomy[J]. Anat Sci Int, 2020, 95(2): 265-276. DOI:10.1007/s12565-019-00516-z |
| [3] | Shen P, Xu JF, Gao YZ, et al. Establishment of a swine model of traumatic cardiac arrest induced by haemorrhage and ventricular fibrillation[J]. J Int Med Res, 2020, 48(6): 300060520931260. DOI:10.1177/0300060520931260 |
| [4] | Jung YH, Jeung KW, Lee DH, et al. Relationship between left ventricle position and haemodynamic parameters during cardiopulmonary resuscitation in a pig model[J]. Heart Lung Circ, 2018, 27(12): 1489-1497. DOI:10.1016/j.hlc.2017.08.020 |
| [5] | Wang GX, Zhang Q, Yuan W, et al. Sildenafil protects against myocardial ischemia-reperfusion injury following cardiac arrest in a porcine model: possible role of the renin-angiotensin system[J]. Int J Mol Sci, 2015, 16(11): 27015-27031. DOI:10.3390/ijms161126010 |
| [6] | Jaeger D, Koger J, Duhem H, et al. Mildly reduced doses of adrenaline do not affect key hemodynamic parameters during cardio-pulmonary resuscitation in a pig model of cardiac arrest[J]. J Clin Med, 2021, 10(20): 4674. DOI:10.3390/jcm10204674 |
| [7] | Vognsen M, Fabian-Jessing BK, Secher N, et al. Contemporary animal models of cardiac arrest: A systematic review[J]. Resuscitation, 2017, 113: 115-123. DOI:10.1016/j.resuscitation.2017.01.024 |
| [8] | 刁孟元, 管军, 林兆奋, 等. 家兔心搏骤停-心肺复苏模型研究进展[J]. 中华危重病急救医学, 2016, 28(12): 1157-1160. DOI:10.3760/cma.j.issn.2095-4352.2016.12.021 |
| [9] | 文才, 李恒, 翟小竹, 等. 长时程电诱发心室纤颤致心搏骤停与心肺复苏家猪模型的建立[J]. 中华危重病急救医学, 2017, 29(6): 536-541. DOI:10.3760/cma.j.issn.2095-4352.2017.06.012 |
| [10] | Dogan EM, Hörer TM, Edström M, et al. Resuscitative endovascular balloon occlusion of the aorta in zone I versus zone III in a porcine model of non-traumatic cardiac arrest and cardiopulmonary resuscitation: a randomized study[J]. Resuscitation, 2020, 151: 150-156. DOI:10.1016/j.resuscitation.2020.04.011 |
| [11] | Rysz S, Lundberg J, Nordberg P, et al. The effect of levosimendan on survival and cardiac performance in an ischemic cardiac arrest model - A blinded randomized placebo-controlled study in swine[J]. Resuscitation, 2020, 150: 113-120. DOI:10.1016/j.resuscitation.2020.02.032 |
| [12] | Idris AHAH, Becker LANB, Ornato JP, et al. Utstein-style guidelines for uniform reporting of laboratory CPR research[J]. Resuscitation, 1996, 33(1): 69-84. DOI:10.1016/s0300-9572(96)01055-6 |
| [13] | Xu J, Yu XZ, Zhang LL, et al. Modified volumetric capnography-derived parameter: a potentially stable indicator in monitoring cardiopulmonary resuscitation efficacy in a porcine model[J]. Resuscitation, 2020, 150: 94-101. DOI:10.1016/j.resuscitation.2020.02.039 |
| [14] | 武军元, 李春盛. 应用程控刺激的心脏骤停模型[J]. 中华急诊医学杂志, 2008, 17(10): 1063-1065. DOI:10.3760/j.issn.1671-0282.2008.10.014 |
| [15] | Woodward M, Previs MJ, Mader TJ, et al. Modifications of myofilament protein phosphorylation and function in response to cardiac arrest induced in a swine model[J]. Front Physiol, 2015, 6: 199. DOI:10.3389/fphys.2015.00199 |
| [16] | Kucewicz JC, Salcido DD, Adedipe AA, et al. Towards a non-invasive cardiac arrest monitor: an in vivo pilot study[J]. Resuscitation, 2019, 134: 76-80. DOI:10.1016/j.resuscitation.2018.10.021 |
| [17] | Chonde M, Flickinger KL, Sundermann ML, et al. Intra-arrest administration of cyclosporine and methylprednisolone does not reduce postarrest myocardial dysfunction[J]. Biomed Res Int, 2019, 2019: 6539050. DOI:10.1155/2019/6539050 |
| [18] | 梁国栋, 郑汝钢, 菅洪健, 等. 体表针刺电刺激诱发心室纤颤猪模型的构建[J]. 南方医科大学学报, 2019, 39(11): 1370-1375. DOI:10.12122/j.issn.1673-4254.2019.11.16 |
| [19] | Fulkerson J, Lowe R, Anderson T, et al. Effects of intraosseous tibial vs ntravenous vasopressin in a hypovolemic cardiac arrest model[J]. West J Emerg Med, 2016, 17(2): 222-228. DOI:10.5811/westjem.2015.12.28825 |
| [20] | Johnson D, Garcia-Blanco J, Burgert J, et al. Effects of humeral intraosseous versus intravenous epinephrine on pharmacokinetics and return of spontaneous circulation in a porcine cardiac arrest model: a randomized control trial[J]. Ann Med Surg (Lond), 2015, 4(3): 306-310. DOI:10.1016/j.amsu.2015.08.005 |
| [21] | Hardig BM, Götberg M, Rundgren M, et al. Physiologic effect of repeated adrenaline (epinephrine) doses during cardiopulmonary resuscitation in the cath lab setting: a randomised porcine study[J]. Resuscitation, 2016, 101: 77-83. DOI:10.1016/j.resuscitation.2016.01.032 |
| [22] | Burgert JM, Johnson AD, Garcia-Blanco JC, et al. An effective and reproducible model of ventricular fibrillation in crossbred yorkshire swine (sus scrofa) for use in physiologic research[J]. Comp Med, 2015, 65(5): 444-447. |
| [23] | Mehaffey JH, Money D, Charles EJ, et al. Adenosine 2A receptor activation attenuates ischemia reperfusion injury during extracorporeal cardiopulmonary resuscitation[J]. Ann Surg, 2019, 269(6): 1176-1183. DOI:10.1097/SLA.0000000000002685 |
| [24] | Jingjun L, Yan Z, Weijie, et al. Effect and mechanism of esmolol given during cardiopulmonary resuscitation in a porcine ventricular fibrillation model[J]. Resuscitation, 2009, 80(9): 1052-9. DOI:10.1016/j.resuscitation.2009.06.003 |
| [25] | Wollborn J, Steiger C, Ruetten E, et al. Carbon monoxide improves haemodynamics during extracorporeal resuscitation in pigs[J]. Cardiovasc Res, 2019, 116(1): 158-170. DOI:10.1093/cvr/cvz075 |
| [26] | 吴彩军, 李春盛, 杨军, 等. 室颤与窒息法心脏骤停动物模型复苏后PET心肌代谢的比较[J]. 中华急诊医学杂志, 2017, 26(10): 1144-1148. DOI:10.3760/cma.j.issn.1671-0282.2017.10.010 |
| [27] | Varvarousi G, Chalkias A, Stefaniotou A, et al. Intraarrest rhythms and rhythm conversion in asphyxial cardiac arrest[J]. Acad Emerg Med, 2015, 22(5): 518-524. DOI:10.1111/acem.12643 |
| [28] | Varvarousis D, Xanthos T, Ferino G, et al. Metabolomics profiling reveals different patterns in an animal model of asphyxial and dysrhythmic cardiac arrest[J]. Sci Rep, 2017, 7(1): 16575. DOI:10.1038/s41598-017-16857-6 |
| [29] | Burgert J, Gegel B, Loughren M, et al. Comparison of tibial intraosseous, sternal intraosseous, and intravenous routes of administration on pharmacokinetics of epinephrine during cardiac arrest: a pilot study[J]. AANA J, 2012, 80(4 Suppl): S6-S10. |
| [30] | Xiao HL, Zhao LX, Yang J, et al. Imbalance of angiotensin-converting enzymes affects myocardial apoptosis during cardiac arrest induced by acute pulmonary embolism in a porcine model[J]. Int J Mol Med, 2019, 43(4): 1575-1584. DOI:10.3892/ijmm.2019.4109 |
| [31] | Watts S, Smith JE, Gwyther R, et al. Closed chest compressions reduce survival in an animal model of haemorrhage-induced traumatic cardiac arrest[J]. Resuscitation, 2019, 140: 37-42. DOI:10.1016/j.resuscitation.2019.04.048 |
| [32] | Manning JE, Ross JD, McCurdy SL, et al. Aortic hemostasis and resuscitation: preliminary experiments using selective aortic arch perfusion with oxygenated blood and intra-aortic calcium coadministration in a model of hemorrhage-induced traumatic cardiac arrest[J]. Acad Emerg Med, 2016, 23(2): 208-212. DOI:10.1111/acem.12863 |
| [33] | Chalkias A, Spyropoulos V, Koutsovasilis A, et al. Cardiopulmonary arrest and resuscitation in severe Sepsis and septic shock: a research model[J]. Shock, 2015, 43(3): 285-291. DOI:10.1097/SHK.0000000000000285 |
| [34] | Morgan RW, Sutton RM, Karlsson M, et al. Pulmonary vasodilator therapy in shock-associated cardiac arrest[J]. Am J Respir Crit Care Med, 2018, 197(7): 905-912. DOI:10.1164/rccm.201709-1818OC |
| [35] | Kern KB, Hanna JM, Young HN, et al. Importance of both early reperfusion and therapeutic hypothermia in limiting myocardial infarct size post-cardiac arrest in a porcine model[J]. JACC Cardiovasc Interv, 2016, 9(23): 2403-2412. DOI:10.1016/j.jcin.2016.08.040 |
| [36] | Lotun K, Truong HT, Cha KC, et al. Cardiac arrest in the cardiac catheterization laboratory: combining mechanical chest compressions and percutaneous LV assistance[J]. JACC Cardiovasc Interv, 2019, 12(18): 1840-1849. DOI:10.1016/j.jcin.2019.05.016 |
| [37] | Mader TJ, Kellogg AR, Walterscheid JK, et al. A randomized comparison of cardiocerebral and cardiopulmonary resuscitation using a swine model of prolonged ventricular fibrillation[J]. Resuscitation, 2010, 81(5): 596-602. DOI:10.1016/j.resuscitation.2010.01.013 |
| [38] | 吴彩军, 李春盛, 杨军, 等. 窒息心脏骤停动物模型中碳酸氢钠对复苏的影响[J]. 中华急诊医学杂志, 2015, 24(4): 403-407. DOI:10.3760/cma.j.issn.1671-0282.2015.04.015 |
| [39] | Nolan JP, Sandroni C, Böttiger BW, et al. European Resuscitation Council and European Society of Intensive Care Medicine Guidelines 2021:Post-resuscitation care[J]. Resuscitation, 2021, 161: 220-269. DOI:10.1016/j.resuscitation.2021.02.012 |
| [40] | Ameloot K, De Deyne C, Eertmans W, et al. Early goal-directed haemodynamic optimization of cerebral oxygenation in comatose survivors after cardiac arrest: The Neuroprotect post-cardiac arrest trial[J]. Eur Heart J, 2019, 40(22): 1804-1814. DOI:10.1093/eurheartj/ehz120 |
| [41] | Skåre C, Karlsen H, Strand-Amundsen RJ, et al. Cerebral perfusion and metabolism with mean arterial pressure 90 vs 60 mmHg in a porcine post cardiac arrest model with and without targeted temperature management[J]. Resuscitation, 2021, 167: 251-260. DOI:10.1016/j.resuscitation.2021.06.011 |
| [42] | Fries M, Brücken A, Çizen A, et al. Combining xenon and mild therapeutic hypothermia preserves neurological function after prolonged cardiac arrest in pigs[J]. Crit Care Med, 2012, 40(4): 1297-303. DOI:10.1097/CCM.0b013e31823c8ce7 |
| [43] | Magliocca A, Fries M. Inhaled gases as novel neuroprotective therapies in the postcardiac arrest period[J]. Curr Opin Crit Care, 2021, 27(3): 255-260. DOI:10.1097/MCC.0000000000000820 |
| [44] | Pischke SE, Hødnebø S, Wester T, et al. Intraperitoneal microdialysis detects intestinal leakage earlier than hemodynamic surveillance and systemic inflammation in a pig model[J]. Scand J Gastroenterol, 2021, 56(2): 219-227. DOI:10.1080/00365521.2020.1863459 |
| [45] | Nosrati R, Lin S, Mohindra R, et al. Study of the Effects of Epinephrine on Cerebral Oxygenation and Metabolism During Cardiac Arrest and Resuscitation by Hyperspectral Near-Infrared Spectroscopy[J]. Crit Care Med, 2019, 47(4): e349-e357. DOI:10.1097/CCM.0000000000003640 |
 2022, Vol. 31
2022, Vol. 31




