心肌缺血威胁人类生命健康,恢复心肌血供是缓解心肌缺血有效治疗手段,但再灌注也会引起心肌损伤[1]。1986年Murry等[2]预先多次短时间缺血处理可以减轻后续长时间缺血后再灌注的损伤首次提出缺血预处理(Ischaemic preconditioning, IPC)的概念。此后大量研究表明药物预处理可以模拟缺血预处理,减轻心肌缺血再灌注损伤,如阿片类药物[3]。由磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B (Protein kinase B,AKT)信号通路组成的再灌注损伤救援激酶通路(Reperfusion injury salvage kinase,RISK)是减轻心肌缺血-再灌注损伤的重要介质,激活PI3K-AKT信号通路,减少心肌细胞凋亡是其药理预适应的机制之一[4]。
加巴喷丁是一种是γ-氨基丁酸(γ-aminobutyric acid,GABA)的衍生物,其结构与GABA相似,但并不是GABA受体的激动剂。加巴喷丁作用于电压依赖性钙通道α2δ亚基的配体,可减弱钙通道流入,从而减少兴奋性递质释放和脊髓致敏,常用于慢性疼痛的预防和治疗作用[5]。在围术期用于减轻术后疼痛和减少阿片类药物的使用,预防术后慢性疼痛形成[6]。在心脏手术中,加巴喷丁也经常在术前或术中使用以减少术后阿片类药物的使用,有利于患者康复[7]。研究表明,在脑缺血再灌注之前使用加巴喷丁可以通过激活PI3K/AKT信号通路减轻脑的再灌注损伤[8]。心肌缺血再灌注时,体内谷氨酸水平升高,通过N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体介导心肌细胞内Ca2+超载从而引起心律失常,加巴喷丁可以通过抑制谷氨酸释放减轻心律失常[9]。但是加巴喷丁是否也能减轻心肌缺血再灌注损伤还不明确,本研究拟观察加巴喷丁对大鼠心肌缺血再灌注损伤的影响并探讨其机制。
1 材料与方法 1.1 实验动物健康雄性60只Sprague Dawley(SD)大鼠,SPF级,体重250~300 g,由常州卡文斯实验动物有限公司提供,动物合格证号:SCXK(苏)2016-0010。饲养于独立通风系统中,每笼5只。温度(22±2)℃,湿度(48±5)%,每天光照和黑暗时间各12 h。在实验过程中,建模和取材的操作均在超洁净工作台中进行,专人负责添加饲料,换水和给药。所有动物和实验程序均符合国家卫生研究院《实验动物护理和使用指导原则》(N1H出版物第80-23号),并经安徽医科大学动物伦理委员会批准(批准号:LLSC20200491)。
1.2 主要药物和试剂加巴喷丁(批号E01-20200713)购自江苏恩华药业股份有限公司;LY294002、2, 3, 5-氯化三苯基四氮唑(2, 3, 5-Triphenyltetrazoliumchloride,TTC),戊巴比妥钠购自美国Sigma公司;伊文斯蓝购自北京绿生源有限公司;RIPA裂解液、BCA蛋白定量试剂盒购自碧云天生物技术公司;PI3K、AKT、p-AKT一抗购自美国CST公司;β-acttin一抗购自美国Sigma公司;所有二抗均购自北京中杉金桥生物技术有限公司。
1.3 主要仪器主要仪器包括:Power-Lab系统(AD Instruments公司,美国);PVDF膜(Bio-RAD公司, 美国);凝胶成像系统(上海天能科技公司,中国);HX-300S呼吸机(成都泰盟科技公司,中国);高速冷冻离心机(Eppendor公司,德国);恒温水浴箱(中科院武汉仪器厂,中国);Tecan M 1000酶标仪(Tecan公司,德国);电泳仪(伯乐公司,美国)。
1.4 模型制备参照参考文献[10]方法,采用结扎左冠状动脉前降支制备大鼠心肌缺血再灌注模型。大鼠腹腔注射1%戊巴比妥钠50 mg/kg麻醉将大鼠固定于恒温解剖台上,取仰卧位,气管插管后连接动物呼吸机,行机械通气,通气参数设置为潮气量2~3 mL/100 g,吸呼比1.2∶1,通气频率65~75次/min。右侧颈总动脉置管,接压力换能器,连Power-Lab系统监测动脉血压、连续监测心电图;右侧股静脉置管给药。于胸骨左缘4肋间开胸显露心脏,6-0 Prolene线在左冠状动脉前降支做一线结,结扎30 min后松开结扎线再灌注120 min。阻断血流后,远端心脏呈灰白色,心电图ST段明显抬高;松开线结后,原缺血区域心脏颜色恢复红润,抬高的ST段回落1/2以上提示冠状动脉恢复血液供应,提示造模成功[3]。记录心肌缺血前基线(T0)、缺血30 min(T1)和再灌注120 min(T2)时大鼠的心率(heart rate,HR)、平均动脉压(mean arterial pressure,MAP)、心率血压乘积(rate pressure product,RPP),以及室性早搏(premature ventricular complexes, PVCs)、室速/室颤(ventricular tachycardia/ventricular fibrillation, VT/VF)发生次数[11]。
1.5 分组及给药60只健康雄性SD大鼠随机(随机数字法)分为5组:①假手术组(Sham组,n=12),打开胸腔,左冠状动脉前降支只穿线不结扎;②缺血-再灌注组(I/R组,n=12),结扎左冠状动脉前降支30 min后,再灌注120 min。③加巴喷丁组(Gap组,n=12),缺血前10 min经股静脉注射加巴喷丁10 mg/kg[9],其余同I/R组。④PI3K抑制剂组(LY组,n=12),缺血前10 min经股静脉注射LY294002 0.3 mg/kg[12],其余同I/R组。⑤加巴喷丁+抑制剂组(LY+Gap组,n=12)缺血前10 min经股静脉注射LY294002 0.3 mg/kg,加巴喷丁10 mg/kg,其余同I/R组。
1.6 心肌梗死面积测定再灌注结束后,采用颈椎脱臼处死老鼠,从主动脉根部剪断取出心脏,PBS冲洗出血液,扎紧左冠状动脉处线结。从主动脉注入2%伊文思蓝溶液约1 mL。置-80℃冰箱冷冻60 min后,从心尖到结扎处平切5~6片,厚度2 mm。置于1%TTC(Sigma公司,美国溶液,37℃(pH 7.4)恒温水浴10 min染色,用10%多聚甲醛溶液固定12 h。用Image J软件计算左心室(left ventricle, LV)、右心室(right ventricle, RV)、心脏缺血危险区(area at risk, AAR)和梗死区(infarct size, IS)面积,计算心肌梗死体积,以IS/ARR表示[3]。
1.7 Western blot检测PI3K,p-AKT蛋白表达再灌注结束后,随机取3只大鼠,处死后剪取缺血心尖心肌组织,使用生理盐水将血液冲洗干净。液氮速冻后研磨成粉末,匀浆前称重。放入装有预冷过RIPA裂解液的匀浆器中匀浆,经过超声细胞破碎仪裂解至澄清,4℃低温,15 000 r/min高速离心10 min,取上清液,BCA蛋白浓度定量后,-20℃保存。实验前取上清液进行western blot检测。在蛋白样品中按4∶1加入上样缓冲液,沸水浴加热10 min。冷却10 min后进行SDS-PAGE电泳分离并转移至PVDF膜上,5%脱脂牛奶室温封闭2 h,TBST洗涤后分别加入各种一抗:鼠抗β-actin(1∶2 000,Sigma公司,美国,货号A5441),兔抗PI3K(1∶1 000,CST公司,美国,货号4249T),兔抗AKT(1:1 000,CST公司,美国,货号4691S),兔抗p-AKT(1∶500,CST公司,美国,货号4060S)。4℃摇床孵育过夜。次日,TBST洗涤3次,每次10 min,加入二抗:辣根酶标记山羊抗鼠IgG或辣根酶标记山羊抗兔IgG(1∶10 000,北京中杉金桥生物技术有限公司)室温孵育1 h,TBST洗涤3次,每次10 min,暗室进行ECL(Thermo Fisher Scientific公司,美国)显影[8]。采用凝胶成像系统(上海天能科技有限公司,中国)拍照,通过Image J软件测定蛋白条带灰度值,以目的蛋白条带灰度值与内参蛋白条带灰度值的比值反映目的蛋白的表达水平。
1.8 统计学方法采用SPSS 13.0软件进行分析,正态分布的计量资料以均数±标准差(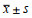
与T0相比,I/R组、Gap组、LY组和LY+Gap组大鼠HR、MAP和RPP在T1和T2时点显著降低(Ρ<0.05);与Sham组相比,I/R组、Gap组、LY组和LY+Gap组大鼠HR、MAP和RPP在T1时点显著降低,MAP和RPP在T2时点显著降低(Ρ<0.05)。见表 1,2,3。
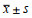
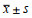
| 组别 | T0 | T1 | T2 |
| Sham组 | 380±12 | 369±15 | 333±13 |
| I/R组 | 381±10 | 311±15ab | 322±9 |
| Gap组 | 377±11 | 309±8ab | 327±20 |
| LY组 | 376±18 | 309±11ab | 318±18 |
| LY+Gap组 | 385±13 | 303±8ab | 327±7 |
| 注:与T0比较,aP<0.05;与Sham组比较,bP<0.05 | |||
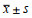
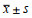
| 组别 | T0 | T1 | T2 |
| Sham组 | 99±5 | 96±6 | 94±7 |
| I/R组 | 101±3 | 59±4ab | 64±5ab |
| Gap组 | 98±5 | 62±3ab | 66±4ab |
| LY组 | 99±2 | 58±3ab | 64±4ab |
| LY+Gap组 | 102±6 | 59±2ab | 66±3ab |
| 注:与T0比较,aP<0.05;与Sham组比较,bP<0.05 | |||
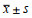
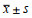
| 组别 | T0 | T1 | T2 |
| Sham组 | 379±18 | 350±20 | 327±25 |
| I/R组 | 377±16 | 192±23ab | 223±18ab |
| Gap组 | 369±23 | 201±17ab | 219±14ab |
| LY组 | 371±10 | 187±11ab | 213±12ab |
| LY+Gap组 | 381±21 | 189±11ab | 224±13ab |
| 注:与T0比较,aP<0.05;与Sham组比较,bP<0.05 | |||
与Sham组比较,其余各组PVCs和VT/VF次数增加(P<0.05);与I/R组比较,Gap组PVCs和VT/VF次数减少(P<0.05);与Gap组比较,Gap+LY组PVCs和VT/VF次数增加(P<0.05)。见图 1。

|
| 与sham组比较,aP<0.05;与I/R组比较,bP<0.05;与Gap组比较,cP<0.05 图 1 各组大鼠PVCs和VT/VF发生次数的比较 Fig 1 Comparison of PVCs and VT/VF frequency in each group |
|
|
与Sham组比较,其余各组心肌梗死面积明显增加(P<0.05);与I/R组相比,Gap组心肌梗死面积显著下降(P<0.05);与Gap组相比,Gap+LY组心肌梗死面积显著增加(P<0.05)。各组LV+RV体积及AAR体积均无统计学意义(P>0.05)。见图 2。

|
| 与Sham组比较,aP<0.05;与I/R组比较,bP<0.05;与Gap组比较,cP<0.05;各组AAR/LV+RV比较差异无统计学差异。 图 2 各组大鼠心肌梗死面积比较 Fig 2 Comparison of myocardial infarction area in each group |
|
|
与Sham组比较,IR组、LY组和Gap+LY组PI3K和p-AKT/AKT显著降低(P<0.05);与IR组比较,Gap组PI3K和p-AKT/AKT显著升高(P<0.05);与Gap组比较,Gap+LY组PI3K和p-AKT/AKT显著降低(P<0.05)见图 3。

|
| 与Sham组比较,aP<0.05;与I/R组比较,bP<0.05;与Gap组比较,cP<0.05 图 3 心肌组织中PI3K, AKT, p-AKT表达情况 Fig 3 Expression of PI3K, AKT, p-Akt in myocardial tissue |
|
|
心肌缺血-再灌注损伤是临床常见的病理生理现象。本研究采用结扎大鼠心脏冠状动脉左前降支构建大鼠心肌缺血再灌注损伤模型[10],结扎大鼠冠状动脉后,出现心肌局部缺血表现、心电图ST段抬高,MAP、HR以及RPP降低,表明大鼠心肌缺血再灌注模型制备成功。
加巴喷丁结构上类似GABA,在临床上广泛用于治疗癫痫、神经性疼痛、焦虑和酒精戒断等。既往对于加巴喷丁心肌保护方面的研究表明,加巴喷丁可以维持大鼠缺血再灌注期间心脏的电生理稳定,减少心律失常的发生[9]。也有研究表明加巴喷丁也可以减轻脑缺血再灌注损伤,发挥脑保护作用[8]。参照文献[9]以及预实验结果选择了加巴喷丁的给药量,本研究发现与I/R组比较,Gap组心肌梗死面积减少,发生心律失常次数的次数也减少。提示加巴喷丁可以减轻大鼠心肌缺血再灌注损伤。本实验中,检测了心肌中PI3K和p-AKT蛋白的表达量,缺血后PI3K以及p-AKT表达下调,加巴喷丁处理可以上调PI3K和p-AKT的表达,提示加巴喷丁可能是通过激活PI3K-AKT通路发挥其保护作用。
PI3K是细胞内重要的信号转导分子,PI3K激活可使膜磷酸肌醇磷酸化生成生成3,4二磷酸磷脂酰肌醇(PI3,4P2),3,4,5-三磷脂酰肌醇(PI3,4,5P3),它们均可作为第二信使在细胞中传递并介导PI3K的多种细胞功能[13]。研究表明PI3K-AKT通路参与心肌缺血再灌注损伤,缺血预处理通过激活PI3K-AKT通路,发挥心肌保护作用[4]。AKT通过磷酸化为p-AKT发挥作用,有研究报道心肌AKT磷酸化水平升高可以减轻心脏的缺血再灌注损伤[14]。Weihrauch等[15]研究发现,吗啡可以通过激活PI3K-AKT信号通路促进异氟烷后处理减轻心肌损伤的作用。Chiari等[16]在兔心肌缺血再灌注模型上发现,在使用PI3K抑制剂以后,缺血后处理以及异氟烷后处理的心肌保护作用全部消失。Sun等[17]研究发现骨髓基质细胞中的外泌体可减轻低氧/复氧诱导的心肌细胞凋亡,保护心肌细胞以避免缺血再灌注损伤,其潜在机制是下调PTEN表达,激活PI3K-Akt信号转导通路Yan等[8]研究表明,加巴喷丁预处理可以减轻大鼠的脑缺血再灌注损伤,其保护作用依赖于PI3K-AKT通路。Gross等[12]利用PI3K抑制剂LY294002可以消除阿片类药物对心肌缺血再灌注的保护作用。在本实验中参照文献[12]和预实验结果确定了PI3K抑制剂LY294002的给药剂量。发现在预先给与PI3K抑制剂之后,加巴喷丁的保护作用受到了明显的抑制。与Gap组比较,LY+Gap组大鼠心肌梗死面积以及心律失常次数都明显增加,PI3K及p-AKT表达量下调。提示加巴喷丁可以通过激活PI3K-AKT信号通路发挥心肌保护作用。由于PI3K-AKT可以调控细胞的凋亡,所以进一步实验重点将放在PI3K-AKT通路下游与凋亡相关蛋白的检测上,如Bcl-2,BAX,Caspase-3等蛋白上。
综上所述,加巴喷丁可以减轻心肌缺血再灌注损伤,其机制与激活PI3K-AKT信号通路有关。
利益冲突 所有作者声明无利益冲突
作者贡献声明 吴彬:研究设计、实验操作、论文撰写;曹亚红:数学统计;李锐:研究设计、论文修改
| [1] | Khan JN, McCann GP. Cardiovascular magnetic resonance imaging assessment of outcomes in acute myocardial infarction[J]. World J Cardiol, 2017, 9(2): 109. DOI:10.4330/wjc.v9.i2.109 |
| [2] | Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J]. Circulation, 1986, 74(5): 1124-1136. DOI:10.1161/01.cir.74.5.1124 |
| [3] | Zhang Y, Irwin MG, Wong TM. Remifentanil preconditioning protects against ischemic injury in the intact rat heart[J]. Anesthesiology, 2004, 101(4): 918-923. DOI:10.1097/00000542-200410000-00017 |
| [4] | Mocanu MM, Bell RM, Yellon DM. PI3 kinase and not p42/p44 appears to be implicated in the protection conferred by ischemic preconditioning[J]. J Mol Cell Cardiol, 2002, 34(6): 661-668. DOI:10.1006/jmcc.2002.2006 |
| [5] | Chen JJ, Li LY, Chen SR, et al. The α 2δ -1-NMDA receptor complex is critically involved in neuropathic pain development and gabapentin therapeutic actions[J]. Cell Rep, 2018, 22(9): 2307-2321. DOI:10.1016/j.celrep.2018.02.021 |
| [6] | Hah J, MacKey SC, Schmidt P, et al. Effect of perioperative gabapentin on postoperative pain resolution and opioid cessation in a mixed surgical cohort: a randomized clinical trial[J]. JAMA Surg, 2018, 153(4): 303-311. DOI:10.1001/jamasurg.2017.4915 |
| [7] | GLARE P, AUBREY K R, MYLES P S. Transition from acute to chronic pain after surgery[J]. The Lancet, 2019, 393(10180): 1537-46. DOI:10.1016/s0140-6736(19)30352-6 |
| [8] | Yan BC, Wang J, Rui YG, et al. Neuroprotective effects of gabapentin against cerebral ischemia reperfusion-induced neuronal autophagic injury via regulation of the PI3K/Akt/mTOR signaling pathways[J]. J Neuropathol Exp Neurol, 2019, 78(2): 157-171. DOI:10.1093/jnen/nly119 |
| [9] | Sun XL, Zhong JQ, Wang DG, et al. Increasing glutamate promotes ischemia-reperfusion-induced ventricular arrhythmias in rats in vivo[J]. Pharmacology, 2014, 93(1/2): 4-9. DOI:10.1159/000356311 |
| [10] | Tarnavski O. Mouse surgical models in cardiovascular research[J]. Methods Mol Biol, 2009, 573: 115-137. DOI:10.1007/978-1-60761-247-6_7 |
| [11] | 徐凯生, 张丽, 张野. β - 内啡肽在RVLM吗啡预处理减轻大鼠心肌缺血再灌注损伤中的变化[J]. 安徽医科大学学报, 2020, 55(04): 557-562. DOI:10.19405/j.cnki.issn1000-1492.2020.04.014 |
| [12] | Gross ER, Hsu AK, Gross GJ. Opioid-induced cardioprotection occurs via glycogen synthase kinase beta inhibition during reperfusion in intact rat hearts[J]. Circ Res, 2004, 94(7): 960-966. DOI:10.1161/01.RES.0000122392.33172.09 |
| [13] | Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296(5573): 1655-1657. DOI:10.1126/science.296.5573.1655 |
| [14] | Liu HG, Hua Z, Zhang Y, et al. Effect of Sevoflurane postconditioning on gene expression in brain tissue of the middle cerebral artery occlusion rat model[J]. Mol Biol Rep, 2012, 39(12): 10505-10513. DOI:10.1007/s11033-012-1935-y |
| [15] | Weihrauch D, Krolikowski JG, Bienengraeber M, et al. Morphine enhances isoflurane-induced postconditioning against myocardial infarction: the role of phosphatidylinositol-3-kinase and opioid receptors in rabbits[J]. Anesth Analg, 2005, 101(4): 942-949. DOI:10.1213/01.ane.0000171931.08371.a2 |
| [16] | Chiari PC, Bienengraeber MW, Pagel PS, et al. Isoflurane protects against myocardial infarction during early reperfusion by activation of phosphatidylinositol-3-kinase signal transduction: evidence for anesthetic-induced postconditioning in rabbits[J]. Anesthesiology, 2005, 102(1): 102-109. DOI:10.1097/00000542-200501000-00018 |
| [17] | Sun XH, Wang X, Zhang Y, et al. Exosomes of bone-marrow stromal cells inhibit cardiomyocyte apoptosis under ischemic and hypoxic conditions via miR-486-5p targeting the PTEN/PI3K/AKT signaling pathway[J]. Thromb Res, 2019, 177: 23-32. DOI:10.1016/j.thromres.2019.02.002 |
 2022, Vol. 31
2022, Vol. 31




