2. 南昌大学第一附属医院肿瘤科,南昌 330006;
3. 南昌大学第一附属医院泌尿外科研究所,南昌 330006
2. Department of Oncology, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China;
3. Research Institute of Urological Surgery, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China
脓毒症是宿主对感染的反应失调而导致危及生命的器官功能障碍,是ICU常见的危重病,在中国脓毒症患者90d病死率高达35.5%[1],肺是脓毒症中最早也是最易受损的靶器官[2]。失控性炎症反应被认为是脓毒症肺损伤的主要特征。目前临床上仍缺乏有效降低肺内炎症反应的药物治疗,因此有必要进一步研究脓毒症肺损伤的发生发展机制,探寻治疗新途径。
细胞外囊泡(extracellular vesicle, EVs)是由细胞分泌释放到细胞外环境的双层膜纳米囊泡,其作为细胞间信息交流的重要载体,将其内包含的RNA、蛋白质和脂质等活性成分传递至远处的受体细胞,进而调节亲代细胞和受体细胞的生理病理过程[3-4]。越来越多的研究表明,肺内微环境中的EVs在脓毒症肺损伤进展中发挥重要作用[5-8]。当肺脏受到病毒和细菌感染或损伤时,EVs含量在肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中显著升高[9-11]。当发生急性呼吸窘迫综合征时,BALF源性EVs高表达分泌性磷脂酶A2,激活炎症并水解肺表面活性磷脂,导致肺萎陷[12]。来自肺内的EVs已被证明具有疾病诊断和预后价值,为脓毒症肺损伤的治疗提供了新途径[13]。目前,肺内细胞EVs和体液EVs一直是研究领域关注的焦点,已有大量关于从细胞上清液和体液中提取EVs的研究[14-16]。但这两种来源的EVs存在不能实时反映疾病的动态进展,缺乏疾病特异性等缺陷[17]。最新研究表明,直接从组织层面提取EVs被认为是一种能够反映机体真实变化的新方法,这对于深入探究疾病演变具有重要意义[18-19]。但关于肺组织EVs的研究有限,尚无统一的分离提取方法,因此本研究从分离提取脓毒症大鼠肺组织EVs着手,为深入研究脓毒症肺损伤的发生发展机制提供新的思路。
1 材料与方法 1.1 实验动物、主要材料与试剂Sprague-Dawley(SD)雄性大鼠,4~5周龄,体重80~100g,购买于江西中医药大学实验动物科技中心[动物合格证号:SCXK(赣)2018-0003]。本实验使用的主要材料与试剂包括RPMI 1640培养基、ELISA检测试剂盒、Collagenase D、DNase I(北京索莱宝科技有限公司,中国);CD9小鼠单克隆抗体、CD63小鼠单克隆抗体、Tsg101小鼠单克隆抗体、GM130小鼠单克隆抗体(Santa Cruz公司,美国);Ly6g兔单克隆抗体、cit-H3兔多克隆抗体(Abcam公司,美国);辣根过氧化物酶(HRP)标记二抗(北京中杉金桥生物技术有限公司,中国);HT7800透射电子显微镜(Hitachi公司,日本);FV3000激光共聚焦显微镜(Olympus公司,日本);Zetasizernano zs90粒度测量仪(Malvern公司,英国);凝胶成像分析仪(Bio-Rad公司,美国)。
1.2 大鼠脓毒症肺损伤模型的构建及肺组织样本收集采用盲肠结扎穿刺术(cecal ligation and puncture, CLP)构建大鼠脓毒症模型。具体操作如下:大鼠术前8h禁食并4h禁饮,以1.5%的戊巴比妥钠溶液(40mg/kg)腹腔注射麻醉大鼠,腹部正中切口1~2cm,找到盲肠,游离盲肠与回肠之间的系膜,用3-0号慕丝线结扎25%的盲肠末端,同时用18G穿刺针在结扎部位贯穿1次,共两个孔,挤出少许粪便(约绿豆大小),回纳腹腔,3-0号慕丝线逐层缝合切口,术后皮下注射乳酸林格溶液20mL/kg。CLP术后24h将大鼠行颈椎脱臼处死,打开胸腔并直至颈部,分离颈部气管,从上至下,分离气管肺脏与周边组织,取左肺叶,以无菌PBS漂洗后,行肺组织EVs分离提取。
1.3 肺组织EVs的分离提取取脓毒症大鼠新鲜肺组织0.2g,于RPMI 1640培养基中用手术刀片轻柔切成2mm×2mm×2mm大小,以0.48U/mL的胶原酶D和40U/mL的DNaseI于37℃消化20min,酶解结束后,将组织裂解液经70μm细胞筛过滤收集。组织悬液于4℃以500g离心5min,取上清液于4℃以2 000g离心10min,再取上清液于4℃以10 000g离心20min。经0.45μm滤器过滤后,将组织上清液于4℃以120 000g超速离心1h,弃上清液,可见离心管底侧壁胶冻状沉淀,即为Ti-EVs。以无菌PBS重悬、漂洗、收集沉淀,置于-80℃分装储存。
1.4 肺组织EVs的鉴定 1.4.1 蛋白质免疫印迹试验(Western blot)检测EVs标志性蛋白表达提取肺组织EVs,蛋白定量后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜、封闭;依次加入抗CD63、CD9、Tsg101和GM130一抗(均1∶1 000),4℃孵育过夜;洗膜后加入相应辣根过氧化物酶标记的二抗,室温孵育1h;洗膜后加入增强化学发光试剂,采用凝胶成像系统采集数据。
1.4.2 透射电镜下观察肺组织EVs的形态吸取20μL提取物滴在碳膜铜网放置3~5min,然后用滤纸吸去多余液体。将2%磷钨酸滴在碳支持膜铜网放置1~2min,用滤纸吸去多余液体,室温干燥。透射电子显微镜下观察,采集图像分析。
1.4.3 肺组织EVs直径检测以无菌PBS稀释样品至1mL,采用Zetasizernano zs90粒度测量仪检测样品颗粒直径大小。
1.5 实验分组取脓毒症造模成功的大鼠18只,随机分成Sham组、CLP组和肺组织胞外囊泡(Ti-EVs)组,每组6只;Ti-EVs组经气道内滴入提取的肺组织EVs,剂量为2.5mg/kg(蛋白定量),CLP组给予等体积的1×PBS,Sham组即开腹假手术组,24h后收集相应标本待测。
1.6 收集肺泡灌洗液以50mL注射器针头(剪去尖端)从声门处插入至气管隆凸上方固定气道,用1mL注射器抽吸生理盐水进行反复冲洗5次,收集约4mL BALF。1 000r/min离心5min,获得上清液,-80℃保存,用于检测炎症因子。
1.7 ELISA检测大鼠BALF炎症因子表达收集各组大鼠术后24h的BALF和血清标本,进行IL-1β、TNF-α、IL-6检测,并配置标准品稀释液。用稀释液将母液,建立浓度梯度(4000pg/mL、2 000pg/mL、1000pg/mL、500pg/mL、250pg/mL、125pg/mL、62.5pg/mL);构建标准曲线,将不同浓度的标准品添加到96孔板内,并设置副孔,每孔添加100μL,用封板胶纸遮盖反应孔,37℃避光孵育30min后洗板3次;每个检测样品均设立对照孔,加入酶结合物稀释液。样品的主孔及其副孔加入等量的酶结合物工作液,各孔液体容量均为100μL,最后用封板胶纸遮盖反应孔,37℃避光孵育30min后洗板3次;加入显色底物,每孔100μL,37℃避光孵育5min;每孔加入100μL终止液充分混匀,酶标仪检测样品和标准品的OD值(450nm波长);根据标准品浓度及其对应的OD值,建立标准品的曲线方程,再用样品的OD值代入标准品的曲线方程,从而推算出对应的TNF-α、IL-1β、IL-6的含量。
1.8 肺组织苏木精-伊红(HE)染色将肺组织在10%中性福尔马林中浸泡24h后,进行石蜡包埋、乙醇梯度脱水、切片(4μm),置于载玻片上,80℃烤箱烘烤30min。予以脱蜡、HE染色,脱水风干后滴上中性树脂,盖上盖玻片完成封片,于普通光学显微镜下观察肺组织病理学变化。
1.9 肺组织中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs)的免疫荧光检测取新鲜大鼠肺组织制备冰冻切片,3% BSA封闭1h,抗Ly6g(1∶100)抗体、抗cit-H3抗体(1∶250)4℃孵育过夜,PBS洗3遍,加入Alexa Fluor 488和Alexa Fluor 594荧光二抗室温孵育1h,PBS洗3遍,DAPI染核5min,PBS清洗后滴入抗淬灭封片剂封片,激光共聚焦显微镜下观察。
1.10 统计学方法采用SPSS 17.0统计分析软件进行数据分析,正态分布计量资料以均数标准差(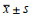
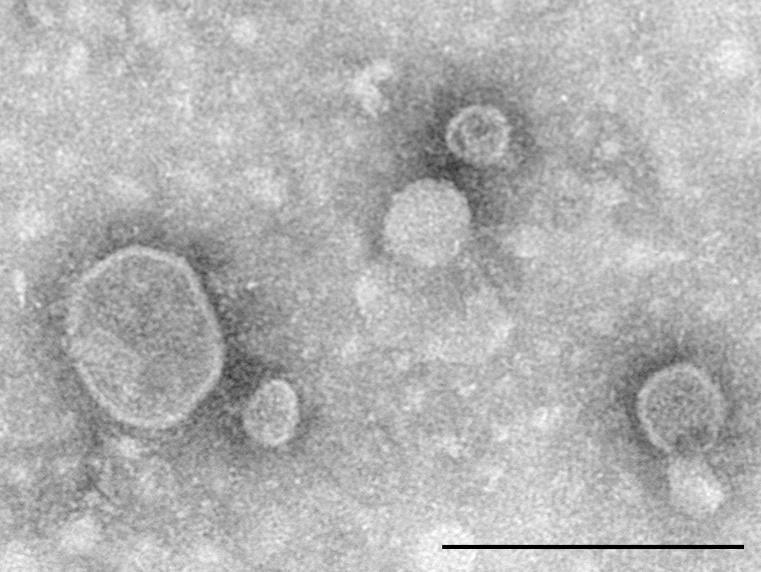
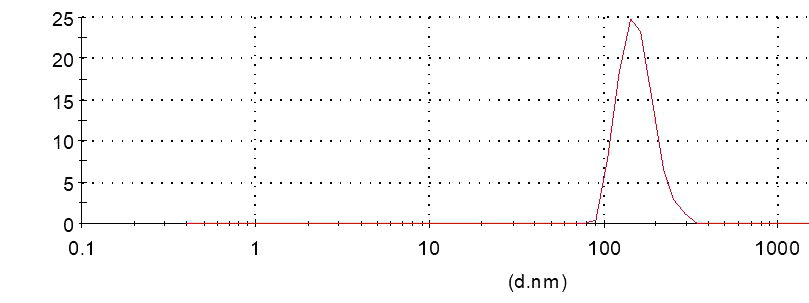
透射电镜下观察肺组织EVs的形态,如图 1所示,可见多个典型的双层圆形的囊性小泡结构。应用Zetasizernano zs90粒度测量仪分析显示囊泡粒子直径主要在150nm左右,符合小细胞外囊泡的粒径范围,见图 2。利用Western Blot技术检测EVs表面标志蛋白marker表达,如图 3所示,与对照组(肺组织)相比,提取的肺组织EVs高表达跨膜蛋白CD9、CD63和细胞溶质蛋白Tsg101等阳性标志物。为进一步排除细胞内囊泡及细胞蛋白的污染,本研究检测了顺式高尔基体的基质蛋白GM130的含量,结果显示提取的Ti-EVs不表达或低表达GM130。综上,以透射电镜、囊泡粒径测量分析以及Western Blot技术分别从EVs的形态、大小、表面标志物等角度证实实验成功分离和提取了大鼠肺组织来源的EVs。
|
| 图 1 透射电镜下观察肺组织胞外囊泡的典型形态图像(bar=200nm) Fig 1 Typical morphological images of lung tissue derived EVs under transmission electron microscopy (bar=200nm) |
|
|
|
| 图 2 肺组织EVs的粒径分布 Fig 2 Particle diameter distribution of lung tissue derived EVs |
|
|
|
| Ctrl组:脓毒症大鼠肺组织;Ti-EVs组:分离提取的脓毒症大鼠肺组织EVs 图 3 蛋白免疫印迹实验检测肺组织EVs表面标志物 Fig 3 Detection of lung tissue derived EVs surface markers by Western blot |
|
|
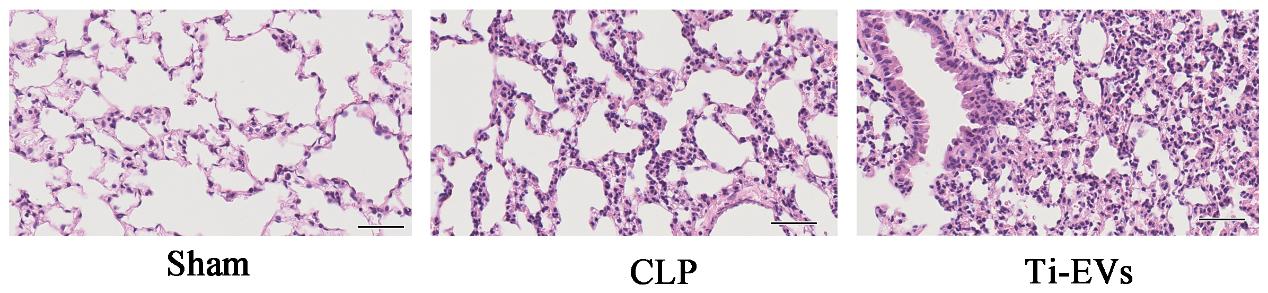
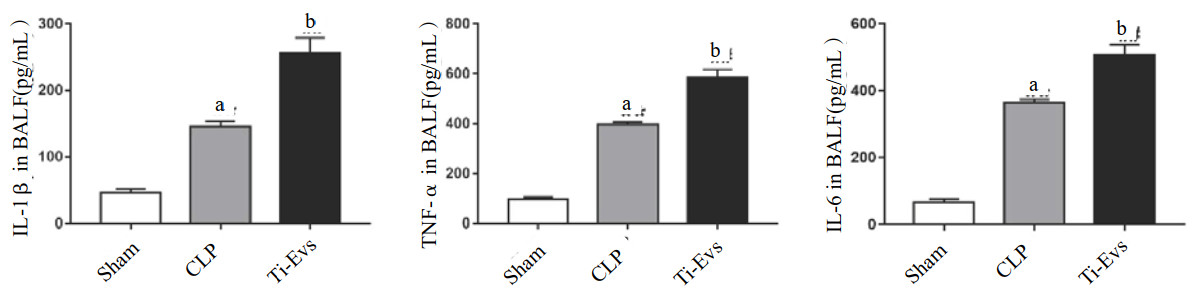
为探索肺组织EVs在脓毒症进程中的作用,本实验检测了气道滴注Ti-EVs 24h后脓毒症大鼠肺组织病理形态学改变及BALF中炎症因子表达情况。如图 4所示,Sham组肺泡结构完整,肺泡壁未见增厚;CLP组肺泡结构完整性破坏,肺泡腔及肺间质内炎症细胞浸润、蛋白沉积;而与CLP组相比,Ti-EVs组肺损伤程度更加严重,表现为肺泡结构严重破坏、肺泡壁明显增厚、大量炎症细胞浸润。ELISA检测BALF内炎症因子水平显示,相较于CLP组,Ti-EVs组中IL-1β、TNF-α、IL-6水平均显著升高,表明肺组织EVs参与脓毒症肺损伤的炎症进程,见图 5。
|
| 图 4 各组大鼠肺组织的病理改变(×400,bar=100μm) Fig 4 The pathological changes of lung tissue in each group of rats (original magnification×400, bar=100μm) |
|
|
|
| Sham组大鼠行开腹假手术处理,CLP组CLP大鼠经气道滴入PBS,Ti-EVs组CLP大鼠经气道滴入肺组织EVs;与Sham组比较,aP<0.01;与CLP组相比,bP<0.01 图 5 ELISA检测大鼠脓毒症肺损伤模型BALF炎症因子表达 Fig 5 The expression of inflammatory factors in BALF of septic lung injury rat model detected by ELISA |
|
|
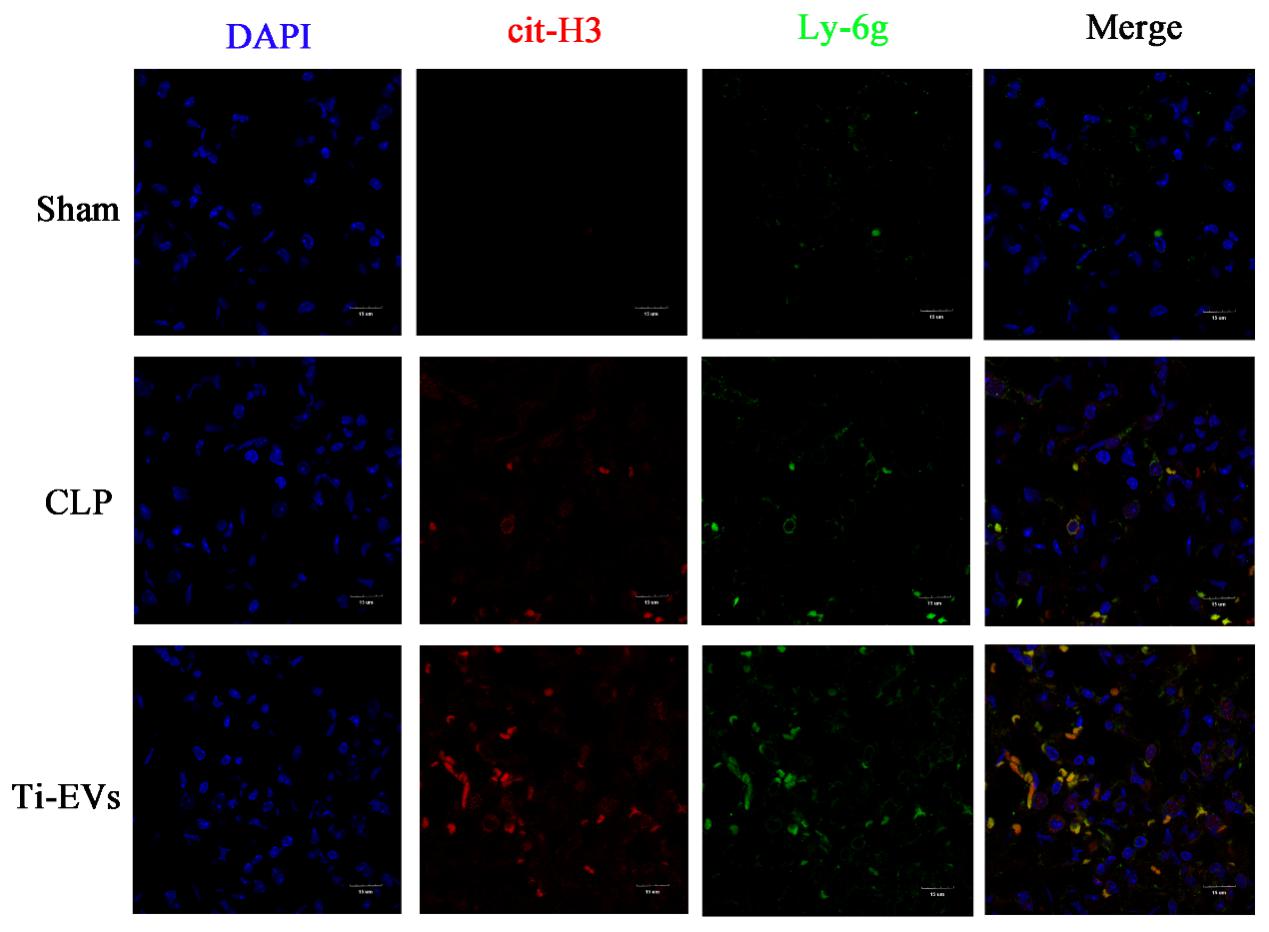
采用激光共聚焦显微镜观察NETs标志蛋白Ly6g(绿色荧光)以及cit-H3(红色荧光)在大鼠肺组织中表达情况。相比CLP组,Ti-EVs组的肺组织中Ly6g蛋白周围cit-H3表达范围及强度显著增加,说明脓毒症肺组织EVs可增加肺内NETs的表达,见图 6。
|
| 图 6 免疫荧光检测大鼠脓毒症肺损伤模型中肺部NETs形成(×1000,bar=15μm) Fig 6 Immunofluorescence detection of the NETs content in lung tissue (original magnification×1000, bar=15μm) |
|
|
EVs是细胞分泌的具有膜结构的微小囊泡,几乎所有类型的细胞均能分泌EVs。基于来源的不同,通常可将EVs分为三类:细胞EVs、体液EVs和Ti-EVs,近来研究发现细胞EVs和体液EVs均存在众多局限性。仅从细胞系培养上清液中获得的细胞EVs,失去了体内微环境中其他细胞群的相互作用,缺乏微环境的复杂性[20]。细胞经长期培养后,其特性可能会受到影响,导致细胞EVs生物功能代表性不佳且不能实时反映疾病的动态进展[21-22]。而体液EVs是机体内各种细胞、组织EVs的混合物,识别起源组织受到极大阻碍,甚至有些局部组织细胞释放的EVs受限于机体空间分布,很难分泌至体液中,欠缺疾病的特异性[23]。相比之下,Ti-EVs存在于组织间质中,包含了组织微环境中大多数细胞类型脱落的囊泡,具有组织特异性、携带组织微环境丰富信息等优点,有助于了解疾病发生发展过程,洞察疾病进展过程中的时空异质性[17, 24]。目前Ti-EVs在疾病中的重要作用已引起研究领域的高度关注,但直接聚焦于肺组织EVs的研究有限,建立稳定、高品质分离、提取Ti-EVs的方法对于深入研究肺部多种疾病演变具有重要意义。
组织EVs富集的关键是组织细胞间EVs的有效释放,同时尽可能避免细胞破裂损伤以及EVs的降解。在通过切割、酶解消化组织而获得细胞悬液的过程中,组织细胞损伤的程度对于后续EVs分离纯化的影响极大,过多破裂的细胞会释放蛋白、核酸、脂质等内含物,导致提取的EVs中存在大量杂质,严重影响EVs的品质。因此对于组织的机械剪切程度、有效酶的选择、酶的作用浓度及酶解时间的把控都需要反复探索,以获得最合适的条件。本实验条件分离提取的大鼠肺组织EVs富含阳性标记蛋白CD9、CD63、Tsg101。为了进一步排除细胞内囊泡及细胞蛋白的污染,本实验检测了细胞表达而组织来源的EVs不表达的顺式高尔基体基质蛋白GM130的含量,结果显示提取的Ti-EVs不表达或低表达GM130,说明分离的EVs受细胞来源的蛋白污染程度低。本研究成功分离提取大鼠肺组织来源EVs,对EVs的表征符合《MISEV 2018》标准[25]。
脓毒症肺损伤时肺内多种炎症细胞趋化、激活,释放大量的炎症因子及分泌EVs。研究表明EVs与脓毒症肺损伤的发生发展密切相关[6-7]。分泌的EVs既能发挥促进炎症作用,同时也有抑制炎症的功能,这与分泌EVs的细胞以及所处的肺组织微环境有关。然而,目前脓毒症肺损伤EVs的研究多数聚焦在细胞EVs和体液EVs,这尚不能真实有效地反应疾病的实时进展。为探究脓毒症肺组织EVs在脓毒症肺损伤中的作用,本实验采用ELISA检测气道滴注肺组织EVs 24h后脓毒症肺损伤大鼠BALF中炎症因子表达情况,结果表明与CLP组相比,Ti-EVs组肺组织病理损伤程度明显加重,BALF中炎症因子显著升高,提示肺组织EVs参与了脓毒症肺部的炎症进程。研究表明脓毒症肺损伤模型中,肺内中性粒细胞的浸润显著增加[26],它不仅可吞噬入侵的病原体,还会将细胞核成分如解凝的染色质、组蛋白、髓过氧化物酶及胞质蛋白以网状结构形式释放到细胞外形成NETs[27-28]。有研究发现,虽然NETs具有防御外来病原菌入侵的重要作用,但NETs的过量形成也将会对组织造成损伤[29]。本研究通过免疫荧光标记观察到,肺组织EVs可明显增加脓毒症肺组织内NETs的表达,这可能与肺组织EVs中携带的有关致炎因子有关。
综上所述,本研究结果表明,在脓毒症肺损伤的疾病状态下,肺组织EVs放大肺内炎症反应同时促进NETs形成,进一步加重肺损伤。未来仍需深入挖掘脓毒症肺组织EVs内的关键致炎因子,明确其在脓毒症肺损伤进程中发挥的作用机制,以期为脓毒症肺损伤的临床治疗提供新思路。
利益冲突:所有作者声明无利益冲突
作者贡献声明 李勇、刘芬:研究设计、基金支持;彭巍、王勇:论文撰写、统计分析;娄远蕾、赵宁:实验操作、数据收集及整理;钱克俭:重症专业指导、论文修改
| [1] | Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: A national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
| [2] | Kim WY, Hong SB. Sepsis and acute respiratory distress syndrome: Recent update[J]. TubercRespir Dis (Seoul), 2016, 79(2): 53-57. DOI:10.4046/trd.2016.79.2.53 |
| [3] | Raposo G, Stoorvogel W. Extracellular vesicles: Exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200(4): 373-383. DOI:10.1083/jcb.201211138 |
| [4] | Tkach M, Théry C. Communication by extracellular vesicles: Where we are and where we need to go[J]. Cell, 2016, 164(6): 1226-1232. DOI:10.1016/j.cell.2016.01.043 |
| [5] | Mohan A, Agarwal S, Clauss M, et al. Extracellular vesicles: Novel communicators in lung diseases[J]. Respir Res, 2020, 21(1): 175. DOI:10.1186/s12931-020-01423-y |
| [6] | Holtzman J, Lee H. Emerging role of extracellular vesicles in the respiratory system[J]. ExpMol Med, 2020, 52(6): 887-895. DOI:10.1038/s12276-020-0450-9 |
| [7] | Lee H, Abston E, Zhang D, et al. Extracellular vesicle: An emerging mediator of intercellular crosstalk in lung inflammation and injury[J]. Front Immunol, 2018, 9: 924. DOI:10.3389/fimmu.2018.00924 |
| [8] | 任颖聪, 陈淼, 刘鑫鑫, 等. 胞外囊泡微小RNA在急性肺损伤中的相关研究进展[J]. 中华危重病急救医学, 2021(5): 633-637. DOI:10.3760/cma.j.cn121430-20200727-00544 |
| [9] | Mills JT, Schwenzer A, Marsh EK, et al. Airway epithelial cells generate pro-inflammatory tenascin-C and small extracellular vesicles in response to TLR3stimuli and rhinovirus infection[J]. Front Immunol, 2019, 10: 1987. DOI:10.3389/fimmu.2019.01987 |
| [10] | Zhang LY, Hei FL. Emerging role of extracellular vesicles in lung injury and inflammation[J]. Biomed Pharmacother, 2019, 113: 108748. DOI:10.1016/j.biopha.2019.108748 |
| [11] | McVey MJ, Maishan M, Blokland KEC, et al. Extracellular vesicles in lung health, disease, and therapy[J]. Am J Physiol Lung Cell Mol Physiol, 2019, 316(6): L977-L989. DOI:10.1152/ajplung.00546.2018 |
| [12] | Papadopoulos S, Kazepidou E, Antonelou MH, et al. Secretory phospholipase A2- Ⅱ A protein and mRNA pools in extracellular vesicles of bronchoalveolar lavage fluid from patients with early acute respiratory distress syndrome: A new perception in the dissemination of inflammation?[J]. Pharmaceuticals (Basel), 2020, 13(11): 415. DOI:10.3390/ph13110415 |
| [13] | Esquivel-Ruiz S, González-Rodríguez P, Lorente JA, et al. Extracellular vesicles and alveolar epithelial-capillary barrier disruption in acute respiratory distress syndrome: Pathophysiological role and therapeutic potential[J]. Front Physiol, 2021, 12: 752287. DOI:10.3389/fphys.2021.752287 |
| [14] | Liu F, Peng W, Chen JQ, et al. Exosomes derived from alveolar epithelial cells promote alveolar macrophage activation mediated by miR-92a-3p in sepsis-induced acute lung injury[J]. Front Cell Infect Microbiol, 2021, 11: 646546. DOI:10.3389/fcimb.2021.646546 |
| [15] | Yuan ZH, Bedi B, Sadikot RT. Bronchoalveolar lavage exosomes in lipopolysaccharide-induced septic lung injury[J]. J Vis Exp, 2018(135): 57737. DOI:10.3791/57737 |
| [16] | Jiang KF, Yang J, Guo S, et al. Peripheral circulating exosomemediated delivery of miR-155as a novel mechanism for acute lung inflammation[J]. MolTher, 2019, 27(10): 1758-1771. DOI:10.1016/j.ymthe.2019.07.003 |
| [17] | Li SR, Man QW, Gao X, et al. Tissue-derived extracellular vesicles in cancers and non-cancer diseases: Present and future[J]. J Extracell Vesicles, 2021, 10(14): e12175. DOI:10.1002/jev2.12175 |
| [18] | Hurwitz SN, Olcese JM, Meckes DG Jr. Extraction of extracellular vesicles from whole tissue[J]. J Vis Exp, 2019, (144): 10.3791/59143. DOI: 10.3791/59143. |
| [19] | Huang YY, Cheng L, Turchinovich A, et al. Influence of species and processing parameters on recovery and content of brain tissue-derived extracellular vesicles[J]. J Extracell Vesicles, 2020, 9(1): 1785746. DOI:10.1080/20013078.2020.1785746 |
| [20] | Chen XD, Zhao J, Yan ZZ, et al. Isolation of extracellular vesicles from intestinal tissue in a mouse model of intestinal ischemia/ reperfusion injury[J]. BioTechniques, 2020, 68(5): 257-262. DOI:10.2144/btn-2019-0159 |
| [21] | Crescitelli R, Lässer C, Jang SC, et al. Subpopulations of extracellular vesicles from human metastatic melanoma tissue identified by quantitative proteomics after optimized isolation[J]. J Extracell Vesicles, 2020, 9(1): 1722433. DOI:10.1080/20013078.2020.1722433 |
| [22] | Crescitelli R, Lässer C, Lötvall J. Isolation and characterization of extracellular vesicle subpopulations from tissues[J]. Nat Protoc, 2021, 16(3): 1548-1580. DOI:10.1038/s41596-020-00466-1 |
| [23] | Shah R, Patel T, Freedman JE. Circulating extracellular vesicles in human disease[J]. N Engl J Med, 2018, 379(22): 2180-2181. DOI:10.1056/NEJMc1813170 |
| [24] | Jang SC, Crescitelli R, Cvjetkovic A, et al. Mitochondrial protein enriched extracellular vesicles discovered in human melanoma tissues can be detected in patient plasma[J]. J Extracell Vesicles, 2019, 8(1): 1635420. DOI:10.1080/20013078.2019.1635420 |
| [25] | Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018(MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014guidelines[J]. J Extracell Vesicles, 2018, 7(1): 1535750. DOI:10.1080/20013078.2018.1535750 |
| [26] | Phillipson M, Kubes P. The neutrophil in vascular inflammation[J]. Nat Med, 2011, 17(11): 1381-1390. DOI:10.1038/nm.2514 |
| [27] | Narasaraju T, Yang E, Samy RP, et al. Excessive neutrophils and neutrophil extracellular traps contribute to acute lung injury of influenza pneumonitis[J]. Am J Pathol, 2011, 179(1): 199-210. DOI:10.1016/j.ajpath.2011.03.013 |
| [28] | 高飞, 高嵩, 惠姣洁, 等. 中性粒细胞与淋巴细胞比值和中性粒细胞胞外诱捕网与脓毒症肝损伤的临床研究[J]. 中华急诊医学杂志, 2021, 30(12): 1484-1488. DOI:10.3760/cma.j.issn.1671-0282.2021.12.013 |
| [29] | Caudrillier A, Kessenbrock K, Gilliss BM, et al. Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury[J]. J Clin Invest, 2012, 122(7): 2661-2671. DOI:10.1172/JCI61303 |
 2022, Vol. 31
2022, Vol. 31




