百草枯(paraquat, PQ)中毒致死率极高,由于缺乏有效的特异性解毒剂,PQ中毒患者的死亡率超过90%[1]。PQ中毒引起的进行性肺纤维化和呼吸衰竭是中毒后的主要死亡原因。目前,PQ致肺纤维化发生发展的相关机制尚不明确,可能涉及炎症反应过度、氧化应激损伤及上皮-间质转化(epithelial-to-mesenchymal transition,EMT)等[2-3]。在上述病理生理学变化中,常伴有多个信号通路的异常,包括TGF-β1/Smad通路、Wnt/β-catenin通路、MAPK通路等[4-5]。研究发现,肌成纤维细胞(myofibroblasts)参与肺纤维化过程中细胞外基质(extracellular matrix, ECM)的产生、沉积和肺组织结构的重塑[6]。肌成纤维细胞细胞有多种不同来源,其中,肺成纤维细胞(fibroblasts)的活化和转分化是其重要来源之一[7]。因此,肺成纤维细胞的转分化也是肺纤维化发生发展的关键步骤,探索肺成纤维细胞转分化的相关分子机制,阻断转分化过程可能是抑制PQ引起肺纤维化的潜在方法。已有研究表明,干扰Wnt/β-catenin通路对PQ诱导的EMT具有抑制作用[8],但对成纤维细胞转分化的影响尚未阐明,本研究通过体外细胞实验探讨抑制Wnt/β-catenin通路对PQ诱导成纤维细胞转分化的影响及相关分子机制,为PQ中毒致肺纤维的干预靶点研究提供参考。
1 材料与方法 1.1 实验材料本研究实验材料包括人胚肺成纤维细胞系(MRC-5,美国ATCC细胞库);DMEM培养基、胎牛血清(FBS)(Gibco,美国);百草枯试剂(Sigma-Aldrich,美国);Wnt信号通路抑制剂DKK1(PeproTech,美国);β-catenin、Cyclin D1、WISP1、α-SMA、Collagen I和Vimentin一抗(Abcam,美国);Western blot和细胞免疫荧光二抗(Invitrogen,美国);PCR引物(生工,上海);Trizol试剂、反转录试剂盒、SYBR Green实时荧光定量PCR(RT-PCR)试剂盒(Takara,日本)。
1.2 实验方法 1.2.1 细胞培养和分组MRC-5细胞在细胞培养箱(37℃,5% CO2)中使用含有10%FBS的高糖DMEM培养基培养,细胞生长至80%融合,按1∶3传代。根据研究目的将细胞分为3组,Control组:无处理;PQ组:以50 μmol/L的PQ处理细胞72 h;PQ+DKK1组:以50 μmol/L的PQ和10 ng/mL的DKK1处理细胞72 h。
1.2.2 细胞免疫荧光用4%多聚甲醛固定细胞,在37℃条件下用含3% BSA的PBS封闭1 h。之后在4℃条件下,分别孵育抗β-catenin、抗α-SMA、抗Collagen I和抗Vimentin抗体过夜。用PBST(含0.2% Triton X-100的PBS)洗3次后,孵育Alexa Fluor 594或488标记的二抗。采用10 μg/mL的DAPI染核后荧光显微镜(徕卡DFC450 C,德国)观察结果。
1.2.3 Western Blot采用12% SDS-PAGE胶分离细胞裂解产物并将蛋白质转移到0.2 μm孔径的PVDF膜(Millipore,美国)。用5%脱脂牛奶封闭,并在4℃条件下分别孵育主要抗β-catenin、抗Cyclin D1、抗WISP1、抗α-SMA、抗Collagen I和抗Vimentin抗体过夜。用PBST洗涤3次后,在37℃下孵育二抗1 h,洗涤后采用化学发光法显影,使用Image J软件扫描分析灰度值。
1.2.4 RT-PCR使用Trizol试剂提取各组细胞总mRNA并逆转录为cDNA。采用SYBR Green试剂盒和ABI 7300系统(Applied Biosystems公司,美国)扩增稀释的cDNA并定量检测。以未加入模板的反应为空白对照、以GAPDH为内参以获得β-catenin、Cyclin D1和WISP1的mRNA水平相对变化情况。
1.3 统计学方法所有实验步骤均至少重复3次,实验数据采用SPSS 21.0软件和Graphpad Prism进行统计分析;计量资料以均数±标准差(x ± s)表示,两组间比较根据正态性检验和方差齐性检验结果采用Student t检验或Mann-Whitney U检验;多组间比较采用单因素方差分析(ANOVA),组间两两比较采用SNK法;所有检验均采用双侧P值,以P < 0.05为差异有统计学意义。
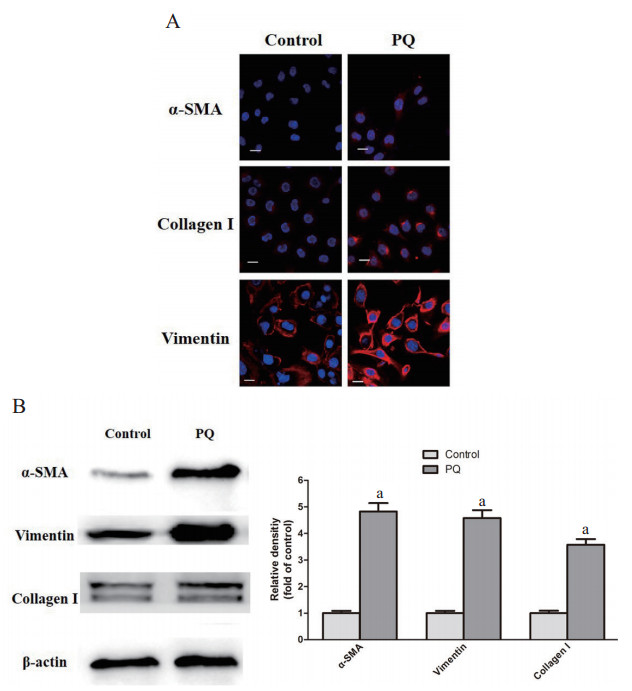
2 结果 2.1 PQ诱导MRC-5细胞转分化模型的建立采用50 μmol/L的PQ处理MRC-5细胞72 h后收获细胞。分别应用细胞免疫荧光和Western Blot技术检测转分化相关标记分子α-SMA、Vimentin和Collagen I的表达水平。如图 1A所示,PQ组细胞α-SMA、Vimentin和Collagen I的荧光强度比Control组细胞高;如图 1B所示,与Control组细胞相比,PQ处理后的MRC-5细胞中α-SMA、Vimentin和Collagen I的表达水平显著上调(P < 0.05)。
|
| A:免疫荧光分析对照组和PQ组细胞α-SMA、Vimentin和Collagen I的表达水平(×600);B:Western Blot检测α-SMA、Vimentin和Collagen I的表达水平,Image J测定目的条带灰度并比较;aP < 0.05 图 1 PQ处理对MRC-5细胞α-SMA、Vimentin和Collagen I表达水平的影响 Fig 1 Expression of α-SMA、Vimentin and Collagen I in MRC-5 cells treated with PQ |
|
|
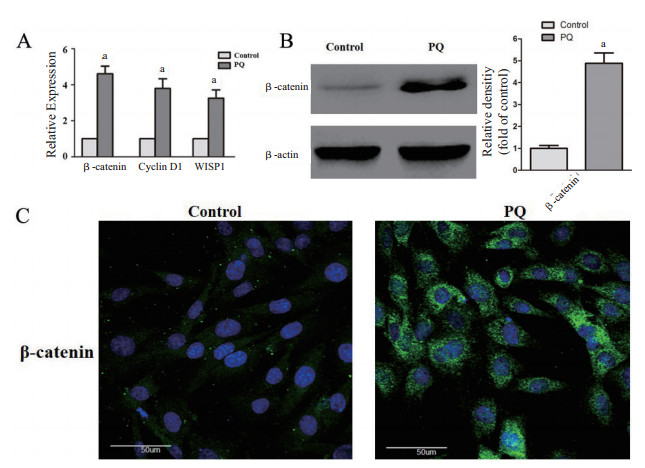
采用PQ(50 μmol/L)处理细胞72 h后,采用RT-PCR检测Wnt通路相关信号分子β-catenin、Cyclin D1和WISP1的mRNA表达水平变化情况,采用Western Blot和免疫荧光技术检测关键信号分子β-catenin的蛋白表达水平变化情况。如图 2A所示,与Control组细胞相比,PQ刺激MRC-5细胞转分化过程中,Wnt通路下游信号分子β-catenin、Cyclin D1和WISP1的mRNA表达水平显著上调(P < 0.05);如图 2B所示,PQ处理3 d后,MRC-5细胞β-catenin蛋白表达水平明显增加(P < 0.05);同时,免疫荧光检测结果也提示PQ组细胞β-catenin的表达水平上调,结果如图 2C所示。
|
| A:RT-PCR检测β-catenin、Cyclin D1和WISP1的mRNA表达水平;B:Western Blot检测β-catenin蛋白表达水平,Image J测定目的条带灰度并比较;C:免疫荧光检测β-catenin蛋白表达水平(×600);aP < 0.05 图 2 PQ刺激对MRC-5细胞中Wnt通路相关信号分子β-catenin、Cyclin D1和WISP1的表达水平的影响 Fig 2 Expression changes of Wnt pathway-related signaling molecules β-catenin、Cyclin D1 and WISP1 of MRC-5 treated by PQ |
|
|
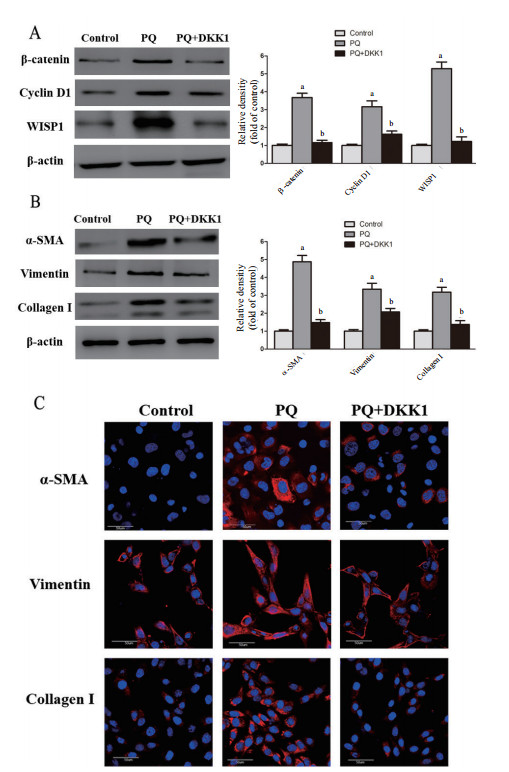
同时采用PQ(50 μmol/L)和DKK1(10 ng/mL)处理细胞进一步分析抑制Wnt信号通路对MRC-5转分化的影响。采用Western Blot方法检测β-catenin、Cyclin D1和WISP1的表达水平,结果如图 3A所示,与PQ组细胞相比,PQ+DKK1组细胞中β-catenin、Cyclin D1和WISP1的表达受到抑制(P < 0.05);采用Western Blot和免疫荧光检测成纤维细胞转分化过程相关标记物α-SMA、Vimentin和Collagen I的表达变化情况,结果如图 3B和3C所示,与PQ组相比,PQ+DKK1组细胞中α-SMA、Vimentin和Collagen的表达受到抑制(P < 0.05)。
|
| A:Western Blot检测β-catenin、Cyclin D1和WISP1表达变化情况,Image J测定目的条带灰度并比较;B:Western Blot检测α-SMA、Vimentin和Collagen I的表达变化情况,Image J测定目的条带灰度并比较;C:免疫荧光检测α-SMA、Vimentin和Collagen I的表达变化情况(放大倍数:600×);a与Control组相比,P < 0.05;b与PQ组相比,P < 0.05 图 3 DKK1对MRC-5细胞Wnt/β-catenin通路及转分化标志分子水平的影响 Fig 3 The effects of DKK1 on Wnt/β-catenin pathway and transition-related markers of MRC-5 cells |
|
|
尽管近年来对PQ制售的管控越来越严格,但PQ中毒或混合中毒病例屡见不鲜。由于缺乏有效的特异性解毒剂,患者预后依然不佳。有关PQ中毒引起肺纤维化发生发展机制及干预的研究虽已取得一定进展,但相关机制尚未完全阐明。本研究发现,PQ作用于肺成纤维细胞系MRC-5能够引起一系列转分化标记物包括α-SMA、Vimentin和Collagen I表达水平的上调,促进MRC-5细胞转分化为肌成纤维细胞。而肌成纤维细胞在损伤、炎症等过程中受到多种细胞因子包括TNF-α,IL-1β等的刺激,产生并分泌大量包括胶原蛋白在内的多种ECM主要成分、参与组织的修复和重构。因此,这一表型转化对肺纤维化的发生发展具有重要作用[9-10],抑制成纤维细胞转分化是阻断PQ致肺纤维化的潜在治疗策略。
研究表明,经典Wnt信号通路的活化参与肺上皮细胞EMT的发生,促进肺纤维化的发生发展,同时,相关药物包括N-乙酰半胱氨酸(NAC)、牛蒡子苷元能够抑制EMT从而抑制肺纤维化[11-13]。但是,有关Wnt/β-catenin通路与成纤维细胞转分化调控的研究较少。本研究发现,在PQ刺激MRC-5细胞引起转分化过程中,Wnt通路相关信号分子β-catenin、Cyclin D1和WISP1的基因和蛋白表达水平均显著上调,Wnt/β-catenin通路呈高度活化状态,因此,Wnt/β-catenin信号通路参与了PQ导致的成纤维细胞转分化过程。本研究进一步通过Wnt/β-catenin信号通路抑制剂DKK1对上述假设进行分析。结果表明,DKK1能够有效抑制PQ刺激引起的Wnt/β-catenin信号途径的激活,下游信号分子β-catenin、Cyclin D1和WISP1的表达水平明显受到抑制;与此同时,DKK1干预能够抑制PQ刺激MRC-5细胞引起的α-SMA、Vimentin和Collagen I的高表达,提示DKK1在干扰Wnt/β-catenin信号的同时抑制MRC-5细胞的转分化。因此,Wnt/β-catenin信号的活化对PQ诱导的肺成纤维细胞转分化具有重要作用,DKK1能够通过抑制Wnt/β-catenin信号传递干扰转分化过程。
值得关注的是,除经典的Wnt通路外,Liu等[14]研究发现,非经典Wnt通路也参与肌成纤维细胞的分化调控,JNK/c-Jun途径参与其中。此外,近年来一些研究提示,在成纤维细胞转分化及肌成纤维细胞分化过程中,其他信号途径也参与其中,影响不同因素诱导的肺纤维化的发生发展。例如,Hippo通路及其关键效应分子YAP1与转录因子Twist参与激活成纤维细胞,促进成纤维细胞的增殖、迁移及胶原分泌,miR-15a参与这一过程[15-16]。其他还包括Hedgehog通路[17]、MAPK通路[18]及一系列miRNAs和LncRNAs[19]等,上述通路及关键信号分子为潜在干预靶点的药物研究也不断被报道。
综上所述,本研究通过体外细胞实验证实干扰Wnt/β-catenin通路的信号传递能够抑制PQ诱导的肺成纤维细胞系MRC-5的转分化。DKK1作为Wnt/β-catenin信号的抑制剂在体内是否具有抑制肺成纤维细胞转分化进而干扰肺纤维化的活性还需进一步动物实验研究。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王蒙蒙、杨志洲:实验操作、论文撰写;任艺、李亮:数据收集与整理;曹丽萍:统计学分析;孙兆瑞:研究设计、论文修改
| [1] | Zhang Z, Nian Q, Chen G, et al. Klotho Alleviates Lung Injury Caused by Paraquat via Suppressing ROS/P38 MAPK-Regulated Inflammatory Responses and Apoptosis[J]. Oxid Med Cell Longev, 2020, 2020: 1-13. DOI:10.1155/2020/1854206 |
| [2] | Bai YW, Ye MJ, Yang DL, et al. Hydrogen sulfide attenuates paraquat-induced epithelial-mesenchymal transition of human alveolar epithelial cells through regulating transforming growth factor-β1/Smad2/3 signaling pathway[J]. J Appl Toxicol, 2019, 39(3): 432-440. DOI:10.1002/jat.3734 |
| [3] | 张宇豪, 杨志洲. 上皮-间质转化参与肺纤维化过程的研究进展[J]. 医学研究生学报, 2021, 34(5): 519-523. DOI:10.16571/j.cnki.1008-8199.2021.05.015 |
| [4] | Tyagi N, Singh D, Dash D, et al. Curcumin Modulates Paraquat-Induced Epithelial to Mesenchymal Transition by Regulating Transforming Growth Factor-β(TGF-β) in A549 Cells[J]. Inflammation, 2019, 42(4): 1441-1455. DOI:10.1007/s10753-019-01006-0 |
| [5] | 符红娜, 聂时南. 百草枯致肺纤维化的上皮-间质转化的机制研究进展[J]. 中华急诊医学杂志, 2019, 28(6): 803-805. DOI:10.3760/cma.j.issn.1671-0282.2019.06.033 |
| [6] | Pakshir P, Hinz B. The big five in fibrosis: Macrophages, myofibroblasts, matrix, mechanics, and miscommunication[J]. Matrix Biol, 2018, 68/69: 81-93. DOI:10.1016/j.matbio.2018.01.019 |
| [7] | Mergault C, Lisée F, Tiroille V, et al. Inhibition of the Arp2/3 complex represses human lung myofibroblast differentiation and attenuates bleomycin-induced pulmonary fibrosis[J]. Br J Pharmacol, 2022, 179(1): 125-140. DOI:10.1111/bph.15675 |
| [8] | Yang Z, Wang M, Ren Y, et al. Inhibition of Wnt10b/β-catenin signaling alleviates pulmonary fibrogenesis induced by paraquat in vivo and in vitro[J]. Life Sci, 2021, 286: 120027. DOI:10.1016/j.lfs.2021.120027 |
| [9] | 黄玉, 王子文, 王会兰, 等. 七甲川花菁类荧光小分子IR-61改善大鼠肺纤维化[J]. 第三军医大学学报, 2020, 42(4): 350-358. DOI:10.16016/j.1000-5404.201909108 |
| [10] | Lacy S H, Woeller C F, Thatcher T H, et al. Activated human lung fibroblasts produce extracellular vesicles with antifibrotic prostaglandins[J]. Am J Respir Cell Mol Biol, 2019, 60(3): 269-278. DOI:10.1165/rcmb.2017-0248OC |
| [11] | 高利红, 周满红. 百草枯中毒致肺纤维化信号通路研究进展[J]. 中华危重病急救医学, 2021, 33(3): 377-380. DOI:10.3760/cma.j.cn121430-20000916-00628 |
| [12] | Gao F, Zhang Y, Yang Z, et al. Arctigenin suppressed epithelial-mesenchymal transition through wnt3a/β-catenin pathway in pq-induced pulmonary fibrosis[J]. Front Pharmacol, 2020, 11: 584098. DOI:10.3389/fphar.2020.584098 |
| [13] | 宋扬, 孙昊, 余国琴, 等. N-乙酰半胱氨酸在百草枯诱导A549细胞转分化过程中的保护作用[J]. 中华急诊医学杂志, 2019, 28(6): 712-716. DOI:10.3760/cma.j.issn.1671-0282.2019.06.011 |
| [14] | Liu T, Gonzalez De Los Santos F, Hirsch M, et al. Non-canonical wnt signaling promotes myofibroblast differentiation in pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2021, 65(5): 489-499. DOI:10.1165/rcmb.2020-0499OC |
| [15] | Chen Y, Zhao X, Sun J, et al. YAP1/Twist promotes fibroblast activation and lung fibrosis that conferred by miR-15a loss in IPF[J]. Cell Death Differ, 2019, 26(9): 1832-1844. DOI:10.1038/s41418-018-0250-0 |
| [16] | Fu J, Zheng M, Zhang X, et al. Fibulin-5 promotes airway smooth muscle cell proliferation and migration via modulating Hippo-YAP/TAZ pathway[J]. Biochem Biophys Res Commun, 2017, 493(2): 985-991. DOI:10.1016/j.bbrc.2017.09.105 |
| [17] | Chen X, Shi C, Cao H, et al. The hedgehog and Wnt/β-catenin system machinery mediate myofibroblast differentiation of LR-MSCs in pulmonary fibrogenesis[J]. Cell Death Dis, 2018, 9(6): 639. DOI:10.1038/s41419-018-0692-9 |
| [18] | 刘卫东, 高歌, 刘函晔, 等. FTY-720通过TGF-β1/P38 MAPK/NF-κB信号通路对小鼠肺纤维化模型的影响[J]. 中国药理学通报, 2020, 36(2): 250-256. DOI:10.3969/j.issn.1001-1978.2020.02.019 |
| [19] | 喻雪飞, 李理, 郑林鑫, 等. 博莱霉素诱导小鼠肺纤维化中差异表达的mRNA及其与LncRNA的共表达网络关系[J]. 南方医科大学学报, 2021, 41(1): 39-46. DOI:10.12122/j.issn.1673-4254.2021.01.05 |
 2022, Vol. 31
2022, Vol. 31




