乌头类生物碱(Aconitum alkaloids)是指存在于川乌、草乌、附子、雪上一枝蒿等毛茛科乌头属植物中的一类生物碱[1]。我国含有乌头类生物碱的植物分布广泛,含有乌头类生物碱的成药也有销售,在风湿性关节炎、关节痛、肿瘤等疾病中均有应用[2]。然而,乌头类生物碱治疗安全窗窄,加工处理不当、过量服用易致急性中毒,导致恶性心律失常和心源性休克,病死率达15.1%[3]。一项研究报告显示,在1961年至2010年期间,由乌头引起的中毒占全部植物性食物中毒事件的16.8%,病死率为4.6%[4]。乌头类生物碱中毒临床表现复杂多样,且人们对乌头类生物碱种类及其毒性作用认知尚不完全,导致各级医院医护人员对乌头类生物碱中毒诊治缺乏统一的认识和应有的规范。为此,急需制定相应的专家共识以指导临床实践。
本专家共识首先经过编写委员会专家组讨论,拟定乌头类生物碱中毒的临床问题,向中国医师协会急诊医师分会专家发放调查问卷,最终确定21个临床问题。基于上述临床问题,以草乌、乌头、乌头碱、川乌和附子为中文检索词,以Aconitum、Aconite及Aconitine为英文检索词搜索中国知网数据库、万方数据库、维普数据库、PubMed、Embase、Cochrane Library、SpringerLink、Web of Science,检索时间截止至2021年8月。经过证据收集、评价,形成推荐意见和推荐分级,完成终稿。共识采用改良Delphi法达成共识的推荐意见,并向急诊医学及相关专业的专家发放问卷。每条推荐意见至少需要获得80%专家的赞成。本专家共识中,证据水平分为高、中、低三级(见表 1)。
| 证据水平 | 描述 |
| 高 | 未来的研究几乎不可能改变现有评估结果的可信度 |
| 中 | 未来的研究可能对现有的评估结果产生重要影响,从而可能改变当前推荐 |
| 低 | 未来的研究很可能对现有的评估结果产生重要影响,从而很可能改变当前推荐 |
乌头类生物碱主要存在于乌头属植物中。根据其药理活性可分为:二酯-二萜生物碱(DDAs)、单酯-二萜生物碱(MDAs)和未酯化-二萜生物碱(UDAs)[5]。DDAs为主要毒素,包含乌头碱AC、新乌头碱MA和次乌头碱HA,可造成心脏与神经毒性[6-7]。DDAs通过水解、酯酶转化形成中度毒性的MDAs,MDAs进一步转化为低毒性的UDAs。乌头属植物中生物碱含量见表 2。
| 中药种类 | 生物碱含量 |
| 草乌 | DDAs总量为0.05%~0.17% |
| 川乌 | DDAs总量为0.15%~0.75% |
| 附子(盐附子、黑顺片、白附片) | DDAs总量≤0.02% MDAs总量≥0.01% |
乌头类生物碱具有高度脂溶性,相对分子质量约469.6~645.7。小鼠中乌头类生物碱蛋白结合率为23.9%~31.9%,表观分布容积(Vd)为(0.632±0.332) mL/kg,血浆达峰时间(Tmax)为(30.08±9.73)min。乌头类生物碱主要经口摄入,在胃肠道内吸收[8],服药后10 min即可发病,以30 min~1 h起病多见[9]。乌头类生物碱口服0.2 mg即可产生中毒症状,对人的致死剂量为2~4 mg[10]。中毒后毒性成分在体内主要分布于肝脏,肾脏、心脏、脑等器官次之。因此,毒素可在血液、尿液、胆汁中被检测到[11-12]。乌头类生物碱主要经肝脏代谢,细胞色素P450s(CYPS)参与乌头类生物碱的代谢过程,通过去甲基化、羟基化、脱氢、蛋白介导的外排等多种代谢形式降低乌头类生物碱的毒性[13-14]。肾脏是毒素排泄最重要的器官,毒性更小的代谢产物主要通过肾脏进行排泄[15-16]。在实验动物中,DDAs半衰期在20 h以内[5],而MDAs半衰期多在20 h以上[17]。
1.3 中毒机制乌头类生物碱通过开放钠离子通道,非选择性阻滞钾离子通道而延长动作电位时程;通过影响钙离子通道,使细胞内钙超载并影响心肌兴奋收缩耦联过程,造成心律失常。其能兴奋心脏迷走神经,降低窦房结自律性和传导性,部分造成传导阻滞甚至停搏,部分触发异常激动或折返,均导致心律失常。此外,乌头类生物碱能直接作用于心肌细胞,造成氧化损伤和凋亡[18-19]。乌头类生物碱所致γ-氨基丁酸(GABA)等神经递质异常分泌损伤神经系统[20-21]。抑制胆碱能神经可出现M样症状和N样症状,并作用于呼吸中枢导致死亡[22]。
2 临床表现乌头碱急性中毒表现主要有神经系统、心血管系统、消化系统三大症候群[23]。多数患者首发症状为口周及面部麻木,恶心呕吐、腹痛腹泻、心慌心悸等表现[9]。严重中毒者可表现出昏迷、心律失常以及循环、呼吸衰竭,甚至死亡[24-25]。
2.1 神经系统轻度中毒患者表现为口周及面部的感觉异常和麻木,部分患者可出现头晕耳鸣,出汗[26];重度患者可表现为全身发麻,肢体僵硬、烦躁、视物模糊、头痛、抽搐,甚至出现昏迷[26]。
2.2 心血管系统心悸和胸闷极为常见。出现血压下降和休克时,则可表现为面色苍白、肢端湿冷、大汗淋漓[27-28]。乌头类生物碱中毒可出现各种心律失常,造成心源性休克、心脏骤停。
2.3 消化系统恶心、呕吐、腹痛和腹泻等症状。
2.4 其他轻度患者可出现气促,咳嗽等表现,严重者则会出现呼吸困难和呼吸衰竭等[29]。
3 诊断与鉴别诊断 3.1 诊断诊断依据主要为:(1)服用或接触乌头类中草药及其制品病史;(2)有紊乱性心律失常表现(图 1);(3)毒物检测。
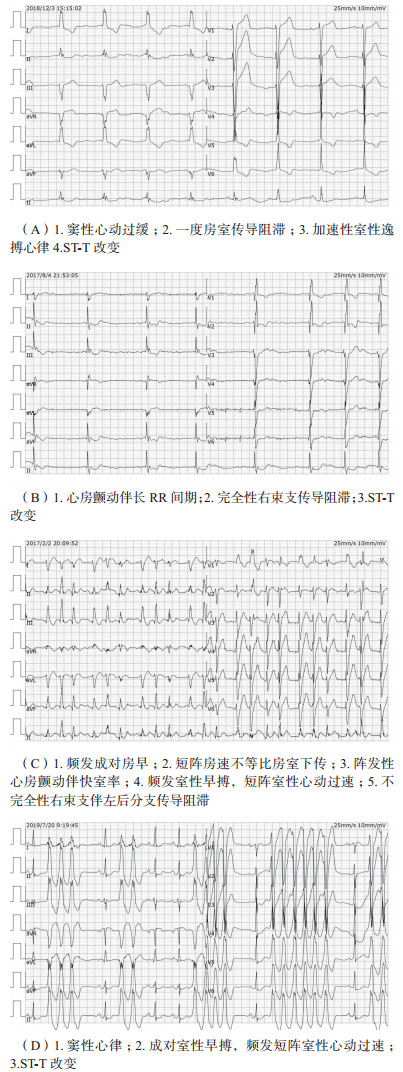
|
| 图 1 典型乌头类生物碱中毒后心电图表现 |
|
|
乌头类生物碱中毒后心电图异常发生率可达80%以上,且以室性心律失常最为常见。有研究发现,乌头类生物碱中毒患者心律失常发生率为71.43%,其中室性心律失常患者约占心律失常患者的50%。另一项病例系列分析也发现,乌头碱中毒后心律失常发生率为100%,室性心律失常的发生率在轻度患者中为67%,在重度患者中为100%[30]。同一患者乌头类生物碱中毒可出现一种或多种类型的心律失常,多种类型心律失常往往同时存在,中毒过程中可能会转变为不同类型的心律失常[31]。
紊乱性心律失常是乌头类生物碱中毒的重要特点,可表现为多源性室性早搏伴短阵室性心动过速,或表现为频繁房性早搏合并短阵房性心动过速,也可存在快速性和缓慢性心律失常并存的情况[9, 30, 32-33]。
血、尿、粪便或胃内容物等中检测到乌头类生物碱或其特异性代产物能为中毒诊断提供依据。据报道,乌头碱AC在血中检测时间窗为24 h,超过7 d后才能在尿液中测出。
患者同时满足(1)和(2)即可作出急性乌头类生物碱碱中毒的临床诊断,有条件者可进行毒物检测为确诊提供依据。如只满足(2)且无其他病因,可作出疑似诊断,需仔细询问病史。如只满足(3)需结合病史特点及临床症状判断是否中毒。
3.2 鉴别诊断根据乌头类生物碱中毒所致心律失常特点,需与毒蘑菇、洋地黄、夹竹桃、博落回等其他植物类中毒所致心律失常相鉴别。
推荐意见1:紊乱性心律失常是乌头类生物碱中毒的重要特点,诊断仍需结合病史和(或)毒物检测结果判断(证据水平:高,一致性:94.7%)。
4 救治流程乌头类生物碱中毒起病急,病情进展迅速,尽早启动血液灌流治疗是乌头类生物碱中毒救治成功的关键。乌头类生物碱中毒的救治流程图见图 2。
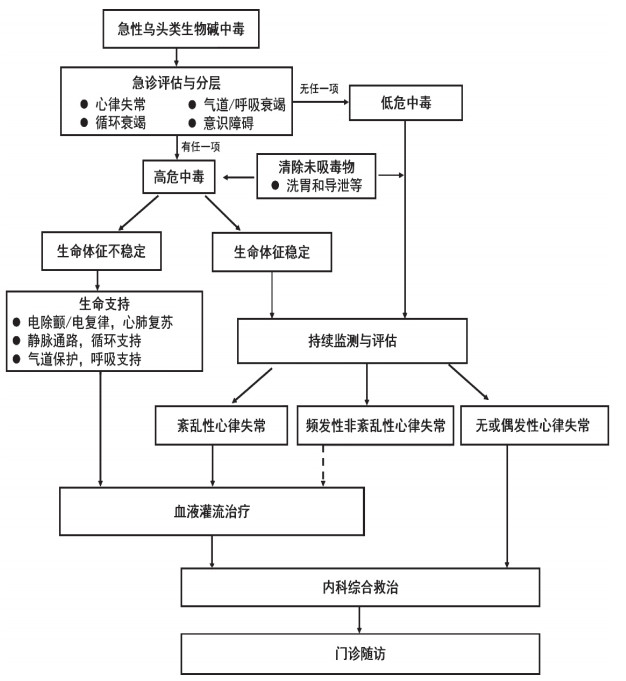
|
| 图 2 急性乌头类生物碱中毒患者急诊诊疗流程 |
|
|
建议对拟诊乌头类生物碱中毒的患者入院后立即予心电监护,并在首次医疗接触后尽早完成12或18导联心电图检查,评估有无高危心律失常。同时对意识、气道(Airway)、呼吸(Breathing)和循环(Circulation)进行评估。出现心律失常以及循环衰竭、意识障碍、呼吸衰竭四项中的任一项即为高危中毒。如无任何一项,则为低危中毒。低危中毒的患者,至少需要进行评估和监测24 h[30],以防其向高危转化。
推荐意见2:对于拟诊乌头类生物碱中毒的患者,入院后立即予心电监护,并在首次医疗接触后尽快完成心电图检查(证据水平:高,一致性:100%)。
4.2 生命支持治疗乌头类生物碱中毒后严重者出现心律失常、心源性休克、心脏骤停。一旦出现心脏骤停,应立即心肺复苏。有研究表明,在延长心肺复苏的15例乌头类生物碱中毒致心脏骤停患者中,9例最终恢复了窦性心律[34]。因此,延长心肺复苏时间能为血液灌流等进一步治疗措施争取时间。对血流动力学不稳定或药物不能控制的心律失常,可考虑使用电复律或心脏起搏治疗。国内有研究报道,电复律联合利多卡因治疗乌头类生物碱中毒室上性心律失常伴血流动力学改变效果显著[35]。但在国外30例乌头类生物碱中毒发生心律失常患者中应用直流电心脏复律,仅5例恢复窦性心律[34]。
对于乌头类生物碱中毒致血流动力学不稳定的血管活性药物选择尚缺乏直接的临床证据。多巴胺和去甲肾上腺素为临床上常用的血管活性药物。既往在急性心肌梗死和脓毒症等疾病中,已经证实多巴胺与去甲肾上腺素相比有增加心律失常的风险[36-37]。对于中毒后休克合并快速性心律失常患者,首选去甲肾上腺素。
对于有恶心呕吐、意识障碍及昏迷的患者,需注意气道保护。一旦出现呼吸频率和节律改变,需警惕呼吸衰竭的发生,及时建立人工气道,并行机械通气[38]。
推荐意见3:乌头类生物碱中毒所致的心脏骤停,应根据临床实际,延长心肺复苏时间(证据水平:中,一致性:100%)。
推荐意见4:乌头类生物碱中毒所致的心律失常,如血流动力学不稳定或药物不能控制,可考虑使用电复律或心脏起搏治疗(证据水平:中,一致性:100%)。
4.3 洗胃、催吐、导泄由于乌头类生物碱吸收快,经口摄入1 h内即可达到血液浓度峰值,因此催吐和洗胃应尽早进行。对胃排空障碍或摄入量大的患者,可放宽洗胃时间窗,超过6 h仍可酌情洗胃。部分摄入毒物量大和中毒严重者应在评估病情,权衡利弊的基础上开展。洗胃液可选择清水,胃内容物吸出干净即可。洗胃过程中注意气道保护,防止误吸。洗胃结束后,可予活性碳保留吸附,也可以予20%甘露醇、硫酸镁、聚乙二醇电解质溶液等导泻,促进肠道毒物排出[39-40]。
推荐意见5:乌头类生物碱中毒洗胃应尽早进行。部分摄入毒物量大和中毒严重者应在评估病情、权衡利弊的基础上延长洗胃时间窗(证据水平:中,一致性:100%)。
4.4 血液净化治疗乌头类生物碱中毒无特效解毒药。乌头类生物碱具有强烈的亲脂性,其与血液中蛋白结合后可形成相对分子质量更大的结合物。在动物实验研究中,血液灌流被证实能够有效减低草乌酒中毒后血浆中乌头碱、新乌头碱、次乌头碱的浓度,降低心律失常的发生率和严重程度,减轻中毒后脑组织、心肌组织和肝脏组织损伤[41]。临床系列病例研究证实,采用血液灌流治疗的草乌中毒患者,其症状持续时间及心电图恢复正常时间明显短于未行血液灌流治疗患者[10]。血液透析及血浆置换在乌头类生物碱中毒救治中的作用尚无可靠临床和基础研究证据。有血液灌流和血液透析联合应用治疗乌头类生物碱中毒的报道,但未有研究提示血液灌流和血液透析联合治疗效果优于血液灌流治疗[42-43]。
综合现有证据和临床经验,生命体征不稳定或紊乱性心律失常是血液灌流的绝对适应证。生命体征稳定的患者,如有频发非紊乱性心律失常,应根据患者中毒剂量、中毒时间、临床表现等综合评估是否行血液灌流;如无心律失常,或仅有偶发性心律失常,如偶发室性/室上性期前收缩时,可先行动态评估和监测。在中毒暴露后越早开展血液灌流越能为患者带来临床获益。血液灌流方案需根据临床实际,把握个体化原则,必要时重复进行,直至无再发心律失常[10, 42]。
推荐意见6:对于生命体征不稳定或有紊乱性心律失常的乌头类生物碱中毒患者,应尽早进行血液灌流治疗(证据水平:高,一致性:89.4%)。
4.5 综合救治 4.5.1 抗心律失常药物(表 3)| 类别 | 药物 | 作用机制 |
| 抗心律失常药物 | ||
| Ⅰa类 | 普鲁卡因胺 | 阻滞钠通道开放和钠离子内流 |
| Ⅰb类 | 利多卡因 | |
| Ⅰc类 | 氟卡尼 | |
| Ⅱ类 | 艾司洛尔 | 阻断β受体 |
| Ⅲ类 | 胺碘酮 | 阻滞钠通道和钙通道开放、阻滞β受体 |
| 其他药物 | 阿托品 | 阻滞M-受体 |
| 硫酸镁 | 减少乙酰胆碱释放、促进细胞外钾离子内流 | |
抗心律失常药物是乌头类生物碱中毒后心律失常治疗的辅助措施。阿托品能够抑制节后受体胆碱能神经支配的平滑肌与腺体活动,缓解神经及消化道症状。更为重要的是,阿托品能阻断迷走神经兴奋,通过提高窦房结自律性和传导性,终止异位节律的发生。对于乌头类生物碱中毒后的各类心律失常,特别是异位心律失常,可尝试使用阿托品[44-46]。一般予0.5~2 mg静脉推注即可取得较好效果[23, 44-46]。
对于血流动力学稳定的快速型心律失常患者,根据乌头类生物碱中毒机制,可选择应用I类抗心律失常药物,如普鲁卡因胺、利多卡因和氟卡尼等。利多卡因起效快,能使钾离子外流,阻断钠离子内流,降低心肌自律性,对中枢神经系统也有双相抑制作用。此外,Ⅱ类和Ⅲ类抗心律失常药物也可选择。有研究报导,胺碘酮对于乌头类生物碱中毒导致的快速性室性心律失常的控制率高于利多卡因[47]。但相对利多卡因,胺碘酮起效慢且有较长的半衰期,同时不良反应也相对较高[47]。因此,如利多卡因无效,可使用胺碘酮或β受体阻滞剂。
硫酸镁可减少乙酰胆碱的释放,促进细胞外钾离子内流,有助于心律失常的转复,对于快速性室性心律失常,特别是尖端扭转性室性心动过速,可试用[44, 48]。
推荐意见7:抗心律失常是乌头类生物碱中毒治疗的重要措施,应根据心律失常类型合理选择药物(证据水平:高,一致性:100%)。
推荐意见8:乌头类生物碱所致的心律失常,可尝试应用阿托品治疗(证据水平:中,一致性:84.2%)。
推荐意见9:乌头类生物碱中毒所致的快速型心律失常,血流动力学稳定者可选用利多卡因或(和)胺碘酮(证据水平:高,一致性:100%)。
4.5.2 器官支持治疗当乌头类生物碱中毒患者并发急性肾功能不全或严重高钾血症、酸中毒等情况时,早期给予持续床旁肾脏替代治疗(continuous renal replacement therapy, CRRT)联合HP提高救治成活率[42-43]。对于无法纠正的呼吸和循环衰竭,可考虑给予体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持[49]。
4.5.3 中药治疗双黄连注射液中的黄芩苷可拮抗乌头类生物碱所致的迷走神经兴奋,减低中枢毒性及心脏毒性[39],降低谷氨酸和提高γ-氨基丁酸(GABA)含量,从而减轻乌头类生物碱中毒后神经元凋亡[21]。国内学者对9例乌头类生物碱中毒患者使用双黄连注射液后,临床症状迅速改善,治愈率达100%[50]。
5 预防对生产人员、医务人员以及使用乌头类药物的人群进行中毒预防宣传教育。医务人员应严格掌握乌头类药物的适应证及用药剂量,避免滥用和误用。告诫患者乌头类药物使用前必须遵嘱炮制,禁用生品。乌头类药物与其他药物配伍时,必须充分水煎后,再与其他药物同煎。此外,对于肝肾功能不全的患者以及需长期服药的患者,宜调整用药剂量。
推荐意见10:积极宣教和合理用药对于预防乌头类生物碱中毒至关重要(证据水平:高,一致性:100%)。
执笔人:卢中秋、赵光举、陈潇荣、马立锋、洪广亮
参与共识制定专家:(按姓名汉语拼音为序)
曹钰(四川大学华西医院)、陈安宝(昆明医科大学第二附属医院)、陈蔚军(东部战区总医院)、邓颖(哈尔滨医科大学附属二院)、樊毫军(天津大学应急医学研究院)、方邦江(上海中医药大学附属龙华医院)、何小军(中华急诊医学杂志编辑部)、洪广亮(温州医科大学附属第一医院)、黄亮(南昌大学一附院)、兰超(郑州大学第一附属医院)、李小刚(中南大学湘雅医院)、李毅(北京协和医院)、卢中秋(温州医科大学附属第一医院)、马岳峰(浙江大学医学院附属第二医院)、聂时南(东部战区总医院)、钱传云(昆明医科大学第一附属医院)、史继学(山东第一医科大学第二附属医院)、宋维(海南省人民医院)、田英平(河北医科大学第二医院)、魏捷(武汉大学人民医院)、杨建中(新疆医科大学附属第一医院)、杨立山(宁夏医科大学总医院)、于学忠(北京协和医院)、张剑锋(广西医科大学第二附属医院)、张斯龙(中华急诊医学杂志编辑部)、赵光举(温州医科大学附属第一医院)、赵敏(中国医科大学附属盛京医院)、赵晓东(中国人民解放军总医院第四医学中心)、郑粉双(云南大学附属医院)、周荣斌(解放军总医院第七医学中心)、朱华栋(北京协和医院)
利益冲突 所有作者声明无利益冲突
| [1] | Zhou W, Liu H, Qiu LZ, et al. Cardiac efficacy and toxicity of aconitine: a new frontier for the ancient poison[J]. Med Res Rev, 2021, 41(3): 1798-1811. DOI:10.1002/med.21777 |
| [2] | Nyirimigabo E, Xu YY, Li YB, et al. A review on phytochemistry, pharmacology and toxicology studies of Aconitum[J]. J Pharm Pharmacol, 2015, 67(1): 1-19. DOI:10.1111/jphp.12310 |
| [3] | 王锐, 丁凡, 高永军, 等. 2004-2013年全国植物性食物中毒事件流行病学分析[J]. 中国食品卫生杂志, 2016, 28(5): 580-584. DOI:10.13590/j.cjfh.2016.05.004 |
| [4] | Toda M, Uneyama C, Kasuga F. Trends of plant toxin food poisonings during the past 50 years in Japan[J]. ShokuhinEiseigakuZasshi, 2014, 55(1): 55-63. DOI:10.3358/shokueishi.55.55 |
| [5] | Wu JJ, Guo ZZ, Zhu YF, et al. A systematic review of pharmacokinetic studies on herbal drug Fuzi: Implications for Fuzi as personalized medicine[J]. Phytomedicine, 2018, 44: 187-203. DOI:10.1016/j.phymed.2018.03.001 |
| [6] | Singhuber J, Zhu M, Prinz S, et al. Aconitum in Traditional Chinese Medicine: a valuable drug or an unpredictable risk?[J]. J Ethnopharmacol, 2009, 126(1): 18-30. DOI:10.1016/j.jep.2009.07.031 |
| [7] | Zhou GH, Tang LY, Zhou XD, et al. A review on phytochemistry and pharmacological activities of the processed lateral root of Aconitum carmichaeliiDebeaux[J]. J Ethnopharmacol, 2015, 160: 173-193. DOI:10.1016/j.jep.2014.11.043 |
| [8] | Tang L, Gong Y, Lv C, et al. Pharmacokinetics of aconitine as the targeted marker of Fuzi (Aconitumcarmichaeli) following single and multiple oral administrations of Fuzi extracts in rat by UPLC/MS/MS[J]. J Ethnopharmacol, 2012, 141(2): 736-741. DOI:10.1016/j.jep.2011.08.070 |
| [9] | Lin CC, Chan TY, Deng JF. Clinical features and management of herb-induced aconitine poisoning[J]. Ann Emerg Med, 2004, 43(5): 574-579. DOI:10.1016/j.annemergmed.2003.10.046 |
| [10] | 赵初环, 卢中秋, 黄唯佳, 等. 血液净化治疗急性乌头碱中毒[J]. 中华内科杂志, 2001, 40(7): 502. DOI:10.3760/j.issn.0578-1426.2001.07.028 |
| [11] | Niitsu H, Fujita Y, Fujita S, et al. Distribution of Aconitum alkaloids in autopsy cases of aconite poisoning[J]. Forensic Sci Int, 2013, 227(1/2/3): 111-117. DOI:10.1016/j.forsciint.2012.10.021 |
| [12] | Ji XY, Yang MB, Or KH, et al. Tissue accumulations of toxic Aconitumalkaloids after short-term and long-term oral administrations of clinically used Radix aconiti lateralispreparations in rats[J]. Toxins (Basel), 2019, 11(6): E353. DOI:10.3390/toxins11060353 |
| [13] | Tang L, Ye L, Lv C, et al. Involvement of CYP3A4/5 and CYP2D6 in the metabolism of aconitine using human liver microsomes and recombinant CYP450 enzymes[J]. Toxicol Lett, 2011, 202(1): 47-54. DOI:10.1016/j.toxlet.2011.01.019 |
| [14] | Ye L, Tang L, Gong Y, et al. Characterization of metabolites and human P450 isoforms involved in the microsomal metabolism of mesaconitine[J]. Xenobiotica, 2011, 41(1): 46-58. DOI:10.3109/00498254.2010.524950 |
| [15] | Ito K, Tanaka S, Funayama M, et al. Distribution of Aconitum alkaloids in body fluids and tissues in a suicidal case of aconite ingestion[J]. J Anal Toxicol, 2000, 24(5): 348-353. DOI:10.1093/jat/24.5.348 |
| [16] | Fujita Y, Terui K, Fujita M, et al. Five cases of aconite poisoning: Toxicokinetics of aconitines[J]. J Anal Toxicol, 2007, 31(3): 132-137. DOI:10.1093/jat/31.3.132 |
| [17] | Zhang H, Liu M, Zhang W, et al. Comparative pharmacokinetics of three monoester-diterpenoid alkaloids after oral administration of Acontiumcarmichaeli extract and its compatibility with other herbal medicines in Sini Decoction to rats[J]. Biomed Chromatogr, 2015, 29(7): 1076-1083. DOI:10.1002/bmc.3394 |
| [18] | Yi MJ, Peng W, Chen XM, et al. Effect of hypaconitine combined with liquiritin on the expression of calmodulin and connexin43 in rat cardiac muscle in vivo[J]. J Pharm Pharmacol, 2012, 64(11): 1654-1658. DOI:10.1111/j.2042-7158.2012.01532.x |
| [19] | Sun GB, Sun H, Meng XB, et al. Aconitine-induced Ca2+overload causes arrhythmia and triggers apoptosis through p38 MAPK signaling pathway in rats[J]. Toxicol Appl Pharmacol, 2014, 279(1): 8-22. DOI:10.1016/j.taap.2014.05.005 |
| [20] | Fu M, Wu M, Qiao Y, et al. Toxicological mechanisms of Aconitum alkaloids[J]. Pharmazie, 2006, 61(9): 735-741. |
| [21] | 王磊, 赵光举, 李萌芳, 等. 急性乌头碱中毒脑损伤机制及黄芩苷的干预作用[J]. 中国中西医结合急救杂志, 2014, 21(4): 289-293. DOI:10.3969/j.issn.1008-9691.2014.04.013 |
| [22] | Voigt N, Abu-Taha I, Heijman J, et al. Constitutive activity of the acetylcholine-activated potassium current IK, ACh in cardiomyocytes[J]. Adv Pharmacol, 2014, 70: 393-409. DOI:10.1016/B978-0-12-417197-8.00013-4 |
| [23] | Chan TY. Aconite poisoning[J]. Clin Toxicol (Phila), 2009, 47(4): 279-285. DOI:10.1080/15563650902904407 |
| [24] | Coulson JM, Caparrotta TM, Thompson JP. The management of ventricular dysrhythmia in aconite poisoning[J]. Clin Toxicol, 2017, 55(5): 313-321. DOI:10.1080/15563650.2017.1291944 |
| [25] | Tai YT, But PP, Young K, et al. Cardiotoxicity after accidental herb-induced aconite poisoning[J]. Lancet, 1992, 340(8830): 1254-1256. DOI:10.1016/0140-6736(92)92951-b |
| [26] | Chan TY, Tomlinson B, Critchley JA, et al. Herb-induced aconitine poisoning presenting as tetraplegia[J]. Vet Hum Toxicol, 1994, 36(2): 133-134. |
| [27] | Tai YT, Lau CP, But PP, et al. Bidirectional tachycardia induced by herbal aconite poisoning[J]. Pacing Clin Electrophysiol, 1992, 15(5): 831-839. DOI:10.1111/j.1540-8159.1992.tb06849.x |
| [28] | Guha S, Dawn B, Dutta G, et al. Bradycardia, reversible panconduction defect and Syncope following self-medication with a homeopathic medicine[J]. Cardiology, 1999, 91(4): 268-271. DOI:10.1159/000006922 |
| [29] | Kimura M, Muroi M, Kimura I, et al. Hypaconitine, the dominant constituent responsible for the neuromuscular blocking action of the Japanese-Sino medicine"bushi"(aconite root)[J]. Jpn J Pharmacol, 1988, 48(2): 290-293. DOI:10.1254/jjp.48.290 |
| [30] | 李玲文, 邱俏檬, 吴斌, 等. 乌头碱急性中毒患者的心电图特点及意义[J]. 中国急救医学, 2007, 27(2): 124-126. DOI:10.3969/j.issn.1002-1949.2007.02.010 |
| [31] | 王荣忠, 王润林, 李守孝, 等. 乌头碱中毒致心律失常的时间和类型分析[J]. 中国中西医结合急救杂志, 2006, 13(6): 375-376. DOI:10.3321/j.issn.1008-9691.2006.06.021 |
| [32] | Vo KT, Tabas JA, Smollin CG. Alternating ventricular complexes afteroverdose from an herbal medication[J]. JAMA Intern Med, 2017, 177(8): 1199-1201. DOI:10.1001/jamainternmed.2017.1839 |
| [33] | 徐华敏, 张爱玲. 急性乌头碱中毒致心律失常心电图分析[J]. 中华全科医学, 2011, 9(7): 1089. DOI:10.16766/j.cnki.issn.1674-4152.2011.07.050 |
| [34] | Coulson JM, Caparrotta TM, Thompson JP. The management of ventricular dysrhythmia in aconite poisoning[J]. Clin Toxicol (Phila), 2017, 55(5): 313-321. DOI:10.1080/15563650.2017.1291944 |
| [35] | 何龙江, 宋大宇, 罗彦, 等. 电复律治疗川乌中毒所致阵发性室上性心动过速1例[J]. 中华危重病急救医学, 2013, 25(9): 557. DOI:10.3760/cma.j.issn.2095-4352.2013.09.014 |
| [36] | de Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock[J]. N Engl J Med, 2010, 362(9): 779-789. DOI:10.1056/NEJMoa0907118 |
| [37] | Avni T, Lador A, Lev S, et al. Vasopressors for the treatment of septic shock: systematic review and meta-analysis[J]. PLoS One, 2015, 10(8): e0129305. DOI:10.1371/journal.pone.0129305 |
| [38] | 徐军, 孙峰, 王亚, 等. 急诊气道管理共识[J]. 中国急救医学, 2016, 36(6): 481-485. DOI:10.3969/j.issn.1002-1949.2016.06.001 |
| [39] | 卢中秋, 胡国新. 乌头碱急性中毒及诊治研究现状[J]. 中国中西医结合急救杂志, 2005(2): 119-121. DOI:10.3321/j.issn.1008-9691.2005.02.031 |
| [40] | 中国医师协会急诊医师分会, 中国毒理学会中毒与救治专业委员会. 急性中毒诊断与治疗中国专家共识[J]. 中华急诊医学杂志, 2016, 25(11): 1361-1375. DOI:10.3760/cma.j.issn.1671-0282.2016.11.004 |
| [41] | 邱俏檬, 刘刚, 卢中秋, 等. 血液灌流对急性草乌中毒兔血浆毒性成分及组织病理学的影响[J]. 中华急诊医学杂志, 2009, 18(3): 247-251. DOI:10.3760/cma.j.issn.1671-0282.2009.03.007 |
| [42] | 陈艳玲, 李亮, 沈锋, 等. 连续性肾脏替代治疗联合血液灌流成功救治重度乌头碱中毒的经验体会[J]. 中国中西医结合急救杂志, 2018, 25(6): 658-661. DOI:10.3969/j.issn.1008-9691.2018.06.024 |
| [43] | 刘国跃, 何旭, 陈淼, 等. 血液灌流联合连续性静脉-静脉血液滤过抢救乌头碱中毒致心搏骤停患者1例[J]. 中华危重病急救医学, 2016, 28(10): 951-952. DOI:10.3760/cma.j.issn.2095-4352.2016.10.020 |
| [44] | Gottignies P, El Hor T, Tameze JK, et al. Successful treatment of monkshood (aconite napel) poisoning with magnesium sulfate[J]. Am J Emerg Med, 2009, 27(6): 755. DOI:10.1016/j.ajem.2008.10.008 |
| [45] | 贾维刚, 曲颖, 李明海. 阿托品治疗乌头类药物中毒致快速性心律失常二例[J]. 中华急诊医学杂志, 2007, 16(11): 1145. DOI:10.3760/j.issn.1671-0282.2007.11.037 |
| [46] | 朱永福, 钟林, 刘浩, 等. 急性乌头碱中毒398例救治分析[J]. 中国中西医结合急救杂志, 2009, 16(2): 102. DOI:10.3969/j.issn.1008-9691.2009.02.015 |
| [47] | 尚云波, 孙海燕, 刘静, 等. 胺碘酮与利多卡因对急性乌头碱中毒所致快速性室性心律失常治疗效果的对比研究[J]. 中国急救医学, 2011, 31(5): 441-444. DOI:10.3969/j.issn.1002-1949.2011.05.018 |
| [48] | 杜学刚. 硫酸镁治疗乌头碱中毒所致顽固性心律失常16例[J]. 临床急诊杂志, 2008, 9(2): 101-102. DOI:10.3969/j.issn.1009-5918.2008.02.014 |
| [49] | Ohuchi S, Izumoto H, Kamata J, et al. A case of aconitine poisoning saved with cardiopulmonary bypass[J]. Kyobu Geka, 2000, 53(7): 541-544. |
| [50] | 肖桂林, 刘国栋, 刘发益, 等. 双黄连注射液治疗乌头碱中毒所致心律失常的临床研究[J]. 中国急救医学, 2004, 24(2): 140-141. DOI:10.3969/j.issn.1002-1949.2004.02.029 |
 2022, Vol. 31
2022, Vol. 31


