共识制定前期,在全国范围内进行了“急诊危重患者肠内营养(enteral nutrition, EN)治疗医护知、信、行现状”调查,结果显示急诊医护人员对急诊危重症患者首选EN治疗方面认识一致、接受度高,但是在知识储备、行为实践方面仍存在明显差异。基于此,在多位专家共同努力下,制定《中国急诊危重症患者肠内营养治疗专家共识》,以规范临床实践,进一步提高急诊危重症患者的治疗质量。
中华医学会急诊医学专业委员会组织急诊等相关领域专家,基于循证医学证据和临床真实世界结果,制定《中国急诊危重症患者肠内营养治疗专家共识》。本共识采用Delphi调查法,经所有参加共识制定的成员对每项参与表决而成,并对有争议的问题公开讨论改进,通过逐一地调整和反馈直到达成共识。
1 急诊危重症患者营养风险筛查【推荐意见1】 对滞留急诊 > 48 h的急诊危重症患者,建议采用营养风险筛查(nutritional risk screening, NRS)-2002进行营养风险评估。NRS-2002≥3分提示患者存在营养风险,建议营养治疗。
【推荐意见2】 对入住急诊重症监护病房(emergency intensive care unit, EICU)的急危重症患者,建议采用危重症患者的营养风险(nutritional risk in critically ill, NUTRIC)评分行营养风险评估。NUTRIC评分≥6分或者改良版NUTRIC评分≥5分提示存在高营养风险,建议营养治疗。
急性感染/应激/损伤后的急危重症患者的病程[1]分为:急性早期、急性晚期和急性后期。急性早期阶段为第1~2天,表现为分解代谢突出。急性晚期阶段为第3~7天,分解代谢伴明显的肌肉萎缩,代谢紊乱趋于缓解[2]。急性早、晚期均主要表现为高分解状态,氨基酸被动员消耗;肠道屏障功能受损、免疫失调和菌群失衡均会加重炎症反应[3]。急性后期可以表现为恢复稳态或者持续性炎症-分解代谢综合征[2]。初步判断患者的营养状态,确定患者是否存在营养风险,以进一步行营养不良评定或制定营养支持计划。
早期营养支持治疗的启动时间宜不超过48 h[4]。Casaer等[5]的研究表明,不伴营养不良的重症监护病房(intensive care unit, ICU)患者,也应该开始早期肠内营养(early enteral nutrition, EEN)。即便EN不能满足目标热卡,补充性肠外营养(parenteral nutrition, PN)推迟至1周后更佳。对于严重营养不良患者或入院前一直处于饥饿状态的患者,需谨慎且渐进地重新引入营养,以避免发生再喂养综合征[1]。
临床常用量表工具包括NRS-2002[6]和改良版NUTRIC评分[7]。NRS-2002量表(表 1)包括三部分,即营养状态受损评分、疾病严重程度评分和年龄评分。如果评分≥3分,即存在营养风险(表 1)。NRS-2002评分以体重和进食量作为营养学指标,得出的营养风险与患者的临床结局相关,具有循证医学基础,并已在回顾性和前瞻性临床研究中得到验证,是目前很多指南推荐首选的筛查工具。急诊危重症患者病情复杂,病种多,NRS-2002操作方便,适用范围广,因此作为首选推荐。
| 评价指标 | 评分 |
| 受损的营养状态(取最高分) | |
| ·正常营养状态 | 0 |
| ·近3个月体重减轻 > 5% 或前1周食物摄入量占正常能量需求的50%~75% | 1 |
| ·近2个月体重减轻 > 5% 或BMI 18.5~20.5 kg/m2+一般状况受损或前1周食物摄入量占正常能量需求的25%~50% | 2 |
| ·近1个月体重减轻 > 5%(≈3个月内减轻 > 15%)或BMI < 18.5 kg/m2且一般状况受损或前1周食物摄入量占正常能量需求 < 25% | 3 |
| 合计 | |
| 疾病的严重程度(取最高分) | |
| ·正常营养需求 | 0 |
| ·髋骨骨折、慢性病患者(尤其合并有肝硬化、慢性阻塞性肺疾病)、慢性血液透析、糖尿病、肿瘤 | 1 |
| ·腹部重大手术、脑卒中、重症肺炎、血液系统恶性肿瘤 | 2 |
| ·颅脑损伤、骨髓移植、ICU患者(APACHE Ⅱ评分 > 10分) | 3 |
| 合计 | |
| 年龄 | |
| ≥70岁 | 1 |
| 计算总分:以上3部分总分≥3分,存在营养风险,开始营养支持 | |
| 注:BMI为体重指数;APACHE Ⅱ为急性生理与慢性健康评分 | |
EICU患者采用NUTRIC评分和改良版NUTRIC评分[不考虑白细胞介素(interleukin, IL)-6]行营养风险评估(表 2)。当NUTRIC评分≥6分或改良版NUTRIC评分≥5分提示存在高营养风险,建议营养治疗[7]。
| 指标 | 参数范围 | 评分值 |
| 年龄(岁) | < 50 | 0 |
| 50~74 | 1 | |
| ≥75 | 2 | |
| APACHE Ⅱ评分(分) | < 15 | 0 |
| 15~19 | 1 | |
| 20~27 | 2 | |
| ≥28 | 3 | |
| SOFA评分(分) | < 6 | 0 |
| 6~9 | 1 | |
| ≥10 | 2 | |
| 合并症(个) | 0~1 | 0 |
| ≥2 | 1 | |
| 入住ICU前住院时间(d) | < 1 | 0 |
| ≥1 | 1 | |
| IL-6(改良版不含)(ng/L) | < 400 | 0 |
| ≥400 | 1 | |
| 计算总分:NUTRIC评分≥6分/改良版NUTRIC评分(不含IL-6)≥5分定义为高营养风险 | ||
| 注:APACHE Ⅱ为急性生理与慢性健康评分;SOFA为序贯器官功能障碍评分;IL-6为白细胞介素-6 | ||
【推荐意见3】 对于血流动力学稳定的患者[平均动脉压(mean arterial pressure, MAP)≥65 mmHg(1mmHg=0.133 kPa),去甲肾上腺素≤1 μg/(kg·min)并在减量中],24~48 h内酌情尽早启动EN。
【推荐意见4】 对于能经口饮食但吞咽不安全的患者,建议使用EN。
EN有助于维持肠道完整性、能调节应激和全身免疫反应、减轻疾病严重程度及改善预后[8]。随机对照临床试验的多个Meta分析显示,与延迟EN治疗相比,EEN能降低重症患者的病死率和感染发生率[1, 9]。在危重症患者中,与营养风险低的患者相比,营养风险高的患者从EEN中获益更大,包括更低的院内感染率、并发症率和病死率[10-11]。在一项大型观察性研究中,在液体复苏后接受至少一种血管加压药物且血流动力学稳定的患者中,与延迟EN (> 48 h)相比,EEN (≤48 h) 组的ICU死亡率和住院死亡率均更低[12]。
在血流动力学不稳定、不可控的休克患者中,将EN引入严重低灌注的肠道会增加肠内喂养不耐受和非闭塞性肠/肠系膜缺血的风险[13]。乳酸水平升高是EN不耐受的独立危险因素[14]。在低血压(MAP < 50 mmHg) 患者中,儿茶酚胺类药物(如去甲肾上腺素、肾上腺素、多巴胺等)正在使用或需要增加剂量以维持血流动力学稳定的患者,均应延迟EN[8, 15]。当需要很高剂量的血管加压药物[如去甲肾上腺素 > 1 μg/(kg·min)],且持续性高乳酸血症/组织低灌注时,应延迟启动EN[4]。危重患者复苏优先,经充分复苏和/或使用稳定的升压药剂量、持续平均动脉压≥65 mmHg后,应启动/重新EN[8]。
建议在以下情况也应延迟EN:未控制的低氧血症和酸中毒、未控制的胃肠道出血、明显肠缺血(闭塞性或非闭塞性)、肠梗阻(机械性肠梗阻)、腹腔间隔室综合征、胃残余量(gastric residual volume, GRV) > 500 mL/6 h或不能实现可靠的远端喂养通路的高输出瘘管[4]。低营养风险(NRS 2002≤2或NUTRIC评分≤5)且不能自主进食的ICU患者,第1周不需要专门的营养治疗[8]。
Tsai等[16]的前瞻性队列研究发现气管插管拔管后48 h吞咽障碍发生率为61.7%。根据不同的评估吞咽困难的时间和方法,发现拔管后吞咽障碍发生率较高(10%~67.5%,平均约50%)[16]。老年患者、长时间的机械通气患者和再插管患者拔管后吞咽障碍的发生率更高,拔管后吞咽障碍可延长至拔管后21 d[16-17]。机械通气拔管后吞咽困难的发生与临床不良结局相关,包括肺炎、再插管和死亡[17]。需严格评估拔管后患者的吞咽功能,如吞咽证实不安全,应采用EN。对于能够EN和(或)经口饮食患者,如果摄入能量能够在3~7 d内达EN目标能量的70%,且没有呕吐或误吸风险,则不应启动补充性PN[4-5]。
3 EN的目标能量和蛋白质目标【推荐意见5】 对于急诊危重症患者,建议基于标准体重的简单计算公式:25~30 kcal/(kg·d)来确定静息目标能量。如果有条件,可使用间接测热(indirect calorimetry, IC)法确定能量需求。
【推荐意见6】 急性疾病早期(前3 d)应用低热卡营养支持治疗(低于目标能量的70%);3 d后,如胃肠功能耐受,能量摄入可逐步提高至目标能量的80%~100%。
【推荐意见7】 推荐给予足够的蛋白质[1.2~2.0 g/(kg·d)],并对蛋白质摄入量的充分性进行持续评估。
临床医生应确定静息能量消耗(resting energy expenditure, REE),以确立营养治疗的目标能量[18]。目标能量可以通过简单的公式法[25~30 kcal/(kg·d)](1 kcal=4.186 kJ)或IC法计算。IC法虽然是危重症患者REE测定的金标准,但是在国内的大多数机构因实用性及成本问题受到限制,暂时无法开展。与IC相比,简单公式法的优势是简便,但是准确性欠佳。除了体重,患者入院前营养状况、体温、用药、治疗等都影响危重患者REE[8]。而且,经过强力容量复苏的危重患者或存在明显液体潴留时,临床医生应使用干体重或正常体重来计算目标能量。应每周重新评估目标能量≥1次[8]。
急性危重症首个72 h因存在内生性热卡(500~1 400 kcal/d)[19],能量补充不应以实际能量消耗为目标。早期全热量喂养+内生性热量,将导致过度喂养[19]。同时,早期全热量喂养可以增加再喂养综合征发生风险。建议在急性疾病的早期阶段使用低热量营养(低于70%的目标能量)[1]。Zusman等[20]的队列研究显示,ICU住院患者中,热量摄入/目标能量比值从0%增加到70%时,死亡率降低;当摄入占比继续增加、尤其达 > 100%时,死亡率升高。摄入不足或过度营养对机械通气的危重患者都是有害的[20]。摄入量过低,< 50%的目标能量,可能耗尽能量储备、肌肉丢失,并可能增加感染并发症[21-22]。3 d后最佳摄入能量大概在目标能量的80%~100%[1]。
在ICU患者中,蛋白质是愈合伤口、支持免疫功能和维持低体重最重要的常量营养素[8]。对于大多数危重患者来说,蛋白质需求比例高于能量需求,因此不容易通过常规的肠内配方(蛋白质能量比例不够高)来满足[8]。尤其是频繁中断EN、EN不佳的患者可从蛋白质补充中获益。蛋白质需求量预计在1.2~2.0 g/(kg·d),烧伤或严重创伤患者的蛋白质需求量可能更高[8]。Weijs等[23]的研究纳入886例ICU连续机械通气患者,蛋白质目标[1.2~1.5 g/(kg·d)]和能量目标均达标治疗与28 d死亡率降低50%相关,而仅达到能量目标与死亡率降低无关。Compher等[24]的研究表明,在NUTRIC评分为高营养风险的ICU机械通气患者中,蛋白质摄入量每增加10%,其死亡率就显著降低6.6%。Bendavid等[25]的队列研究显示,危重症患者早期给予足量蛋白质[前3天 > 0.7 g/(kg·d)]较不足量蛋白质者显著提高患者生存率。在EN的第1周达到1.2~2.0 g/(kg·d)的蛋白质目标,并持续评估蛋白质摄入量的充分性,以随时调整添加蛋白质的方案[3, 8]。
4 EN的途径【推荐意见8】 推荐盲法留置鼻胃/鼻肠管,首选胃内途径;对有高误吸风险,或促动力药物无效的经胃EN不耐受患者,建议采用幽门后喂养。
【推荐意见9】 对于鼻胃/鼻肠管置管困难的患者,建议在超声或透视引导下放置, 若仍无法成功,建议在内镜引导下放置。
EN治疗, 喂养管的远端可以是胃、十二指肠或空肠。目前通过胃内途径启动EN治疗在技术上更容易实现,会减少EN的启动时间。而幽门后置管需要专业技术,通常伴有一定的时间延迟,且其生理性不如经胃EN。因此建议胃内途径作为EN的常规标准途径。Meta分析显示,与经胃EN相比,ICU患者经幽门后EN的耐受性更好、肺炎的风险更低,但两组的死亡率和ICU住院时间无差异[1, 26]。这些均显示幽门后EN可能降低了误吸风险。接受EN的患者应评估误吸风险,并积极采取措施减少误吸。高误吸风险的临床因素包括:气道保护能力差、机械通气、年龄 > 70岁、意识水平下降、神经功能缺陷、镇静镇痛肌松药物的使用、口腔护理差、医患比例低、仰卧位、胃食管反流、转出ICU以及间歇性单次大量输注EN[8]。
临床常用的鼻肠管放置方法包括:盲插法、超声下引导法[27]、透视引导法[28]、内镜下引导法[28]等。目前鼻肠管通常使用内置导丝的螺旋形鼻肠管。对于重症患者,盲法鼻肠管的成功放置需要临床实践以及对标准技术的熟练掌握。床旁超声引导下行鼻空肠管置入术,以生理盐水的应用作为声窗,以金属丝为追踪目标,是一种有效的置管方法[27]。危重患者经透视引导和内镜引导的幽门后置管都是安全的,可准确地在床边进行,且两种幽门后置管的成功率和时间没有显著性差异[28]。
5 EN制剂【推荐意见10】 推荐胃肠功能完整或胃肠功能康复的患者,选择整蛋白配方;存在胃肠功能损伤的患者,选择短肽配方。现有EN药品能够基本满足临床需求,应作为首选。不推荐首选特殊医学用途食品。
有研究表明,重症患者胃肠功能损伤发生率可高达85%,且损伤持续5~7 d仍无法完全恢复[29-30]。EN药品有整蛋白配方、短肽配方和氨基酸配方。2016年美国住院患者营养治疗指南推荐EN实施前应评估胃肠功能,当胃肠功能损伤时应采用特殊EN配方。研究证实,与整蛋白喂养相比,短肽喂养改善了胰腺炎小鼠肠屏障功能,并显著减少肠道细菌移位[31],同时短肽吸收无需受体转运[32]。正常人群服用短肽,血液中的氨基酸峰值浓度较服用整蛋白的正常人显著升高,且上升速度更快[33-34]。当患者胃肠功能正常时,可选择整蛋白配方。此外,对于疾病特异配方,目前尚没有足够循证医学证据证明改善某种疾病患者临床预后,因此,并不推荐常规使用[8]。
至2020年,国内已有多家公司生产的系列EN药品上市。这些药品临床疗效确切、质量稳定可靠,价格合理,能够满足大部分患者的需求,应作为门急诊和住院患者首选。特殊医学用途食品作为营养补充,目前价格普遍较高,以提供相同的热卡量或者蛋白量进行比较,特殊医学用途食品的日治疗费用是EN药品的1~3倍,且需要患者自费。因此,只有当现有EN药品无法满足患者的某些特殊需求时,才考虑选用特殊医学用途食品。常见营养配方热卡及三大营养物质含量汇总(表 3所示)。
| 胃肠功能评估 | 通用名 | 能量(kcal) | 蛋白(g) | 脂肪(g) | 碳水化合物(g) | 适宜人群 |
| 胃肠功能损伤 | 肠内营养混悬液(SP) | 100 | 4 | 1.7 | 17.6 | 胃肠功能受损患者 |
| 短肽型肠内营养剂 | 100 | 3.7 | 1.7 | 17.7 | ||
| 胃肠功能完整 | 肠内营养混悬液(TPF) | 100 | 4 | 3.9 | 12.3 | 胃肠功能完整患者 |
| 肠内营养混悬液(TPF) | 150 | 6 | 5.8 | 18.5 | 高能量代谢、高蛋白补充需求的患者 | |
| 肠内营养混悬液(TP-MCT) | 100 | 5 | 3.3 | 12.6 | 需要蛋白含量高,或伴脂代谢障碍的患者 | |
| 肠内营养混悬液(TPF-DM) | 75 | 3.2 | 3.2 | 8.4 | 应激性高血糖或糖尿病患者 | |
| 整蛋白型肠内营养剂(粉剂) | 100 | 4 | 3.9 | 12.1 | 口服营养补充患者 | |
| 注:SP为短肽型;TPF为整蛋白含纤维型;TPF-DM为整蛋白含纤维-糖尿病型;TP-MCT为整蛋白-中链脂肪酸型 | ||||||
【推荐意见11】 对于急诊危重症患者,使用持续输注EN,而不是间歇性单次大量输注EN[8]。
【推荐意见12】 输注速度建议10~20 mL/h起始,如胃肠功能耐受,可逐渐增加速度。
【推荐意见13】 所有接受EN的机械通气患者应将床头抬高30~45°,以减少误吸。
【推荐意见14】 血糖大于10 mmol/L的患者, 推荐首选静脉滴注胰岛素控制血糖。当血糖难以控制,可采用低血糖指数配方。
与间歇性单次大量输注EN相比,持续输注EN在减少反流和误吸方面具有理论上的优势,但遗憾的是,目前仍证据不足。MacLeod等[35]的随机对照试验显示,危重症创伤患者中持续输注EN组的ICU死亡率较间歇性单次大量输注EN组有降低的趋势(持续EN组7.4% vs. 间歇性单次大量输注EN组13.9%, P=0.18)。小型试验表明,与间歇性单次大量输注EN相比,连续输注EN组的GRV升高率更低[36-37]。美国胃肠外营养和肠内营养协会(American Society for Parenteral and Enteral Nutrition, ASPEN)目前的建议是,高危患者或对经胃间歇性单次大量输注EN不耐受者,应改用持续输注EN[8]。
对于急诊危重症患者,应慢速启动EN (10~20 mL/h)[4, 8],同时监测腹部及胃肠症状。EN的输注浓度宜从低到高,循序渐进;输注速度宜由慢到快,初始速度为20 mL/h,耐受后次日起每8~12 h可增加10~20 mL/h,逐渐增加至100 mL/h,约12 ~ 24 h完成[38]。
Drakulovic等[39]的研究显示,ICU的插管和机械通气患者中,与仰卧位组相比,半卧位组的院内获得性肺炎的发生率显著降低。体位管理是防止误吸的重要措施,半卧位有利于食物通过幽门进入小肠,减少胃内容物潴留,从而有效减少反流和误吸。研究发现,与仰卧位比较,接受EN的重症患者采取半卧位时胃潴留状况明显减轻[40]。ASPEN推荐在无禁忌证的情况下,接受EN的机械通气患者应将床头抬高30~45°,这有助于减少吸入性肺炎的发生[8]。
应激性高血糖是急重症患者常见症状。当血糖异常升高、难以控制时,与患者预后差相关[41]。但应激性高血糖是人类基本的保护反应,有研究表明伴有应激性高血糖的脓毒症患者,死亡率低于血糖正常脓毒症患者[42]。近年来,多项研究证实,强化控制血糖增加了低血糖风险,增加了病死率[43-45]。2017年中国医师协会内分泌代谢科医师分会[46]建议EN/PN时,血糖保持在7.8~13.9 mmol/L。2019年欧洲营养学会[1]和2020年美国糖尿病协会住院患者指南[47]建议危重症患者若持续血糖≥10 mmol/L,应使用胰岛素控制血糖,血糖建议控制在7.8~10 mmol/L [47]。低糖指数配方可以减少血糖波动,降低血糖峰值[48-49],当胰岛素难以控制血糖波动时,建议使用。
7 常见急诊危重症患者EN治疗策略【推荐意见15】 急性呼吸衰竭的患者,不推荐高脂肪/低碳水化合物配方。也不常规推荐使用含有omega-3脂肪酸的配方。
【推荐意见16】 重症急性胰腺炎患者建议经鼻胃管EEN。如患者无法耐受经胃喂养,可采用幽门后喂养。
【推荐意见17】 接受目标体温管理(target temperature management, TTM)的患者,推荐低剂量EEN治疗,在复温后增加剂量。
呼吸衰竭也是急诊常见危重症。含高脂/低碳水化合物的配方,过去曾被认为能降低呼吸熵、减少CO2的生成。但2015年meta分析显示,过多的脂肪(即脂肪供能比 > 40%), 在危重症患者中是有害的、有增加急性呼吸窘迫综合征患者死亡率的趋势[50]。2016年美国重症患者营养指南[8]指出,在ICU急性呼吸衰竭患者中不推荐使用高脂肪/低碳水化合物配方;其含有大量的omega-6脂肪酸,有可能加重炎症过程。在急性肺损伤患者中,与使用标准的肠内制剂相比,添加使用omega-3脂肪酸、γ-亚麻酸和抗氧化剂并没有显著降低ICU住院时间、机械通气时间、器官衰竭率和住院死亡率[51]。Meta分析也不推荐急性呼吸窘迫综合征和急性肺损伤患者补充omega-3脂肪酸[8, 52]。机械通气患者,应避免总能量供给超过能量需求,避免与营养相关的CO2产生增加[53]。
轻中度急性胰腺炎(尤其是合并营养不良)患者需行营养风险筛查,存在高营养风险者需营养治疗[54];重症急性胰腺炎患者始终存在高营养风险,建议EEN[4, 8, 54]。多项研究结果显示,轻中度急性胰腺炎患者可以耐受早期经口饮食,可选择低脂软食[55-57]。Meta分析显示,与PN相比,EN显著降低重症急性胰腺炎患者的总死亡风险、多器官衰竭风险和胰腺感染风险[4, 58]。在EN启动时机上,Meta分析显示AP患者在入院24 h[59-61]或48 h[62-64]内开始EN具有良好的临床效果和耐受性。应避免在中度至重度急性胰腺炎中使用PN作为初始营养治疗[8]。对于合并高脂血症的急性胰腺炎患者,应减少脂肪类物质的补充[54]。进行EN时,应动态观察患者的腹痛、肠麻痹、腹部压痛等症状体征,并定期复查血常规、肝肾功能、电解质、血脂、血糖等水平以评价机体的代谢状况。应用EN剂型可先采用短肽类制剂[65]。有研究表明[31],短肽维护肠屏障,减少细菌移位方面,优于整蛋白。同时,研究证实氨基酸型相较于短肽型或整蛋白型制剂,无显著临床获益[66]。与经鼻肠管EN相比,重症急性胰腺炎患者经鼻胃管喂养的安全性、耐受性无显著性差异,但更方便[67-70]。当急性胰腺炎患者出现胃肠功能损伤、消化吸收障碍、胃排空障碍、幽门关闭综合征时,需采用经鼻肠管喂养[67-68]。
TTM是心脏骤停患者重要治疗手段,降低了能量代谢。由于缺血-再灌注损伤,肠道受到二次打击,导致患者胃肠功能损伤明显。研究表明,在心脏骤停后TTM患者中,EEN是安全的,与延迟EN比较,EEN并未增加肺炎、肠道缺血、胃肠道出血、肠梗阻等的发生率[71]。同时,另一份研究也证实了EEN的安全性,并认为TTM患者EEN可能与更好的神经学预后相关[72]。Williams等[73]的心脏骤停患者行低温治疗的单中心纵向队列研究发现,低温期间对EN的耐受性受损、耐受性中位数为72%,但在复温期间对EN的耐受性中位数上升至95%,正常体温期耐受性中位数为100%。该研究的前24 h低温期喂养量约占正常目标能量的12%。常规使用促动力药物可能会增加EN的成功率。
8 EN的耐受性评估【推荐意见18】 推荐采用急性胃肠功能损伤(Acute gastrointestinal function injury, AGI)标准对患者进行胃肠功能评估,若AGI Ⅰ~Ⅲ级,仍应积极启动EN,若AGI IV级应暂缓EN。EN过程中应对AGI实施动态评估。
【推荐意见19】 推荐对误吸高风险的急诊危重症患者进行GRV监测,连续2次GRV > 250 mL时,如促胃动力药无效,推荐使用幽门后喂养。
2012年欧洲危重学会发布的AGI分级[74]对危重患者胃肠功能损伤严重程度提出了指导性意见:Ⅰ级到Ⅳ级,逐级加重,分别代表:AGIⅠ级为存在胃肠道功能障碍和衰竭的风险、AGIⅡ级为胃肠功能障碍、AGI Ⅲ级为胃肠功能衰竭、AGI Ⅳ级为胃肠功能衰竭伴有远隔器官功能障碍,当AGI Ⅰ~Ⅲ级时,患者仍然存在胃肠功能,应积极或尝试启动EN(表 5所示)。EN过程中应根据胃肠耐受情况动态评估,调整EN实施。
| AGI分级 | 定义 | 表现 | 干预手段 |
| AGIⅠ级 | 存在胃肠道功能障碍或衰竭的风险 | ●腹部术后恶心或呕吐 ●肠鸣音缺失 ●休克早期肠蠕动减少 |
●早期肠内启动,胃肠受损后24~48 h内 ●限制使用损伤胃肠动力药物(如儿茶酚胺, 阿片类) |
| AGIⅡ级 | 胃肠道功能障碍 | ●胃瘫伴高度胃潴留或返流, ●肠麻痹 ●腹泻 ●腹高压Ⅰ级,腹内压(12~15 mmHg) ●胃内容物或粪便可视性出血 ●喂养不耐受,不能72 h内肠内喂养到达20 kcal/kg BW/day |
●小剂量起始肠内营养 ●胃瘫,不能使用促动力药,则幽门后喂养 ●防治胃肠功能衰竭(治疗腹高压;促肠动力药 |
| AGI Ⅲ级 | 胃肠道功能衰竭 | ●持续喂养不耐受 ●高胃潴留 ●持续肠麻痹 ●腹胀,腹高压Ⅱ级,腹内压(15~20 mmHg) ●低腹腔灌注压(< 60 mmHg) |
●挑战性考虑小剂量起始肠内营养 ●即使EN喂养不足,避免早期PN(入ICU7 d内),因增加院内感染 ●监测治疗腹高压 ●停用促进肠麻痹药物 |
| AGI Ⅳ级 | 胃肠功能衰竭伴远隔器官功能障碍(MODS/休克) | ●肠缺血伴坏死 ●消化道出血导致失血性休克 ●Ogilvie’s syndrome ●腹腔间隔室综合征 |
●停营养 ●救命治疗(开腹或急诊干预) |
| 注:AGI为急性胃肠功能损伤,EN为肠内营养,MODS为多器官功能障碍综合征 | |||
对于GRV的监测,尽管国际上有研究表明,停止监测GRV可能对患者误吸风险并没有显著影响,且能降低护理风险[75-76]。当GRV在200~500 mL时,应引起关注,观察患者有无恶心呕吐、腹胀,肠鸣音是否正常等,并结合腹部体格检查综合评估,并采取措施(如使用促胃动力药物如甲氧氯普胺或红霉素、调整喂养量、选择恰当的喂养方法等)以减少误吸的风险[8, 38]。然而,GRV < 500 mL且没有其他EN不耐受表现时,不应自动停止EN[8]。
同时,研究提示对实施EN的患者每4 h进行1次GRV监测是合适的[77]。因此结合国内急诊情况,建议对于高误吸风险患者进行GRV监测,GRV持续增长或大于200 mL的患者建议4 h监测1次。如果GRV < 250 mL宜继续实施EN;如果2次GRV > 250 mL且促胃动力无效,应实施幽门后喂养。
肠鸣音减弱或消失可能反映疾病的严重程度和预后恶化。肠鸣音正常患者的ICU死亡率比肠鸣音不活跃或缺失的患者低(分别为11.3%、22.6%和36.0%)[78],所以急诊危重症患者需要监测肠鸣音。
9 EN的并发症处理【推荐意见20】 对于存在腹泻、肠鸣音减弱或消失(排除肠缺血或肠梗阻)的患者,建议评估其原因、予适当治疗的同时继续EN。
【推荐意见21】 当腹腔内压(intra-abdominal pressure, IAP)增高时,应谨慎实施EN。IAP 12~15 mmHg时,可以继续常规实施;IAP 16~20 mmHg时,应采用滋养型喂养;当IAP > 20 mmHg时,则应暂停EN。
【推荐意见22】 对存在再喂养综合征风险患者,营养启动时最大目标为目标热卡的40%~50%。
重症患者腹泻的发生率在14%~21%[79],其中2%~68%的腹泻发生在EN喂养期间[80]。腹泻的原因包括肠道的消化/吸收功能受损、细菌过度生长或感染(如艰难梭菌)、药物(抗生素、质子泵抑制剂、降糖药、促动力药、非甾体类消炎药、泻药等)的使用等[4, 8, 79]。治疗腹泻应首先针对病因处理,并调整EN输注方式为持续输注[79]。当胃或胃肠道远端喂养时,比较发现胃更能耐受较高的渗透压[79]。若患者仍持续性腹泻,可能会受益于富含可溶性纤维配方或短肽半要素配方[8, 79]。在EN中,腹泻可以通过这些规范的措施得到有效控制,而不是立即停止EN[4]。研究发现,中断EN输注将导致营养摄入不足,无法满足重症患者的需求[81]。
肠鸣音减弱或消失代表肠道收缩功能受损, 可反映疾病的严重程度和不良预后。但与肠道粘膜的完整性、屏障功能或吸收能力并不相关。可以应用促胃肠动力药改善肠蠕动,而不应以肠鸣音作为标准推迟或停止EN[4]。对于接受血管加压药物治疗的EN患者,尤其应密切排查任何EN不耐受的迹象[腹胀,鼻胃管输出或GRV增加,排便和排气减少,肠鸣音减退,代谢性酸中毒和(或)碱缺失]。
危重患者正常的IAP通常波动于5~7 mmHg,Malbrain等[82]的研究表明,所有ICU患者中有近50%患有腹腔内高压。当危重患者IAP升高到10 mmHg时,肠系膜血流会减少。IAP升高至40 mmHg时,腹腔动脉血流可减少43%,肠系膜上动脉血流可减少69%[83]。研究表明,IAP升高后,胃肠不耐受的发生率,逐渐升高[84],应根据IAP的动态变化及时调整EN方案。一般在条件允许的情况下,至少每4 h监测1次IAP。在IAP 12~15 mmHg时可以继续进行常规EN;IAP 16~20 mmHg时应采用滋养型喂养,滋养型EN指维持机体功能的最低喂养量,其目的是保护小肠上皮细胞、刺激十二指肠纹状缘分泌酶类、增强免疫功能、保护上皮细胞间的紧密连接以及防止菌群移位,通常定义为10~20 kcal/h或不超过500 kcal/d;当IAP > 20 mmHg时则应暂停EN[85]。
再喂养综合征[86]是能量摄入减少一段时间后,恢复或增加能量供应时发生的。2020年美国肠外肠内营养学会提出再喂养综合征的诊断标准为:在重新启动或大幅增加能量供应后5 d内血清磷、钾和(或)镁水平下降达10%~20% 的为轻度再喂养综合征;其水平下降达20%~30%的为中度再喂养综合征;下降 > 30%伴有或不伴有器官功能障碍的为重度再喂养综合征。对具有再喂养综合征风险的患者,营养支持启动应从小剂量开始,最大能量为目标能量的40%~50%。当电解质水平严重危及生命或急剧下降时,根据医生的判断和临床表现,考虑停止营养支持。
10 急诊危重症患者EN的流程推荐EN治疗流程参见图 1。
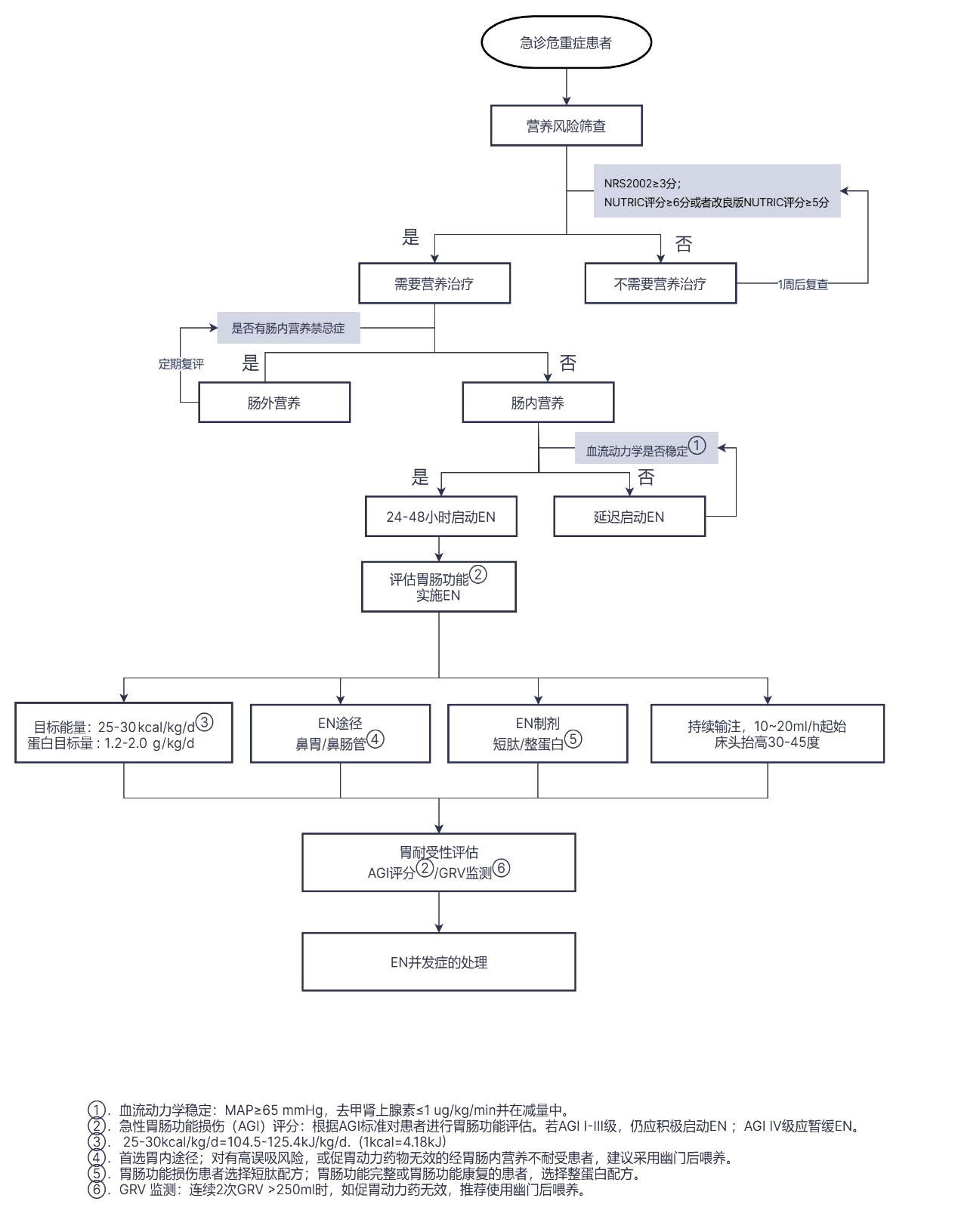
|
|
①血流动力学稳定: MAP≥65 mmHg, 去甲肾上腺素≤1 ug/(kg·min)并在减量中; ② AGI评分: 根据AGI标准对患者进行胃肠功能评估。若AGI Ⅰ~Ⅲ级,仍应积极启动EN; AGI Ⅳ级应暂缓EN; ③ 25~30 kcal/(kg·d)=104.5~125.4 kJ/(kg·d); ④首选胃内途径,对有高误吸风险,或促胃动力药物无效的经胃肠内营养不耐受患者,建议采用幽门后喂养; ⑤胃肠功能损伤患者选择短肽配方;胃肠功能完整或胃肠功能康复的患者,选择整蛋白配方; ⑥ GRV监测: 连续2次GRV > 250 mL时,如促胃动力药无效,推荐使用幽门后喂养 图 1 急诊危重症患者EN治疗流程图 |
|
|
执笔人: 李彦、方珊娟
编写组(按姓名拼音字母为序): 柴艳芬、陈兵、陈晓辉、陈玉国、邓颖、董士民、甘永雄、顾伟、郭伟、郭杨、何小军、何新华、黄亮、黄中伟、金红旭、金文扬、李杰、李小刚、李欣、刘励军、刘英华、吕传柱、吕瑞娟、马青变、马渝、毛恩强、潘曙明、潘新亭、秦历杰、曲爱君、孙传政、童朝阳、屠苏、王大明、王军、王美堂、王弋、王宇、王振杰、温伟、吴彩军、谢苗荣、邢吉红、熊辉、徐玢、徐峰(齐鲁)、曾红科、詹红、张泓、张斯龙、赵斌、赵剡、郑亚安、朱志强
利益冲突 所有作者声明无利益冲突
| [1] | Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit[J]. Clin Nutr, 2019, 38(1): 48-79. DOI:10.1016/j.clnu.2018.08.037 |
| [2] | Puthucheary ZA, Rawal J, McPhail M, et al. Acute skeletal muscle wasting in critical illness[J]. JAMA, 2013, 310(15): 1591-1600. DOI:10.1001/jama.2013.278481 |
| [3] | Martindale R, Patel JJ, Taylor B, et al. Nutrition therapy in critically ill patients with coronavirus disease 2019[J]. JPEN J Parenter Enteral Nutr, 2020, 44(7): 1174-1184. DOI:10.1002/jpen.1930 |
| [4] | Reintam Blaser A, Starkopf J, Alhazzani W, et al. Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines[J]. Intensive Care Med, 2017, 43(3): 380-398. DOI:10.1007/s00134-016-4665-0 |
| [5] | Casaer MP, Mesotten D, Hermans G, et al. Early versus late parenteral nutrition in critically ill adults[J]. N Engl J Med, 2011, 365(6): 506-517. DOI:10.1056/NEJMoa1102662 |
| [6] | Kondrup J, Rasmussen HH, Hamberg O, et al. Nutritional risk screening (NRS 2002): A new method based on an analysis of controlled clinical trials[J]. Clin Nutr, 2003, 22(3): 321-336. DOI:10.1016/s0261-5614(02)00214-5 |
| [7] | Rahman A, Hasan RM, Agarwala R, et al. Identifying critically-ill patients who will benefit most from nutritional therapy: Further validation of the "modified NUTRIC" nutritional risk assessment tool[J]. Clin Nutr, 2016, 35(1): 158-162. DOI:10.1016/j.clnu.2015.01.015 |
| [8] | McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of critical care medicine (SCCM) and American society for parenteral and enteral nutrition (A.S.P.E.N.)[J]. JPEN J Parenter Enteral Nutr, 2016, 40(2): 159-211. DOI:10.1177/0148607115621863 |
| [9] | Doig GS, Heighes PT, Simpson F, et al. Early enteral nutrition, provided within 24 h of injury or intensive care unit admission, significantly reduces mortality in critically ill patients: A meta-analysis of randomised controlled trials[J]. Intensive Care Med, 2009, 35(12): 2018-2027. DOI:10.1007/s00134-009-1664-4 |
| [10] | Heyland DK, Dhaliwal R, Jiang X, et al. Identifying critically ill patients who benefit the most from nutrition therapy: The development and initial validation of a novel risk assessment tool[J]. Crit Care, 2011, 15(6): R268. DOI:10.1186/cc10546 |
| [11] | Jie B, Jiang ZM, Nolan MT, et al. Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk[J]. Nutrition, 2012, 28(10): 1022-1027. DOI:10.1016/j.nut.2012.01.017 |
| [12] | Khalid I, Doshi P, DiGiovine B. Early enteral nutrition and outcomes of critically ill patients treated with vasopressors and mechanical ventilation[J]. Am J Crit Care, 2010, 19(3): 261-268. DOI:10.4037/ajcc2010197 |
| [13] | Mancl EE, Muzevich KM. Tolerability and safety of enteral nutrition in critically ill patients receiving intravenous vasopressor therapy[J]. JPEN J Parenter Enteral Nutr, 2013, 37(5): 641-651. DOI:10.1177/0148607112470460 |
| [14] | Mao Z, Liu G, Yu Q, et al. Association between serum lactate levels and enteral feeding intolerance in septic patients treated with vasopressors: A retrospective cohort study[J]. Ann Transl Med, 2020, 8(19): 1240. DOI:10.21037/atm-20-6317 |
| [15] | Simo Es Covello LH, Gava-Brandolis MG, Castro MG, et al. Vasopressors and nutrition therapy: Safe dose for the outset of enteral nutrition?[J]. Crit Care Res Pract, 2020, 2020: 1095693. DOI:10.1155/2020/1095693 |
| [16] | Tsai MH, Ku SC, Wang TG, et al. Swallowing dysfunction following endotracheal intubation: Age matters[J]. Medicine (Baltimore), 2016, 95(24): e3871. DOI:10.1097/md.0000000000003871 |
| [17] | Macht M, Wimbish T, Clark BJ, et al. Postextubation dysphagia is persistent and associated with poor outcomes in survivors of critical illness[J]. Crit Care, 2011, 15(5): R231. DOI:10.1186/cc10472 |
| [18] | Schlein KM, Coulter SP. Best practices for determining resting energy expenditure in critically ill adults[J]. Nutr Clin Pract, 2014, 29(1): 44-55. DOI:10.1177/0884533613515002 |
| [19] | Tappy L, Schwarz JM, Schneiter P, et al. Effects of isoenergetic glucose-based or lipid-based parenteral nutrition on glucose metabolism, de novo lipogenesis, and respiratory gas exchanges in critically ill patients[J]. Crit Care Med, 1998, 26(5): 860-867. DOI:10.1097/00003246-199805000-00018 |
| [20] | Zusman O, Theilla M, Cohen J, et al. Resting energy expenditure, calorie and protein consumption in critically ill patients: A retrospective cohort study[J]. Crit Care, 2016, 20(1): 367. DOI:10.1186/s13054-016-1538-4 |
| [21] | Dvir D, Cohen J, Singer P. Computerized energy balance and complications in critically ill patients: An observational study[J]. Clin Nutr, 2006, 25(1): 37-44. DOI:10.1016/j.clnu.2005.10.010 |
| [22] | Villet S, Chiolero RL, Bollmann MD, et al. Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients[J]. Clin Nutr, 2005, 24(4): 502-509. DOI:10.1016/j.clnu.2005.03.006 |
| [23] | Weijs PJ, Stapel SN, de Groot SD, et al. Optimal protein and energy nutrition decreases mortality in mechanically ventilated, critically ill patients: A prospective observational cohort study[J]. JPEN J Parenter Enteral Nutr, 2012, 36(1): 60-68. DOI:10.1177/0148607111415109 |
| [24] | Compher C, Chittams J, Sammarco T, et al. Greater Protein and Energy Intake May Be Associated With Improved Mortality in Higher Risk Critically Ill Patients: A Multicenter, Multinational Observational Study[J]. Crit Care Med, 2017, 45(2): 156-163. DOI:10.1097/ccm.0000000000002083 |
| [25] | Bendavid I, Zusman O, Kagan I, et al. Early administration of protein in critically ill patients: A retrospective cohort study[J]. Nutrients, 2019, 11(1): 106. DOI:10.3390/nu11010106 |
| [26] | Alhazzani W, Almasoud A, Jaeschke R, et al. Small bowel feeding and risk of pneumonia in adult critically ill patients: A systematic review and meta-analysis of randomized trials[J]. Crit Care, 2013, 17(4): R127. DOI:10.1186/cc12806 |
| [27] | Li Y, Ye Y, Mei Y, et al. Semi-automated ultrasound guidance applied to nasogastrojejunal tube replacement for enteral nutrition in critically ill adults[J]. Biomed Eng Online, 2018, 17(1): 21. DOI:10.1186/s12938-018-0452-1 |
| [28] | Foote JA, Kemmeter PR, Prichard PA, et al. A randomized trial of endoscopic and fluoroscopic placement of postpyloric feeding tubes in critically ill patients[J]. JPEN J Parenter Enteral Nutr, 2004, 28(3): 154-157. DOI:10.1177/0148607104028003154 |
| [29] | 呼邦传, 孙仁华, 吴爱萍, 等. 急性胃肠损伤分级系统对重症患者适应性及临床预后的评估[J]. 中华医学杂志, 2017, 97(5): 325-331. DOI:10.3760/cma.j.issn.0376-2491.2017.05.002 |
| [30] | Hu B, Sun R, Wu A, et al. Severity of acute gastrointestinal injury grade is a predictor of all-cause mortality in critically ill patients: A multicenter, prospective, observational study[J]. Crit Care, 2017, 21(1): 188. DOI:10.1186/s13054-017-1780-4 |
| [31] | Zhang J, Yu WQ, Wei T, et al. Effects of Short-Peptide-Based Enteral Nutrition on the Intestinal Microcirculation and Mucosal Barrier in Mice with Severe Acute Pancreatitis[J]. Mol Nutr Food Res, 2020, 64(5): e1901191. DOI:10.1002/mnfr.201901191 |
| [32] | 王洁, 何桂珍, 王玉康, 等. 小肽的吸收转运机制及生理学作用[J]. 中华临床营养杂志, 2013, 21(5): 300-304. DOI:10.3760/cma.j.issn.1674-635X.2013.05.007 |
| [33] | Heimburger DC, Geels VJ, Bilbrey J, et al. Effects of small-peptide and whole-protein enteral feedings on serum proteins and diarrhea in critically ill patients: A randomized trial[J]. JPEN J Parenter Enteral Nutr, 1997, 21(3): 162-167. DOI:10.1177/0148607197021003162 |
| [34] | Koopman R, Crombach N, Gijsen AP, et al. Ingestion of a protein hydrolysate is accompanied by an accelerated in vivo digestion and absorption rate when compared with its intact protein[J]. Am J Clin Nutr, 2009, 90(1): 106-115. DOI:10.3945/ajcn.2009.27474 |
| [35] | MacLeod JB, Lefton J, Houghton D, et al. Prospective randomized control trial of intermittent versus continuous gastric feeds for critically ill trauma patients[J]. J Trauma, 2007, 63(1): 57-61. DOI:10.1097/01.ta.0000249294.58703.11 |
| [36] | Bonten MJ, Gaillard CA, van der Hulst R, et al. Intermittent enteral feeding: The influence on respiratory and digestive tract colonization in mechanically ventilated intensive-care-unit patients[J]. Am J Respir Crit Care Med, 1996, 154(2 Pt 1): 394-399. DOI:10.1164/ajrccm.154.2.8756812 |
| [37] | Steevens EC, Lipscomb AF, Poole GV, et al. Comparison of continuous vs intermittent nasogastric enteral feeding in trauma patients: perceptions and practice[J]. Nutr Clin Pract, 2002, 17(2): 118-122. DOI:10.1177/0115426502017002118 |
| [38] | 陈丽, 袁慧, 李菊芳, 等. 肠内营养相关并发症预防与管理最佳证据总结[J]. 肠外与肠内营养, 2021, 28(2): 109-116. DOI:10.16151/j.1007-810x.2021.02.010 |
| [39] | Drakulovic MB, Torres A, Bauer TT, et al. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: A randomised trial[J]. Lancet, 1999, 354(9193): 1851-1858. DOI:10.1016/s0140-6736(98)12251-1 |
| [40] | Farsi Z, Kamali M, Butler S, et al. The effect of semirecumbent and right lateral positions on the gastric residual volume of mechanically ventilated, critically ill patients[J]. J Nurs Res, 2020, 28(4): e108. DOI:10.1097/jnr.0000000000000377 |
| [41] | Krinsley JS. Association between hyperglycemia and increased hospital mortality in a heterogeneous population of critically ill patients[J]. Mayo Clin Proc, 2003, 78(12): 1471-1478. DOI:10.4065/78.12.1471 |
| [42] | Tiruvoipati R, Chiezey B, Lewis D, et al. Stress hyperglycemia may not be harmful in critically ill patients with sepsis[J]. J Crit Care, 2012, 27(2): 153-158. DOI:10.1016/j.jcrc.2011.06.011 |
| [43] | Johnston KC, Bruno A, Pauls Q, et al. Intensive vs standard treatment of hyperglycemia and functional outcome in patients with acute ischemic stroke: The shine randomized clinical trial[J]. JAMA, 2019, 322(4): 326-335. DOI:10.1001/jama.2019.9346 |
| [44] | Abdelmalak BB, Lansang MC. Revisiting tight glycemic control in perioperative and critically ill patients: when one size may not fit all[J]. J Clin Anesth, 2013, 25(6): 499-507. DOI:10.1016/j.jclinane.2012.09.006 |
| [45] | Finfer S, Chittock DR, Su SY, et al. Intensive versus conventional glucose control in critically ill patients[J]. N Engl J Med, 2009, 360(13): 1283-1297. DOI:10.1056/NEJMoa0810625 |
| [46] | 中国医师协会内分泌代谢科医师分会, 中国住院患者血糖管理专家组. 中国住院患者血糖管理专家共识[J]. 中华内分泌代谢杂志, 2017, 33(1): 1-10. DOI:10.3760/cma.j.issn.1000-6699.2017.01.001 |
| [47] | American Diabetes Association. 15. Diabetes care in the hospital: standards of medical care in Diabetes-2020[J]. Diabetes Care, 2020, 43(Suppl 1): S193-S202. DOI:10.2337/dc20-S015 |
| [48] | Magnoni D, Rouws CH, Lansink M, et al. Long-term use of a diabetes-specific oral nutritional supplement results in a low-postprandial glucose response in diabetes patients[J]. Diabetes Res Clin Pract, 2008, 80(1): 75-82. DOI:10.1016/j.diabres.2007.10.027 |
| [49] | 张馨, 衡卫卫, 李姗姗, 等. 新型糖尿病肠内营养制剂改善急性重症缺血性脑卒中病人的血糖和胰岛素抵抗状态[J]. 肠外与肠内营养, 2016, 23(6): 342-345. DOI:10.16151/j.1007-810x.2016.06.007 |
| [50] | Santacruz CA, Orbegozo D, Vincent JL, et al. Modulation of Dietary Lipid Composition During Acute Respiratory Distress Syndrome: Systematic Review and Meta-Analysis[J]. JPEN J Parenter Enteral Nutr, 2015, 39(7): 837-846. DOI:10.1177/0148607114562913 |
| [51] | Rice TW, Wheeler AP, Thompson BT, et al. Enteral omega-3 fatty acid, gamma-linolenic acid, and antioxidant supplementation in acute lung injury[J]. JAMA, 2011, 306(14): 1574-1581. DOI:10.1001/jama.2011.1435 |
| [52] | Kristine Koekkoek W, Panteleon V, van Zanten AR. Current evidence on ω-3 fatty acids in enteral nutrition in the critically ill: A systematic review and meta-analysis[J]. Nutrition, 2019, 59: 56-68. DOI:10.1016/j.nut.2018.07.013 |
| [53] | Talpers SS, Romberger DJ, Bunce SB, et al. Nutritionally associated increased carbon dioxide production. Excess total calories vs high proportion of carbohydrate calories[J]. Chest, 1992, 102(2): 551-555. DOI:10.1378/chest.102.2.551 |
| [54] | Arvanitakis M, Ockenga J, Bezmarevic M, et al. ESPEN guideline on clinical nutrition in acute and chronic pancreatitis[J]. Clin Nutr, 2020, 39(3): 612-631. DOI:10.1016/j.clnu.2020.01.004 |
| [55] | Lariño-Noia J, Lindkvist B, Iglesias-García J, et al. Early and/or immediately full caloric diet versus standard refeeding in mild acute pancreatitis: A randomized open-label trial[J]. Pancreatology, 2014, 14(3): 167-173. DOI:10.1016/j.pan.2014.02.008 |
| [56] | Moraes JM, Felga GE, Chebli LA, et al. A full solid diet as the initial meal in mild acute pancreatitis is safe and result in a shorter length of hospitalization: results from a prospective, randomized, controlled, double-blind clinical trial[J]. J Clin Gastroenterol, 2010, 44(7): 517-522. DOI:10.1097/MCG.0b013e3181c986b3 |
| [57] | Eckerwall GE, Tingstedt BB, Bergenzaun PE, et al. Immediate oral feeding in patients with mild acute pancreatitis is safe and may accelerate recovery-—a randomized clinical study[J]. Clin Nutr, 2007, 26(6): 758-763. DOI:10.1016/j.clnu.2007.04.007 |
| [58] | Yao H, He C, Deng L, et al. Enteral versus parenteral nutrition in critically ill patients with severe pancreatitis: A meta-analysis[J]. Eur J Clin Nutr, 2018, 72(1): 66-68. DOI:10.1038/ejcn.2017.139 |
| [59] | Qi D, Yu B, Huang J, et al. Meta-analysis of early enteral nutrition provided within 24 hours of admission on clinical outcomes in acute pancreatitis[J]. JPEN J Parenter Enteral Nutr, 2018, 42(7): 1139-1147. DOI:10.1002/jpen.1139 |
| [60] | Bakker OJ, van Brunschot S, Farre A, et al. Timing of enteral nutrition in acute pancreatitis: Meta-analysis of individuals using a single-arm of randomised trials[J]. Pancreatology, 2014, 14(5): 340-346. DOI:10.1016/j.pan.2014.07.008 |
| [61] | Li X, Ma F, Jia K. Early enteral nutrition within 24 hours or between 24 and 72 hours for acute pancreatitis: evidence based on 12 RCTs[J]. Med Sci Monit, 2014, 20: 2327-2335. DOI:10.12659/msm.892770 |
| [62] | Song J, Zhong Y, Lu X, et al. Enteral nutrition provided within 48 hours after admission in severe acute pancreatitis: A systematic review and meta-analysis[J]. Medicine (Baltimore), 2018, 97(34): e11871. DOI:10.1097/md.0000000000011871 |
| [63] | Petrov MS, Pylypchuk RD, Uchugina AF. A systematic review on the timing of artificial nutrition in acute pancreatitis[J]. Br J Nutr, 2009, 101(6): 787-793. DOI:10.1017/s0007114508123443 |
| [64] | Feng P, He C, Liao G, et al. Early enteral nutrition versus delayed enteral nutrition in acute pancreatitis: A PRISMA-compliant systematic review and meta-analysis[J]. Medicine (Baltimore), 2017, 96(46): e8648. DOI:10.1097/md.0000000000008648 |
| [65] | 中华医学会消化病学分会胰腺疾病学组, 中华胰腺病杂志编辑委员会, 中华消化杂志编辑委员会. 中国急性胰腺炎诊治指南(2019年, 沈阳)[J]. 中华消化杂志, 2019, 39(11): 721-730. DOI:10.3760/cma.j.issn.0254-1432.2019.11.001 |
| [66] | Endo A, Shiraishi A, Fushimi K, et al. Comparative effectiveness of elemental formula in the early enteral nutrition management of acute pancreatitis: A retrospective cohort study[J]. Ann Intensive Care, 2018, 8(1): 69. DOI:10.1186/s13613-018-0414-6 |
| [67] | Petrov MS, Correia MI, Windsor JA. Nasogastric tube feeding in predicted severe acute pancreatitis. A systematic review of the literature to determine safety and tolerance[J]. Jop, 2008, 9(4): 440-448. |
| [68] | Nally DM, Kelly EG, Clarke M, et al. Nasogastric nutrition is efficacious in severe acute pancreatitis: A systematic review and meta-analysis[J]. Br J Nutr, 2014, 112(11): 1769-1778. DOI:10.1017/s0007114514002566 |
| [69] | Chang YS, Fu HQ, Xiao YM, et al. Nasogastric or nasojejunal feeding in predicted severe acute pancreatitis: A meta-analysis[J]. Crit Care, 2013, 17(3): R118. DOI:10.1186/cc12790 |
| [70] | Zhu Y, Yin H, Zhang R, et al. Nasogastric Nutrition versus Nasojejunal Nutrition in Patients with Severe Acute Pancreatitis: A Meta-Analysis of Randomized Controlled Trials[J]. Gastroenterol Res Pract, 2016, 2016: 6430632. DOI:10.1155/2016/6430632 |
| [71] | Gutierrez A, Carlson C, Kalra R, et al. Outcomes associated with delayed enteral feeding after cardiac arrest treated with veno-arterial extracorporeal membrane oxygenation and targeted temperature management[J]. Resuscitation, 2021, 164: 20-26. DOI:10.1016/j.resuscitation.2021.04.029 |
| [72] | Martin M, Reignier J, Le Thuaut A, et al. Nutrition during targeted temperature management after cardiac arrest: Observational study of neurological outcomes and nutrition tolerance[J]. JPEN J Parenter Enteral Nutr, 2020, 44(1): 138-145. DOI:10.1002/jpen.1596 |
| [73] | Williams ML, Nolan JP. Is enteral feeding tolerated during therapeutic hypothermia?[J]. Resuscitation, 2014, 85(11): 1469-1472. DOI:10.1016/j.resuscitation.2014.08.018 |
| [74] | Reintam Blaser A, Malbrain ML, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM working group on abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [75] | Heyland DK, van Zanten ARH, Grau-Carmona T, et al. A multicenter, randomized, double-blind study of ulimorelin and metoclopramide in the treatment of critically ill patients with enteral feeding intolerance: PROMOTE trial[J]. Intensive Care Med, 2019, 45(5): 647-656. DOI:10.1007/s00134-019-05593-2 |
| [76] | Reignier J, Mercier E, Le Gouge A, et al. Effect of not monitoring residual gastric volume on risk of ventilator-associated pneumonia in adults receiving mechanical ventilation and early enteral feeding: A randomized controlled trial[J]. Jama, 2013, 309(3): 249-256. DOI:10.1001/jama.2012.196377 |
| [77] | Cheatham ML, Malbrain ML, Kirkpatrick A, et al. Results from the international conference of experts on intra-abdominal hypertension and abdominal compartment syndrome. II. Recommendations[J]. Intensive Care Med, 2007, 33(6): 951-962. DOI:10.1007/s00134-007-0592-4 |
| [78] | Reintam A, Parm P, Kitus R, et al. Gastrointestinal symptoms in intensive care patients[J]. Acta Anaesthesiol Scand, 2009, 53(3): 318-324. DOI:10.1111/j.1399-6576.2008.01860.x |
| [79] | Pitta MR, Campos FM, Monteiro AG, et al. Tutorial on Diarrhea and Enteral Nutrition: A Comprehensive Step-By-Step Approach[J]. JPEN J Parenter Enteral Nutr, 2019, 43(8): 1008-1019. DOI:10.1002/jpen.1674 |
| [80] | de Brito-Ashurst I, Preiser JC. Diarrhea in Critically Ill Patients: The Role of Enteral Feeding[J]. JPEN J Parenter Enteral Nutr, 2016, 40(7): 913-923. DOI:10.1177/0148607116651758 |
| [81] | Heyland DK, Murch L, Cahill N, et al. Enhanced protein-energy provision via the enteral route feeding protocol in critically ill patients: results of a cluster randomized trial[J]. Crit Care Med, 2013, 41(12): 2743-2753. DOI:10.1097/CCM.0b013e31829efef5 |
| [82] | Malbrain ML, Chiumello D, Pelosi P, et al. Prevalence of intra-abdominal hypertension in critically ill patients: A multicentre epidemiological study[J]. Intensive Care Med, 2004, 30(5): 822-829. DOI:10.1007/s00134-004-2169-9 |
| [83] | Rajasurya V, Surani S. Abdominal compartment syndrome: Often overlooked conditions in medical intensive care units[J]. World J Gastroenterol, 2020, 26(3): 266-278. DOI:10.3748/wjg.v26.i3.266 |
| [84] | Bordejé ML, Montejo JC, Mateu ML, et al. Intra-abdominal pressure as a marker of enteral nutrition intolerance in critically ill patients. The PIANE Study[J]. Nutrients, 2019, 11(11). DOI:10.3390/nu11112616 |
| [85] | Kirkpatrick AW, Roberts DJ, De Waele J, et al. Intra-abdominal hypertension and the abdominal compartment syndrome: Updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome[J]. Intensive Care Med, 2013, 39(7): 1190-1206. DOI:10.1007/s00134-013-2906-z |
| [86] | da Silva JSV, Seres DS, Sabino K, et al. ASPEN Consensus Recommendations for Refeeding Syndrome[J]. Nutr Clin Pract, 2020, 35(2): 178-195. DOI:10.1002/ncp.10474 |
 2022, Vol. 31
2022, Vol. 31


