肝脓肿(liver abscess, LA)是致病菌通过胆道、肝动脉、门静脉、直接蔓延等途径侵入肝脏引起的肝内局灶性、化脓性病变,是临床上常见的消化系统感染性疾病之一。LA常见病原菌包括细菌、真菌、阿米巴,其中细菌性肝脓肿(pyogenic liver abscess, PLA)最常见,占肝脓肿发病率的80%[1]。PLA临床主要表现为发热、腹痛、白细胞及C反应蛋白等炎症指标升高,但也有部分患者腹部症状及体征不明显,体格检查缺乏特异性,容易造成漏诊、误诊。随着医学技术的进展,PLA的诊断率与治愈率已显著提高,死亡率已低至10%以下。但近年来随着糖尿病、恶性肿瘤、使用免疫抑制等患者增多,临床上肝胆有创操作增多,以及多重耐药和高毒力致病菌株的产生,PLA的病因、病原体和临床表现发生相应变化,给临床诊治工作带来了新的挑战;同时随着介入治疗的发展及应用,PLA治疗策略也发生了变化。急诊科作为肝脓肿首诊的主要科室之一,临床诊治工作须做到快速、高效且精准。本共识旨在通过回顾细菌性肝脓肿相关临床研究和指南、整合专家意见、结合急诊诊疗具体情况等来进行制定。
共识采用共识会议法制订,过程包括:题目的选定、成立编写小组、提出关键问题、系统检索整理相关文献、撰写共识初稿。初稿提交编写组专家函审,提出修改意见,修订后召开专家讨论会,确定终稿,再次提交共识编写组专家审核定稿,最终专家组成员得出一致性程度较高的推荐意见[2]。
1 PLA流行病学专家意见1 细菌性肝脓肿发病率呈上升趋势,急诊诊疗应注意肝脓肿发病的危险因素,其中糖尿病患者需特别关注。
1.1 发病率PLA在各个地区的发病率略有差异,这与各地区患者的基础疾病、地理气候差异、医疗技术水平不同相关。中国大陆地区年发病率约(1.1~5.4)/10万,亚洲部分国家年发病率达到(12~18)/10万,欧美国家约(1.0~4.1)/10万[3-6];男性发病率高于女性(3.3/10万vs. 1.3/10万)[7-8]。PLA发病率在全球范围内均有逐年上升趋势。
1.2 危险因素目前认为肝胆或胰腺疾病、胰十二指肠手术、肝移植手术等是PLA潜在的危险因素。而近年来,越来越多的肝脓肿患者被发现合并有糖尿病,有研究显示,肝脓肿在糖尿病患者中的发病率为健康人群的3倍以上[9],因此急诊诊疗应注意肝脓肿发病的危险因素,其中糖尿病患者需特别关注。另外中老年、高血压病史、恶性疾病病史(如结直肠癌病史)等亦被视作PLA的独立危险因素[10-11]。
2 感染途径专家意见2 胆源性和门静脉感染途径导致的细菌性肝脓肿发病率在下降,隐源性肝脓肿已成为细菌性肝脓肿最常见的感染方式。
肝脓肿通常为继发性化脓性炎症病变,近年研究发现隐源性肝脓肿的发病率呈明显上升趋势。
2.1 胆源性感染临床上胆系结石、急性胆囊炎、肝胆恶性肿瘤、肝胆侵入性操作等,导致细菌逆行至肝脏引起继发性肝内感染。
2.2 门静脉感染腹腔内感染(如急性阑尾炎、腹腔内手术、肠瘘等所致腹膜炎)及肠道感染,导致细菌经门静脉及其分支进入肝脏引起感染。
2.3 血流播散感染当体内存在肺部感染、感染性心内膜炎等时,细菌可经肝动脉进入肝脏,引发肝脓肿。
2.4 直接肝脏感染当肝脏因外伤出现破损时,如车祸或刀刺伤等,细菌可直接经过破损处侵入肝脏。
2.5 隐源性感染有研究表明胆系疾病或恶性肿瘤与欧美国家PLA患者发病密切相关,而隐源性感染是东亚地区PLA患者的主要感染途径[12]。近年来胆源性和门静脉感染途径所致PLA发病率在下降[13],而隐源性肝脓肿从4%上升到40%,已成为PLA最常见的感染方式[14]。有学者认为结肠黏膜屏障受损可能导致隐源性PLA,尤其是肺炎克雷伯杆菌阳性的患者,数据显示其患结肠癌的风险是正常人的7倍[15]。因此,隐源性PLA患者需考虑行结肠镜检查。
3 PLA的诊断与鉴别诊断 3.1 PLA的临床表现及病原学构成专家意见3 细菌性肝脓肿患者腹部症状及体征常不明显,易造成漏诊、误诊,无典型腹痛的患者不能排除肝脓肿可能。
PLA的典型临床表现为发热和腹痛,其他常见症状包括恶心、呕吐、厌食、体重减轻等。腹部症状和体征通常局限于右上腹,包括疼痛、肌卫、肝区叩击痛,甚至有反跳痛等。约半数的肝脓肿患者可出现肝肿大、右上腹压痛或黄疸[8, 16]。部分PLA患者病初缺乏右上腹痛、黄疸等典型症状及体征,仅表现为发热,所以因发热首诊的患者,在进行充分的问诊、体格检查及胸部影像学评估后仍不能明确感染病灶时,应考虑肝脓肿的可能性,特别是合并糖尿病的患者。
PLA临床表现的非特异性可能延迟疾病的诊断。临床表现不典型的原因可能有:①脓肿早期较小或脓肿位置较深未累及肝包膜;②早期应用抗菌药物延缓病情进展;③高龄患者应激反应及腹痛等不适感觉减弱;④细菌毒力较弱;⑤被腹部其他疾病掩盖。若患者出现顽固性呃逆、胸痛等症状,需考虑脓肿靠近膈肌,形成反应性胸腔积液,并应怀疑有混合性感染可能。
脓肿破裂是一种罕见的并发症,脓肿直径 > 6 cm及合并肝硬化是脓肿破裂的主要危险因素,大多数破裂发生在肝脏周围或破溃入胸膜腔。
专家意见4 肺炎克雷伯杆菌是中国细菌性肝脓肿的主要致病菌,尤其在糖尿病患者中感染比例有上升趋势。
一项2016年的Meta分析发现,PLA常见病原体检出构成如下:革兰氏阴性细菌,包括肠杆菌科细菌(克雷伯氏菌约54%,埃希菌属约29%)、变性杆菌属及假单胞菌属;革兰氏阳性细菌中以葡萄球菌属最常见,其余包括链球菌及肠球菌属[17]。大肠埃希菌及链球菌是欧美地区PLA的主要致病菌[12, 18],而在中国乃至整个亚太地区,PLA最主要病原菌为克雷伯氏菌(如肺炎克雷伯杆菌)。肺炎克雷伯杆菌肝脓肿在亚裔人群中高发,可能与华人族群本身更易在肠道定植K1/K2血清型肺炎克雷伯杆菌有关[19-20]。有研究发现,我国PLA病原菌中克雷伯氏菌占比为42%~70%,尤其在糖尿病患者中多见。上海仁济医院回顾性分析了2010—2015年105例肝脓肿患者,脓液培养结果显示:肺炎克雷伯菌(22.7%)、大肠埃希菌(6.1%)、肠球菌(1.5%)、链球菌(1.5%)、铜绿假单胞菌(3%)[21]。
米勒链球菌群在肝脓肿的致病菌中偶有发现,包括咽峡炎链球菌、中间链球菌及星座链球菌。检出这些细菌时,应立刻寻找同时发生于其他部位的转移性感染。假丝酵母菌也可导致肝脓肿,肝脾假丝酵母菌病可发生于已接受化疗的患者,出现于中性粒细胞减少后恢复期。人畜共患的布鲁氏菌亦可存在于PLA,原因可能与地区经济、年龄组成、基础疾病、种族易感性等相关。
专家意见5 高毒力型肺炎克雷伯杆菌感染所致PLA患者易出现肝外侵袭综合征,其中眼内炎虽发病率低,但危害严重,需高度警惕。
相比其他病原体导致的肝脓肿,肺炎克雷伯杆菌肝脓肿(Klebsiella pneumoniae liver abscess, KLA)具有较高的脓毒性转移感染风险,临床表现为肝外侵袭综合征,如脑膜炎、眼内炎、骨髓炎及其他部位脓肿形成(如肺脓肿)。这种肝外转移性感染已经越来越受到国内外专家学者的重视,并将引起侵袭综合征的这种肺炎克雷伯菌称为高毒力型肺炎克雷伯菌。
高毒力型肺炎克雷伯菌多见于社区获得性感染,有研究显示社区获得性感染中更常见K1荚膜血清型和高黏液表型,而存在毒力更强的K1血清型及高黏液表型被认为与侵袭性感染有关。拉丝实验(String test)常用于高黏液表型检测,有助于高毒力型肺炎克雷伯菌感染的诊断,具体方法为:用接种环轻柔挑起单克隆菌落,粘液丝长度大于5 mm判断为拉丝实验阳性,若小于5 mm判断为阴性。rmpA、rmpA 2、iutA、magA、Aerobactin等毒力基因检测亦有助于高毒力型肺炎克雷伯菌感染的诊断[22]。高毒力肺炎克雷伯菌较医院获得性肺炎克雷伯菌耐药率低,但需要警惕的是近年来高毒力、高耐药肺炎克雷伯菌引起的感染有不断增多的趋势,有学者认为这可能与高耐药肺炎克雷伯菌获得毒力质粒有关[23]。
KLA引起的眼内炎多见于中老年男性,常单眼受累,右眼为主,约20%的患者可双眼受累[24]。KLA并发眼内炎的危险因素主要包括静脉药物滥用、合并糖尿病、留置导管及免疫功能低下等[25-26]。由于早期缺乏特异性症状,眼内炎极易漏诊、误诊,误诊率高达16%~50%[27],虽然发病率较低,但危害严重,患者多会出现视力严重下降甚至失明[28],因此KLA患者早期行眼底镜检查十分关键。
3.2 实验室检查及微生物培养专家意见6 细菌性肝脓肿患者应尽可能在抗菌药物使用前完善病原学检测,高通量测序可协助精确诊断病原微生物。
对感染患者行病原学检测是十分关键的。PLA患者应尽可能在抗菌药物使用前完善病原学检测,如血培养,有条件的情况下尽早完善脓液培养。既往研究发现高达50%的PLA患者血培养可呈阳性[29]。而实际临床上血培养阳性率低于50%,这可能与抗菌药物的早期使用有关。CT或超声引导下穿刺抽取的脓液样本应送至实验室进行革兰氏染色和培养(包括需氧和厌氧),其培养阳性率可明显高于血液培养。上海仁济医院报道105例肝脓肿患者,血培养阳性率仅1.9%,脓液培养阳性率高达37.9%[21]。通过先前放置的引流管获取的样本常被皮肤菌群和其他微生物污染,其培养结果不太可靠,不足以指导抗微生物治疗[30]。
近年来宏基因组测序(metagenomics next-generation sequencing,mNGS)技术被应用于临床检验,可以快速、精确地检出致病微生物[31]。尤其对于血或脓液培养阴性的PLA患者,mNGS技术可协助临床医生更早期、准确的实施抗感染治疗。
专家意见7 血培养阳性的细菌性肝脓肿患者降钙素原(procalcitonin, PCT)明显升高,PCT的动态监测在细菌性肝脓肿的诊治中有一定指导价值。
PLA患者实验室检查可见胆红素、转氨酶升高,67%~90%的患者出现血清碱性磷酸酶升高,均需动态密切随访。其他实验室检查的异常包括静脉血中白细胞计数、C反应蛋白(c reaction protein, CRP)、PCT及其他炎症因子等炎症指标的升高,严重感染可出现相应脏器功能指标异常,如心肌肌钙蛋白升高、凝血指标异常、血肌酐升高、低白蛋白血症、贫血(正细胞正色素性贫血)及血小板下降等。有研究显示白细胞及白蛋白水平与脓肿大小密切相关,脓肿越大,血白细胞升高越明显,同时血清白蛋白下降越明显[32]。有研究显示,大部分PLA患者血PCT升高,而血培养阳性的PLA患者PCT水平升高明显;也有研究发现,大部分PLA患者经抗感染治疗后PCT下降明显。因此,动态监测血清PCT水平在指导PLA抗感染治疗有一定指导价值[33-34]。
3.3 影像学检查专家意见8 超声检测仍然是诊断细菌性肝脓肿的一线手段,急诊超声的普及和推广对于PLA,特别是临床症状不典型的PLA的早发现、早治疗有益。
PLA的早期发现和诊断常常通过超声、CT或MRI,结合临床感染性表现确诊。
(1)超声:超声在临床中易得、经济、可重复性强,常作为一线检测手段,应对所有可疑患者进行超声检查。超声可清晰地显示脓肿大小、位置及深度等,不仅可用于诊断,而且还可以引导介入穿刺治疗。典型PLA超声特点为囊壁厚、内缘多不光滑、可呈虫蛀样内壁、边界不清,其脓腔内可见浮动的点状回声,短期随访即有动态改变。对于部分临床症状不典型或难以确诊的、复杂的PLA患者,有条件的情况下建议完善超声造影。近年来随着急诊超声的普及和推广,超声已成为急重症医师快速床旁评估病情的重要工具。建议条件允许的情况下可进行快速超声评估。
(2)CT:PLA病例CT通常表现为单个或多个圆形或卵圆形界限清楚、密度不均的低密度区,有时可见气液平,提示该脓肿为产气杆菌等引起。增强CT可出现典型的“日晕征”或“环月征”,即脓腔密度无变化,腔壁呈现密度不规则增高的强化。
(3)MRI:细菌性肝脓肿在T1加权像上呈现低信号,在T2加权像上呈现高信号。肝脓肿愈合后,其边缘可形成薄的钙化环。
3.4 鉴别诊断(1)阿米巴肝脓肿:阿米巴肝脓肿是阿米巴病最常见的肠外表现,以长期发热、右上腹或右下胸痛、全身消耗及肝脏肿大压痛、血白细胞增多等为主要临床表现。穿刺抽吸物为类似“鱼酱”的棕色液体,抽吸物显微镜检查中见到滋养体可确诊[35]。
(2)原发性肝癌:尚没有完全液化的肝脓肿,其影像学表现与肝癌相似,继发感染的肝癌也可出现肝脓肿的表现,临床上需要结合病史、实验室检查及影像资料综合鉴别。原发性肝癌患者多有慢性肝病史、全身情况进行性恶化、血AFP及CEA明显升高等表现,肝血管造影、腹部增强CT或MRI、肝穿刺活检等可协助确诊。临床上如遇肝脓肿与肝癌鉴别困难时,应先按感染进行治疗。
(3)胆道感染:胆道感染也可表现为发热伴右上腹痛,但常伴有明显的皮肤巩膜黄染,腹部超声或CT检查可协助确诊。
(4)右膈下脓肿:多继发于腹腔感染或腹腔术后,临床亦常表现为发热、右上腹或右下胸痛,腹部超声或CT检查可协助确诊。
(5)肝血管瘤:临床多无特殊症状,常在腹部影像学检查时偶然发现。瘤体较大时可能因压迫造成局部疼痛等表现。超声可见肝脏内圆形或类圆形的均质、高回声、边界清晰的占位。
4 PLA的治疗 4.1 初步评估和支持治疗PLA患者入院后需完善全身状况的评估并给予支持治疗。病情评估包括生命体征监测、营养风险评估、脏器功能评估等。对于病情稳定的患者,在抗菌治疗的同时应酌情予以补充优质蛋白。对于危重症患者(脓毒症或脓毒症休克),入院即进行营养风险评估,如不能耐受肠内营养,建议在初始阶段提供滋养型喂养(10~20 kcal/h或500 kcal/d)(1 kcal=4.186 kJ),24~48 h后如可耐受则逐步增加至目标热量的80%,建议每天输送1.2~2 g蛋白质/kg。危重症患者应尽早恢复肠内营养[36]。对于并发多脏器功能衰竭的患者,应予以积极保护脏器功能,如呼吸衰竭的患者予机械通气辅助呼吸,肾功能衰竭的患者予以床旁连续性肾脏替代治疗,肝功能衰竭的患者积极保护肝脏功能,必要时可考虑行人工肝治疗,心功能衰竭的患者在明确诱因后酌情对症支持治疗;对于正在行免疫抑制治疗的患者,需综合评估调整原治疗方案,及时减量或停用免疫抑制药物等。对于合并休克的患者,应积极予以充分补液扩容,必要时可使用血管活性药物,同时注意纠正水、电解质及酸碱平衡紊乱。中药皮硝有消肿清火、泻下、软坚等功效,可局部外敷促进肝脓肿成熟液化。
4.2 原发病的筛查和治疗消除及控制潜在病因是治疗PLA的基础,PLA原发病的治疗尤为重要。通过病史、实验室检测和影像学检查等可以明确患者是否有PLA的高危因素,在此基础上可进一步行胃肠镜、经内镜逆行性胰胆管造影术(ERCP)、心超等检查。合并糖尿病的PLA患者需加强血糖管理,但应注意防止低血糖的发生,一般在治疗后的10~14天易发生低血糖;既往有胆道操作史,肝脓肿(感染)与胆道相通的患者,ERCP有助于引流肝脓肿[37-38];合并消化道肿瘤的患者在PLA治疗结束后需尽早进行肿瘤的内外科治疗;存在感染性心内膜炎的患者抗菌药物选择方面应覆盖阳性菌等。
药物治疗、介入穿刺引流治疗是治疗PLA的基本手段,需根据临床实际情况采用个体化治疗策略。对于巨大肝脓肿、穿刺引流效果不理想的患者,可考虑外科手术治疗。
4.3 PLA的抗菌治疗专家意见9 早期经验性应用抗菌药物应在考虑原发病因的基础上尽可能全面覆盖肝脓肿常见致病菌,根据药敏结果及时调整药物治疗方案。
在获得病原学之前,早期积极应用广谱抗菌药治疗对尚未液化的肝脓肿患者可以延缓病情进展,并改善患者的预后。目前尚无高质量随机对照试验对经验性抗菌治疗方案在治疗PLA中的作用进行评估。抗菌药物的选择是基于可能的感染源,并以当地的细菌耐药情况作为参考。早期经验性应用抗菌药物应尽可能全面覆盖PLA常见致病菌群,如肠杆菌(肺炎克雷伯菌,大肠埃希菌和其他肠杆菌)、葡萄球菌、厌氧菌。无论最初采取何种经验性治疗方案,治疗方案均应在得到培养结果和药敏结果时重新评估。
专家意见10 经验性抗菌药物治疗首选三代头孢+甲硝唑,或β-内酰胺类/β-内酰胺酶抑制剂联合甲硝唑。
(1)经验性抗菌药物的选择及治疗疗程[39]
① 单纯抗菌药物治疗适用于3 cm以下的PLA。
② 对于轻/中度感染不合并MODS的患者,首选推荐:三代头孢联合甲硝唑;β-内酰胺类/β-内酰胺酶抑制剂联合甲硝唑;氨苄西林联合庆大霉素及甲硝唑。
③ 替代方案:氟喹诺酮类联合甲硝唑。
④ 单纯抗菌药物治疗建议4~6周[40]。对初始引流反应良好的患者建议2~4周静脉抗菌药物治疗,而引流不完全的患者建议4~6周静脉抗菌治疗。目前尚无随机对照试验评估最佳治疗持续时间,通常根据感染程度及患者对初始治疗的临床反应确定。临床上建议将患者的体温、PCT等作为评估抗菌治疗效果的有效指标,协助指导合理停药。脓肿难以引流的患者通常需要较长的疗程。
⑤ 治疗后期口服抗菌药物治疗可根据培养和药敏试验结果采用特定口服药物[41-42]。若没有培养结果,可合理选择经验性口服抗菌药物,包括阿莫西林克拉维酸单药治疗或氟喹诺酮类联合甲硝唑治疗。
(2)特殊况下的抗菌选择:
① 肝脓肿伴脓毒症休克/MODS:初始经验性抗菌治疗方案可选择碳青霉烯类(如亚胺培南-西司他汀、美罗培南、比阿培南等)或广谱青霉素/β-内酰胺酶抑制剂组合,也可使用三代或四代头孢菌素联合甲硝唑。抗菌药物疗程为7~10 d;对于脓毒性休克患者,若初始应用联合抗菌药物治疗后临床症状得以改善或感染好转,推荐降阶梯治疗[43]。
② 怀疑导管相关感染:需考虑金葡菌感染可能,经验性治疗药物包括万古霉素或者达托霉素,如药敏结果提示MSSA,则抗菌药物降阶梯为β-内酰胺类药物。
③ 免疫抑制宿主伴或不伴有中性粒细胞减少:需警惕真菌感染的风险,如侵袭性假丝酵母菌病或假丝酵母菌菌血症等,经验性治疗药物包括卡泊芬净、米卡芬净、氟康唑等[44]。
有研究发现,对于直径小于3~5 cm的肝脓肿,可单独使用抗菌药物治疗,但行穿刺抽吸可直接找到病原菌,增强治疗效果。对于较大的肝脓肿,抗菌药物应与其他治疗方式相结合[45-46](见图 1)。
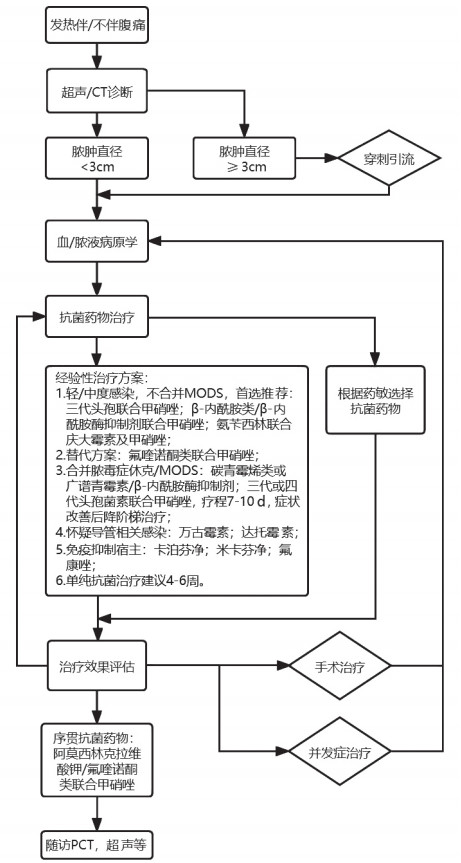
|
| 图 1 PLA诊治流程图 |
|
|
专家意见11 超声或CT引导下经皮肝脓肿穿刺置管引流是细菌性肝脓肿治疗的重要方法,应尽早实现引流。
经皮肝脓肿穿刺置管引流的优势在于:方便、安全有效、创伤小、患者接受度高。即使对于较难处理的多发PLA,其治疗成功率也在90%以上[47]。穿刺或置管引流的适应证包括:①液化成熟的肝脓肿;②药物保守治疗效果不明显,持续高热的肝脓肿;③直径 > 3 cm的脓肿首选置管引流。超声造影对肝脓肿液化坏死区的检出率高于常规超声,对于常规超声未明确是否液化的肝脓肿,推荐行超声造影以提高穿刺治疗的成功率[48]。有研究发现,接受抗菌治疗联合经皮穿刺引流(置管引流或细针抽吸)的患者,无论采取何种引流方式,脓肿直径≤5 cm的所有患者均治疗成功。然而,在脓肿直径 > 5 cm的患者中,采用置管引流的患者治疗成功率为100%,而采用细针抽吸的患者治疗成功率为50%[41]。在穿刺或置管引流的过程中,应保证充分、彻底地引流。待患者实验室检查及症状明显缓解后,引流量持续数日小于10 mL,脓腔直径小于2 cm即可拔管。巨大脓肿(脓肿直径 > 10 cm)也可以通过置管引流治疗,如无法耐受手术者,可留置多根引流管,以达到满意效果,但此类患者治疗失败及其他并发症风险较大[49-50]。有研究发现细菌性肝脓肿直径 > 10 cm的患者,经皮引流后,有25%发生了并发症,包括脓毒症、胸腔积液及需重复行经皮引流[49]。不推荐常规进行脓肿冲洗[50]。
专家意见12 PLA合并凝血功能异常的患者在补充凝血因子、血小板基础上尽早完善穿刺引流。
急性凝血功能异常定义为凝血酶原时间国际正常化比值(INR) ≥1.5或血小板计数≤100×109/L[51]。对于临床上考虑低凝状态的患者可予补充凝血因子和血小板。有研究发现,在凝血障碍未纠正的情况下可以进行肝脓肿穿刺引流,出血并发症并未显著增加,有报道对未纠正凝血功能障碍的患者可以安全地进行经皮气管切开术[52]。有指南建议,对于无明显出血时血小板计数小于10×109/L,或存在明显出血风险且血小板计数小于20×109/L时考虑预防性输注血小板。伴有活动性出血风险的患者,在拟行外科手术或侵入性操作时需要达到更高的血小板水平(50×109/L)[53]。建议对于有临床穿刺引流指征的患者尽早实施B超或CT引导下穿刺引流以改善患者预后。
4.5 PLA的手术治疗出现以下情况建议行手术治疗:①脓肿有高度破溃风险,或已经破溃形成腹膜炎、胸膜炎;②合并其他胆道疾病需手术的PLA。③经规范的药物及介入治疗(经皮穿刺引流7 d)病情无明显改善者;④脓肿内容物黏稠致引流不畅或堵塞引流管;⑤多房性及多发性PLA。
4.6 PLA并发眼内炎的治疗专家意见13 PLA眼内炎的治疗包括全身使用抗菌药物,玻璃体腔注药术和玻璃体切除术。
PLA合并有肝外侵袭表现时,如肺炎克雷伯菌感染可远处侵袭导致眼内炎、脑膜炎、脑脓肿、肺脓肿及腰肌脓肿等,除全身静脉给予抗菌治疗外,还需要以局部引流及手术治疗。眼内炎的治疗流程主要包括:评估眼部受累程度、确定病原体和原发感染灶,以及综合治疗眼部及全身感染。眼内炎手术治疗方案主要包括玻璃体腔注药术以及玻璃体切除术。研究证实,在起病24 h以内行玻璃体腔注药预后较好,在经验性用药时通常选用眼内渗透性好的广谱抗菌药物,包括万古霉素、头孢他啶、阿米卡星、氟喹诺酮类等药物,如果48 h内没有改善,则需根据药敏结果再次行玻璃体腔药物注射[54-56]。对于眼内炎程度严重或药物治疗效果差者应考虑进行玻璃体切割术,可有效去除玻璃体及视网膜下感染病灶,复位脱离的视网膜,及时的玻璃体切割术对改善预后有重要意义[57]。
5 PLA患者的随访专家意见14 定期随访,随访时间根据脓肿大小而定。临床随访指标包括症状及体温、白细胞计数以及血清CRP、PCT等炎症指标水平。仅在临床症状持续或引流不佳的情况下进行影像学随访;影像学消退要比临床症状和生化指标改善慢得多。尼泊尔的一项研究对102例细菌性肝脓肿患者进行随访,发现10 cm以下脓肿超声消退的平均时间为16周;10 cm以上脓肿超声消退的平均时间为22周[58]。
6 总结细菌性肝脓肿是细菌通过各种途径侵入肝脏导致的肝内局灶性炎症及化脓性渗出,其中隐源性肝脓肿发病率逐年升高。细菌性肝脓肿的患者临床症状和体征往往不典型,容易造成临床误诊或漏诊。B超仍然是肝脓肿诊断的一线检测手段。近年来肺炎克雷伯杆菌成为我国细菌性肝脓肿的主要致病菌,高毒力的肺炎克雷伯菌易引起肝外侵袭综合征。尽早完善病原学检查是治疗细菌性肝脓肿的基石,血及脓液的高通量测序对于常规培养阴性的患者有助于病原体早期诊断。超声或CT引导下的经皮肝脓肿穿刺置管引流是获取病原学依据的重要手段,同时也是细菌性肝脓肿的首选疗法。在获得病原学依据前建议经验性抗菌治疗,因目前尚无高质量临床数据支持,治疗方案需动态评估病情并结合培养和药敏结果及时调整。
执笔者:闵珉、蔡晓琳、邢玲玉、王思佳
专家共识组成员(按姓名汉语拼音排序):
白建文(同济大学附属东方医院急诊科)、曹珏(四川大学华西医院急诊科)、柴艳芬(天津医科大学总医院急诊科)、陈明泉(复旦大学附属华山医院急诊科)、陈玉国(山东大学齐鲁医院急诊科)、崇巍(中国医科大学附属第一医院急诊科)、邓医宇(广东省人民医院急危重病科)、方邦江(上海中医药大学附属龙华医院急诊科)、封启明(上海交通大学医学院附属第六人民医院急诊科)、高成金(上海交通大学医学院附属新华医院急诊科)、郭东风(上海浦东新区公利医院急诊科)、林兆奋(海军军医大学附属长征医院急诊科)、刘励军(苏州大学附属第二医院急诊科)、陆晓晔(上海交通大学医学院附属仁济医院急诊科)、吕传柱(四川省人民医院急诊科)、马林浩(海军军医大学附属长征医院急诊科)、马青变(北京大学第三医院急诊科)、马岳峰(浙江大学医学院附属第二医院)、毛恩强(上海交通大学医学院附属瑞金医院急诊科)、潘珏(复旦大学附属中山医院感染科)、潘曙明(上海交通大学医学院附属新华医院急诊科)、彭沪(同济大学附属第十人民医院急诊科)、彭鹏(新疆医科大学第一附属医院急救中心)、申捷(复旦大学附属金山医院急危重症中心)、宋振举(复旦大学附属中山医院急诊科)、童朝阳(复旦大学附属中山医院急诊科)、王瑞兰(上海交通大学医学院附属第一人民医院急诊科)、王毅鑫(上海中医药大学附属普陀医院急诊科)、吴先正(同济大学附属同济医院急诊科)、邢吉红(吉林大学第一医院急诊科)、许硕贵(海军军医大学附属长海医院急诊科)、许铁(徐州医科大学附属医院急诊科)、曾红科(广东省人民医院急危重病科)、张国强(中日友好医院急诊科)、张劲松(江苏省人民医院急诊科)、朱长清(上海交通大学医学院附属仁济医院急诊科)
利益冲突 所有作者声明无利益冲突
| [1] | 尹大龙, 刘连新. 细菌性肝脓肿诊治进展[J]. 中国实用外科杂志, 2013, 33(9): 793-795. |
| [2] | 周奇, 王琪, 俞阳, 等. 临床实践指南制定中的共识方法[J]. 药品评价, 2016, 13(16): 13-17. DOI:10.3969/j.issn.1672-2809.2016.16.002 |
| [3] | Zhang J, Gao Y, Du ZQ, et al. Clinical features and prognosis of gas-forming and non-gas-forming pyogenic liver abscess: a comparative study[J]. Surg Infect (Larchmt), 2021, 22(4): 427-433. DOI:10.1089/sur.2020.245 |
| [4] | Li WF, Chen HJ, Wu S, et al. A comparison of pyogenic liver abscess in patients with or without diabetes: A retrospective study of 246 cases[J]. BMC Gastroenterol, 2018, 18(1): 144. DOI:10.1186/s12876-018-0875-y |
| [5] | Meddings L, Myers RP, Hubbard J, et al. A population-based study of pyogenic liver abscesses in the United States: Incidence, mortality, and temporal trends[J]. Am J Gastroenterol, 2010, 105(1): 117-124. DOI:10.1038/ajg.2009.614 |
| [6] | Song HW, Wang XB, Lian YB, et al. Analysis of the clinical characteristics of 202 patients with liver abscess associated with diabetes mellitus and biliary tract disease[J]. J Int Med Res, 2020, 48(8): 300060520949404. DOI:10.1177/0300060520949404 |
| [7] | Tsai FC, Huang YT, Chang LY, et al. Pyogenic liver abscess as endemic disease, Taiwan[J]. Emerg Infect Dis, 2008, 14(10): 1592-1600. DOI:10.3201/eid1410.071254 |
| [8] | Kaplan GG, Gregson DB, Laupland KB. Population-based study of the epidemiology of and the risk factors for pyogenic liver abscess[J]. Clin Gastroenterol Hepatol, 2004, 2(11): 1032-1038. DOI:10.1016/s1542-3565(04)00459-8 |
| [9] | Liao WI, Sheu WHH, Chang WC, et al. An elevated gap between admission and A1C-derived average glucose levels is associated with adverse outcomes in diabetic patients with pyogenic liver abscess[J]. PLoS One, 2013, 8(5): e64476. DOI:10.1371/journal.pone.0064476 |
| [10] | Qu K, Liu C, Wang ZX, et al. Pyogenic liver abscesses associated with nonmetastatic colorectal cancers: an increasing problem in Eastern Asia[J]. World J Gastroenterol, 2012, 18(23): 2948-2955. DOI:10.3748/wjg.v18.i23.2948 |
| [11] | Lo JZ, Leow JJ, Ng PL, et al. Predictors of therapy failure in a series of 741 adult pyogenic liver abscesses[J]. J Hepatobiliary Pancreat Sci, 2015, 22(2): 156-165. DOI:10.1002/jhbp.174 |
| [12] | Cerwenka H. Pyogenic liver abscess: differences in etiology and treatment in Southeast Asia and Central Europe[J]. World J Gastroenterol, 2010, 16(20): 2458-2462. DOI:10.3748/wjg.v16.i20.2458 |
| [13] | Seeto RK, Rockey DC. Pyogenic liver abscess changes in etiology, management, and outcome[J]. Medicine, 1996, 75(2): 99-113. DOI:10.1097/00005792-199603000-00006 |
| [14] | Tian LT, Yao K, Zhang XY, et al. Liver abscesses in adult patients with and without diabetes mellitus: an analysis of the clinical characteristics, features of the causative pathogens, outcomes and predictors of fatality: a report based on a large population, retrospective study in China[J]. Clin Microbiol Infect, 2012, 18(9): E314-30. DOI:10.1111/j.1469-0691.2012.03912.x |
| [15] | Mohan BP, Meyyur Aravamudan V, Khan SR, et al. Prevalence of colorectal cancer in cryptogenic pyogenic liver abscess patients. Do they need screening colonoscopy?A systematic review and meta-analysis[J]. Dig Liver Dis, 2019, 51(12): 1641-1645. DOI:10.1016/j.dld.2019.08.016 |
| [16] | Rubin RH, Swartz MN, Malt R. Hepatic abscess: changes in clinical, bacteriologic and therapeutic aspects[J]. Am J Med, 1974, 57(4): 601-610. DOI:10.1016/0002-9343(74)90012-6 |
| [17] | Luo M, Yang XX, Tan B, et al. Distribution of common pathogens in patients with pyogenic liver abscess in China: a meta-analysis[J]. Eur J Clin Microbiol Infect Dis, 2016, 35(10): 1557-1565. DOI:10.1007/s10096-016-2712-y |
| [18] | Mukthinuthalapati VVPK, Attar BM, Parra-Rodriguez L, et al. Risk factors, management, and outcomes of pyogenic liver abscess in a US safety net hospital[J]. Dig Dis Sci, 2020, 65(5): 1529-1538. DOI:10.1007/s10620-019-05851-9 |
| [19] | Kim JH, Jeong Y, Lee CK, et al. Characteristics of Klebsiella pneumoniae isolates from stool samples of patients with liver abscess caused by hypervirulent K. pneumoniae[J]. J Korean Med Sci, 2020, 35(2): e18. DOI:10.3346/jkms.2020.35.e18 |
| [20] | Zhang SQ, Zhang XC, Wu Q, et al. Clinical, microbiological, and molecular epidemiological characteristics of Klebsiella pneumoniae-induced pyogenic liver abscess in southeastern China[J]. Antimicrob Resist Infect Control, 2019, 8: 166. DOI:10.1186/s13756-019-0615-2 |
| [21] | Liu L, Chen WJ, Lu XY, et al. Pyogenic liver abscess: a retrospective study of 105 cases in an emergency department from East China[J]. J Emerg Med, 2017, 52(4): 409-416. DOI:10.1016/j.jemermed.2016.09.026 |
| [22] | Yu WL, Lee MF, Chen CC, et al. Impacts of hypervirulence determinants on clinical features and outcomes of bacteremia caused by extended-spectrum β-lactamase-producing Klebsiella pneumoniae[J]. Microb Drug Resist, 2017, 23(3): 376-383. DOI:10.1089/mdr.2016.0018 |
| [23] | Gu DX, Dong N, Zheng ZW, et al. A fatal outbreak of ST11 carbapenem-resistant hypervirulent Klebsiella pneumoniae in a Chinese hospital: a molecular epidemiological study[J]. Lancet Infect Dis, 2018, 18(1): 37-46. DOI:10.1016/S1473-3099(17)30489-9 |
| [24] | 唐旭园, 童剑萍. 内源性肺炎克雷伯杆菌性眼内炎的研究现状[J]. 中华眼视光学与视觉科学杂志, 2017, 19(5): 317-320. DOI:10.3760/cma.j.issn.1674-845X.2017.05.013 |
| [25] | Lee SS, Chen YS, Tsai HC, et al. Predictors of septic metastatic infection and mortality among patients with Klebsiella pneumoniae liver abscess[J]. Clin Infect Dis, 2008, 47(5): 642-650. DOI:10.1086/590932 |
| [26] | Regan KA, Radhakrishnan NS, Hammer JD, et al. Endogenous Endophthalmitis: yield of the diagnostic evaluation[J]. BMC Ophthalmol, 2020, 20(1): 138. DOI:10.1186/s12886-020-01418-9 |
| [27] | 张自然, 孟凡征, 尹大龙, 等. 肺炎克雷伯菌性肝脓肿伴内源性眼内炎的诊断及治疗[J]. 中华肝脏外科手术学电子杂志, 2017, 6(6): 433-436. DOI:10.3877/cma.j.issn.2095-3232.2017.06.003 |
| [28] | Sheu SJ, Kung YH, Wu TT, et al. Risk factors for endogenous endophthalmitis secondary to Klebsiella pneumoniae liver abscess: 20-year experience in Southern Taiwan[J]. Retina, 2011, 31(10): 2026-2031. DOI:10.1097/IAE.0b013e31820d3f9e |
| [29] | Chemaly RF, Hall GS, Keys TF, et al. Microbiology of liver abscesses and the predictive value of abscess gram stain and associated blood cultures[J]. Diagn Microbiol Infect Dis, 2003, 46(4): 245-248. DOI:10.1016/s0732-8893(03)00088-9 |
| [30] | Everts RJ, Heneghan JP, Adholla PO, et al. Validity of cultures of fluid collected through drainage catheters versus those obtained by direct aspiration[J]. J Clin Microbiol, 2001, 39(1): 66-68. DOI:10.1128/JCM.39.1.66-68.2001 |
| [31] | 宏基因组分析和诊断技术在急危重症感染应用专家共识组. 宏基因组分析和诊断技术在急危重症感染应用的专家共识[J]. 中华急诊医学杂志, 2019, 28(2): 151-155. DOI:10.3760/cma.j.issn.1671-0282.2019.02.005 |
| [32] | Du ZQ, Zhang LN, Lu Q, et al. Clinical charateristics and outcome of pyogenic liver abscess with different size: 15-year experience from a single center[J]. Sci Rep, 2016, 6: 35890. DOI:10.1038/srep35890 |
| [33] | 王水线, 朱婉, 王慧, 等. 降钙素原在细菌性肝脓肿诊治中的临床价值[J]. 中华医院感染学杂志, 2014(8): 2072-2074. DOI:10.11816/cn.ni.2014-124053 |
| [34] | 胡跃峰, 黄强, 李惠. 血清降钙素原在细菌性肝脓肿经皮引流治疗中的价值[J]. 中华介入放射学电子杂志, 2014, 2(1): 42-44. |
| [35] | Salata RA, Ravdin JI. The interaction of human neutrophils and Entamoeba histolytica increases cytopathogenicity for liver cell monolayers[J]. J Infect Dis, 1986, 154(1): 19-26. DOI:10.1093/infdis/154.1.19 |
| [36] | McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.)[J]. JPEN J Parenter Enteral Nutr, 2016, 40(2): 159-211. DOI:10.1177/0148607115621863 |
| [37] | Lam YH, Wong SK, Lee DW, et al. ERCP and pyogenic liver abscess[J]. Gastrointest Endosc, 1999, 50(3): 340-344. DOI:10.1053/ge.1999.v50.98065 |
| [38] | Sersté T, Bourgeois N, Vanden Eynden F, et al. Endoscopic drainage of pyogenic liver abscesses with suspected biliary origin[J]. Am J Gastroenterol, 2007, 102(6): 1209-1215. DOI:10.1111/j.1572-0241.2007.01140.x |
| [39] | [美]桑福德. 抗微生物治疗指南[M]. 45版. 范洪伟, 等译. 北京: 中国协和医科大学出版社, 2016: 36. |
| [40] | Chen YW, Chen YS, Lee SS, et al. A pilot study of oral fleroxacin once daily compared with conventional therapy in patients with pyogenic liver abscess[J]. J Microbiol Immunol Infect, 2002, 35(3): 179-183. |
| [41] | Zerem E, Hadzic A. Sonographically guided percutaneous catheter drainage versus needle aspiration in the management of pyogenic liver abscess[J]. AJR Am J Roentgenol, 2007, 189(3): W138-W142. DOI:10.2214/AJR.07.2173 |
| [42] | Yu SC, Ho SS, Lau WY, et al. Treatment of pyogenic liver abscess: prospective randomized comparison of catheter drainage and needle aspiration[J]. Hepatology, 2004, 39(4): 932-938. DOI:10.1002/hep.20133 |
| [43] | 中国医师协会急诊医师分会, 中国研究型医院学会休克与脓毒症专业委员会. 中国脓毒症/脓毒性休克急诊治疗指南(2018)[J]. 临床急诊杂志, 2018, 19(9): 567-588. DOI:10.13201/j.issn.1009-5918.2018.09.001 |
| [44] | Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the infectious diseases society of America[J]. Clin Infect Dis, 2009, 48(5): 503-35. DOI:10.1086/596757 |
| [45] | Lardière-Deguelte S, Ragot E, Amroun K, et al. Hepatic abscess: Diagnosis and management[J]. J Visc Surg, 2015, 152(4): 231-243. DOI:10.1016/j.jviscsurg.2015.01.013 |
| [46] | Rismiller K, Haaga J, Siegel C, et al. Pyogenic liver abscesses: a contemporary analysis of management strategies at a tertiary institution[J]. HPB (Oxford), 2017, 19(10): 889-893. DOI:10.1016/j.hpb.2017.06.005 |
| [47] | Cai YL, Xiong XZ, Lu J, et al. Percutaneous needle aspiration versus catheter drainage in the management of liver abscess: A systematic review and meta-analysis[J]. HPB (Oxford), 2015, 17(3): 195-201. DOI:10.1111/hpb.12332 |
| [48] | 潘桔红, 陈文卫, 李蓬, 等. 细菌性肝脓肿不同临床病理分期的超声造影表现[J]. 中华医学超声杂志(电子版), 2014, 11(12): 22-26. DOI:10.3877/cma.j.issn.1672-6448.2014.12.006 |
| [49] | Ahmed S, Chia CL, Junnarkar SP, et al. Percutaneous drainage for giant pyogenic liver abscess: Is it safe and sufficient?[J]. Am J Surg, 2016, 211(1): 95-101. DOI:10.1016/j.amjsurg.2015.03.002 |
| [50] | Singh O, Gupta S, Moses S, et al. Comparative study of catheter drainage and needle aspiration in management of large liver abscesses[J]. Indian J Gastroenterol, 2009, 28(3): 88-92. DOI:10.1007/s12664-009-0032-1 |
| [51] | Wheeler AP, Rice TW. Coagulopathy in critically ill patients: part 2-soluble clotting factors and hemostatic testing[J]. Chest, 2010, 137(1): 185-194. DOI:10.1378/chest.08-2535 |
| [52] | Takahashi M, Itagaki S, Laskaris J, et al. Percutaneous tracheostomy can be safely performed in patients with uncorrected coagulopathy after cardiothoracic surgery[J]. Innovations (Phila), 2014, 9(1): 22-26. DOI:10.1097/IMI.0000000000000041 |
| [53] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock, 2012[J]. Crit Care Med, 2013, 41(2): 165-228. DOI:10.1007/s00134-012-2769-8 |
| [54] | Durand ML. Endophthalmitis[J]. Clin Microbiol Infect, 2013, 19(3): 227-234. DOI:10.1111/1469-0691.12118 |
| [55] | 张自然, 孟凡征, 尹大龙, 等. 肺炎克雷伯菌性肝脓肿伴内源性眼内炎的诊断及治疗[J]. 中华肝脏外科手术学电子杂志, 2017, 6(6): 433-436. DOI:10.3877/cma.j.issn.2095-3232.2017.06.003 |
| [56] | Sadiq MA, Hassan M, Agarwal A, et al. Endogenous endoph-thalmitis: Diagnosis, management, and prognosis[J]. J Ophthalmic Inflamm Infect, 2015, 5(1): 32. DOI:10.1186/s12348-015-0063-y |
| [57] | 王峰, 陶勇, 孙兵, 等. 肺炎克雷伯杆菌肺炎并发内源性眼内炎三例并文献复习[J]. 中华结核和呼吸杂志, 2019, 42(6): 438-443. DOI:10.3760/cma.j.issn.1001-0939.2019.06.007 |
| [58] | K c S, Sharma D. Long-term follow-up of pyogenic liver abscess by ultrasound[J]. Eur J Radiol, 2010, 74(1): 195-198. DOI:10.1016/j.ejrad.2009.01.017 |
 2022, Vol. 31
2022, Vol. 31


