2. 湖北省利川市民族中医院麻醉科,利川 445400
2. Dpartment of Anesthesiology, The Lichuan Ethnic Hospital of Traditional Chinese Medicine, Wuhan 445400, China
脓毒症是由于宿主免疫反应失调所导致的威胁生命的器官功能障碍。多器官功能障碍是脓毒症的主要死因,其中急性肺损伤是最常见的原因之一[1-2]。炎症反应在急性肺损伤中发挥着重要作用,包括炎性蛋白的渗出、炎症细胞的聚集以及对上皮细胞完整性的破坏以及大量有害物质的释放等,导致了免疫系统以及免疫细胞的过度激活[3-4]。细胞焦亡是一种程序性的细胞死亡,不同于其他形式的细胞死亡,细胞焦亡是可以由促炎性的天冬氨酸蛋白水解酶(caspase)所触发并释放大量炎症因子[5]。有研究表明,细胞焦亡可以通过释放炎症因子入血导致远处器官的炎症反应,从而进一步加重脓毒症[6]。大麻素2型受体(cannabinoid 2 receptor, CB2R)作为内源性大麻素系统的一员,主要表达于外周的免疫细胞,参与机体的免疫反应过程。有研究表明,炎症反应会引起CB2R的表达增加,特异性激活CB2R可以减少白细胞的黏附,进而缓解内毒素引起的葡萄膜炎[7]。而CB2R与细胞焦亡是否也存在一定关系还有待确定。本实验通过盲肠结扎穿孔法建立不同程度的脓毒症肺损伤模型,测定相应的CB2RmRNA的表达量以及肺组织细胞焦亡的相关指标,进一步探讨肺组织细胞焦亡与CB2R的相关性,为脓毒症肺损伤的治疗提供新的可能。
盲肠结扎穿孔法(cecal ligation and puncture, CLP)是构建脓毒症动物模型的最经典的方法之一,因其与人类脓毒症的特征及进展高度相似而被广泛用于脓毒症的病理生理研究[8-9]。虽然CLP模型应用广泛,但是存在众多因素影响此种模型的结局,包括盲肠结扎的部位、穿刺针的大小、动物的性别、周龄和品系等。有实验指出其中盲肠结扎部位是决定脓毒症模型严重程度的主要因素[10]。本研究正是通过结扎不同部位的盲肠,构建不同严重程度的小鼠脓毒症肺损伤模型,进行肺组织焦亡与大麻素2型受体的相关性研究。
1 材料与方法 1.1 实验动物及分组SPF级雄性C57BL/6小鼠24只,8~10周龄,体重22~25 g,购自湖北省疾病控制中心。实验小鼠饲养于SPF级动物房内,用无菌水及饲料喂养,动物房温度保持在24~26 ℃,明暗周期12 h/d。采用随机数字表法将小鼠随机分为4组(n=6):假手术组(sham)、轻度脓毒症组(ALMi)、中度脓毒症组(ALIMo)、重度脓毒症组(ALIS)。
1.2 动物模型制备用标准盲肠结扎穿孔术(CLP)建立脓毒症模型。术前12 h禁食,自由饮水。通过腹腔注射60 mg/kg戊巴比妥钠施行麻醉,手术部位备皮后常规消毒,于小鼠前腹正中作1 cm手术切口,游离盲肠,3组实验组小鼠分别用4号无菌丝线在距离回盲瓣前、中、后三分之一处环形结扎,20 G针头在盲端部位穿孔,挤出等量粪便少许,将肠管还纳并逐层缝合关腹,越靠近回盲瓣结扎脓毒症程度越重[10-11]。术毕皮下注射预热的37 ℃生理盐水5 mL/100 g复苏,并在暖灯下观察2 h以避免医源性低温对实验结果的影响,术后自由饮水。假手术组不行盲肠结扎和穿孔,其他操作均同实验组。术后12 h将各组小鼠处死并取肺组织,左肺用于测定肺组织湿干重比及损伤评分、右肺用于做分子生物学实验。
1.3 肺组织湿干重比测定和肺组织损伤评分用电子秤测定新鲜左肺(湿)与置入65 ℃烘箱72 h后的左肺(干)的重量,并计算湿重/干重。将小鼠肺组织进行苏木精-伊红染色(HE染色),在光学显微镜下随机选取10个高倍视野进行肺损伤病理评分,采用2010年美国胸科协会研讨会报告推荐的“肺损伤评分系统”fail进行评分,评分标准如下:A=每高倍视野中肺泡内中性粒细胞数量,0个记0分,1~5个记1分,> 5个记2分;B=每高倍视野中间质内中性粒细胞浸润数量,0个记0分,1~5个记1分,> 5个记2分;C=每高倍视野中肺透明膜的形成,无记0分,1个记1分,> 1个记2分;D=肺泡腔内蛋白碎屑填充,无记0分,1个记1分,> 1个记2分;E=肺泡间隔增厚,< 正常厚度2倍记0分,为正常厚度2~4倍记1分,> 正常厚度4倍记2分。计算公式为:肺损伤评分分值=[(20×A)+(14×B)+(7×C)+(7×D)+(2×E)]/(视野数×100)。
1.4 ELISA法测定炎症因子IL-6、TNF-α的表达水平取新鲜右肺下叶组织剪碎、匀浆后,经3000 r/min 4 ℃离心5 min后取上清液置于-20 ℃下保存。按照ELISA试剂盒(R & D Systems, 美国)的说明测定上清液中IL-6和TNF-α的水平。
1.5 RT-PCR法测定CB2R、NLRP3、caspase-1、caspase-11和GSDMD mRNA的相对表达量取右肺上叶,按照Trizol试剂盒(Invitrogen公司,美国)的说明提取总RNA,再通过逆转录(Thermo Fisher Scientific公司,美国)得到cDNA,用PCR对目的基因进行扩展。CB2R引物序列:上游5’-GAA GGT CGG AGT CAA CGG-3’,下游5’-GGA AGA TGG TGA TGG GAT T-3;内参基因GAPDH引物序列:上游5’-TGA GGC AGG GGG ATG GAT GTC G-3’,下游5’-GCA CTT GTC ACC ATG CTG GGT-3’;NLRP3引物序列:上游5’-AGA GCC TAC AGT TGG GTG AAA TG-3’,下游5’-CCA CGC CTA CCA GGA AAT CTC-3’;caspase-1引物序列:上游5’-TGG TCT TGT GAC TTG GAG GA-3’,下游5’-TGG CTT CTT ATT GGC ACG AT-3’;caspase-11引物序列:上游5’-ACC GAG ACA AAA CAG GAG GC-3’,下游5’-ATG GTG GGC ATC TGG GAA TG-3’;GSDMD引物序列:上游5’-CCA TCG GCC TTT GAG AAA GTG-3’,下游反应5’-ACA CAT GAA TAA CGG GGT TTC C-3’。PCR体系:2×q PCR Mix 12.5 μL,2.5 μmol/L的内标引物2.0 μL,反转录产物2.0 μL,ddH2O 8.5 μL。反应条件:95℃预变性1 min,58℃退火20 s,共进行40个循环,此后在72 ℃延伸5 min。PCR结束后,以GAPDH为内参,采用2-△△CT法计算目的基因的相对表达量。
1.6 Western Blot法测定CB2R蛋白的表达水平小鼠肺组织解冻后用RIPA裂解液(Roche公司,瑞士)裂解,4℃离心后取上清液。BCA法测定蛋白样品的浓度后取40 μg总蛋白,行SDS-PAGE胶分离后转移至PVDF膜上,用5%脱脂奶粉溶于0.5%TBST配成封闭液,膜置于封闭液中室温作用2 h,加入兔抗鼠CB2R一抗(稀释度1:500,Abcam,美国),4 ℃孵育过夜,TBST漂洗滤膜3次,每次10 min,加入山羊抗兔二抗(稀释度1∶10 000,武汉三鹰生物技术有限公司,中国),室温下孵育2 h,TBST漂洗3次,每次10 min,ECL法显影曝光。采用AlphaEase FC软件分析显影带,以目的蛋白光密度值与β-actin光密度值的比值表示各目的蛋白的表达量。
1.7 统计学方法采用SPSS 22.0软件进行分析,呈正态分布的计量资料以均数±标准差(x±s)表示,采用单因素方差分析进行各项指标多组间比较,分别采用LSD-t检验或Games-Howell检验进行两组间比较,采用Pearson相关系数分析法进行炎症因子及焦亡相关指标与大麻素2型受体的相关性分析,以P < 0.05为差异有统计学意义。
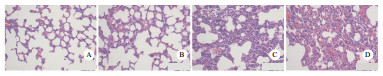
2 结果 2.1 盲肠结扎部位越靠近回盲部,小鼠肺组织的炎症程度越重与假手术组相比,脓毒症组小鼠肺组织损伤评分、湿干重比及炎症因子(IL-6、TNF-α)的表达增加(P < 0.05),且结扎部位越接近回盲部肺组织损伤评分、湿干重比越大,炎症因子的表达随之上调(P < 0.05)。见表 1、2,图 1。
| 组别 | 肺组织损伤评分 | 肺组织湿重/干重 |
| sham | 1.67±0.52 | 4.11±0.70 |
| ALIMi | 7.83±1.17a | 6.96±0.80a |
| ALIMo | 11.67±1.37ab | 10.37±0.92ab |
| ALIS | 15.17±0.75abc | 15.18±1.57abc |
| F值 | 197.21 | 121.99 |
| 注:多组间比较采用单因素方差分析,两组间比较采用LSD检验,与sham组比较,aP < 0.05;与ALIMi组比较,bP < 0.05;与ALIMo组比较,cP < 0.05 | ||
| 组别 | IL-6 | TNF-α |
| sham | 37.17±11.28 | 49.17±10.45 |
| ALIMi | 140.09±27.56a | 261.36±40.73a |
| ALIMo | 277.31±41.07ab | 501.09±73.91ab |
| ALIS | 475.90±67.65abc | 713.93±58.85abc |
| F值 | 133.57 | 306.64 |
| 注:多组间比较采用Welch's分析,两组间比较采用Games-Howell检验,与sham组比较,aP < 0.05;与ALIMi组比较,bP < 0.05;与ALIMo组比较,cP < 0.05 | ||
|
| A: Sham组;B:ALIMi组;C: ALIMo组;D:ALIS组 图 1 各组小鼠肺组织HE染色(×200) Fig 1 H & E staining of lung tissues from each group(×200) |
|
|
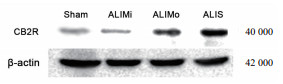
与假手术组相比,脓毒症组小鼠肺组织中CB2RmRNA水平及蛋白的表达量升高,且随着炎症程度的加重而增加(P < 0.05)。见表 3,图 2。
| 组别 | CB2R mRNA | CB2R protein |
| sham | 1.02±0.02 | 0.12±0.04 |
| ALIMi | 2.02±0.19a | 0.23±0.05a |
| ALIMo | 2.99±0.28ab | 0.44±0.08ab |
| ALIS | 4.00±0.19abc | 0.61±0.05abc |
| F值 | 529.45 | 76.21 |
| 注:CB2RmRNA多组间比较采用Welch's分析,两组间比较采用Games-Howell检验,CB2蛋白多组间比较采用单因素方差分析,两组间比较采用LSD检验,与sham组比较,aP < 0.05;与ALIMi组比较,bP < 0.05;与ALIMo组比较,cP < 0.05 | ||
|
| 图 2 各组小鼠肺组织中CB2R蛋白的表达水平 Fig 2 The expression level of CB2R protein in lung tissues of mice from each group |
|
|
与假手术组相比,脓毒症组小鼠肺组织细胞焦亡相关指标(NLRP3、caspase-1、caspase-11、GSDMD)的mRNA的表达水平增加(P < 0.05),且随着炎症程度的加重,上述指标的表达水平也随着升高(P < 0.05)。见表 4。
| 组别 | NLRP3 | caspase-1 | caspase-11 | GSDMD |
| sham | 1.00±0.05 | 1.02±0.02 | 1.03±0.02 | 1.04±0.07 |
| ALIMi | 1.61±0.15a | 3.60±0.38a | 6.30±0.65a | 5.67±0.54a |
| ALIMo | 2.53±0.26ab | 6.02±0.35ab | 11.43±0.83ab | 10.46±0.62ab |
| ALIS | 4.75±0.40abc | 8.76±0.72abc | 16.31±1.13abc | 16.46±1.22abc |
| F值 | 211.79 | 605.60 | 688.88 | 764.35 |
| 注:多组间比较采用Welch's分析,两组间比较采用Games-Howell检验,与sham组比较,aP < 0.05;与ALIMi组比较,bP < 0.05;与ALIMo组比较,cP < 0.05 | ||||
CB2RmRNA与炎症因子(IL-6、TNF-α)及细胞焦亡相关指标(NLRP3、caspase-1、caspase-11、GSDMD)mRNA的表达水平呈高度正相关。见表 5,6。
| 指标 | IL-6 | TNF-α |
| Pearson相关系数(r) | 0.957 | 0.960 |
| P值 | < 0.01 | < 0.01 |
| 指标 | NLRP3 | Caspase-1 | Caspase-11 | GSDMD |
| Pearson相关系数(r) | 0.939 | 0.978 | 0.977 | 0.983 |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
大麻素2型受体(CB2R)是一种G蛋白偶联受体,它介导了内源性大麻素以及外源性大麻素发挥作用的过程。CB2R主要表达于单核细胞、自然杀伤细胞、B淋巴细胞以及巨噬细胞等免疫细胞[12],在免疫反应中发挥着重要的作用。同时有研究指出CB2R也参与炎症反应,它可以通过抑制白细胞的增殖、诱导T淋巴细胞和巨噬细胞的凋亡以及减少促炎症因子的释放介导减轻炎症的过程[13]。Chiurchiù等[14]关于动脉粥样硬化的研究指出CB2R可以通过抑制TNF-α等炎症因子的释放来干扰泡沫细胞的形成,从而实现抗动脉粥样硬化效应。在本实验中,通过盲肠结扎穿孔法建立了不同程度的脓毒症肺损伤模型,随着肺损伤程度的加重,CB2RmRNA的表达水平也随之升高。通过Pearson相关分析,得出CB2RmRNA水平和炎症因子(IL-6、TNF-α)的表达量呈高度正相关,因此,本实验验证了CB2R参与炎症反应的过程。
细胞焦亡是由促炎性的天冬氨酸蛋白水解酶(人体内的caspase-1/-4/-5或小鼠体内的caspase-1/-11)所触发的,并伴随着大量的炎症因子的释放。细胞焦亡的激活有经典和旁路两种途径。有研究表明焦亡的发生与5种胞质模式识别受体有关,以其中的炎症小体NLRP3为例进行阐述[5]。NLRP3炎症小体由三部分组成,传感器NLRP3、适配器ASC和效应器caspase-1。在一定因素的刺激下,NLRP3通过募集ASC,使多个ASC结合成一个大分子,即ASC颗粒;ASC颗粒继续募集caspase-1,诱导caspase-1裂解和激活,从而触发焦亡的经典激活途径[15]。在旁路途径中,caspase-11/4/5可以通过直接结合脂多糖(LPS)而被激活,触发焦亡[16]。激活状态下的caspase-1和caspase-11把焦亡执行蛋白GSDMD水解为N-端和C-端两种结构域,其中N-端结构域可以使细胞膜产生孔洞,进而引起细胞破裂死亡[17]。IL-1β、IL-18等促炎因子正是依赖这些孔洞释放至组织间隙或者进入血液循环[5, 18]。因此,本实验采用了焦亡相关炎症小体NLRP3、焦亡相关水解酶caspase-1/11、焦亡执行蛋白GSDMD等指标评估脓毒症小鼠肺组织的细胞焦亡水平。在本实验中,焦亡的相关指标在脓毒症小鼠的肺组织中升高,这说明在脓毒症时肺组织中存在细胞的焦亡现象,而且,随着脓毒症损伤的加重,细胞焦亡的水平随之上调。为了进一步明确细胞焦亡与CB2R的关系,通过对CB2RmRNA和NLRP3、caspase-1/11、GSDMD mRNA进行Pearson相关性分析,得出二者之间呈高度正相关,说明脓毒症小鼠肺组织细胞焦亡与其CB2R的表达水平存在密切的联系。
有研究证明电针刺激可以通过CB2R抑制炎症小体NLRP3的激活,从而减轻炎症性疼痛[19]。结合NLRP3炎症小体在触发焦亡中的作用,可以推测CB2R调节焦亡的机制与NLRP3炎症小体有关。也有研究指出CB2受体的激活可以改善小鼠脓毒症引起的肺损伤,其中的机制可能与p38蛋白激酶的激活有关[20]。本课题组前期的研究也发现激活大麻素2型受体可以通过抑制细胞自噬减轻细胞的炎症反应[20]。总而言之,CB2R可能通过多个机制参与脓毒症肺组织焦亡的过程,还有待进一步研究。
利益冲突 所有作者均声明不存在利益冲突
作者贡献申明:张彬直接参与设计实验、实施研究、采集数据、起草文章等;杨宗斌对文章的知识性内容性作批评性审阅、指导、支持性贡献;李祯设计实验、实施研究;刘安鹏实施研究、采集数据;杨柳实施研究;郑锋对文章的知识性内容作批评性审阅及后期的文章处理;郑菲采集数据、分析数据;詹佳工作支持,获取研究经费、技术或材料支持、指导、支持性贡献
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Fan YW, Jiang SW, Chen JM, et al. A pulmonary source of infection in patients with sepsis-associated acute kidney injury leads to a worse outcome and poor recovery of kidney function[J]. World J Emerg Med, 2020, 11(1): 18-26. DOI:10.5847/wjem.j.1920-8642.2020.01.003 |
| [3] | Chen ZB, Zhang XM, Chu X, et al. Preventive effects of valnemulin on lipopolysaccharide-induced acute lung injury in mice[J]. Inflammation, 2010, 33(5): 306-314. DOI:10.1007/s10753-010-9186-3 |
| [4] | Chen XH, Yin YJ, Zhang JX. Sepsis and immune response[J]. World J Emerg Med, 2011, 2(2): 88. DOI:10.5847/wjem.j.1920-8642.2011.02.002 |
| [5] | Kayagaki N, Stowe IB, Lee BL, et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling[J]. Nature, 2015, 526(7575): 666-671. DOI:10.1038/nature15541 |
| [6] | Liu X, Lieberman J. A mechanistic understanding of pyroptosis: the fiery death triggered by invasive infection[J]. Adv Immunol, 2017, 135: 81-117. DOI:10.1016/bs.ai.2017.02.002 |
| [7] | Porter RF, Szczesniak AM, Toguri JT, et al. Selective cannabinoid 2 receptor agonists as potential therapeutic drugs for the treatment of endotoxin-induced uveitis[J]. Molecules, 2019, 24(18): E3338. DOI:10.3390/molecules24183338 |
| [8] | Gong W, Wen HT. Sepsis induced by cecal ligation and puncture[J]. Methods Mol Biol, 2019, 1960: 249-255. DOI:10.1007/978-1-4939-9167-9_22 |
| [9] | 林名瑞, 石松菁, 陈怀宇, 等. 脓毒症大鼠早晚期脾组织mRNA表达变化[J]. 中华急诊医学杂志, 2020, 29(2): 209-212. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0016 |
| [10] | Dejager L, Pinheiro I, Dejonckheere E, et al. Cecal ligation and puncture: the gold standard model for polymicrobial sepsis?[J]. Trends Microbiol, 2011, 19(4): 198-208. DOI:10.1016/j.tim.2011.01.001 |
| [11] | Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [12] | Staiano RI, Loffredo S, Borriello F, et al. Human lung-resident macrophages express CB1 and CB2 receptors whose activation inhibits the release of angiogenic and lymphangiogenic factors[J]. J Leukoc Biol, 2016, 99(4): 531-540. DOI:10.1189/jlb.3HI1214-584R |
| [13] | Katchan V, David P, Shoenfeld Y. Cannabinoids and autoimmune diseases: a systematic review[J]. Autoimmun Rev, 2016, 15(6): 513-528. DOI:10.1016/j.autrev.2016.02.008 |
| [14] | Chiurchiù V, Lanuti M, Catanzaro G, et al. Detailed characterization of the endocannabinoid system in human macrophages and foam cells, and anti-inflammatory role of type-2 cannabinoid receptor[J]. Atherosclerosis, 2014, 233(1): 55-63. DOI:10.1016/j.atherosclerosis.2013.12.042 |
| [15] | Swanson KV, Deng M, Ting JP. The NLRP3 inflammasome: molecular activation and regulation to therapeutics[J]. Nat Rev Immunol, 2019, 19(8): 477-489. DOI:10.1038/s41577-019-0165-0 |
| [16] | Shi JJ, Zhao Y, Wang YP, et al. Inflammatory caspases are innate immune receptors for intracellular LPS[J]. Nature, 2014, 514(7521): 187-192. DOI:10.1038/nature13683 |
| [17] | Sborgi L, Rühl S, Mulvihill E, et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death[J]. EMBO J, 2016, 35(16): 1766-1778. DOI:10.15252/embj.201694696 |
| [18] | He WT, Wan HQ, Hu LC, et al. Gasdermin D is an executor of pyroptosis and required for interleukin-1β secretion[J]. Cell Res, 2015, 25(12): 1285-1298. DOI:10.1038/cr.2015.139 |
| [19] | Gao F, Xiang HC, Li HP, et al. Electroacupuncture inhibits NLRP3 inflammasome activation through CB2 receptors in inflammatory pain[J]. Brain Behav Immun, 2018, 67: 91-100. DOI:10.1016/j.bbi.2017.08.004 |
| [20] | Tschöp J, Kasten KR, Nogueiras R, et al. The cannabinoid receptor 2 is critical for the host response to sepsis[J]. J Immunol, 2009, 183(1): 499-505. DOI:10.4049/jimmunol.0900203 |
| [21] | 袁清红, 刘安鹏, 刘强胜, 等. 激活大麻素2型受体在LPS诱导的RAW264.7巨噬细胞炎症因子分泌中的作用及其可能机制[J]. 中华急诊医学杂志, 2019, 28(8): 978-982. DOI:10.3760/cma.j.issn.1671-0282.2019.08.012 |
 2022, Vol. 31
2022, Vol. 31




