2. 睢县中医院急诊科,商丘 476999;
3. 兰考第一医院,开封 475399;
4. 郑州大学第一附属医院,郑州 450052
肺动脉栓塞起病急、进展快,典型症状包括呼吸困难、胸痛和咯血,临床表现多样,从无症状偶然发现到突然死亡[1],年发病率0.1%~0.2%[2]。高危肺栓塞定义为[3]栓塞阻塞肺血流导致持续性右心室衰竭、早期血流动力学不稳定,缺氧或持续性低血压,收缩压低于90 mmHg(1 mmHg=0.133 kPa)至少15 min或需要正性肌力药支持的患者并排除其他原因引起的持续性心动过缓(心率 < 40次/min)。高危肺栓塞患者院内病死率超50%[4],现将本院多学科联合成功救治的一例产后高危肺栓塞病例(伦理号:2021-C67)报道如下。
1 资料与方法患者,女,34岁,以“剖宫产术后胸闷10 h,加重7 h”为主诉入院,10 h前剖宫产后翻身时出现胸闷不适; 7 h前下床活动胸闷、气喘加重,初步诊断“肺栓塞”,“低分子肝素5 000 U皮下注射、华法林5 mg口服”,以“①肺栓塞?②剖宫产术后”为诊断急诊收入ICU。发病来,精神差。既往体健。查体: T36.6℃,P84次/min,R30次/min,BP78/66 mmHg,APACHEⅡ评分12分,血氧饱和度(pulse oxygen saturation, SPO2)80%~90%(面罩吸氧6~10 L/min); 神志清,烦躁,呼吸急促。宫底触诊符合产后位置,下腹部可见约20 cm横行手术切口、敷料覆盖,双下肢对称性凹陷性水肿。诊断:①肺栓塞?急性心力衰竭?②剖宫产术后。化验: D-二聚体7.92 mg/L,N-端脑钠肽4 050 pg/mL,PO2 61.5 mmHg。超声估测肺动脉压30 mmHg,右心增大、三尖瓣大量反流。心电图: 交界性逸搏心律偶呈窦性夺获。计算机成像肺动脉造影(computer tomography pulmonary angiography, CTPA)提示: 主肺动脉、左右肺动脉主干显示良好,双侧肺动脉多发肺栓塞。
结合查体及化验、检查,符合高危肺栓塞诊断标准①临床表现:烦躁,呼吸困难; ②实验室检查D-二聚体、N-BNP水平升高,低氧血症; CTPA证实肺栓塞; ③休克、收缩压 < 90 mmHg,持续15 min以上,排除低血容量或感染所致休克治疗计划:①无创呼吸机辅助呼吸,去甲肾上腺素0.2~0.4 μg/(kg·min)静脉泵入维持血压; ②高危肺栓塞伴高出血风险,体外循环支持中心建议体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)治疗。入院第2日患者精神差,无创呼吸机辅助呼吸SPO2 93%,心率145次/min,血压83/65 mmHg,呼吸急促; 肺栓塞严重指数评分(pulmonary embolism severity index, PESI)130分、Ⅴ级,给予(veno-arterial, VA)VA-ECMO治疗,流量3 L/min、通气量3 L/min、氧体积分数60%;③抗凝及对症支持治疗:低分子肝素5 000 U皮下注射1次/12 h。住院第2天至第5天病情稳定,PESI风险评估Ⅰ级。
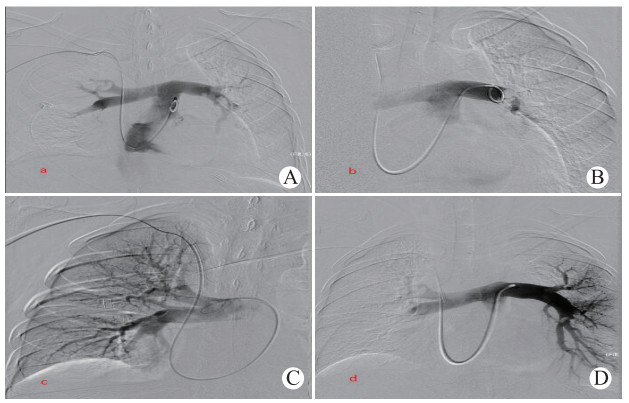
入院第5天血压再次下降,去甲肾上腺素0.5 μg/(kg·min)静脉泵入,胸闷、胸痛发作频繁,精神恍惚,无创呼吸机辅助呼吸SPO2 94%,ECMO流量3.5 L/min、通气量4 L/min、氧体积分数90%。查体:P 122次/min,RR 35次/min,BP 86/40 mmHg; 化验:降钙素原3.110 ng/mL,WBC 11.80×109/L,中性粒细胞% 77.3%。原因分析:高危肺栓塞患者经抗凝治疗并ECMO支持下出现循环衰竭加重,PESI评分Ⅴ级,新发肺栓塞导致梗阻性休克可能性大。化验指标不支持严重感染、脉压差大于30 mmHg,大量心包积液因抗凝或右心室梗阻、右心室阻力增加慢性渗血可能,不支持心包填塞导致休克。经介入科、心血管外科及重症医学科MDT讨论治疗方案:静脉溶栓风险极高,建议导管定向溶栓治疗或外科手术取栓,拟ECMO支持、局麻下急诊行“下腔静脉造影+肺动脉造影+肺动脉溶栓术”。手术过程:右锁骨下静脉穿刺置入8 F鞘,引入5 F Pigtail导管配合导丝进入下腔静脉及双侧肺动脉,高压造影显示双侧肺动脉主干完全闭塞、对比剂三尖瓣大量反流瘀滞(见图 1A, B); 5 F导管、6 F椎动脉GC与导丝配合,行双侧肺动脉搅拌溶栓、抽栓,20 min内缓慢注入尿激酶20万单位、替罗非班注射液2.5 mg/10 mL,造影复查双侧肺动脉血流通畅、少量血栓负影残留,血管成功开通, 见图 1C,D。对比入院肺动脉CTA(多发肺动脉栓塞)考虑新发肺栓塞。生命体征平稳,安返病房。
|
| A:双侧肺动脉主干; B:左侧肺动脉主干; C: 开通后的右侧肺动脉; D:开通后的左侧肺动脉 图 1 患者CT肺动脉造影 |
|
|
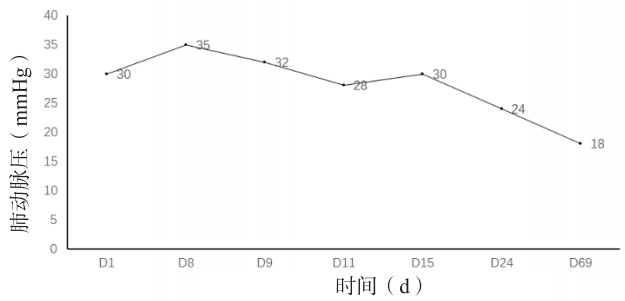
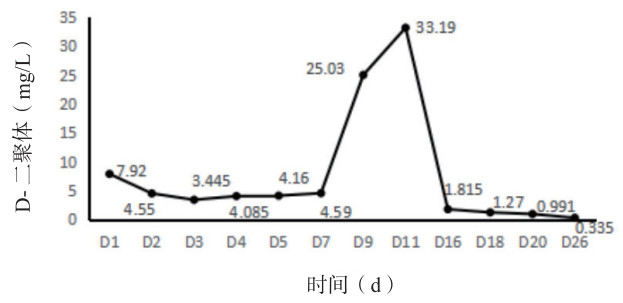
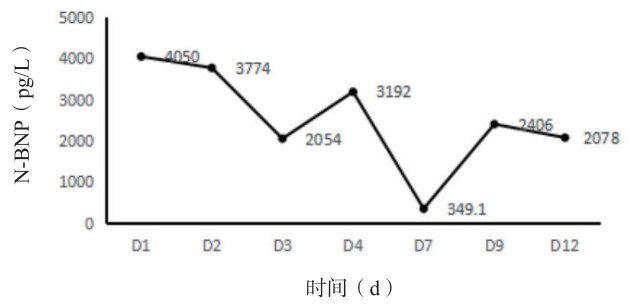
介入机械开通梗阻并局部溶栓治疗2 d后心包积液无明显增减,循环稳定,排除心包填塞所致休克。导管定向治疗原理是机械开通梗阻肺动脉,大量碎解血栓可能会堵塞分支肺动脉,局部小剂量定位溶栓加快血凝块溶解。术后继续低分子肝素5 000 U皮下注射1次/12 h抗凝治疗,患者精神好转,面罩吸氧、氧流量5 L/min,SPO295%,去甲肾上腺素0.05~0.1 μg/(kg·min),有创动脉血压106/60 mmHg,PESI评分Ⅱ级; 化验: PO2 69.7 mmHg,D-二聚体3.28 mg/L。第7 R,彩超引导下心包穿刺引流血性液体约800 mL,伴血尿,低分子肝素5 000 U皮下注射, 1次/d; 第10天循环稳定,调整ECMO支持力度流量2.5 L/min、通气量2.5 L/min、氧体积分数40%;第11天拔除心包穿刺引流管、肺动脉造影复查未见明显异常,撤ECMO,口服利伐沙班10 mg/d。ICU住院17 d转普通病房,总住院天数30 d,ECMO治疗9 d。肺动脉压24~35 mmHg、N-脑钠肽呈下降趋势、D-二聚体介入干预治疗后升高,整体变化水平见图 2-4。1个月后随访CTPA复查未见异常,少量心包积液,估测肺动脉压18 mmHg。1年半后随访,复查各项指标基本在正常范围。
|
| 图 2 肺动脉压(超声估测)变化趋势 |
|
|
|
| 图 3 D-二聚体变化趋势图 |
|
|
|
| 图 4 N-BNP变化趋势图 |
|
|
肺栓塞治疗包括基础支持治疗、抗凝、静脉溶栓、导管定向溶栓治疗及ECMO治疗等[5],预防及治疗方面仍存在一些争议[6-7]。高危肺栓塞早期目标是恢复肺循环血流、降低肺动脉压力[3]。常规治疗失败或没有条件进一步治疗时,需提供机械辅助维持循环稳定[5]。本案例患者剖宫产术后高危肺动脉栓塞,早期应用ECMO治疗。尽管有类似报道,但系统阐述ECMO支持治疗下导管定向治疗的典型案例较少见。
虽然高危肺栓塞ECMO支持下抗凝治疗血流动力学改善较慢,但有成功案例报道[8]。结合CTPA结果多发肺动脉栓塞、肺动脉主干通畅,本例患者入院后选择ECMO支持下抗凝治疗。高危肺栓塞常在急性症状发生1 h内死亡,30 d病死率高达25%~65%[9]。死亡原因主要是缺氧和血流动力学不稳定,ECMO可以迅速纠正低氧血症及循环衰竭,作为初始循环氧合支持治疗早期使用受益更多[10]。虽然文献报道多为个案报道、回顾性研究及荟萃分析,存活率差别较大,但明确有生存获益[9]。主要用于以下情况[11]:高危肺栓塞伴严重血流动力学障碍又不宜常规溶栓治疗或需要迅速手术解除梗阻者; 溶栓失败、准备行导管定向溶栓治疗或无条件进行外科手术治疗的患者; 等待血栓溶解、心功能恢复或转上级医院诊治的患者[12]。机械开通梗阻肺动脉联合ECMO治疗可以改善患者氧合、提高二氧化碳清除率,从而降低肺动脉血管阻力、改善右心室功能[13]。ECMO启动后24 h内可以明显减少升压药物和正性肌力药物用量[14],不同模式都有成功案例[15],优先用于清醒状态、有自主呼吸的患者,作为桥接手段进行溶栓、介入治疗、外科手术或转上级医院治疗[16]。
入院第5天患者病情再次加重,PESI评分150分为Ⅴ级,治疗选择:ECMO支持下静脉溶栓、导管定向治疗或外科肺栓塞切除术。静脉溶栓可降低高危肺栓塞患者病死率[17],但有9%重大出血风险和2%出血性脑卒中风险。导管定向溶栓治疗指通过血管介入导管进行机械性破碎、抽吸血栓,对破碎血栓小剂量溶栓治疗,可快速减轻肺栓塞患者血流动力学负担,院内病死率、出血性脑卒中发生率明显低于静脉溶栓[18]。经多学科诊疗模式(multi disciplinary team, MDT)共同讨论,选择肺动脉造影(双侧肺动脉主干梗阻),机械开通梗阻双侧肺动脉及局部溶栓治疗。导管内定向溶栓可以选择局部缓慢注射尿激酶、链激酶或重组组织型纤溶酶原激活剂阿替普酶(recombinant tissue plasminogen activator, rt-PA),具体药物及剂量文献报道不一[19],具体剂量根据栓子大小、部位、新鲜或陈旧而定[20]。本例患者20 min内缓慢注入尿激酶20万单位、替罗非班注射液2.5 mg/10 mL局部溶栓治疗,造影复查肺动脉开通良好。结合指南意见[3, 21],肺动脉主干或主要分支血栓患者,出血风险高或溶栓禁忌,经静脉溶栓或积极内科治疗无效,行经皮导管定向溶栓治疗。血流动力学持续不稳定或全身溶栓禁忌的高危肺栓塞患者,可直接导管定向溶栓治疗[5]。主要风险是大的肺动脉分支穿孔或夹层导致大量肺出血甚至死亡[22]。
ECMO联合导管定向溶栓可以减少右心室劳损、恢复血流动力学稳定[23],虽然存在动脉夹层、静脉撕裂和闭塞、大出血等机械性或治疗相关并发症,但并不增加病死率[24]。肺栓塞反应团队(pulmonary embolism response team, PERT)前瞻性评估发现[25],无论联合静脉溶栓、导管定向溶栓或外科切开取栓均可明显降低高危肺栓塞患者病死率。本例产后高危肺栓塞患者早期清醒状态下ECMO联合抗凝治疗病情缓解,但肺动脉造影提示新发双侧肺动脉主干栓塞,联合导管定向溶栓治疗最终临床治愈。快速、果断、合理的多学科联合救治模式更有利于发挥学科优势,最大程度让高危患者获益。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Prandoni P, Lensing AW, Prins MH, et al. Prevalence of pulmonary embolism among patients hospitalized for Syncope[J]. N Engl J Med, 2016, 375(16): 1524-1531. DOI:10.1056/NEJMoa1602172 |
| [2] | Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC)[J]. Eur Respir J, 2019, 54(3): 1901647. DOI:10.1183/13993003.01647-2019 |
| [3] | Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism[J]. Eur Heart J, 2014, 35(43) 3033-3069, 3069a-3069k. DOI:10.1093/eurheartj/ehu283 |
| [4] | Solomon RS, Corwin GS, Barclay DC, et al. Effectiveness of rapid response teams on rates of in-hospital cardiopulmonary arrest and mortality: a systematic review and meta-analysis[J]. J Hosp Med, 2016, 11(6): 438-445. DOI:10.1002/jhm.2554 |
| [5] | Duffett L, Castellucci LA, Forgie MA. Pulmonary embolism: update on management and controversies[J]. BMJ Clin Res Ed, 2020, 370: m2177. DOI:10.1136/bmj.m2177 |
| [6] | 米玉红. 急性肺栓塞研究现状及研究热点[J]. 中华急诊医学杂志, 2015, 24(2): 133-138. DOI:10.3760/cma.j.issn.1671-0282.2015.02.004 |
| [7] | Jia D, Ji C, Zhao M. Saddle pulmonary embolism is not a sign of high-risk deterioration in non-high-risk patients: a propensity score-matched study[J]. World J Emerg Med, 2021, 12(4): 261-267. DOI:10.5847/wjem.j.1920-8642.2021.04.002 |
| [8] | Ghoreishi M, DiChiacchio L, Pasrija C, et al. predictors of recovery in patients supported with venoarterial extracorporeal membrane oxygenation for acute massive pulmonary embolism[J]. Ann Thorac Surg, 2020, 110(1): 70-75. DOI:10.1016/j.athoracsur.2019.10.053.Epub2019Dec14.PMID:31846635 |
| [9] | Corsi F, Lebreton G, Bréchot N, et al. Life-threatening massive pulmonary embolism rescued by venoarterial-extracorporeal membrane oxygenation[J]. Crit Care, 2017, 21(1): 76. DOI:10.1186/s13054-017-1655-8 |
| [10] | George B, Parazino M, Omar HR, et al. A retrospective comparison of survivors and non-survivors of massive pulmonary embolism receiving veno-arterial extracorporeal membrane oxygenation support[J]. Resuscitation, 2018, 122: 1-5. DOI:10.1016/j.resuscitation.2017.11.034 |
| [11] | King CS, Roy A, Ryan L, et al. Cardiac support: emphasis on venoarterial ECMO[J]. Crit Care Clin, 2017, 33(4): 777-794. DOI:10.1016/j.ccc.2017.06.002 |
| [12] | 曾妃, 封秀琴, 邱坤凡, 等. ECMO航空转运重症肺栓塞患者分析[J]. 中华急诊医学杂志, 2020, 29(2): 237-238. DOI:10.3760/cma.j.issn.1671-0282.2020.02.0012 |
| [13] | Balanos GM, Talbot NP, Dorrington KL, et al. Human pulmonary vascular response to 4 h of hypercapnia and hypocapnia measured using Doppler echocardiography[J]. J Appl Physiol, 2003, 94(4): 1543-51. DOI:10.1152/japplphysiol.00890.2002 |
| [14] | Kmiec L, Philipp A, Floerchinger B, et al. Extracorporeal membrane oxygenation for massive pulmonary embolism as bridge to therapy[J]. ASAIO J, 2020, 66(2): 146-152. DOI:10.1097/MAT.0000000000000953 |
| [15] | Giraud R, Banfi C, Siegenthaler N, et al. Massive pulmonary embolism leading to cardiac arrest: one pathology, two different ECMO modes to assist patients[J]. J Clin Monit Comput, 2016, 30(6): 933-937. DOI:10.1007/s10877-015-9796-2 |
| [16] | Lang G, Kim D, Aigner C, et al. Awake extracorporeal membrane oxygenation bridging for pulmonary retransplantation provides comparable results to elective retransplantation[J]. J Heart Lung Transplant, 2014, 33(12): 1264-1272. DOI:10.1016/j.healun.2014.07.009 |
| [17] | Keller K, Hobohm L, Ebner M, et al. Trends in thrombolytic treatment and outcomes of acute pulmonary embolism in Germany[J]. Eur Heart J, 2020, 41(4): 522-529. DOI:10.1093/eurheartj/ehz236 |
| [18] | Bajaj NS, Kalra R, Arora P, et al. Catheter-directed treatment for acute pulmonary embolism: Systematic review and single-arm meta-analyses[J]. Int J Cardiol, 2016, 225: 128-139. DOI:10.1016/j.ijcard.2016.09.036 |
| [19] | Kasper W, Konstantinides S, Geibel A, et al. Management strategies and determinants of outcome in acute major pulmonary embolism: results of a multicenter registry[J]. J Am Coll Cardiol, 1997, 30(5): 1165-1171. DOI:10.1016/s0735-1097(97)00319-7 |
| [20] | Thabut G, Thabut D, Myers RP, et al. Thrombolytic therapy of pulmonary embolism: a meta-analysis[J]. J Am Coll Cardiol, 2002, 40(9): 1660-1667. DOI:10.1016/s0735-1097(02)02381-1 |
| [21] | 中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14): 1060-1087. DOI:10.3760/cma.j.issn.0376-2491.2018.14.007 |
| [22] | Biederer J, Charalambous N, Paulsen F, et al. Treatment of acute pulmonary embolism: local effects of three hydrodynamic thrombectomy devices in an ex vivo porcine model[J]. J Endovascular Ther, 2006, 13(4): 549-560. DOI:10.1583/06-1862.1 |
| [23] | Choi JH, O'Malley TJ, Maynes EJ, et al. Surgical pulmonary embolectomy outcomes for acute pulmonary embolism[J]. Ann Thorac Surg, 2020, 110(3): 1072-1080. DOI:10.1016/j.athoracsur.2020.01.075 |
| [24] | Hosmane SR, Barrow T, Ashworth A, et al. Extracorporeal membrane oxygenation: a radiologists' guide to who, what and where[J]. Clin Radiol, 2015, 70(5): e58-66. DOI:10.1016/j.crad.2015.01.006 |
| [25] | Al-Bawardy R, Rosenfield K, Borges J, et al. Extracorporeal membrane oxygenation in acute massive pulmonary embolism: a case series and review of the literature[J]. Perfusion, 2019, 34(1): 22-28. DOI:10.1177/0267659118786830 |
 2021, Vol. 30
2021, Vol. 30




