急性骨筋膜室综合征(acute osteofascial compartment syndrome,AOCS)是一种继发于多种临床情况的严重并发症,如肌骨创伤、烧伤、血管损伤等[1-4]。多种原因导致筋膜室内的压力逐渐增加, 组织灌注压降低而发生缺血损伤,严重的可发生肌肉坏死和挛缩、永久性神经损伤、截肢、急性肾功能衰竭甚至死亡[1, 5],极大影响患者的生活质量和家庭幸福[6]。诊断与处理的延迟是导致急性骨筋膜室综合征不良预后的主要原因,也是发生相关医疗纠纷的主要原因[1, 7]。诊断延迟的原因除了患者病情复杂、医生经验不足之外,缺乏早期有效的监测手段也是重要因素。
当前公认的AOCS评估方法是筋膜室内压力(intra-compartment pressure,ICP)监测。但该方法有创,有增加患者痛苦、出血、测压管断裂、感染、甚至导致急性骨筋膜室综合征进一步恶化的风险[8]。其他无创监测技术如近红外光谱技术、外周脉搏血氧饱和度、MRI成像的价值有限[9-12]。床旁超声因无创、便捷及可视化的特点,在急危重症患者的快速评估中得到广泛的应用,但至今尚未见在骨筋膜室综合征中应用的报道。笔者通过给健康志愿者小腿外部袖带加压建立急性骨筋膜室综合征的模型,观察多普勒超声在早期无创监测中的价值,为进一步的临床应用提供依据。
1 资料与方法本研究设计为前瞻性自身对照研究,共纳入25名健康志愿者,男10名,女15名,年龄(28±4)岁,身高(166.6±6.5)cm,体质量(62.0±10.4)kg,身体质量指数(body mass index, BMI)为(22.3±3.0)。纳入标准如下:(1)健康成人,年龄18~60岁; (2)无明显心脑血管等内外科疾病; (3)四肢完整无畸形,无下肢创伤病史; (4)获得知情同意。排除标准如下:(1)怀孕或使用口服避孕药; (2)糖尿病病史; (3)深静脉血栓病史; (4)外周神经病变; (5)外周血管疾病; (6)有横纹肌溶解病史。研究过程中出现各种不良状况、不能耐受小腿加压或因其他任何原因中断者,可自主退出研究。研究经浙江大学医学院附属第二医院人体研究伦理委员会批准(I2019001099),获取参与者的知情同意。
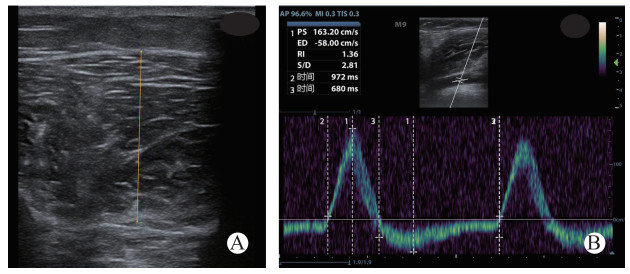
1.1 研究对象准备及模型建立研究开始前收集志愿者的一般信息,包括姓名、性别、年龄、身高、体质量,计算BMI。取双侧小腿围最大处水平用软尺测量腿围,并做标记。便携式超声机(M9,深圳迈瑞生物医疗电子股份有限公司,中国)测量双侧小腿胫前筋膜室厚度,使超声探头垂直于皮肤、测量胫前筋膜室内皮下组织与筋膜室交界处到胫腓骨间膜的距离[18],见图 1A。
|
| PS:收缩期最大血流速,ED:舒张期最小血流速,RI:阻力指数,时间2为一个心动周期总时间,时间3为舒张期反向血流时间。 图 1 小腿胫前筋膜室厚度(A)和下肢动脉多普勒血流频谱测量(B) Fig 1 A: Measurement of the limb anterior compartment thickness; B: Measurement of Doppler blood flow waveform of limb arteries. |
|
|
保持室温20~24℃,空气湿度50%~60%。志愿者下肢衣物宽松,避免肢体受压。采取仰卧位,足跟部给予支撑以保持小腿悬空,小腿高度与心脏齐平,休息5 min。用随机数字表法将12名志愿者左侧下肢分为实验组,其中三名志愿者申请调整为右侧实验组。最终实验组9名志愿者的实验组选在左侧(男5/女4),16名选在右侧(男5/女11)。两侧小腿分别包裹宽20 cm的下肢血压袖带(U1884S,优尼美医疗用品有限公司,中国)。充分暴露双侧腘动脉、腘静脉及足背动脉,选定最佳的测量位置并做体表标记。
参考经典的健康人急性骨筋膜室综合征模型,以袖带加压的方法模拟骨筋膜室内压力增加的过程[19-22]。使用压力表监测气囊内压力,然后依次给予实验组小腿袖带充气加压到20、30、40、50、60、70、80 mmHg(1 mmHg=0.133 kPa),加压时保证袖带内压力在10 s内达标,平稳1 min后在4 min内完成测量并记录各项指标。
1.2 监测指标使用多功能监护仪(M3002A,飞利浦麦迪津系统博布林根有限公司,德国)连续监测心电图、心率(heart rate,HR)、左上臂测量血压(blood pressure,BP)、右手中指监测脉搏血氧饱和度(pulse oxygen saturatio,SpO2)。
采用前述超声机,使用线阵探头(L12-5Q)监测外周血管血流多普勒频谱,测量腘动脉(popliteal artery, PA)的直径(PA diameter, PAD)、横截面积(PA area, PAA)、收缩期最大血流速(PA systolic velocity, PAVs)、舒张期最小血流速(PA diastolic velocity, PAVd)、阻力指数(PA resistance index, PARI)及舒张期动脉反向血流比(PA diastolic retrograde artery flow ratio, PADRAFR); 腘静脉(popliteal vein, PV)的直径(PVD)、横截面积(PVA)、收缩期最大血流速(PVVs); 足背动脉(dorsal artery, DA)的收缩期最大血流速(DAVs)、舒张期最小血流速(DAVd)、阻力指数(DARI)、正向动脉血流比(DA systolic forward artery flow ratio, DASFAFR)及parvus tardus波形比(DA parvus tardus waveform ratio, DAPTWR)。PADRAFR为腘动脉一个心动周期内舒张期反向血流时间与心动周期时长比值; DASFAFR为足背动脉一个心动周期内正向血流时间与心动周期时长比值; DAPTWR为足背动脉前向主血流内舒张期血流时间与收缩期血流时间比值。超声检测部位及探测血管的角度保持一致,声束方向与血流方向夹角小于60°。频谱测量至少连续3个周期,取3个周期测量值的平均值为测量结果(见图 1B)。
1.3 统计学方法使用SPSS 20.0(IBM, Chicago, US)进行数据统计分析。计量资料以均数±标准差(Mean±SD)表示; 计数资料以率表示。使用重复测量方差分析和配对t检验,以P < 0.05为差异有统计学意义。以平均动脉压减去袖带内压为筋膜室内灌注压(perfusion pressure, PP),将PP与超声监测指标做多元线性回归分析。以灌注压30 mmHg为阈值模拟AOCS的诊断进行Logistic回归分析,建立AOCS的诊断预测模型,并对模型进行曲线下面积(area under curve,AUC)曲线分析。
2 结果 2.1 小腿围、胫前筋膜室厚度、心率、血压、SpO2实验组的小腿围为(36.4±2.9)cm,对照组(36.3±3.1)cm,胫前筋膜室的厚度分别为(2.81±0.42)cm和(2.81±0.37)cm,两组差异均无统计学意义(P=0.978、0.962)。
志愿者基线的心率为(70±10)次/min、平均动脉压(81.7±8.8)mmHg、中指脉搏氧饱和度SpO2为(98.8±1.1)%,在实验过程中变化均无统计学意义(F=3.400、0.409、0.639,均P > 0.05)。实验过程中未发生不良事件,包括且不限于心率血压明显异常、腿部异常疼痛和其他不适、过敏反应等。
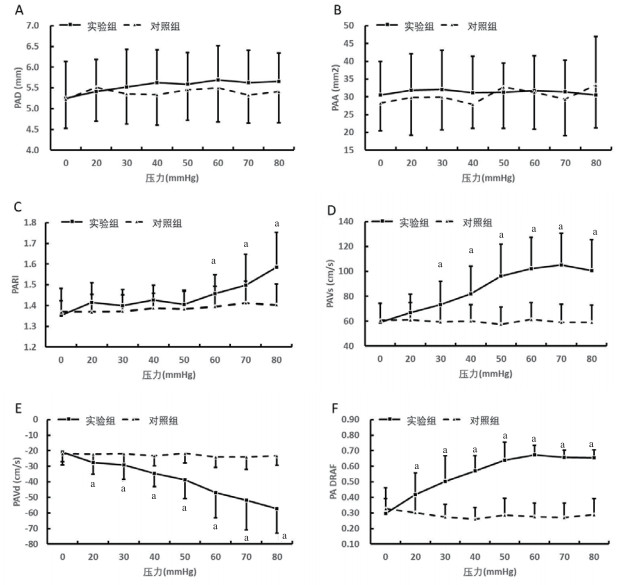
2.2 两组腘动脉、腘静脉超声指标的动态变化胫前筋膜室内压力增加前,腘动脉直径(PAD)、横截面积(PAA)、收缩期最大血流速(PAVs)、舒张期最小血流速(PAVd)、阻力指数(PARI)及舒张期动脉反向血流比(DRAF)两组相比,差异均无统计学意义(均P > 0.05)(见图 2)。两组腘动脉形态在小腿压力增加的过程中无明显改变,差异均无统计学意义(PAD:F=0.344,P=0.561;PAA:F=0.210,P=0.649)。在小腿压力增加的过程中,PAVs、PAVd、PARI、PADRAFR也逐渐增加(PAVs:F=48.748,P < 0.001;PAVd:F=6.420,P=0.015;PARI:F=43.172,P < 0.001;PADRAFR:F=242.459,P < 0.001)。加压20~80 mmHg时,实验组PAVd均高于对照组(均P < 0.05);加压30~80 mmHg时,实验组PAVs均高于对照组(均P < 0.05);PARI缓慢增加,在袖带内压力增加到60~80 mmHg时,实验组PARI与对照组相比差异有统计学意义(均P < 0.05);实验组PADRAFR在压力20~80 mmHg时均高于对照组(均P < 0.05)。
|
| 与对照组相比较,aP < 0.05;PAD:腘动脉直径; PAA:腘动脉横截面积; PARI:腘动脉阻力指数; PAVs:腘动脉收缩期最大血流速; PAVd:腘动脉舒张期最小血流速; PA DRAF:腘动脉舒张期反向血流比 图 2 两组腘动脉超声与多普勒频谱指标的动态变化 Fig 2 Changes of ultrasound Doppler blood flow waveform indexes between the two groups of popliteal arteries |
|
|
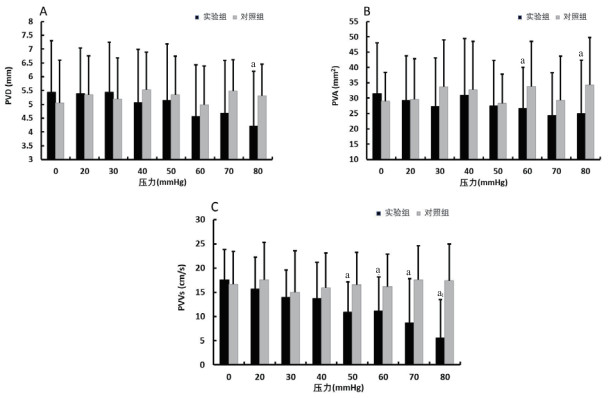
腘静脉直径(PVD)、横截面积(PVA)、收缩期最大血流速(PVVs)在基线时两组差异均无统计学意义(均P > 0.05)(见图 3)。在小腿加压的过程中,PVD有降低趋势,但两组间差异无统计学意义(F=0.789,P=0.379)。两组间PVA在加压期间差异也无统计学意义(F=1.476,P=0.230),但在压力60 mmHg和80 mmHg时,实验组PVA与对照组相比明显降低(均P < 0.05)。在压力增加的过程中,PVVs逐渐降低(F=17.064,P < 0.001),在袖带内压力50~80 mmHg时,实验组PVVs均显著低于对照组(均P < 0.05)。
|
| 与对照组相比,aP < 0.05;PVD:腘静脉直径,PVA:腘静脉横截面面积,PVVs:腘静脉收缩期最大流速 图 3 两组腘静脉超声与多普勒频谱指标的动态变化 Fig 3 Changes of ultrasound Doppler blood flow waveform indexes between the two groups of popliteal veins |
|
|
在未加压前,两组足背动脉收缩期最大血流速(DAVs)、舒张期最小血流速(DAVd)、阻力指数(DARI)、正向动脉血流比(DASFAFR)及parvus tardus波形比(DAPTWR)差异均无统计学意义(均P > 0.05)(见表 1)。在小腿加压的过程中,实验组的DAVs逐渐降低(F=7.045,P=0.011),压力60~80 mmHg时,实验组DAVs均显著低于对照组(均P < 0.05)。两组DAVd在小腿加压的过程中差异无统计学意义(F=1.388,P=0.244),但压力60~80 mmHg时,实验组DAVd均显著低于对照组(均P < 0.05)。整个小腿加压过程中,两组DARI差异无统计学意义(F=0.931,P=0.339),但压力70 mmHg时,实验组DARI低于对照组(P < 0.05)。随着小腿压力增加,足背动脉SFAF逐渐降低(F=8.818,P=0.005),袖带内压力30、50~80 mmHg时,实验组足背动脉SFAF明显降低(均P < 0.05)。加压过程中,实验组DAPTWR逐渐增加(F=14.886,P < 0.05),在40~80 mmHg时,实验组DAPTWR明显高于对照组(均P < 0.05)。
| 组别 | 0 mmHg | 20 mmHg | 30 mmHg | 40 mmHg | 50 mmHg | 60 mmHg | 70 mmHg | 80 mmHg |
| PAVs-DAVs(cm/s) | ||||||||
| 实验组 | -22.47±33.08 | -6.74±36.11 | 2.76±31.38b | 5.89±41.40 | 33.76±33.54ab | 61.86±30.57ab | 63.55±35.87ab | 72.22±29.28ab |
| 对照组 | -10.39±40.23 | -15.16±29.96 | -19.63±34.66 | -16.74±29.94 | -18.73±26.93 | -20.12±34.25a | -17.45±28.33a | -16.79±27.61a |
| PAVd-DAVd(cm/s) | ||||||||
| 实验组 | -10.50±13.84 | -11.95±9.69 | -13.17±11.11 | -23.03±15.40 | -28.02±20.82b | -39.00±21.81b | -45.38±21.45b | -55.19±17.87b |
| 对照组 | -14.80±13.89 | -8.51±11.29 | -10.59±14.92 | -12.28±15.50 | -9.07±15.50 | -7.65±10.60 | -9.02±13.28 | -9.09±13.32 |
| PARI-DARI | ||||||||
| 实验组 | 0.20±0.14 | 0.19±0.19 | 0.17±0.15 | 0.26±0.23 | 0.21±0.19 | 0.28±0.25 | 0.34±0.37 | 0.48±0.38b |
| 对照组 | 0.22±0.21 | 0.16±0.16 | 0.18±0.18 | 0.20±0.16 | 0.20±0.23 | 0.15±0.16 | 0.18±0.20 | 0.17±0.18 |
| PAVs/DAVs | ||||||||
| 实验组 | 0.85±0.39 | 1.12±0.54 | 1.23±0.59b | 1.41±0.89 | 1.92±1.15ab | 3.17±1.81ab | 3.30±2.00ab | 4.38±3.01ab |
| 对照组 | 1.16±0.69 | 0.97±0.49 | 0.91±0.48 | 0.94±0.50 | 0.87±0.39 | 0.90±0.45 | 0.92±0.52 | 0.91±0.51 |
| PAVd/DAVd | ||||||||
| 实验组 | 1.02±1.44 | 2.03±1.02 | 1.54±1.67 | 1.30±2.75 | 2.07±2.68 | 2.20±1.89b | 4.14±1.44 | 2.55±3.47b |
| 对照组 | 1.07±1.77 | 0.96±1.74 | 0.93±1.51 | 0.75±1.80 | -0.16±3.00 | 1.03±1.02 | -0.33±6.25 | 0.47±1.75 |
| PARI/DARI | ||||||||
| 实验组 | 1.20±0.17 | 1.17±0.20 | 1.16±0.16 | 1.34±0.67 | 1.20±0.19 | 1.28±0.26 | 1.33±0.37 | 1.53±0.38ab |
| 对照组 | 1.23±0.27 | 1.15±0.18 | 1.18±0.22 | 1.19±0.20 | 1.21±0.26 | 1.14±0.17 | 1.17±0.20 | 1.16±0.19 |
| 注:与0 mmHg相比较,aP < 0.05;与对照组相比较,bP < 0.05;Vs:收缩期最大流速; Vd:舒张期最小流速; RI:阻力指数; PAVs:腘动脉收缩期最大血流速; PAVd:腘动脉舒张期最小血流速; PARI:腘动脉阻力指数; DAVs:足背动脉收缩期最大血流速; DAVd:足背动脉舒张期最小血流速; DARI:足背动脉阻力指数 | ||||||||
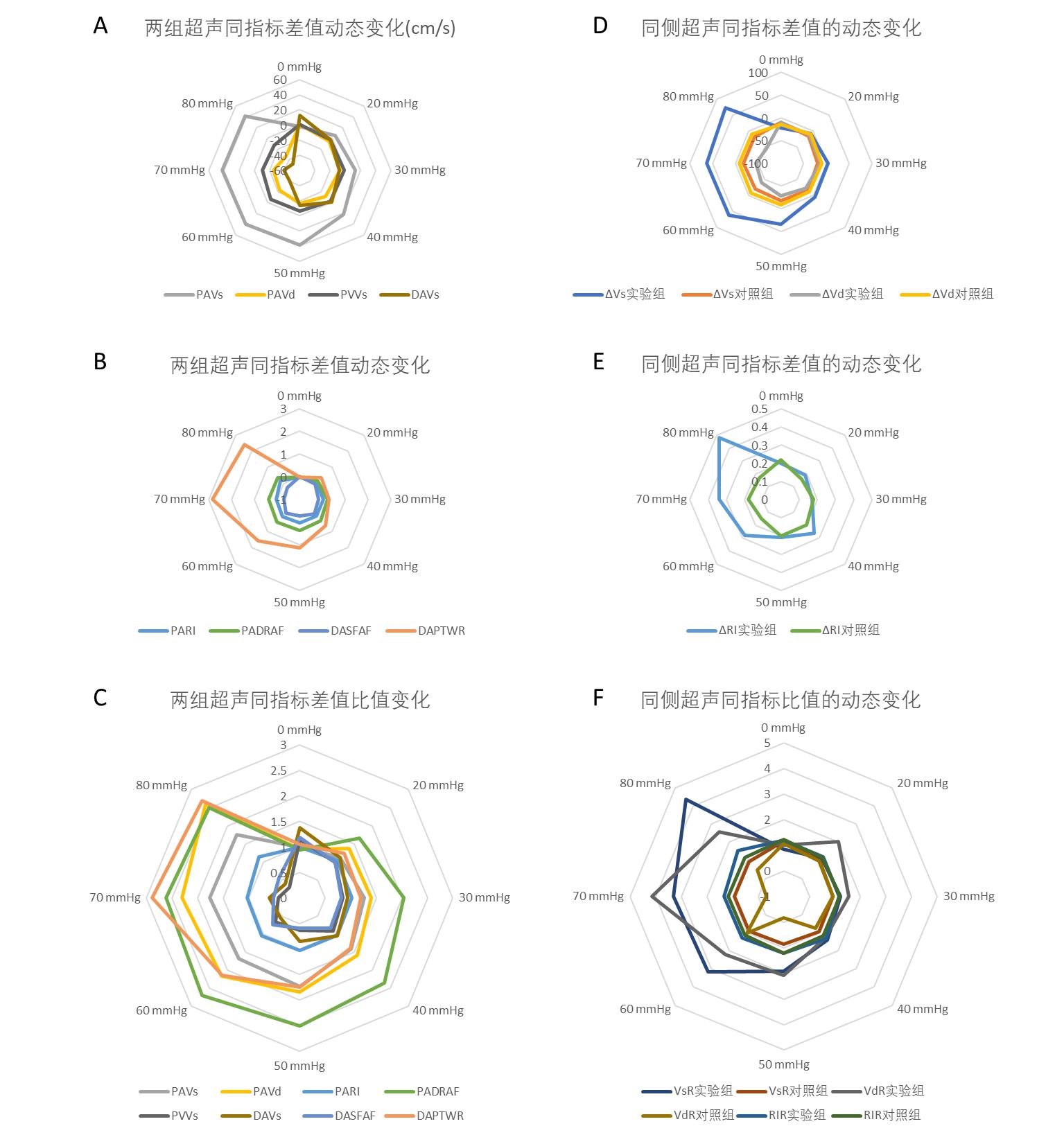
三血管超声指标的实验组与对照组差值、比值的动态变化见图 4。实验组与对照组PAD、PAA、PVD、PVA、DAVd、DARI差值在不同压力时差异无统计学意义(均P > 0.05)。PAVs、PARI、PADRAFR、DAPTWR实验组与对照组差值在压力增加时逐渐增加(分别为F=18.923、3.245、26.801、13.885,均P < 0.05),PAVd、PVVs、DAVs、DASFAFR实验组与对照组差值在压力增加时逐渐减小(分别F=26.201、8.141、12.956、5.083,均P < 0.05)。
|
| PAD:腘动脉直径; PAA:腘动脉横截面积; PAVs:腘动脉收缩期最大血流速; PAVd:腘动脉舒张期最小血流速; PARI:腘动脉阻力指数; PA DRAF:腘动脉舒张期反向血流比; PVD:腘静脉直径,PVA:腘静脉横截面面积,PVVs:腘静脉收缩期最大流速; DAVs:足背动脉收缩期最大血流速; DAVd:足背动脉舒张期最小血流速; DARI:足背动脉阻力指数; DASFAFR:足背动脉收缩期正向血流比 图 4 腘动脉、腘静脉及足背动脉超声相同指标差值、比值的动态变化 Fig 4 Dynamic changes of the same index difference and ratio of popliteal artery, popliteal vein and dorsal plantar artery |
|
|
实验组与对照组PAD、PAA、PVD、PVA、DAVd、DARI比值在不同压力时差异无统计学意义(均P > 0.05)。PAVs、PAVd、PARI、PADRAFR、PVVs、DAPTWR两组比值在压力增加时比值逐渐增大(分别F=14.184、21.602、3.548、28.759、8.553、13.096,均P < 0.05),DAVs和DASFAFR实验组与对照组比值加压后比值逐渐减小(分别F=9.64、6.097,均P < 0.05)。
2.5 同侧腘动脉与足背动脉超声相同指标差值、比值的动态变化实验组腘动脉与足背动脉Vs和RI差值在加压过程中逐渐增大,Vd逐渐减小(F=43.901、4.653、32.54,均P < 0.05)(见图 4)。对照组腘动脉与足背动脉Vs、Vd和RI差值在实验过程中无明显改变(F值分别为0.331、1.418、0.967,均P > 0.05)。与对照组相比较,实验组腘动脉与足背动脉Vs差值较高(F=35.775,P < 0.001),Vd差值较低(F=23.904,P < 0.001)。实验组腘动脉与足背动脉RI差值与对照组差异无统计学意义(F=2.676,P=0.109)。
实验组腘动脉与足背动脉Vs和RI比值在加压过程中逐渐增大(F值分别为27.922、3.579,均P < 0.05),但Vd无明显改变(F值分别为5.752,P > 0.05)。对照组腘动脉与足背动脉Vs、Vd和RI比值在实验过程中无明显改变(F值分别为1.488、0.875、1.18,均P > 0.05)。与对照组相比,实验组腘动脉与足背动脉Vs比值较高(F=22.802,P < 0.001);Vd和RI比值双侧差异无统计学意义(分别F=2.003、2.417,均P > 0.05)。
2.5 回归分析结果将以上所有指标与灌注压PP分别进行相关性分析,结果发现实验组PAVd、PADRAF、两组PAVd和PADRAF差值、实验组腘动脉与足背动脉Vs和Vd差值与灌注压PP之间有较好的相关性,pearson相关系数分别为0.6~0.8(均P < 0.05);实验组PAVs、PARI、DAVs、DASFAF、DAPTWR,两组PAVs、PVVs、DAVs、DAPTWR差值,两组PAVs、PAVd、PADRAF、PVVs、DAVs、DASFAF、DAPTWR比值,实验组腘动脉与足背动脉Vs比值与灌注压PP之间中等程度相关,Pearson相关系数为0.4~0.6(均P < 0.05)。筋膜室近段动静脉与灌注压PP相关性最佳指标为实验组PADRAF,远端动脉最佳指标为实验组DASFAF。以上所有指标与袖带内压P进行相关性分析,结果发现相关性及强度与灌注压PP的相关性一致。筋膜室近段动静脉与袖带内压力P相关性最佳指标同样为实验组PADRAF,远端动脉最佳指标为实验组DASFAF。
以上指标与灌注压PP逐步法进行线性回归分析,选取单一超声指标模型,以PADRAFR为自变量(X),以PP为应变量(Y),得到回归方程Y=93.598-124.241X,调整R2=0.677。同指标与袖带内压力P逐步法进行线性回归分析,以PADRAFR为自变量(X),以袖带内压力为应变量(Y),得到回归方程Y=-16.899+98.844X,调整R2=0.603。
以灌注压30 mmHg为AOCS诊断阈值,将灌注压转变为分类变量,与以上指标分别进行ROC分析。筋膜室近段指标中实验组PADRAF的AUC值最大(AUC=0.921,95%置信区间为0.878~0.965)(见图 5A),远端DASFAF的AUC值最大(AUC=0.788, 95%置信区间为0.723~0.852))(见图 5B)。以尤登指数为标准,实验组PADRAF的最佳界值57.91%,诊断敏感度为81.7%,特异度90.9%;实验组DASFAF最佳界值为26.69%,诊断敏感度为87%,特异度67.2%。以筋膜内压30 mmHg为AOCS诊断阈值,将其转变为分类变量。ROC分析发现,筋膜室近段指标中实验组PADRAF的AUC值最大(AUC=0.919,95%置信区间0.874~0.965)(见图 5C),远端DASFAF的AUC值最大(AUC=0.807,95%置信区间为0.744~0.869)(见图 5D)。以尤登指数为标准,实验组PADRAF最佳界值47.04%,诊断敏感度88.8%,特异度82.0%;实验组DASFAF最佳界值27.22%,诊断敏感度94.0%,特异度61.1%。
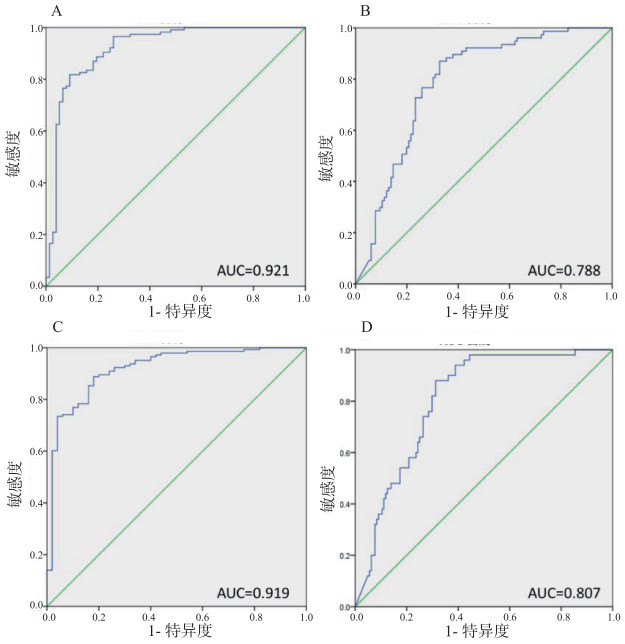
|
| A、B:自变量分别为PADRAF、DASFAFR,应变量为灌注压≥30 mmHg; C、D:自变量分别为PADRAF、DASFAFR,应变量为ICP ≥30 mmHg 图 5 ROC曲线分析 Fig 5 ROC curve analysis |
|
|
本研究通过小腿袖带加压法建立健康人急性骨筋膜室综合征的模型,使用超声监测筋膜室近远端主支血管的形态学及血流频谱的变化,发现小腿筋膜室内压力增加导致腘动脉和足背动脉明显的收缩期和舒张期血流速的改变,腘动脉舒张期反向血流比例增加,足背动脉收缩期正向血流比例减小,提示超声检测这些指标可用于骨筋膜室综合征的早期监测。
早期诊断和及时处理是急性骨筋膜室综合征诊治的重点。由于目前临床诊断缺乏金标准,主要依靠病史和症状、体征,有条件的单位会进行ICP监测[3, 23]。临床症状诊断AOCS的阳性预测值小于15%,阴性预测值97%~98%,更适合排除性诊断。且ICP的测量为侵入性,需要专门的材料且增加患者痛苦、感染等风险,未能够在临床得到广泛应用。已有一些无创监测技术用于AOCS早期监测的研究,包括超声脉冲相位环分析筋膜位移,剪切波弹性成像和应变弹性称像定量测量硬度,以及近红外光谱观察肌肉氧合程度等[17, 22]。但这些技术都是动物或尸体研究,或者缺乏大样本的临床研究,无法指导临床应用。对比增强超声可反应组织灌注,但超声造影成本较高,且操作难度大,需要大量后期数据分析[17]。因此,目前还缺乏满足临床需要的急性骨筋膜室综合征早期监测的理想工具。
以止血带加压的方法增加筋膜室内压力,是模拟骨筋膜室综合征的经典模型[19-22]。Breit等[21]通过小腿外袖套内充气加压40 mmHg维持14 min,配合运动模拟健康人慢性骨筋膜室综合征模型。Gentilello等[20]对15名志愿者以小腿袖带加压最高达70 mmHg持续30 min的方式模拟急性骨筋膜室综合征。Lynch等[22]对23位健康志愿者用两个血压袖带覆盖从膝盖到脚踝的区域模拟急性骨筋膜室综合征,IMP逐步升高至80 mmHg。研究均发现骨筋膜室内压力增加导致组织氧合指数迅速下降; 神经组织损伤,神经敏感度降低; 以脉冲锁相环技术检测AOCS过程中筋膜微小位移,发现随着IMP增加筋膜位移也增加,符合骨筋膜室综合征的发展过程。所有上述研究均无不良事件报道。另外,也已有研究证明外部止血带内压力与筋膜室内压力有良好的一致性。
在骨筋膜室综合征的病理生理过程中,ICP逐渐增大,对血流动力学影响也逐渐加大。筋膜室内压力增加导致骨筋膜室内血管扩张受限,ICP压力较小时对动脉影响较小,而静脉内压力较小、受ICP影响较大。早期研究发现,当胫骨前筋膜室ICP增加到23.8 mmHg时,胫骨动脉血流无显着变化,而静脉引流严重受损。本研究中当小腿加压为20 mmHg时,腘动脉阻力指数、峰值血流速和足背动脉血流速没有出现明显改变。当筋膜室内压力继续增大,对组织血流动力学影响逐渐增加,筋膜室内血管扩张受限,收缩期血流流速增加,近心端血管下游阻力增加、舒张期压力阶梯减小,导致反向血流增加。肌肉动脉舒张期反向血流是一种常见现象,例如三向流。尽管如此,与基线相比,舒张中期与晚期舒张期反向血流依然可以作为一种有效的量化指标。研究发现,当手臂抬高时,血管阻力明显增加,舒张期最低血流速明显增加,舒张期反向血流也明显增加。本研究与之前研究结果一致。而且,与血流速度不同的是,舒张期反向血流比不受超声声束角度的影响。ICP增加导致筋膜室内动脉压力迅速降低,使筋膜室远端动脉压力减小,导致收缩期前向血流减少,流速减小; 导致舒张期足背动脉与远端组织压力阶梯减小,血流减少。本研究也发现,ICP升高导致足背动脉收缩期舒张期血流速降低,前向血流比例减小,符合急性骨筋膜室综合征血流动力学的理论变化。简而言之,筋膜室内压力增加可导致筋膜室内及近段和远端血流动力学的改变,使多普勒超声成为潜在的无创筛选筋膜室内高压的工具。
单一位点超声参数测量值个体差异可能较大,而两位点参数比较往往使个体差异减小。且临床上肢体损伤往往情况复杂,在对侧肢体完好的情况下,肢体超声参数PAVs、PAVd、PARI、PADRAFR、PVVs、DAVs、DAPTWR、DASFAFRAOCS侧及对侧差值、比值均为筋膜室内压力增加的敏感指标; 而当对侧肢体同时损伤,超声参数不可获取时,同侧骨筋膜室近段与远端超声参数Vs、Vd差值,Vs比值变化可敏感的反应筋膜室内压力的改变。因此,灵活应用单一及多位点超声参数的绝对值及差比值有助于及时准确地发现和诊断AOCS。同时,结果也发现双侧比较的敏感超声参数与单一位点的敏感超声参数一致,因此,该类指标具有无创、可连续测量、敏感度高等优点。超声监测技术的进展使下肢超声多位点连续多普勒监测成为可能,该技术将有力地推进AOCS早期监测和诊断的进展。
本研究也有一些不足。首先,本研究采用健康人小腿外部加压模型模拟AOCS,可能与内部压力增加的临床实际有差异。临床实际可能合并骨折、血管损伤等复杂情况,或只存在一个或少数几个筋膜室存在压力增加。其次,本研究中压力增加程度及持续时间均较短,与临床实际不符合,导致某些指标的变化来不及表现出来。最后,研究比较了AOCS早期筋膜室近远端血流信号和筋膜室内压力的关系,而没有与其他反应组织缺血坏死的指标进行比较,这也是下一步研究改进的方向。
总之,在健康人急性骨筋膜室综合征模型中,随着筋膜室压力的增加,近端动脉的收缩期最大血流速、舒张期反向血流比例和远端动脉的收缩期正向血流比例可显著增加,提示超声可用于急性骨筋膜室综合征的早期监测,值得进一步的临床研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Duckworth AD, McQueen MM. The diagnosis of acute compartment syndrome: a critical analysis review[J]. JBJS Rev, 2017, 5(12): e1. DOI:10.2106/JBJS.RVW.17.00016 |
| [2] | Schmidt AH, Bosse MJ, Frey KP, et al. Predicting acute compartment syndrome (PACS): the role of continuous monitoring[J]. J Orthop Trauma, 2017, 31(1): S40-S47. DOI:10.1097/bot.0000000000000796 |
| [3] | von Keudell AG, Weaver MJ, Appleton PT, et al. Diagnosis and treatment of acute extremity compartment syndrome[J]. Lancet, 2015, 386(10000): 1299-1310. DOI:10.1016/s0140-6736(15)00277-9 |
| [4] | McQueen MM, Duckworth AD. The diagnosis of acute compartment syndrome: a review[J]. Eur J Trauma Emerg Surg, 2014, 40(5): 521-528. DOI:10.1007/s00068-014-0414-7 |
| [5] | Alobaidi A, Backdash MM, El-Menyar A. Thigh compartment syndrome complicated by sciatic nerve palsy, rhabdomyolysis, and acute renal failure[J]. Clin Case Rep, 2016, 4(2): 107-110. DOI:10.1002/ccr3.446 |
| [6] | Giannoudis PV, Nicolopoulos C, Dinopoulos H, et al. The impact of lower leg compartment syndrome on health related quality of life[J]. Injury, 2002, 33(2): 117-121. DOI:10.1016/s0020-1383(01)00073-0 |
| [7] | Bhattacharyya T, Vrahas MS. The medical-legal aspects of compartment syndrome[J]. J Bone Jo Surg Am Vol, 2004, 86(4): 864-868. DOI:10.2106/00004623-200404000-00029 |
| [8] | Bloch A, Tomaschett C, Jakob SM, et al. Compression sonography for non-invasive measurement of lower leg compartment pressure in an animal model[J]. Injury, 2018, 49(3): 532-537. DOI:10.1016/j.injury.2017.11.036 |
| [9] | Mars M, Maseko S, Thomson S, et al. Can pulse oximetry detect raised intracompartmental pressure?[J]. S Afr J Surg, 1994, 32: 48. DOI:10.1097/00024382-199406000-00012 |
| [10] | Mars M, Hadley GP. Failure of pulse oximetry in the assessment of raised limb intracompartmental pressure[J]. Injury, 1994, 25(6): 379-381. DOI:10.1016/0020-1383(94)90130-9 |
| [11] | Amendola A, Rorabeck CH, Vellett D, et al. The use of magnetic resonance imaging in exertional compartment syndromes[J]. Am J Sports Med, 1990, 18(1): 29-34. DOI:10.1177/036354659001800105 |
| [12] | Shuler MS, Roskosky M, Kinsey T, et al. Continual near-infrared spectroscopy monitoring in the injured lower limb and acute compartment syndrome: an FDA-IDE trial[J]. Bone Joint J, 2018, 100-B(6): 787-797. DOI:10.1302/0301-620X.100B6.BJJ-2017-0736.R3 |
| [13] | Toyoshima Y, Webb J, Gregory A, et al. Ultrasound shear wave elastography for measuring intracompartmental pressure of compartment syndrome using a Turkey hind limb model[J]. J Biomech, 2020, 98: 109427. DOI:10.1016/j.jbiomech.2019.109427 |
| [14] | Sellei RM, Wollnitz J, Reinhardt N, et al. Non-invasive measurement of muscle compartment elasticity in lower limbs to determine acute compartment syndrome: Clinical results with pressure related ultrasound[J]. Injury, 2020, 51(2): 301-306. DOI:10.1016/j.injury.2019.11.027 |
| [15] | Sellei RM, Hingmann SJ, Kobbe P, et al. Measurement of compartment elasticity using pressure related ultrasound: a method to identify patients with potential compartment syndrome[J]. Acta Chir Orthop Traumatol Cech, 2015, 82(3): 198-202. |
| [16] | Wiemann JM, Ueno T, Leek BT, et al. Noninvasive measurements of intramuscular pressure using pulsed phase-locked loop ultrasound for detecting compartment syndromes: a preliminary report[J]. J Orthop Trauma, 2006, 20(7): 458-463. DOI:10.1097/00005131-200608000-00002 |
| [17] | Geis S, Gehmert S, Lamby P, et al. Contrast enhanced ultrasound (CEUS) and time intensity curve (TIC) analysis in compartment syndrome: first results[J]. Clin Hemorheol Microcirc, 2012, 50(1/2): 1-11. DOI:10.3233/CH-2011-1438 |
| [18] | Rajasekaran S, Beavis C, Aly AR, et al. The utility of ultrasound in detecting anterior compartment thickness changes in chronic exertional compartment syndrome: a pilot study[J]. Clin J Sport Med, 2013, 23(4): 305-311. DOI:10.1097/JSM.0b013e3182856046 |
| [19] | Soller BR, Yang Y, Soyemi OO, et al. Noninvasively determined muscle oxygen saturation is an early indicator of central hypovolemia in humans[J]. J Appl Physiol (1985), 2008, 104(2): 475-481. DOI:10.1152/japplphysiol.00600.2007 |
| [20] | Gentilello LM, Sanzone A, Wang L, et al. Near-infrared spectroscopy versus compartment pressure for the diagnosis of lower extremity compartmental syndrome using electromyography-determined measurements of neuromuscular function[J]. J Trauma, 2001, 51(1): 1-8. DOI:10.1097/00005373-200107000-00001 |
| [21] | Breit GA, Gross JH, Watenpaugh DE, et al. Near-infrared spectroscopy for monitoring of tissue oxygenation of exercising skeletal muscle in a chronic compartment syndrome model[J]. J Bone Joint Surg Am, 1997, 79(6): 838-843. DOI:10.2106/00004623-199706000-00006 |
| [22] | Lynch JE, Lynch JK, Cole SL, et al. Noninvasive monitoring of elevated intramuscular pressure in a model compartment syndrome via quantitative fascial motion[J]. J Orthop Res, 2009, 27(4): 489-494. DOI:10.1002/jor.20778 |
| [23] | Shadgan B, Menon M, Sanders D, et al. Current thinking about acute compartment syndrome of the lower extremity[J]. Can J Surg, 2010, 53(5): 329-334. |
 2021, Vol. 30
2021, Vol. 30




