2. 惠州市第一人民医院老年病科 516000
鹦鹉热衣原体感染是一种自然疫源性疾病,鸟类为主要宿主,传播途径多为接触含鹦鹉热衣原体的气溶胶或分泌物、排泄物等,典型表现包括高热、畏寒、肌肉酸痛、头痛及出现肺部浸润性病变,严重者可发展至重症肺炎、多器官功能衰竭等[1]。如不能及时准确诊断及针对性治疗,往往预后很差。既往由于病原学检测技术的限制,临床诊断的鹦鹉热衣原体感染病例数较少[2]。宏基因二代测序(metagenomics next-generation sequencing, mNGS)作为一种新的精准医学技术,可以快速检测出包括真菌、病毒、鹦鹉热衣原体等特殊病原体[3-4]。本研究拟对惠州市中心人民医院通过mNGS诊断的鹦鹉热衣原体重症肺炎病例进行分析,探讨该病的诊治方法。
1 资料与方法 1.1 一般资料对2020年1月至2021年1月由惠州市中心人民医院收治,通过mNGS诊断为鹦鹉热衣原体重症社区获得性肺炎[5-6]的6例患者进行回顾性分析。鹦鹉热衣原体重症社区获得性肺炎诊断标准为:①符合重症社区获得性肺炎诊断标准[5];②所有常规病原学检测均为阴性,包括血、痰及肺泡灌洗液等培养未发现其他病原;③血液、肺泡灌洗液等通过mNGS检测出鹦鹉热衣原体。
本研究已通过医院伦理委员会审核(编号:KYLL2020059),患者均已签署知情同意书。
1.2 资料收集记录所有研究对象的年龄、性别、基础疾病、鸟类接触史等基础资料;记录出现的临床症状及体征;记录血常规、超敏C反应蛋白(high sensitive C-reactive protein, Hs-CRP)、降钙素原(procalcitonin,PCT)、血沉(erythrocyte sedimentation rate, ESR)、肝肾功能、凝血功能、脑利钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)、肌钙蛋白T(troponin T,cTnT)、T淋巴细胞亚群等实验室检查结果;记录胸部CT及治疗用药情况,并计算入院当天PSI、CURB-65评分。
1.3 mNGS检测① 样本处理和DNA提取:严格按照临床操作规范采集样本(血、肺泡灌洗液等),使用Ion Ampliseq试剂盒(广州达瑞生物技术股份有限公司,中国)提取DNA;②文库构建、上机测序及数据分析:将DNA随机打碎成200~300 bp长度的核酸片段,使用达安基因通用文库构建试剂盒(广州达瑞生物技术股份有限公司,中国)质控文库插入接头片段大小,经环化形成单链环形结构,制备好的DNA纳米球加载到测序芯片,采用DA8600高通量测序仪(广州达安基因股份有限公司,中国)进行测序及生物信息分析。
2 结果 2.1 患者基本信息及临床表现6例患者中女性4例、男性2例,年龄30~78岁,其中5例患者存在基础疾病。所有患者均为急性发病,起病初期均有高热症状,体温39.0~41.0℃,均伴有呼吸困难、咳嗽、纳差,部分出现畏寒(3例)、意识障碍(3例)、肌痛(2例)、头痛(1例),咳痰不明显。所有患者均有家禽类接触史,见表 1。
| 病例 | 性别 | 年龄(岁) | 基础疾病 | 接触史 | CURB-65(分) | PSI(分) | 住院时间(d) | 胸部CT表现 |
| 1 | 女 | 54 | Ⅱ型糖尿病 | 饲养鸡鸭 | 1 | 94 | 13 | 双下肺大片实变 |
| 2 | 女 | 78 | 冠心病、卵圆孔未闭 | 饲养鸡鸭 | 4 | 158 | 11 | 左上肺尖后段实变,左下肺大片实变,右肺上叶炎症 |
| 3 | 男 | 73 | 高血压、卵圆孔未闭 | 处理死鸡 | 3 | 143 | 12 | 左肺大片实变,下肺为主 |
| 4 | 男 | 30 | 乙肝并肝硬化 | 清理鸡粪 | 3 | 110 | 16 | 双上肺炎症,双下肺实变 |
| 5 | 女 | 60 | 无 | 清理鸡粪 | 3 | 140 | 20 | 左肺上叶、右肺中叶实变,右肺下叶大片实变 |
| 6 | 女 | 43 | Ⅱ型糖尿病 | 饲养鸡鸭 | 1 | 83 | 10 | 右肺各段及左肺下叶背段炎症、实变(右下肺实变明显) |
4例患者白细胞正常,2例患者出现升高;4例患者中性粒细胞比例升高,2例正常;5例患者ESR不同程度升高(32~88 mm/h);6例患者Hs-CRP升高明显;3例PCT升高明显,3例轻度升高;6例患者均出现转氨酶异常;3例患者出现心功能不全,4例出现轻度心肌损伤;1例患者出现肾功能不全。5例患者CD3+、CD4+细胞数减少,表现为细胞免疫抑制。患者胸部影像学检查结果表现为渗出性病变,实变为主,可累及多个肺叶,肺下叶受累较常见,病灶进展迅速,后期可出现少许胸腔积液,见表 1、2及图 1。
| 病例 | WBC(×109/L) | N(%) | ESR(mm/h) | Hs-CRP(mg/L) | PCT(ng/mL) | ALT/AST(U/L) | NT-proBNP(pg/mL) | cTnT(μg/L) | 肌酐(μmol/L) | T淋巴细胞亚群(/μL) | |||
| CD3 | CD4 | CD8 | CD4/CD8 | ||||||||||
| 1 | 7.5 | 68.4 | 12 | 79.5 | 0.11 | 100/105 | 94.1 | 12.0 | 24 | 680 | 356 | 292 | 1.22 |
| 2 | 11.6 | 87.9 | 72 | 287.8 | 3.35 | 41/73 | 3286.0 | 23.9 | 72 | 404 | 220 | 160 | 1.38 |
| 3 | 9.8 | 93.3 | 56 | 479.9 | 37.30 | 113/318 | 1303.0 | 32.1 | 113 | 472 | 280 | 164 | 1.71 |
| 4 | 16.5 | 57.0 | 52 | 75.4 | 0.87 | 111/303 | 217.2 | 56.4 | 46 | 1884 | 1120 | 624 | 1.79 |
| 5 | 6.2 | 91.7 | 88 | 98.7 | 0.33 | 31/60 | 518.7 | 8.7 | 58 | 556 | 284 | 232 | 1.22 |
| 6 | 5.7 | 87.0 | 32 | 196.4 | 0.10 | 45/59 | 1174 | 43.1 | 43 | 604 | 248 | 320 | 0.78 |
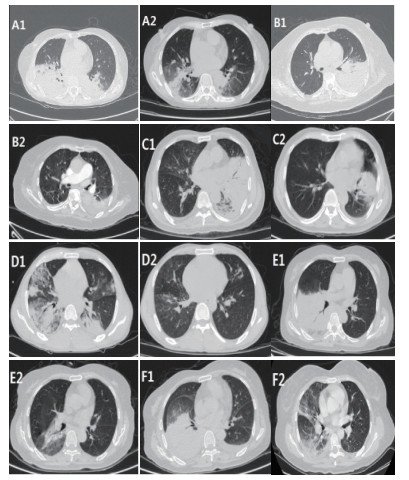
|
| A1、A2;B1、B2;C1、C2;D1、D2;E1、E2;F1、F2分别为病例1~6患者治疗前后胸部CT变化情况,患者表现为大片状实变影,经治疗后胸部CT可见病灶明显吸收。 图 1 6例患者胸部CT表现 |
|
|
5例患者的mNGS标本为肺泡灌洗液,1例为静脉血。mNGS检测肺泡灌洗液除检出鹦鹉热衣原体(序列数为5~102)外,还包括其他病原微生物,见表 3。
| 病例 | 标本类型 | 诊断前用药情况 | mNGS检测结果及序列数 | 诊断后抗感染用药 |
| 1 | 肺泡灌洗液 | 亚胺培南,万古霉素,阿比多尔,左氧氟沙星 | 鹦鹉热衣原体(13),金黄色葡萄糖球菌(485),缓症链球菌(257),肺炎克雷伯菌(278),白色念珠菌(900),人类疱疹病毒7型(2) | 左氧氟沙星 |
| 2 | 肺泡灌洗液 | 亚胺培南,左氧氟沙星,阿比多尔 | 鹦鹉热衣原体(25) | 左氧氟沙星+多西环素 |
| 3 | 肺泡灌洗液 | 亚胺培南,左氧氟沙星 | 鹦鹉热衣原体(102),光滑念珠菌(1) | 多西环素 |
| 4 | 肺泡灌洗液 | 亚胺培南,左氧氟沙星,阿比多尔 | 鹦鹉热衣原体(36),金黄色葡萄球菌(194),EB病毒(2) | 左氧氟沙星+阿奇霉素 |
| 5 | 肺泡灌洗液 | 亚胺培南,万古霉素,阿比多尔,左氧氟沙星 | 鹦鹉热衣原体(5),白色念珠菌(58) | 多西环素 |
| 6 | 静脉血 | 亚胺培南,万古霉素,阿比多尔,左氧氟沙星 | 鹦鹉热衣原体(17) | 莫西沙星 |
结合患者流行病学史、临床症状、胸部CT及mNGS等结果,诊断鹦鹉热衣原体重症肺炎,予呼吸支持(5例经鼻高流量氧疗,1例吸氧)及调整为以多西环素、阿奇霉素、莫西沙星为基础药物治疗方案后,6例患者体温约2~3 d逐渐降至正常,约1周左右肺内病灶明显吸收,最终好转出院,见表 3。
3 讨论鹦鹉热衣原体属于革兰阴性、需氧、专性胞内寄生菌,可引起鹦鹉热肺炎甚至重症肺炎,感染者多有鸟类接触史,主要由于接触过含鹦鹉热衣原体的气溶胶或分泌物、排泄物等,人群普遍易感[7-8]。目前鹦鹉热衣原体在社区获得性肺炎(community-acquired pneumonia,CAP)中的发病率仍难以确定,一项Meta分析发现约有1%的CAP是由鹦鹉热衣原体感染引起[8]。在本报道中5例有基础疾病史,免疫功能检测也发现患者普遍存在细胞免疫抑制,提示存在基础疾病或细胞免疫功能低下的患者更容易发展为危重症。
鹦鹉热本质上是一种全身性疾病,以呼吸系统感染为主,也可累及肝脏、肾脏、血液、循环及中枢神经等系统,导致多器官功能不全[9-10]。Chen等[6]报道的9例重症鹦鹉热肺炎患者中均出现畏寒发热、咳嗽、乏力及呼吸衰竭等症状,多个患者出现头晕、肌痛并发展为脓毒血症;实验室检查提示白细胞正常或轻度升高,中性粒细胞比例升高,CRP、PCT升高明显,部分患者出现心肌酶、肝酶升高,这与本研究报道的结果基本一致。患者均表现有高热及CRP明显升高,但白细胞数正常或轻度升高,这是与细菌性肺炎鉴别的一个重要特征。影像学方面,该疾病尚缺乏特异性表现,胸部X线最常见表现为单个下肺叶改变,胸部CT显示实变结节与周围磨玻璃改变[1]。本研究所报道的6例病例胸部CT均以实变为主要征象,多为大片实变,以肺下叶受累明显,与Coutts等[11]、Kong等[12]报道相一致。而Gu等[7]报道的5例鹦鹉热衣原体肺炎中2例以肺下叶实变为主,2例以右肺上叶实变为主,1例起初以右上肺实变为主,后病情加重,胸部CT显示双肺弥漫病灶,以双下肺大片实变为主。出现以上差异,可能与纳入研究病例的病情严重程度有关。
传统用于鹦鹉热衣原体诊断的方法包括分离和培养、血清学试验及PCR检测,病原学培养阳性率不高且存在实验室污染风险,但血清学试验不适用于急性感染的诊断,多用于回顾性诊断[13]。PCR检测快速、敏感性高[2],但对病原体的诊断比较单一,目前国内开展鹦鹉热衣原体PCR检测的机构不多,故既往临床报道病例数较少,2006—2012年间美国CDC也仅报道58例[13]。mNGS作为新一代检测技术,可以准确、高效的鉴定出样本中存在的可疑致病微生物,特别适用于疑难、危重、特殊感染的患者。由于mNGS覆盖范围广、敏感性高,样本中常检测出多种病原微生物包括条件致病菌、定植菌等,故需要结合标本类型、序列数、临床表现及影像学检查等综合分析判断[14-15]。鹦鹉热衣原体作为胞内寄生菌,一旦mNGS检出其系列,应考虑为致病病原体的可能性[15]。本研究中病例样本均来自血液及肺泡灌洗液,确诊鹦鹉热衣原体肺炎前的常规抗感染治疗效果不佳,针对性调整用药后,症状改善且胸部CT提示病灶明显吸收,故诊断成立。
目前鹦鹉热衣原体感染治疗可选择四环素类、大环内酯类、喹诺酮类等对胞内革兰阴性菌活性较强的抗菌药物[16],上述药物作用机制主要是选择性干扰DNA和蛋白质合成。目前指南[17]推荐首选四环素类,次选大环内酯类,每疗程至少连续用药10 d。多项研究发现四环素类药物治疗鹦鹉热衣原体肺炎疗效显著[18],本研究也发现初始治疗失败的患者加用多西环素治疗后病情均得到好转。体外研究发现阿奇霉素、莫西沙星对鹦鹉热衣原体有较强的抗菌活性[19],但由于大环内酯类药物对衣原体耐药率高,临床疗效需进一步验证。Kong等[12]、朱榕生等[20]均有报道莫西沙星治疗鹦鹉热肺炎可以取得很好的临床疗效,但左氧氟沙星治疗效果不佳[21]。本研究6例患者确诊前均有使用左氧氟沙星,但只有1例患者临床治疗有效,其余患者疗效不佳。1例患者改用莫西沙星治疗后病情好转,2例患者予多西环素治疗,2例患者在左氧氟沙星的基础上分别加用阿奇霉素、多西环素,上述病例在药物调整后均预后良好。
目前鹦鹉热衣原体肺炎病原学诊断困难,mNGS作为新兴的病原诊断技术,可以快速、特异性地诊断鹦鹉热衣原体等特殊病原体,为临床精准治疗提供技术支持。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Cillóniz C, Torres A, Niederman M, et al. Community-acquired pneumonia related to intracellular pathogens[J]. Intensive Care Med, 2016, 42(9): 1374-1386. DOI:10.1007/s00134-016-4394-4 |
| [2] | Nieuwenhuizen AA, Dijkstra F, Notermans DW, et al. Laboratory methods for case finding in human psittacosis outbreaks: a systematic review[J]. BMC Infect Dis, 2018, 18(1): 442. DOI:10.1186/s12879-018-3317-0 |
| [3] | Duan LW, Qu JL, Wan J, et al. Effects of viral infection and microbial diversity on patients with Sepsis: a retrospective study based on metagenomic next-generation sequencing[J]. World J Emerg Med, 2021, 12(1): 29. DOI:10.5847/wjem.j.1920-8642.2021.01.005 |
| [4] | Gu W, Miller S, Chiu CY. Clinical metagenomic next-generation sequencing for pathogen detection[J]. Annu Rev Pathol, 2019, 14: 319-338. DOI:10.1146/annurev-pathmechdis-012418-012751 |
| [5] | Mandell LA, Wunderink RG, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults[J]. Clin Infect Dis, 2007, 44(Suppl 2): S27-S72. DOI:10.1086/511159 |
| [6] | Chen X, Cao K, Wei Y, et al. Metagenomic next-generation sequencing in the diagnosis of severe pneumonias caused by Chlamydia psittaci[J]. Infection, 2020, 48(4): 535-542. DOI:10.1007/s15010-020-01429-0 |
| [7] | Gu L, Liu W, Ru M, et al. The application of metagenomic next-generation sequencing in diagnosing Chlamydia psittaci pneumonia: a report of five cases[J]. BMC Pulm Med, 2020, 20(1): 65. DOI:10.1186/s12890-020-1098-x |
| [8] | Hogerwerf L, DE Gier B, Baan B, et al. Chlamydia psittaci (psittacosis) as a cause of community-acquired pneumonia: a systematic review and meta-analysis[J]. Epidemiol Infect, 2017, 145(15): 3096-3105. DOI:10.1017/S0950268817002060 |
| [9] | 汪洋, 鲁厚清, 邵仁德, 等. 鹦鹉热衣原体感染肺炎患者的临床特征分析[J]. 中华危重病急救医学, 2020, 32(11): 1388-1390. DOI:10.3760/cma.j.cn121430-20200408-00259 |
| [10] | Zhang H, Zhan DT, Chen DD, et al. Next-generation sequencing diagnosis of severe pneumonia from fulminant psittacosis with multiple organ failure: a case report and literature review[J]. Ann Transl Med, 2020, 8(6): 401. DOI:10.21037/atm.2020.03.17 |
| [11] | Coutts Ⅱ, Mackenzie S, White RJ. Clinical and radiographic features of psittacosis infection[J]. Thorax, 1985, 40(7): 530-532. DOI:10.1136/thx.40.7.530 |
| [12] | Kong CY, Zhu J, Lu JJ, et al. Clinical characteristics of Chlamydia psittaci pneumonia[J]. Chin Med J (Engl), 2021, 134(3): 353-355. DOI:10.1097/cm9.0000000000001313 |
| [13] | Balsamo G, Maxted AM, Midla JW, et al. Compendium of measures to control Chlamydia psittaci infection among humans (psittacosis) and pet birds (avian chlamydiosis), 2017[J]. J Avian Med Surg, 2017, 31(3): 262-282. DOI:10.1647/217-265 |
| [14] | Miao Q, Ma Y, Wang Q, et al. Microbiological diagnostic performance of metagenomic next-generation sequencing when applied to clinical practice[J]. Clin Infect Dis, 2018, 67((suppl_2): S231-S240. DOI:10.1093/cid/ciy693 |
| [15] | 宏基因组分析和诊断技术在急危重症感染应用专家共识组. 宏基因组分析和诊断技术在急危重症感染应用的专家共识[J]. 中华急诊医学杂志, 2019, 28(2): 151-155. DOI:10.3760/cma.j.issn.1671-0282.2019.02.005 |
| [16] | Kohlhoff SA, Hammerschlag MR. Treatment of Chlamydial infections: 2014 update[J]. Expert Opin Pharmacother, 2015, 16(2): 205-212. DOI:10.1517/14656566.2015.999041 |
| [17] | 中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(4): 253-279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005 |
| [18] | Teng XQ, Gong WC, Qi TT, et al. Clinical analysis of metagenomic next-generation sequencing confirmed Chlamydia psittaci pneumonia: a case series and literature review[J]. Infect Drug Resist, 2021, 14: 1481-1492. DOI:10.2147/IDR.S305790 |
| [19] | Donati M, Rodrìguez Fermepin M, Olmo A, et al. Comparative in-vitro activity of moxifloxacin, minocycline and azithromycin against Chlamydia spp[J]. J Antimicrob Chemother, 1999, 43(6): 825-827. DOI:10.1093/jac/43.6.825 |
| [20] | 朱榕生, 罗汝斌, 王选锭. 鹦鹉热衣原体致重症社区获得性肺炎一例[J]. 中华结核和呼吸杂志, 2019, 42(7): 548-551. DOI:10.3760/cma.j.issn.1001-0939.2019.07.021 |
| [21] | 骆煜, 金文婷, 马玉燕, 等. 5例鹦鹉热衣原体肺炎的诊断及临床特点[J]. 中华医院感染学杂志, 2020, 30(22): 3394-3398. DOI:10.11816/cn.ni.2020-201728 |
 2021, Vol. 30
2021, Vol. 30




