近年来,脓毒症发生率逐年升高,病死率高达30%~70%,早期识别脓毒症,把握“黄金时间”,尽早实施早期目标导向治疗对降低病死率,改善预后至关重要。为了能早期识别脓毒症,2016年国际组织对脓毒症2.0中21条诊断标准进行了多因素回归分析,筛选出了呼吸频率、格拉斯哥昏迷评分(Glasgow Coma Scale, GCS)、收缩压三个指标,作为脓毒症床旁快速筛查工具,命名为quick SOFA(qSOFA)[1],但其敏感性不高,可能会导致治疗的滞后,延误病情。胃肠道往往是脓毒症的始动器官,又是最易受累的器官,胃肠功能障碍影响着疾病的预后[2],但至今为止脓毒症的诊断及筛选标准中均未涵盖胃肠道功能。本研究旨在评价急性胃肠损伤(acute gastrointestinal injury, AGI)分级联合qSOFA评分在诊断脓毒症中的价值。
1 资料与方法 1.1 一般资料本研究为前瞻性观察性研究,纳入2018年9月至2019年9月收住苏州大学附属常熟医院(常熟市第一人民医院)普通病房的感染或疑似感染患者,纳入标准:住院期间使用抗生素并留取微生物的培养,两者开始的时间在以下范围内:如果先使用抗生素,培养留取必须在24 h内完成。如果先进行培养留取,则必须在72 h内使用抗生素。感染的时间点定义为这两个事件中的第一个发生的时间[3]。排除标准:年龄小于18岁;妊娠;入院后3 d内死亡患者;中途放弃治疗的患者。
分组:根据患者是否诊断为脓毒症分为脓毒症组和非脓毒症组。脓毒症诊断标准[4]:对于感染乃至疑似感染的患者,若患者序贯器官衰竭评分(sequential organ failure assessment,SOFA)变化程度≥2分,表示存在器官功能障碍,定义为脓毒症。本研究符合医学伦理标准,通过了苏州大学附属常熟医院(常熟市第一人民医院)医学伦理委员会的审核[2017伦审(申报)批第4号]。
1.2 监测指标由指定人员负责收集并录入相关信息数据。基本临床资料包括:发病前48 h内至发病后24 h的基本生命体征、实验室化验结果、AGI分级情况(根据2012年欧洲危重病学会AGI标准[5])、qSOFA评分、是否发生脓毒症及预后情况,相关数据及评分值取记录期间最差值。
1.3 统计学方法首先通过R语言编程将患者按7∶3比例随机分为建模组和验证组。正态分布数据用均值±标准差(Mean±SD),偏态分布数据使用中位数(四分位数)表示,正态分布数据组间比较使用t检验,偏态分布数据组间比较使用Mann-Whitney U秩和检验,率的比较用χ2检验,以P < 0.05为差异有统计学意义。对单因素分析有统计学差异的因素进行多因素logistic回归分析。利用建模组中的数据构建诊断模型,分别建立qSOFA,AGI分级联合qSOFA,及多因素分析中有统计学差异的变量为参数的诊断模型,在验证组中进行验证。通过ROC分析评价模型的诊断效果,绘制校准曲线评价各预测模型的一致性,并使用决策曲线分析(decision curve analysis,DCA)评价净效益。最后使用R语言绘制各预测模型诊断脓毒症的列线图。所有统计分析均采用SPSS 22.0及R 3.0.1语言进行。
2 结果 2.1 基本资料2018年9月至2019年9月普通病房共收治感染及疑似感染患者2 855例,其中年龄小于18岁51例,妊娠27例,入院后3天内死亡16例,中途放弃治疗者208例予以排除,最终2 553例患者纳入研究,其中326例(12.8%)患者发生了脓毒症。所有患者中AGI的发生率为49%,其中Ⅰ级30.8%,Ⅱ级14.9%,Ⅲ级2.6%,Ⅳ级0.7%;脓毒症患者中AGI的发生率为95.7%,其中Ⅰ级12%,Ⅱ级58.6%,Ⅲ级19.9%,Ⅳ级5.2%。通过R语言编程将患者按7∶3随机比例分为建模组和验证组,其中建模组1 789例,验证组764例,两组患者基本资料上差异无统计学意义(表 1)。
| 指标 | 建模组(n=1789) | 验证组(n=764) | 检验值(Z/χ2) | P |
| 年龄[岁,M(QL, QU)] | 62(47, 74) | 62(48-74) | -0.178 | 0.859 |
| 性别(男)[例(%)] | 1 004(56.1) | 416(54.5) | 0.605 | 0.437 |
| 感染源(例, %) | 0.772 | 0.856 | ||
| 腹腔 | 788(44.0) | 340(44.5) | ||
| 血液或其他 | 176(9.8) | 69(9.0) | ||
| 肺部 | 609(34.0) | 256(33.5) | ||
| 泌尿系统 | 216(12.1) | 99(13.0) | ||
| 体温(例, %) | 4.54 | 0.103 | ||
| 36~38 ℃ | 1193(66.7) | 534(69.9) | ||
| > 38 ℃ | 589(32.9) | 224(29.3) | ||
| < 36 ℃ | 7(0.4) | 6(0.8) | ||
| 心率(例, %) | 1.012 | 0.314 | ||
| 60~100次/min | 1 159(64.8) | 511(66.9) | ||
| > 100次/min | 628(35.1) | 252(33) | ||
| < 60次/min | 2(0.1) | 1(0.1) | ||
| 呼吸急促(> 22次/min)(例, %) | 250(14) | 89(11.6) | 2.513 | 0.113 |
| 意识改变(GCS评分 < 12分)(例, %) | 27(1.5) | 15(2.0) | 0.682 | 0.409 |
| 严重水肿/液体正平衡 > 20 mL/kg(例, %) | 10(0.6) | 1(0.1) | 1.398 | 0.237 |
| 高血糖(> 10 mmol/l)(例, %) | 295(16.5) | 127(16.6) | 0.007 | 0.934 |
| 白细胞数量(WBC)(例, %) | 0.842 | 0.656 | ||
| > 12×109/L | 288(16.1) | 144(8.0) | ||
| < 4×109/L | 113(14.8) | 59(7.7) | ||
| C反应蛋白(CRP大于2倍标准以上)(例, %) | 1 294(72.3) | 538(70.4) | 0.966 | 0.326 |
| 降钙素原(PCT大于2倍标准以上)(例, %) | 224(12.5) | 81(10.6) | 1.874 | 0.171 |
| 低血压(SBP < 100 mmHg)(例, %) | 89(5.0) | 37(4.8) | 0.020 | 0.888 |
| 低氧血症(氧合指数 < 300 mmHg)(例, %) | 149(8.3) | 57(7.5) | 0.544 | 0.461 |
| 急性少尿(复苏后尿量 < 0.5 mL/h)(例, %) | 264(14.8) | 98(12.8) | 1.638 | 0.201 |
| 凝血功能异常(例, %)(INR > 1.5, APTT > 60 s或PLT < 100×109/L) | 14(0.8) | 6(0.8) | 0.000 | 0.994 |
| 高胆红素(总胆红素 > 70 mmol/L)(例, %) | 266(14.9) | 107(14) | 0.320 | 0.572 |
| 高乳酸血症(lac > 4 mmol/L)(例, %) | 53(3.0) | 17(2.2) | 1.092 | 0.296 |
| 毛细血管充盈受损或皮肤花斑(例, %) | 2(0.1) | 1(0.1) | 0.016 | 0.898 |
| AGI分级[级, M(QL, QU)] | 1(0, 1) | 0(0, 1) | -1.544 | 1.200 |
| qSOFA评分[分, M(QL, QU)] | 0(0, 1) | 0(0, 1) | -0.760 | 0.447 |
| 脓毒症(例, %) | 238(13.3) | 88(11.5) | 1.532 | 0.216 |
| 病死率(例, %) | 34(1.9) | 10(1.3) | 1.106 | 0.293 |
| 住院时间[d, M(QL, QU)] | 8(6, 12) | 8(6, 12) | -0.400 | 0.968 |
| 注:1 mmHg=0.133 kPa | ||||
单因素分析显示年龄、性别、感染源、体温、心率、呼吸急促、意识改变、严重水肿、高血糖、白细胞数量、CRP、PCT、低血压、低氧、急性少尿、凝血功能异常、高乳酸血症、毛细血管充盈受损或皮肤花斑、AGI分级及qSOFA评分对脓毒症的发生有显著影响(P均 < 0.01)(表 2)。对单因素分析有统计学差异的因素(除qSOFA评分外)进行多因素Logistic回归分析,显示预测脓毒症的危险因素为年龄(OR=1.027, P < 0.01),感染源(OR=2.809, P=0.03),低血压(OR=35.449, P < 0.01)、低氧血症(OR=57.018, P < 0.01),AGI分级(OR=19.313, P < 0.01)。(见表 3)。
| 脓毒症组(n=238) | 非脓毒症组(n=1551) | 检验值(Z/χ2) | P | |
| 年龄[岁,M(QL, QU)] | 60(45, 72) | 74(63, 83) | -10.055 | < 0.01 |
| 性别(男)[例(%)] | 159(66.8) | 845(54.4) | 12.730 | < 0.01 |
| 感染源(例, %) | 48.067 | < 0.01 | ||
| 腹腔 | 126(52.9) | 662(42.7) | ||
| 血液或其他 | 5(2.1) | 171(11.0) | ||
| 肺部 | 101(42.4) | 508(2.8) | ||
| 泌尿系统 | 6(2.5) | 210(13.5) | ||
| 体温(例, %) | 70.245 | < 0.01 | ||
| > 38℃ | 126(52.9) | 463(78.6) | ||
| < 36℃ | 6(2.5) | 1(0.1) | ||
| 心率(例, %) | 91.238 | < 0.01 | ||
| > 100次/min | 146(61.3) | 482(31.1) | ||
| < 60次/min | 2(0.8) | 0(0) | ||
| 呼吸急促(> 22次/min)(例, %) | 110(46.2) | 140(9.0) | 237.422 | < 0.01 |
| 意识改变(GCS评分 < 12分)(例, %) | 25(10.5) | 2(0.1) | 142.528 | < 0.01 |
| 严重水肿/液体正平衡 > 20 mL/kg(例, %) | 10(4.2) | 0(0) | 58.193 | < 0.01 |
| 高血糖(> 10 mmol/l)(例, %) | 105(44.1) | 190(12.3) | 152.168 | < 0.01 |
| 白细胞数量(WBC)(例, %) | 122.843 | < 0.01 | ||
| > 12×109/L | 94(39.5) | 194(12.5) | ||
| < 4×109/L | 27(11.3) | 117(7.5) | ||
| CRP大于2倍标准以上(例, %) | 214(89.9) | 1080(69.6) | 42.417 | < 0.01 |
| PCT大于2倍标准以上(例, %) | 100(42.0) | 124(8.0) | 218.050 | < 0.01 |
| 低血压(SBP < 100 mmHg)(例, %) | 86(36.1) | 3(0.2) | 563.821 | < 0.01 |
| 低氧血症(氧合指数 < 300 mmHg)(例, %) | 116(48.7) | 33(2.1) | 587.167 | < 0.01 |
| 急性少尿(复苏后尿量 < 0.5 ml/h)(例, %) | 78(32.8) | 186(12) | 70.836 | < 0.01 |
| 凝血功能异常(例, %)(INR > 1.5, APTT > 60 s或PLT < 100×109/L) | 12(5.0) | 2(0.1) | 57.976 | < 0.01 |
| 高胆红素(总胆红素 > 70 mmol/l)(例, %) | 45(18.9) | 221(14.2) | 3.538 | 0.06 |
| 高乳酸血症(lac > 4 mmol/l)(例, %) | 51(21.4) | 2(0.1) | 325.625 | < 0.01 |
| 毛细血管充盈受损或皮肤花斑(例, %) | 2(0.8) | 0(0) | 8.083 | 0.004 |
| AGI分级[级, M(QL, QU)] | 0(0, 1) | 2(2, 2) | -22.171 | < 0.01 |
| qSOFA评分[分, M(QL, QU)] | 0(0, 0) | 1(0, 1) | -21.962 | < 0.01 |
| 注:1 mmHg=0.133 kPa | ||||
| 因素 | B | S.E | Wald | P | OR | 95%CI |
| 年龄 | 0.026 | 0.008 | 12.283 | < 0.01 | 1.027 | 1.012-1.042 |
| 感染源 | 8.945 | 0.03 | ||||
| 腹腔 | - | - | - | - | - | - |
| 血液或其他 | 1.721 | 1.106 | 2.419 | 0.120 | 5.588 | 0.639-48.860 |
| 肺部 | 1.033 | 0.455 | 5.154 | 0.023 | 2.809 | 1.152-6.853 |
| 泌尿系统 | 1.777 | 0.743 | 5.723 | 0.017 | 5.910 | 1.379-25.339 |
| 低血压(SBP < 100 mmHg) | 3.568 | 0.630 | 43.054 | < 0.01 | 35.449 | 10.308-121.912 |
| 低氧血症(氧合指数 < 300 mmHg) | 4.043 | 0.497 | 66.137 | < 0.01 | 57.018 | 21.518-151.085 |
| AGI分级 | 2.961 | 0.258 | 132.134 | < 0.01 | 19.313 | 11.657-31.996 |
| 常数 | -8.520 | 0.688 | 153.377 | < 0.01 | 0.000 |
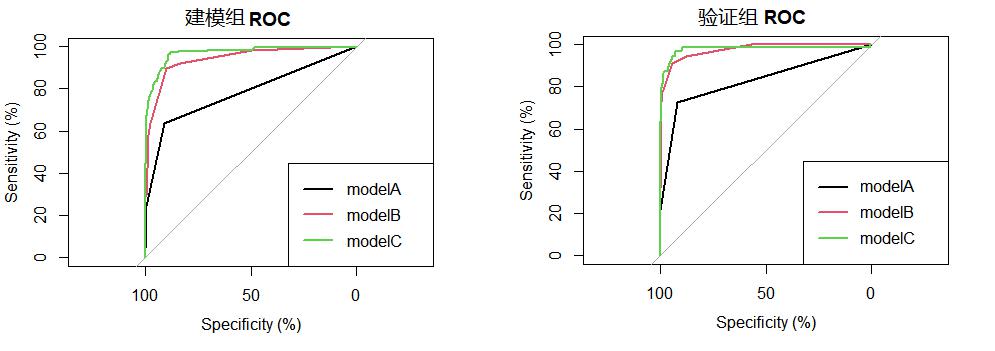
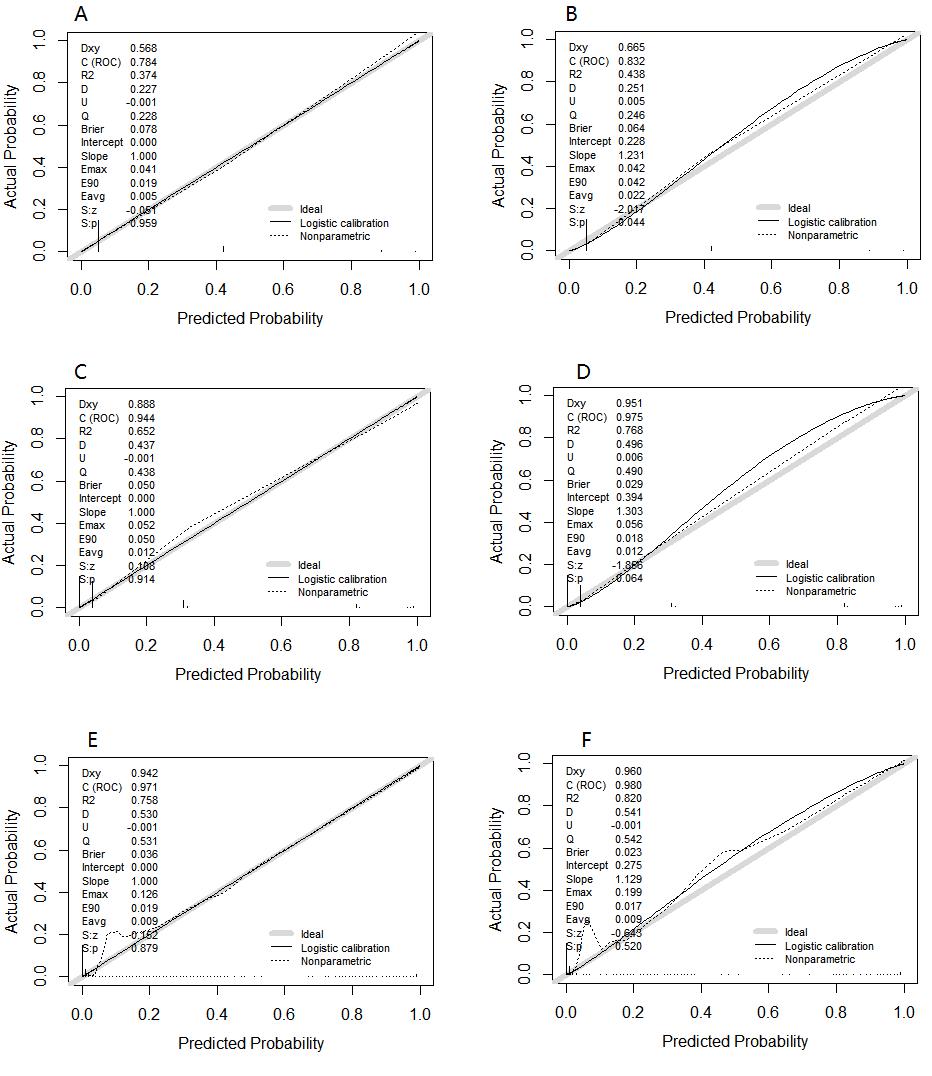
以qSOFA评分构建诊断脓毒症的模型A,以AGI分级联合qSOFA构建模型B,选择多因素分析中P < 0.05的临床参数(年龄、感染源、低血压、低氧血症、AGI分级)构建模型C(表 4),并分别绘制各模型的ROC曲线(图 1)。建模组中,模型A、B、C的曲线下面积(AUC)分别为0.784、0.944、0.971,敏感度分别为63.9%、89.5%、97.5%,特异度分别为90.8%、90.3%、88.1%,模型C的AUC明显大于模型A和B(P < 0.01);验证组中,模型A、B、C的AUC为0.832、0.975、0.980,敏感度分别为72.7%、90.9%、96.6%,特异度分别为92.2%,94.5%,92.8%。模型B、模型C的AUC明显大于模型A(P < 0.01),而B、C之间无明显差异(P=0.684)(表 5)。分别绘制各诊断模型的校准图形(图 2),模型A在验证组中的校准度较差,精确性低,有遗漏诊断脓毒症的风险(P=0.044)。
| 参数 | 系数 | OR | 95%CI | AIC | |
| 模型A | qSOFA | 2.509 | 12.295 | 9.229-16.598 | 1 000.7 |
| 模型B | qSOFA | 2.346 | 10.444 | 6.723-16.617 | 625.86 |
| AGI | 2.321 | 10.183 | 7.558-14.065 | ||
| 模型C | 年龄 | 0.026 | 1.027 | 1.012-1.042 | 468.59 |
| 感染源(肺) | 1.033 | 2.809 | 1.128-6.811 | ||
| 血流或其他 | 1.720 | 5.588 | 0.294-3.475 | ||
| 泌尿系统 | 1.777 | 5.910 | 1.252-2.390 | ||
| 低血压 | 3.568 | 35.449 | 11.940-153.272 | ||
| 低氧 | 4.043 | 57.018 | 22.568-159.990 | ||
| AGI | 2.961 | 19.313 | 11.946-32.931 |
|
| 图 1 各预测模型的ROC曲线 Fig 1 ROC curve for each predictive model |
|
|
| 模型 | AUC | Cut-off值 | 特异度(%) | 敏感度(%) | P (与A相比) | P (与B相比) |
| 建模组 | ||||||
| A | 0.784 | 0.239 | 90.8 | 63.9 | - | < 0.01 |
| B | 0.944 | 0.180 | 90.3 | 89.5 | < 0.01 | - |
| C | 0.971 | 0.067 | 88.1 | 97.5 | < 0.01 | < 0.01 |
| 验证组 | ||||||
| A | 0.832 | 0.239 | 92.2 | 72.7 | - | < 0.01 |
| B | 0.975 | 0.18 | 94.5 | 90.9 | < 0.01 | - |
| C | 0.980 | 0.056 | 92.8 | 96.6 | < 0.01 | 0.684 |
|
| A:建模组模型A;B:验证组模型A;C:建模组模型B;D:验证组模型B;E:建模组模型C;F:验证组模型C 图 2 各预测模型的校准图 Fig 2 Calibration plot for each predictive model |
|
|
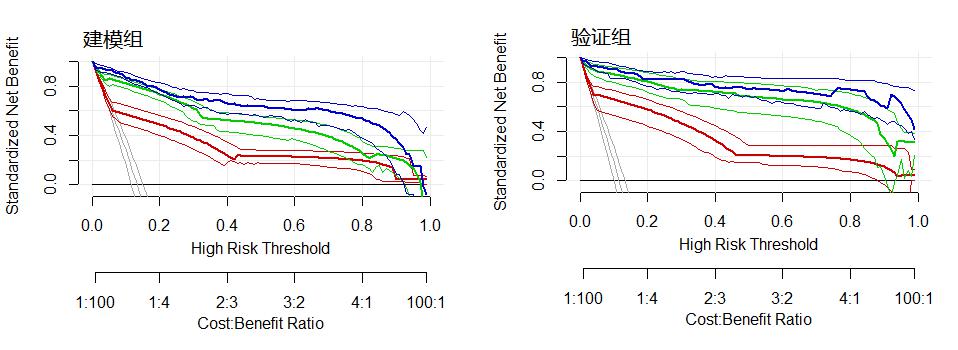
绘制建模组及验证组的各诊断模型预测脓毒症的决策曲线,模型B及模型C的净效益均优于模型A(图 3)。
|
| 红色曲线:模型A;绿色曲线:模型B;蓝色曲线:模型C;灰色曲线:全部获益;黑色曲线:均不获益 图 3 各预测模型的DCA曲线 Fig 3 Decision curve analysis (DCA) for each predictive model |
|
|
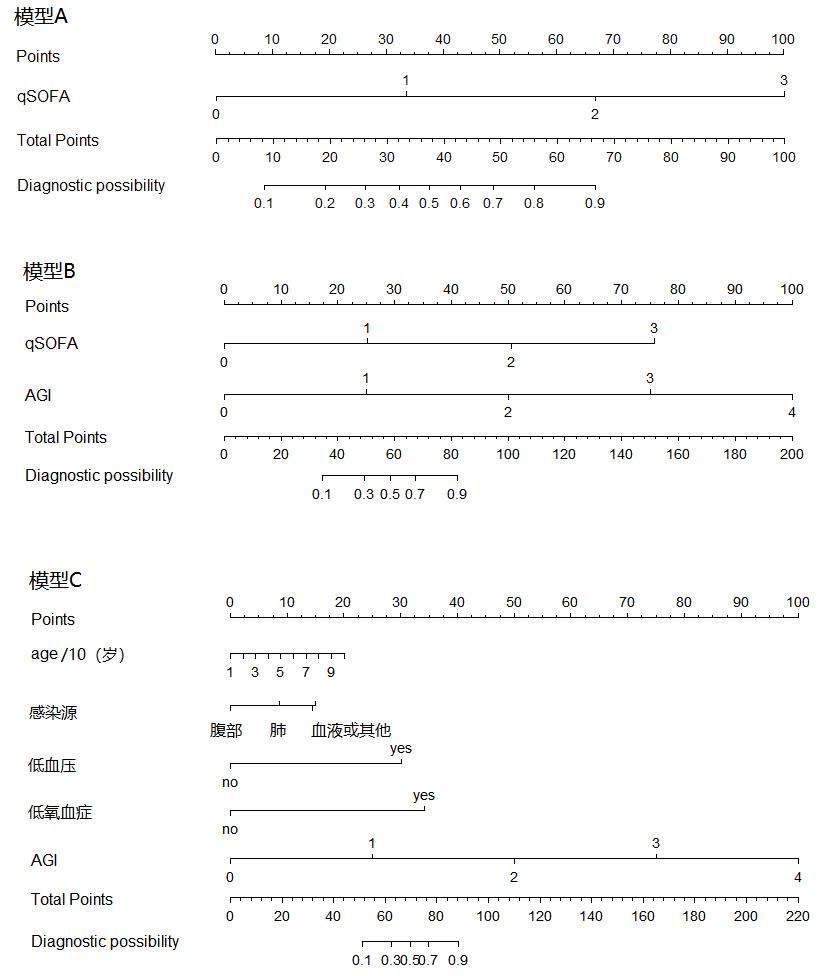
绘制诊断脓毒症的预测模型列线图(图 4)。图左侧为各项评分项目,对应顶部分值表计算所对应的积分,各项积分相加得到总分,对应对底部总分值表计算诊断为脓毒症的阳性预测值。
|
| 图 4 各预测模型的列线图 Fig 4 Nomograms for each predictive model |
|
|
近30多年来尽管在提高脓毒症的识别和治疗上进行了大量的临床研究,但全球的发生率仍很高,流行病学调查显示脓毒症发病率为288人/10万人,严重脓毒症发生率为148人/10万人。目前虽然已在抗生素使用、液体复苏及综合治疗方面有了很大的改善,但致死性脓毒症的病死率仍高达17%,严重脓毒症病死率为26%。脓毒症因其较高的发病率及病死率,至今仍然是全球关注的公共卫生问题[6-7]。因此需要有可靠的筛选工具,可以快速准确地判断病情,早期进行救治、改善患者预后。
最早脓毒症1.0使用SIRS评分作为诊断标准[8],但由于其过于敏感且缺乏特异性限制了它的应用。故脓毒症2.0提出了更严格的筛选标准,包括感染、炎症指标、器官功能、血流动力学、组织灌注等参数[9],但该诊断过于复杂,也阻碍了其临床应用。2016年制定了脓毒症3.0,以感染引起的器官功能障碍为核心,推荐使用qSOFA作为非ICU病区全身感染的筛查指标[3]。但在后期的研究中发现qSOFA虽然特异度高,但敏感度较低,易造成诊断的遗漏及治疗延误,这与指南提出的早期识别早期处理的观点相悖。一项886例急诊就诊疑似或证实感染患者的回顾性研究显示院前qSOFA≥2分对预测入住ICU的敏感度为36.3%,预测ICU时间大于3 d的敏感度为17.4%,预测48 h内死亡的敏感度为68%。急诊分诊时qSOFA≥2分对预测入住ICU的敏感度为31.2%,预测ICU时间大于3 d的敏感度为30.5%,预测48 h内死亡的敏感度为60.0%[10]。另外一项130 595例感染患者的回顾性分析显示NEWS≥4分、SIRS≥2分、qSOFA≥2分预测脓毒症的敏感度分别为84.2%(95%CI 81.5%~86.5%)、86.1%(95%CI 83.6%~88.2%)、28.5%(95%CI 25.6%~31.7%),特异度分别为85.0%(95%CI 84.8%~85.3%)、79.1%(95%CI 78.9%~79.3%)、98.9%(95%CI 98.8%~99.0%)[11]。Williams等[12]对8 871例急诊患者进行回顾性分析显示qSOFA预测器官功能障碍的特异度高达96.1%,而敏感度仅有29.9%。本研究中也显示建模组中qSOFA预测脓毒症的敏感度仅63.9%,验证组中为72.7%,稍高于其他研究,这可能和研究对象不同有关,既往研究对象为院前或急诊就诊的感染患者,而本研究的观察对象是收住普通病房的感染患者。
脓毒症患者由于炎症介质释放、毛细血管渗漏、液体渗出、血管收缩舒张障碍等,引起胃肠功能受损,影响营养物质及水的消化吸收、肠道菌群及其产物的吸收和调控、胃肠内分泌和免疫功能,导致不良预后[13],因此胃肠道往往是脓毒症的始动器官及最易受累的器官。2012年,欧洲重症监护医学会根据有无消化道出血、消化道麻痹、腹泻次数、喂养不耐受、肠鸣音及腹腔内压等客观指标提出了AGI的定义与分级标准[5]。在危重患者中AGI的发生率并不低,且AGI分级越高病死率越高。我国浙江省的多中心调查显示550例危重患者中470例合并AGI,其中AGI等级分布为Ⅰ级24.5%,Ⅱ级49.4%, Ⅲ级20.6%,Ⅳ级5.5%,AGI分级与28 d、60 d病死率呈正相关(P < 0.01)。多变量分析中,糖尿病(HR 1.43, 95%CI 1.03-1.87, P=0.05),血管活性药物的使用(HR 1.56, 95%CI 1.12~2.11, P= 0.01),血清乳酸(HR 1.15, 95% CI 1.06~1.24, P= 0.03),AGI等级(HR 1.65, 95%CI 1.28~2.12, P=0.008)和APACHE Ⅱ评分(HR 1.04, 95% CI 1.02~1.06,P < 0.01)与60 d病死率相关[2]。而另一项多中心研究显示脓毒症增加了AGI Ⅳ级发生的可能性[14]。在本研究中观察到感染或疑似感染患者中AGI的发生率为49%(Ⅰ级30.8%,Ⅱ级14.9%,Ⅲ级2.6%,Ⅳ级0.7%),脓毒症患者中AGI的发生率高达95.7%(Ⅰ级12%,Ⅱ级58.6%,Ⅲ级19.9%,Ⅳ级5.2%),分布情况与其他研究相似。多因素回归分析显示除年龄、感染源、血压、低氧是预测脓毒症的独立危险因素以外,AGI分级也是预测脓毒症的独立危险因素。
既往有研究将AGI分级联合SOFA评分来提高对疾病预后的预测价值。王玲玲等[15]发现通过AGI分级联合SOFA评分可提高老年脓毒症患者预后的预测价值,SOFAmax+AGImax值为14时预测预后的敏感度为67.65%,特异度为87.72%。在急性重症胰腺炎的患者中将AGI分级系统引入SOFA评分,绘制预测预后的ROC曲线,显示SOFA+AGI评分的AUC为0.963±0.037(95%CI 0.882~0.994), 明显高于APACHEⅡ评分及SOFA评分(P=0.013, 0.008),3种评分系统中以SOFA+AGI的Youden指数和阳性似然比最大,分别为0.863和15.38[16]。但将AGI分级应用在脓毒症筛选中的报道并不多,本研究通过AGI分级联合qSOFA评分(模型B)对普通病房的感染患者进行筛选,与qSOFA相比提高了预测脓毒症的敏感性,且特异度并无明显下降。此模型在验证组中得到了验证,ROC曲线分析显示模型B其诊断价值明显高于qSOFA,而和模型C之间无明显差异,校准图提示qSOFA的精确性低,有遗漏诊断脓毒症的风险,模型B的精确度相对更好。决策曲线分析也显示模型B及模型C的净效益均优于模型A。模型B的相关参数均是可在普通病房获得的简易指标,提高了其在临床的应用性。最后根据预测模型绘制各模型的列线图,便于操作及临床推广应用。
本研究尚存在不足:(1)选择的指标为单一时间点的数值,尚不明确测量变化的最佳时间窗口。(2)没有区分慢性和急性器官功能障碍,并去区分器官功能障碍是否有除感染以外的其他原因。(3)预测模型缺乏外部验证,有待进一步的多中心研究。
综上所述,AGI分级联合qSOFA评分在脓毒症诊断中的具有较高的预测价值和准确性,有助于指导临床医师进行判断并早期采取相应措施,有较高的临床价值。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of Clinical Criteria for Sepsis: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [2] | Hu B, Sun R, Wu A, et al. Severity of acute gastrointestinal injury grade is a predictor of all-cause mortality in critically ill patients: a multicenter, prospective, observational study[J]. Crit Care, 2017, 21(1): 188. DOI:10.1186/s13054-017-1780-4 |
| [3] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [4] | Napolitano, Lena M. Sepsis 2018: Definitions and Guideline Changes[J]. Surgical Infections, 2018, 19(2): 117-125. DOI:10.1089/sur.2017.278 |
| [5] | Reintam Blaser A, Malbrain ML, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [6] | Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193: 259-272. DOI:10.1164/rccm.201504-0781OC |
| [7] | 俞隼, 叶宏伟, 冯玉峰, 等. 江苏省常熟地区脓毒性休克指南依从性及预后的调查[J]. 中华急诊医学杂志, 2020, 29(5): 700-706. DOI:10.3760/cma.j.issn.1671-0282.2020.05.017 |
| [8] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med, 2013, 41(2): 580-637. DOI:10.1097/CCM.0b013e31827e83a |
| [9] | Petros S, John S. The 2016 Surviving Sepsis Campaign sepsis guideline[J]. Med Klin Intensivmed Notfmed, 2017, 112(5): 454-458. DOI:10.1007/s00063-017-0298-5 |
| [10] | Tusgul S, Carron PN, Yersin B, et al. Low sensitivity of qSOFA, SIRS criteria and sepsis definition to identify infected patients at risk of complication in the prehospital setting and at the emergency department triage[J]. Scand J Trauma Resusc Emerg Med, 2017, 25(1): 108. DOI:10.1186/s13049-017-0449-y |
| [11] | Usman OA, Usman AA, Ward MA. Comparison of SIRS, qSOFA, and NEWS for the early identification of sepsis in the Emergency Department[J]. Am J Emerg Med, 2019, 37(8): 1490-1497. DOI:10.1016/j.ajem.2018.10.058 |
| [12] | Williams JM, Greenslade JH, McKenzie JV, et al. Systemic Inflammatory Response Syndrome, Quick Sequential Organ Function Assessment, and Organ Dysfunction: Insights From a Prospective Database of ED Patients With Infection[J]. Chest, 2017, 151(3): 586-596. DOI:10.1016/j.chest.2016.10.057 |
| [13] | Xing J, Zhang Z, Ke L, et al. Enteral nutrition feeding in Chinese intensive care units: a cross-sectional study involving 116 hospitals[J]. Crit Care, 2018, 22(1): 229. DOI:10.1186/s13054-018-2159-x |
| [14] | Li H, Zhang D, Wang Y, et al. Association between acute gastrointestinal injury grading system and disease severity and prognosis in critically ill patients: A multicenter, prospective, observational study in China[J]. J Crit Care, 2016, 36: 24-28. DOI:10.1016/j.jcrc.2016.05.001 |
| [15] | 王玲玲, 陈蕊, 莫泽珣, 等. SOFA评分联合AGI分级对老年脓毒症的预后预测价值: 附91例患者的回顾性分析[J]. 中华危重病急救医学, 2017, 29(2): 145-149. DOI:10.3760/cma.j.issn.2095-4352.2017.02.010 |
| [16] | 张东, 杨艺敏, 段奥凇, 等. AGI分级系统引入SOFA评分对重症急性胰腺炎患者预后预测价值的研究[J]. 中华急诊医学杂志, 2015, 24(010): 1118-1121. DOI:10.3760/cma.j.issn.1671-0282.2015.10.017 |
 2021, Vol. 30
2021, Vol. 30




