2. 同济大学附属东方医院转化医学研究中心,上海 200120
2. Translational Medicine Research Center, Shanghai East Hospital, Shanghai 200120, China
脓毒症是宿主对感染反应失调引起的危及生命的器官功能衰竭[1];免疫抑制是脓毒症患者后期继发二重感染导致死亡的重要原因[2]。研究表明,广泛的细胞重编程是脓毒症中宿主继发免疫抑制的重要特征,主要包括淋巴细胞功能衰竭与凋亡增加[3-4],近年来,表观遗传在脓毒症进展中调控淋巴细胞的应答成为治疗感染与炎症的新思路和潜在的治疗新靶点[5]。众多研究表明,组蛋白甲基化是重要的表观遗传修饰方式,通过调控基因表达影响细胞功能。已知组蛋白修饰中,H3K27的甲基化与炎症和感染密切相关,其三甲基化(H3K27me3)是基因沉默的标志[6]。EZH2是PcG蛋白家族成员多梳抑制复合物2(polycomb repressive complex 2, PRC2)的核心组分,是H3K27me3转移酶,研究发现其在细胞的生长周期中,通过抑制相关靶基因来调节细胞的增殖与分化[7]。本课题组前期研究发现,EZH2药物抑制剂3-DZNeP明显抑制脓毒症小鼠的全身炎症反应[8], 进一步临床发现脓毒症患者外周血CD14+单核[8]、CD4+和CD8+T淋巴细胞[9]上EZH2的阳性率与平均荧光强度均明显高于健康对照组,且可预测脓毒症患者的不良结局[8-9]。B淋巴细胞在脓毒症诱导的先天性和适应性免疫反应中发挥关键作用,可以通过MHC II表达激活T细胞,同时通过分泌特定抗体在体液免疫反应中发挥作用[10],研究还发现CD27是淋巴细胞活化的标志,记忆B细胞亚群以CD19+CD27+B细胞表达为主[11-12]。然而迄今为止尚无脓毒症患者外周血CD19+B淋巴细胞、CD19+CD27+B细胞上EZH2的变化水平的研究结果。基于此,本研究拟通过动态监测脓毒症患者外周血B淋巴细胞上EZH2的阳性率以及平均荧光强度(Mean fluorescence intensity,MFI),评估其表达水平对脓毒症患者预后预测的价值。
1 资料与方法 1.1 一般资料收集2018年6月至2020年1月在同济大学附属东方医院重症监护病房(intensive care unit, ICU)的脓毒症患者。入组标准:①符合sepsis 3.0中脓毒症的诊断标准[1],即存在感染,序贯性器官衰竭(sequential organ failure assessment, SOFA)评分≥2;②年龄≥18岁。排除标准:①年龄 < 18岁;②恶性肿瘤;③自身免疫性缺陷病;④血液系统疾病;⑤孕妇、哺乳期妇女。筛选出脓毒症组48例,其中男性27例,女性21例,所有患者年龄在36~89岁(75.15±13.47)岁;募集同期在健康体检中心的健康志愿者共计40例(健康对照组),其中男性20例,女性20例,年龄在40~85岁(70±10.12)岁。
本研究符合医学伦理标准,并获得患者或其直系亲属的知情同意,且经同济大学附属东方医院伦理委员会审批后实施(批件号:【2019】研审第(009)号)。
1.2 研究分组根据研究对象入组与排除标准,分为脓毒组与健康对照组,脓毒症组随访28 d生存情况分为存活组和死亡组。
1.3 临床数据收集记录所有脓毒症患者性别、年龄、入住和转出ICU时间、28生存情况;记录患者确诊脓毒症后第1、3、7天血常规、炎症相关指标如C反应蛋白、降钙素原、IL-6等。计算SOFA评分、急性生理慢性健康(acute physiology and chronic health evaluation,APACHE Ⅱ)评分等指标。入院后患者接受脓毒症规范治疗[13]。
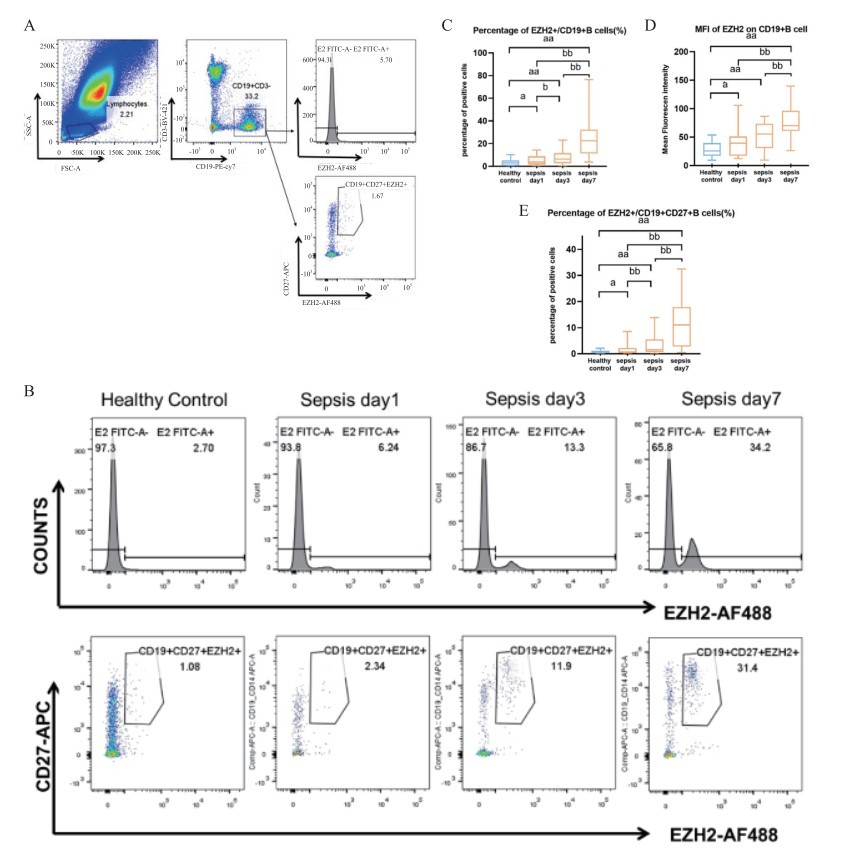
1.4 流式细胞术检测CD19+B细胞、CD19+CD27+B细胞EZH2的表达留取确诊脓毒症患者第1天、第3天、第7天外周血6 mL于K2 EDTA抗凝管内(对照组于清晨空腹抽取1次),置于4℃冰箱中保存,当天即对其进行处理,根据流式细胞技术检测人外周血淋巴细胞上EZH2的表达情况,采用BD Pharmingen流式表面染色抗体BV421-CD3、AF488-EZH2、PE-CY7-CD19、APC-CD27进行染色;对脓毒症组、健康对照组外周血细胞进行流式细胞分析,应用BD Aria2流式细胞仪结合Flow Jo 10软件,在门控策略中,正常人和脓毒症患者的所有的样本都在相同的参数下进行了门控(如图 1)。淋巴细胞亚群通过CD19+CD3-和CD19+CD27+染色进一步识别,每个样本至少分析10 000个细胞,比较实验组和对照组中EZH2在淋巴细胞上的阳性率以及平均荧光强度值(图 1)。
|
|
A:EZH2在B淋巴细胞上表达的划门示意图;B:健康对照组和脓毒症组第1、3、7天EZH2表达流式细胞散点图与直方图差异示例;C:脓毒症组和健康对照组CD19+B淋巴细胞上EZH2阳性率的动态变化;D:脓毒症组和健康对照组CD19+B淋巴细胞上EZH2平均荧光强度的动态变化;E:脓毒症组和健康对照组CD19+ CD27+B淋巴细胞上EZH2阳性率的动态变化; 脓毒症组与健康对照组对比,aP < 0.05;脓毒症组与健康对照组对比,aaP < 0.01;脓毒症组组内对比,bP < 0.05;脓毒症组组内对比,bbP < 0.01 图 1 脓毒症组和健康对照组EZH2在CD19+B、CD19+CD27+B淋巴细胞上的表达情况 Fig 1 Expression of EZH2 on CD19+B lymphocytes and CD19+CD27+B lymphocytes in septic patients and healthy controls |
|
|
采用SPSS 20.0进行数据分析,所有数据均先进行正态性检验及方差齐性检验,正态分布数据采用均值±标准差(Mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。非正态分布数据以中位数(四分位数)[M(QL, QU)]表示,两组比较采用Mann Whitney U检验。定性资料(性别、存活状态、呼吸机使用情况等资料)采用χ2检验。采用二元多因素logistic回归分析选择脓毒症患者28 d死亡的独立危险因素。ROC曲线用于评价不同指标的预测效果。以双侧P < 0.05为差异具有统计学意义。
2 结果 2.1 脓毒症组与健康对照组的基础临床资料本研究纳入脓毒症患者的主要感染部位为:肺部感染20例,腹部感染12例,泌尿系感染9例,多系统感染7例;其中应用呼吸机治疗17例。所有患者28 d病死率为37.5%,约50%的患者继发院内二重感染。诊断脓毒症时APACHE Ⅱ评分为(16.91±7.87)和SOFA评分为(6.75±4.79)。纳入健康对照组40例;两组之间性别、年龄差异无统计学意义(表 1)。
| 项目 | 脓毒症组(n=48) | 健康对照组(n=40) | P值 |
| 年龄(岁, Mean±SD) | 75.15±13.47 | 70±10.12 | 0.052 |
| 性别(男/女) | 27/21 | 20/20 | 0.711 |
| 白细胞计数(×109/L, Mean±SD)第1天 | 16.35±8a | 6.1±1.73 | < 0.01 |
| 白细胞计数(×109/L, Mean±SD)第3天 | 11.72±5.82a | < 0.01 | |
| 白细胞计数(×109/L, Mean±SD)第7天 | 11.56±5.39a | < 0.01 | |
| 外周血淋巴细胞计数(×109/L, Mean±SD)第1天 | 0.84±0.39a | 2.09±0.77 | < 0.01 |
| 外周血淋巴细胞计数(×109/L, Mean±SD)第3天 | 1.04±0.73a | < 0.01 | |
| 外周血淋巴细胞计数(×109/L, Mean±SD)第7天 | 1.3±0.83a | < 0.01 | |
| 外周血中性粒细胞计数(×109/L, Mean±SD)第1天 | 14.91±7.67a | 3.16±1.17 | < 0.01 |
| 外周血中性粒细胞计数(×109/L, Mean±SD)第3天 | 9.84±5.26a | < 0.01 | |
| 外周血中性粒细胞计数(×109/L, Mean±SD)第7天 | 9.55±5.78a | < 0.01 | |
| APACHE Ⅱ(分, Mean±SD)第1天 | 16.91±7.87 | - | |
| APACHE Ⅱ(分, Mean±SD)第3天 | 13.68±8.57 | - | |
| APACHE Ⅱ(分, Mean±SD)第7天 | 10.93±7.22 | - | |
| SOFA(分, Mean±SD)第1天 | 6.75±4.79 | - | |
| SOFA(分, Mean±SD)第3天 | 5.23±4.89 | - | |
| SOFA(分, Mean±SD)第7天 | 5.03±6.01 | - | |
| 总住院时间[d, M(QL, QU)] | 13(7.25, 16) | - | |
| ICU住院时间[d, M(QL, QU)] | 9(4.75, 15.25) | - | |
| 存活时间[d, M(QL, QU)] | 28(14.5, 28) | - | |
| 28 d死亡(例,%) | 18(37.5) | - | |
| 院内二重感染(例,%) | 24(50) | - | |
| 肺部感染(例,%) | 20(41.67) | - | |
| 腹部感染(例,%) | 12(25.00) | - | |
| 泌尿系统感染(例,%) | 9(18.75) | - | |
| 多部位感染(例,%) | 7(14.58) | - | |
| 使用呼吸机(例,%) | 17(35.42) | - | |
| 注:APACHE Ⅱ评分为急性生理学与慢性健康状况评分;与健康对照组比较,aP < 0.05 | |||
与健康对照组相比,脓毒症患者各时间点(1、3、7 d)外周血CD19+B淋巴细胞百分比计数水平均明显下调,差异具有统计学意义,且随着时间推移,呈现下降趋势(表 2);脓毒症患者确诊后第7天,存活组CD19+B淋巴细胞的百分比计数是明显高于死亡组的,差异具有统计学意义。脓毒症患者确诊后第3、7天外周血中记忆B细胞(CD19+CD27+)数量和比例较健康对照组显著上升,差异具有统计学意义;而死亡组CD19+CD27+的百分比计数较存活组低,差异具有统计学意义(P < 0.05)(表 2)。
| 项目 | 脓毒症组 | 健康对照组 | 存活组 | 死亡组 |
| CD19+ Bcells(%)第1天 | 9.63±5.32a | 14.14±8.35 | 10.06±5.08 | 8.97±5.76 |
| CD19+ Bcells(%)第3天 | 8.99±6.98a | 14.14±8.35 | 9.50±6.58 | 7.99±7.93 |
| CD19+ Bcells(%)第7天 | 7.62±6.81a | 14.14±8.35 | 9.30±7.47b | 3.90±2.68 |
| CD19+ CD27+ Bcells(%)第1天 | 28.27±12.17 | 30.05±8.99 | 31.11±11.00b | 23.48±12.89 |
| CD19+ CD27+ Bcells(%)第3天 | 35.96±14.66a | 30.05±8.99 | 39.39±11.85b | 28.29±16.41 |
| CD19+ CD27+ Bcells(%)第7天 | 48.74±20.28a | 30.05±8.99 | 55.27±13.86b | 34.22±25.29 |
| 注:脓毒症组vs健康对照组,aP < 0.05;存活组vs死亡组,bP < 0.05 | ||||
脓毒症组在确诊后第1、3、7天外周血CD19+B淋巴细胞上EZH2表达的阳性率及平均荧光强度、CD19+CD27+B淋巴细胞上EZH2表达的阳性率较健康对照组均显著增加(见图 1),并且差异均具有统计学意义(P < 0.05)。脓毒症组CD19+B细胞、CD19+CD27+B细胞上EZH2阳性率随着住院天数的延长阳性率计数增加,差异均具有统计学意义(P < 0.05);CD19+B淋巴细胞上EZH2表达的平均荧光强度第7天明显高于第1、3天,差异具有统计学意义(P < 0.05)。
2.4 不同预后的脓毒症患者CD19+B细胞及CD19+CD27+B细胞上EZH2表达的比较死亡组第1天CD19+B细胞上EZH2的阳性率较存活组显著升高,死亡与存活组第3、7天CD19+B细胞上EZH2的阳性率的无明显差异;死亡组与存活组第1、3、7天CD19+ B细胞上EZH2的平均荧光强度的差异无统计学意义;存活组第3、7天CD19+CD27+B细胞上EZH2的表达明显高于死亡组,差异具有统计学意义(表 3)。
| 项目 | 存活组(n=30) | 死亡组(n=18) | P值 |
| EZH2+/CD19+ B细胞第1天(%) | 4.84±5.16a | 9.81±4.72 | 0.002 |
| EZH2+/CD19+ B细胞第3天(%) | 9.13±7.86 | 5.99±3.71 | 0.200 |
| EZH2+/CD19+ B细胞第7天(%) | 26.55±14.47 | 23.21±27.85 | 0.672 |
| EZH2 on CD19+B第1天平均荧光强度 | 41.27±32.68 | 42.55±9.78 | 0.880 |
| EZH2 on CD19+B第3天平均荧光强度 | 49.44±27.94 | 52.48±15.54 | 0.729 |
| EZH2 on CD19+B第7天平均荧光强度 | 76.01±23.46 | 82.82±42.77 | 0.582 |
| EZH2+/CD19+CD27+ B细胞第1天(%) | 1.79±2.73 | 1.73±1.76 | 0.938 |
| EZH2+/CD19+CD27+ B细胞第3天(%) | 4.95±5.07a | 1.44±1.18 | 0.024 |
| EZH2+/CD19+CD27+ B细胞第7天(%) | 14.52±9.45a | 7.11±7.74 | 0.049 |
| 注:死亡组vs存活组比较,aP < 0.05 | |||
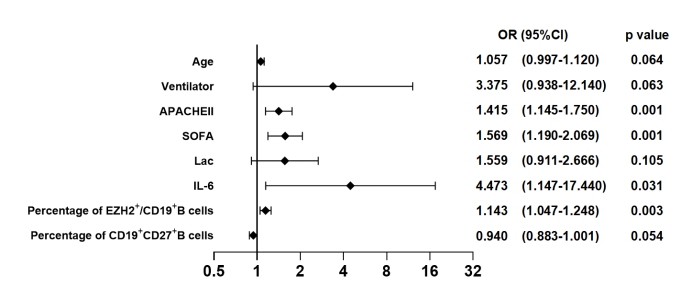
脓毒症组28 d死亡危险因素的多因素logistic回归分析提示,脓毒症患者第1天指标中APACHEⅡ评分、SOFA评分、CD19+B淋巴细胞上EZH2阳性率、IL-6(图 2)为其独立危险因素(P < 0.05);患者年龄、是否使用呼吸机、早期乳酸、早期CD19+CD27+细胞的百分比计数与患者28 d预后无关(P > 0.05)。
|
| 图 2 脓毒症患者28d死亡危险因素的森林图 Fig 2 Forest map of 28-day mortality risk factors for septic patients |
|
|
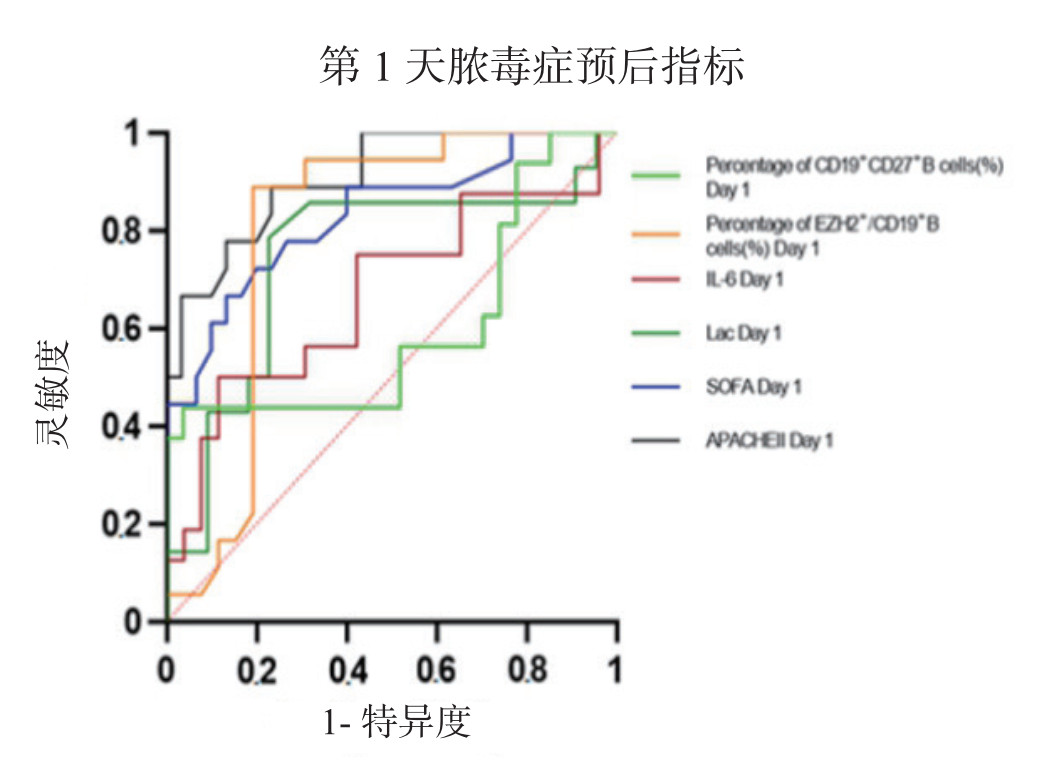
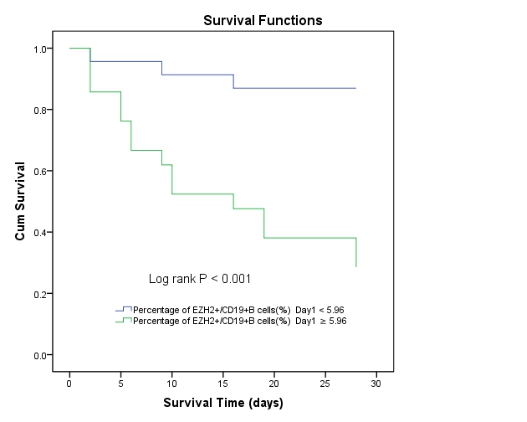
结合ROC曲线(图 3, 表 4),APACHE II评分的AUC为0.907(95%CI: 0.825~0.990),灵敏度分别为88.89%,特异度为76.67%;SOFA评分的AUC为0.831(95%CI: 0.706~0.955),灵敏度分别为66.67%,特异度为86.67%;CD19+B淋巴细胞上EZH2阳性率的AUC为0.799(95%CI: 0.657~0.941), 灵敏度分别为88.89%,特异度为80.77%,灵敏度优于SOFA评分,特异度高于APACHE Ⅱ评分;根据ROC曲线所确定的截断值,以CD19+B淋巴细胞上EZH2阳性率达到5.96为临界点,绘制生存死亡曲线,CD19+B淋巴细胞上EZH2阳性率高于5.96%的患者在第28天的生存概率明显降低(P < 0.01)(图 4),阳性预测率是71.4%,阴性预测值是87%。以脓毒症患者第1天CD19+B淋巴细胞上EZH2阳性率5.96%作为临界值,将脓毒症组划分≥5.96组和 < 5.96组,建立预后预测模型(表 5),≥5.96组的APACHEⅡ评分(第1、3、7天)、SOFA评分(第1、3天)显著高于 < 5.96组,差异均具有统计学意义(P < 0.05)。≥5.96组28 d生存人数、生存时间低于 < 5.96组,差异均具有统计学意义(P < 0.05)。脓毒症组乳酸(第3、7天)均为≥5.96组明显高于 < 5.96组,差异均具有统计学意义(P < 0.05)。
|
| 图 3 预测脓毒症患者28 d死亡的ROC曲线分析 Fig 3 ROC curve analysis for predicting 28-day mortality in septic patients |
|
|
| 项目(第1天) | AUC | 95%CI | 灵敏度 | 特异度 | 截断值 | P值 |
| APACHE II(分) | 0.907 | 0.825~0.990 | 88.89 | 76.67 | 16.49 | < 0.01 |
| SOFA(分) | 0.831 | 0.706~0.955 | 66.67 | 86.67 | 7.50 | 0.001 |
| 乳酸(mmol/L) | 0.744 | 0.561~0.926 | 78.57 | 77.27 | 2.13 | 0.015 |
| IL-6 (pg/mL) | 0.668 | 0.488~0.848 | 50.00 | 88.46 | 2.36 | 0.070 |
| EZH2+/CD19+B细胞(%) | 0.799 | 0.657~0.941 | 88.89 | 80.77 | 5.96 | 0.001 |
| CD19+CD27+B细胞(%) | 0.599 | 0.404~0.795 | 43.75 | 96.3 | 16.25 | 0.280 |
|
| 图 4 根据CD19+B淋巴细胞上EZH2百分比绘制脓毒症患者生存曲线 Fig 4 Survival curves of septic patients according to the percentage of EZH2 on CD19+B lymphocytes |
|
|
| 项目 | EZH2+/CD19+B细胞(%) Day1 < 5.96 | EZH2+/CD19+B细胞(%) Day1 ≥5.96 | P值 |
| APACHEⅡ第1天[分, M(QL, QU)] | 17.00(9.00, 20.50) | 21.09(19.00, 22.00) | < 0.01 |
| APACHEⅡ第3天[分, M(QL, QU)] | 10.00(3.50, 10.50) | 22.00(17.00, 35.00) | < 0.01 |
| APACHEⅡ第7天[分, M(QL, QU)] | 6.00(3.50, 7.50) | 24.00(15.00, 27.00) | < 0.01 |
| SOFA第1天[分, M(QL, QU)] | 5.00(3.50, 8.50) | 8.00(3.00, 13.00) | 0.005 |
| SOFA第3天[分, M(QL, QU)] | 5.00(3.50, 8.00) | 9.00(3.00, 20.00) | 0.006 |
| SOFA第7天[分, M(QL, QU)] | 4.00(0.97, 7.05) | 16.00(5.00, 21.00) | 0.109 |
| 生存人数(例,%) | 20(87.00) | 6(28.6) | < 0.01 |
| 存活时间[d, M(QL, QU)] | 28.00(28.00, 28.00) | 19.00(10.00, 28.00) | 0.001 |
| ICU住院时间[d, M(QL, QU)] | 15.00(5.00, 16.00) | 17.00(10.00, 28.00) | 0.556 |
| 乳酸第1天[mmol/L,M(QL, QU)] | 1.85(1.52, 3.30) | 3.07(2.40, 8.90) | 0.286 |
| 乳酸第3天[mmol/L,M(QL, QU)] | 0.78(0.62, 1.52) | 2.98(1.00, 9.90) | 0.002 |
| 乳酸第7天[mmol/L,M(QL, QU)] | 0.90(0.69, 1.02) | 3.11(1.62, 4.10) | 0.001 |
| IL-6第1天[pg/mL,M(QL, QU)] | 2.17(2.03, 2.21) | 2.10(0.85, 2.41) | 0.482 |
| IL-6第3天[pg/mL,M(QL, QU)] | 1.75(0.46, 1.92) | 2.09(1.13, 2.41) | 0.030 |
| IL-6第7天[pg/mL,M(QL, QU)] | 1.55(1.09, 2.31) | 2.41(1.05, 3.70) | 0.333 |
脓毒症本质上是一种免疫失衡性疾病,抗炎反应的持续存在引起患者免疫抑制,免疫细胞可出现程序性死亡,由此导致总淋巴细胞计数减少,CD4+T细胞、CD8+T细胞以及B细胞等获得性免疫细胞的凋亡增加,使机体清除病原体能力下降,导致脓毒症患者易继发感染继而增加死亡风险[4, 14]。
B细胞通过产生抗体、细胞因子和抗原递呈在免疫调控过程中发挥重要作用。B细胞,特别是记忆B细胞和抗体分泌细胞,是连接先天和适应性免疫应答之间的桥梁[15],免疫应答紊乱是脓毒症患者后期继发感染并导致死亡的重要原因[2]。因此,B细胞绝对数量减少可能在脓毒症的预后中发挥重要作用。既往研究表明,脓毒症患者B细胞的数量显著减少提示死亡风险高[16-18],主要是B细胞凋亡导致,也可能与B细胞成熟障碍有关[19]。本研究显示脓毒症患者外周血CD19+B淋巴细胞计数较健康对照组明显下调,且随着住院时间延长进一步降低,死亡组计数明显低于存活组,这与Duan[19]等研究一致;研究还发现,B细胞耗竭始于记忆B细胞亚群[11],因此笔者进一步观察脓毒症患者记忆B细胞(CD19+CD27+B)变化,结果发现,脓毒症患者确诊后第3、7天外周血中记忆B细胞(CD19+CD27+B)显著上升,与既往报道一致[20];本研究对比死亡存活组CD19+CD27+B细胞百分比计数变化,发现存活组CD19+CD27+B细胞数目是明显高于死亡组,脓毒症患者CD19+CD27+B细胞数目恢复可能提示脓毒症患者预后良好。
表观遗传参与脓毒症相关基因表达的调控。研究表明,多种表观遗传修饰(如组蛋白修饰、DNA甲基化、染色质重塑、非编码RNA等)均可影响宿主免疫细胞的染色质结构和转录[21]。近年来研究发现,EZH2和H3K27me3在免疫细胞发育和功能中起着至关重要的作用。人和小鼠的生发中心的B细胞中迅速诱导表达EZH2[22-23];抑制EZH2可导致B细胞向浆细胞分化发生改变,与诱导浆细胞成熟相关,并导致免疫球蛋白分泌升高[22]。Zhang等[24]检测了EZH2在系统性红斑狼疮(systemic lupus erythematosus,SLE)患者外周血B细胞中的表达情况,结果发现SLE患者CD19+细胞中EZH2表达水平明显高于正常人,这一发现提示EZH2在免疫功能障碍患者B细胞的功能调控中发挥重要作用。基于此,本研究发现脓毒症组确诊后第1、3、7天外周血CD19+B淋巴细胞上EZH2表达的阳性率和平均荧光强度、CD19+CD27+B淋巴细胞上EZH2表达的阳性率较健康对照组均显著增加,并且差异均具有统计学意义(P < 0.05)。随着住院时间的延长,EZH2在CD19+B淋巴细胞、CD19+CD27+B淋巴细胞上表达水平逐渐增加,这提示EZH2可能参与了脓毒症患者免疫抑制的发生。
为了明确EZH2对于脓毒症患者预后的判断价值,本研究进一步分析了存活组和死亡组之间CD19+B淋巴细胞及CD19+CD27+B细胞亚群EZH2表达的差异,结果显示脓毒症患者死亡组第1天CD19+ B细胞上EZH2的表达明显高于存活组,是预测患者28 d死亡的独立危险因素,死亡的预测效力上灵敏度优于SOFA评分,特异度高于APACHE Ⅱ评分,还有待扩大样本量进一步验证。此外,本研究还发现存活组第3、7天CD19+CD27+B细胞上EZH2的表达明显高于死亡组(P < 0.05),这提示我们不同预后的脓毒症患者免疫调控后期CD19+CD27+B细胞上EZH2的表达之间存在差异,由于CD19+CD27+B细胞可以快速召集抗体对感染产生免疫应答,此时免疫功能尚可的患者CD19+CD27+B细胞数目相对较多,预后相对较好,而存活患者CD19+CD27+B细胞EZH2升高是否与促进CD19+CD27+B细胞募集分泌抗体,控制感染相关及其潜在的可能机制尚待进一步体外实验的功能验证研究探索。
既往研究提示血乳酸水平受多种因素影响,组织缺氧、过量肾上腺素刺激导致糖有氧酵解加速或由肝功能障碍导致的清除率降低均会导致乳酸水平升高[25]。Ryoo等[26]研究指出,脓毒症患者的28 d病死率与6 h的乳酸水平和6 h乳酸清除率相关。一项我国研究显示ICU中脓毒症患者较高的乳酸水平与90 d病死率相关[27],这提示血乳酸变化水平与脓毒症患者预后存在一定的相关性。在本研究中,虽然ROC结果显示早期乳酸水平预测患者28 d死亡存在一定价值(P < 0.05),曲线下面积为0.744,但进一步多因素回归提示早期乳酸升高不是脓毒症患者28 d死亡的独立危险因素,这可能与样本量较小、早期乳酸不能反映动态乳酸清除情况以及受到是否使用血管活性药物等因素影响。脓毒症患者死亡危险因素的多因素回归分析还提示是否使用呼吸机的OR为3.375,其与患者28 d预后无关(P > 0.05),这可能与样本量较小、纳入研究对象包括应用无创呼吸机人数、部分患者家属拒绝患者使用呼吸机等有关,且统计学分析后可信区间范围较大(95%CI: 0.938~12.140),因此差异无统计学意义。故还需要更大样本量的研究,并排除相关干扰因素去进一步判断血乳酸水平及是否应用呼吸机与脓毒症患者预后的相关关系。
综上所述,本研究初步发现了脓毒症患者外周血B淋巴细胞上EZH2上调与脓毒症患者不良预后相关。未来的研究将着眼于通过体内外模型,验证EZH2调控脓毒症B细胞分化和功能的作用及其潜在机制。本研究样本量小,为单中心研究,需要进一步扩大样本量,进行多中心研究进一步验证结论。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who Die of Sepsis and multiple organ failure[J]. JAMA, 2011, 306(23): 2594-2605. DOI:10.1001/jama.2011.1829 |
| [3] | Landelle C, Lepape A, Français A, et al. Nosocomial infection after septic shock among intensive care unit patients[J]. Infect Control Hosp Epidemiol, 2008, 29(11): 1054-1065. DOI:10.1086/591859 |
| [4] | Otto GP, Sossdorf M, Claus RA, et al. The late phase of Sepsis is characterized by an increased microbiological burden and death rate[J]. Crit Care LondEngl, 2011, 15(4): R183. DOI:10.1186/cc10332 |
| [5] | Rimmelé T, Payen D, Cantaluppi V, et al. Immune cell phenotype and function in Sepsis[J]. Shock, 2016, 45(3): 282-291. DOI:10.1097/shk.0000000000000495 |
| [6] | Koppens MA, Bounova G, Gargiulo G, et al. Deletion of polycomb repressive complex 2 from mouse intestine causes loss of stem cells[J]. Gastroenterology, 2016, 151(4): 684-697.e12. DOI:10.1053/j.gastro.2016.06.020 |
| [7] | Italiano A. Role of the EZH2 histone methyltransferase as a therapeutic target in cancer[J]. PharmacolTher, 2016, 165: 26-31. DOI:10.1016/j.pharmthera.2016.05.003 |
| [8] | Zhang Q, Sun H, Zhuang S, et al. Novel pharmacological inhibition of EZH2 attenuates septic shock by altering innate inflammatory responses to Sepsis[J]. Int Immunopharmacol, 2019, 76: 105899. DOI:10.1016/j.intimp.2019.105899 |
| [9] | Zhao D, Li Z, Liu X, et al. Lymphocyte expression of EZH2 is associated with mortality and secondary infectious complications in Sepsis[J]. Int Immunopharmacol, 2020, 89(pt b): 107042. DOI:10.1016/j.intimp.2020.107042 |
| [10] | Shankar-Hari M, Fear D, Lavender P, et al. Activation-associated accelerated apoptosis of memory B cells in critically ill patients with Sepsis[J]. Crit Care Med, 2017, 45(5): 875-882. DOI:10.1097/CCM.0000000000002380 |
| [11] | Torigoe M, Iwata S, Nakayamada S, et al. Metabolic Reprogramming Commits Differentiation of Human CD27IgD B Cells to Plasmablasts or CD27IgD Cells[J]. J immunol, 2017, 199(2): 425-434. DOI:10.4049/jimmunol.1601908 |
| [12] | Tangye SG, Good KL. Human IgM+CD27+B cells: memory B cells or "memory" B cells?[J]. J Immunol, 2007, 179(1): 13-19. DOI:10.4049/jimmunol.179.1.13 |
| [13] | Levy MM, Evans LE, Rhodes A. The surviving Sepsis campaign bundle: 2018 update[J]. Intensive Care Med, 2018, 44(6): 925-928. DOI:10.1007/s00134-018-5085-0 |
| [14] | Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy[J]. Nat Rev Immunol, 2013, 13(12): 862-874. DOI:10.1038/nri3552 |
| [15] | Kelly-Scumpia KM, Scumpia PO, Weinstein JS, et al. B cells enhance early innate immune responses during bacterial Sepsis[J]. J Exp Med, 2011, 208(8): 1673-1682. DOI:10.1084/jem.20101715 |
| [16] | Monserrat J, de Pablo R, Diaz-Martín D, et al. Early alterations of B cells in patients with septic shock[J]. Crit Care, 2013, 17(3): R105. DOI:10.1186/cc12750 |
| [17] | Gogos C, Kotsaki A, Pelekanou A, et al. Early alterations of the innate and adaptive immune statuses in Sepsis according to the type of underlying infection[J]. Crit Care, 2010, 14(3): R96. DOI:10.1186/cc9031 |
| [18] | Venet F, Davin F, Guignant C, et al. Early assessment of leukocyte alterations at diagnosis of septic shock[J]. Shock, 2010, 34(4): 358-363. DOI:10.1097/shk.0b013e3181dc0977 |
| [19] | Duan SX, Jiao YF, Wang JM, et al. Impaired B-cell maturation contributes to reduced B cell numbers and poor prognosis in Sepsis[J]. Shock Augusta Ga, 2020, 54(1): 70-77. DOI:10.1097/SHK.0000000000001478 |
| [20] | Gustave CA, Gossez M, Demaret J, et al. Septic shock shapes B cell response toward an exhausted-like/immunoregulatory profile in patients[J]. J Immunol, 2018, 200(7): 2418-2425. DOI:10.4049/jimmunol.1700929 |
| [21] | Binnie A, Tsang JLY, Hu P, et al. Epigenetics of sepsis[J]. Crit Care Med, 2020, 48(5): 745-756. DOI:10.1097/ccm.0000000000004247 |
| [22] | Herviou L, Jourdan M, Martinez AM, et al. EZH2 is overexpressed in transitional preplasmablasts and is involved in human plasma cell differentiation[J]. Leukemia, 2019, 33(8): 2047-2060. DOI:10.1038/s41375-019-0392-1 |
| [23] | Caganova M, Carrisi C, Varano G, et al. Germinal center dysregulation by histone methyltransferase EZH2 promotes lymphomagenesis[J]. J Clin Investig, 2013, 123(12): 5009-5022. DOI:10.1172/JCI70626 |
| [24] | Zhang M, Iwata S, Hajime M, et al. Methionine commits cells to differentiate into plasmablasts through epigenetic regulation of BTB and CNC homolog 2 by the methyltransferase EZH2[J]. Arthritis Rheumatol, 2020, 72(7): 1143-1153. DOI:10.1002/art.41208 |
| [25] | Levy B. Lactate and shock state: the metabolic view[J]. Curr Opin Crit Care, 2006, 12(4): 315-321. DOI:10.1097/01.ccx.0000235208.77450.15 |
| [26] | Ryoo SM, Lee J, Lee YS, et al. Lactate level versus lactate clearance for predicting mortality in patients with septic shock defined by sepsis-3[J]. Crit Care Med, 2018, 46(6): e489-e495. DOI:10.1097/CCM.0000000000003030 |
| [27] | Xie J, Wang H, Kang Y, et al. Chinese epidemiological study of sepsis (CHESS) study investigators. The epidemiology of sepsis in chinese ICUs: A national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
 2021, Vol. 30
2021, Vol. 30




