缺血后处理是指在心肌发生缺血后,在再灌注之前对缺血心脏进行多次短暂的缺血-再灌注,以减轻心肌损伤的方法[1]。一些经典的阿片类药物(如吗啡)后处理也具有相似的心肌保护作用[2-3]。氢吗啡酮是一种新型的μ-阿片受体激动剂,其镇痛效果比吗啡高5倍,已被证实具有较好的心肌保护作用[4-6]。在再灌注初期给予适量的氢吗啡酮可减轻离体心肌缺血再灌注损伤[5-6],而氢吗啡酮后处理对在体心肌缺血-再灌注损伤的影响及机制尚不清楚。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)/丝氨酸-苏氨酸激酶(serine/threonine kinase, Akt)是细胞内最重要的信号转导途径,在调节细胞凋亡、增殖及存活方面发挥着重要生物学功能[7]。研究表明,PI3K/Akt信号通路的激活在心肌再灌注损伤的保护中起着决定性作用。缺血后处理及多种阿片类药物后处理均可通过激活PI3K/Akt信号途径,减轻心肌细胞凋亡,发挥心肌保护作用[2-3, 8]。因此,本研究拟评价PI3K/Akt信号通路在氢吗啡酮后处理减轻心肌缺血-再灌注细胞凋亡中的作用。
1 材料与方法 1.1 实验动物健康雄性40只Sprague Dawley(SD)大鼠,SPF级,体质量220~250 g,由武汉大学中南医院动物中心提供。动物合格证号:SCXK(鄂)2008-0004。饲养于独立的通风笼系统中,每笼5只。温度(22 ± 2) ℃,湿度(48±5) %,每天光照与黑夜时间各12 h。在实验过程中,建模和取材的操作均在超洁净工作台中进行,专人负责添加饲料,换水和给药。所有动物和实验程序均符合国家卫生研究院《实验动物护理和使用指导原则》(NIH出版物第80-23号),并经武汉大学动物伦理委员会批准。
1.2 主要药物和试剂盐酸氢吗啡酮注射液(批号H20120100)购自湖北宜昌人福药业有限责任公司;渥曼青霉素、2,3,5-三苯基氯化四氮唑(2, 3, 5 - Triphenyltetrazole chloride,TTC)购自美国Sigma公司;末端脱氧核苷酸转移酶介导的缺口末端标记(terminal-deoxynucleoitidyltransferase mediatednick end labeling,TUNEL) 检测试剂盒、ECL化学发光试剂盒购自美国Roche公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所;戊巴比妥钠由上海新亚药业有限公司提供;BCA蛋白测定试剂盒购自碧云天生购自物技术研究所;Bcl-2、Bax、phosphorylated Akt(p-Akt)、GAPDH一抗均购自美国Santa Cruz公司。
1.3 主要仪器DW-2000型小型动物呼吸机(上海嘉鹏科技有限公司);小动物手术器械(深圳市瑞沃德生命科技有限公司);HH-501超级恒温水槽(江苏金坛市成辉仪器厂);SHINESO MF1高速冷冻离心机(美国Beckman公司);MR23i高速多功能冷冻离心机、DU530分光光度计(美国Thermo公司);MDF-U442低温保持箱(日本三洋公司);TS-200B恒温摇床(上海天呈实验仪器制造有限公司)。
1.4 模型制备按参考文献[2]的方法建立心肌缺血-再灌注损伤模型,大鼠腹腔注射1%戊巴比妥钠30 mg/kg麻醉后,行气管切开,接微型呼吸机机械通气(呼吸频率60次/min,潮气量20 mL/kg)。沿胸骨左缘第四肋骨开胸,结扎左冠状动脉前降支,结扎30 min后松开结扎线,再灌注120 min。以结扎后左心室前壁结扎下心肌颜色发绀和运动功能下降,心电图ST段明显抬高和(或)T波高耸作为冠状动脉结扎成功的标准,放松丝线则先前缺血心肌颜色立刻恢复正常,抬高的ST段回落1/2以上标志冠状动脉恢复血液灌注。
1.5 分组及给药40只健康雄性SD大鼠随机(随机数字法)分为5组:①假手术组(Sham组,n=8),打开胸腔,左冠状动脉前降支只穿线不结扎;②缺血-再灌注组(I/R组,n=8),结扎左冠状动脉前降支30 min后再灌注2 h;③缺血-再灌注+氢吗啡酮组(I/R+H组,n=8),再灌注前5 min经股静脉注入氢吗啡酮0.1 mg/kg,其余同I/R组;④缺血-再灌注+PI3K抑制剂组(I/R+W组,n=8),再灌注前5 min经股静脉注入渥曼青霉素15μg/kg,其余同I/R组;⑤缺血-再灌注+氢吗啡酮+PI3K抑制剂组(I/R+H+W组,n=8),于再灌注前5 min经股静脉注入氢吗啡酮0.1 mg/kg及渥曼青霉素15 μg/kg,其余同I/R组。氢吗啡酮、渥曼青霉素的给药剂量参照文献报道[6]及预实验来确定。
1.6 心肌梗死面积的测定再灌注结束时将左冠状动脉前降支重新结扎,经股静脉注射0.5%伊文蓝1.5 mL, 待缺血区显示后迅速取出心脏,用冰冻生理盐水冲洗后剪除心房,-20℃冰冻10 min, 沿左室长轴切成1.0 mm厚的薄片,置于1% TTC溶液中,37℃孵育20 min后,用4%多聚甲醛溶液固定,观察染色结果,非梗死心肌组织为红色,梗死心肌为苍白色。分离各染色区分别进行称重,缺血面积(area at risk,AAR)=危险区心肌重量/左室总重量×100%。梗死面积(infarct size,IS)=梗死区心肌重量/危险区心肌重量×100%。
1.7 血清乳酸脱氢酶(LDH)活性检测再灌注2 h后,经腹主动脉采血,按照LDH试剂盒说明书用RT-6000生化自动分析仪(Rayto公司,美国)测定LDH活性。
1.8 Western blot检测p-Akt(Ser473)、Bcl-2、Bax蛋白表达再灌注结束时,随机取6只大鼠,处死后剪取缺血心尖心肌组织,生理盐水冲洗血液。将心尖缺血心肌组织剪碎,加入裂解液,13 000 g离心30 min,取上清,用BCA蛋白法定蛋白含量。取50 mg胞浆蛋进行聚丙烯酰胺凝胶电泳并转膜于PDVF膜上,5%脱脂牛奶封闭2 h。依次用的兔抗鼠p-Akt(1∶1 000)、兔抗鼠Bcl-2(1∶1 000)、兔抗鼠Bax(1∶1 000)和的GAPDH抗体(1∶10 000),4℃下孵育过夜。取膜用溶液漂洗3次后加入羊抗兔二抗(1∶10 000)摇床孵育2 h。TBST冲洗3次后,滴加新鲜配制的ECL混合溶液,暗室中曝光。采用并使用Image-J软件分析蛋白条带灰度,以目的条带灰度值与GAPDH灰度值的比值反映心肌组织p-Akt、Bcl-2和Bax蛋白表达水平。
1.9 末端脱氧核苷酸转移酶介导的缺口末端标记(TUNEL)法检测心肌细胞凋亡取左心室前壁部分组织,4%多聚甲醛固定,常规石蜡包埋,切片。按常规方法将石蜡切片进行脱蜡水合(二甲苯脱蜡2次,每次10 min,将脱蜡好的切片依次放入100%乙醇、95%乙醇、90%乙醇、80%乙醇、70%乙醇,每次2 min)。切片浸入PBS漂洗3次,每次5 min。吸干切片周围的水分后,将切片加入蛋白酶K工作液,37℃孵育30 min。PBS漂洗3次,每次5 min。在切片上滴加TUNEL检测液,37℃孵育1 h,荧光显微镜下观察拍照。随机选取5个高倍(×200)视野,光镜下分别计数凋亡细胞数和总细胞数,以凋亡细胞数占细胞总数的百分比作为凋亡指数(apoptotic index, AI),AI=凋亡细胞数/心肌细胞总数×100,评价凋亡程度。
1.10 统计学方法采用SPSS 13.0统计软件进行分析,正态分布的计量资料以均数±标准差(Mean±SD)表示,组间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
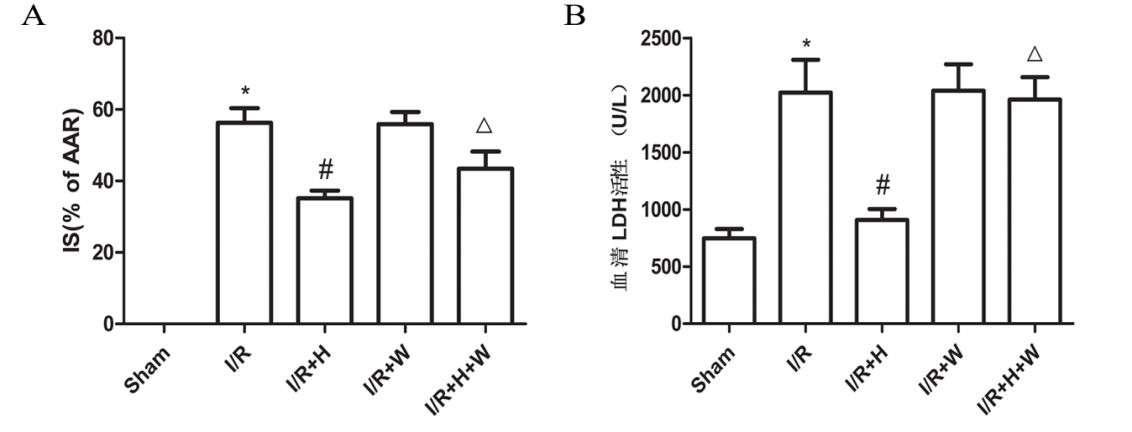
2 结果 2.1 心肌梗死面积的比较与Sham组相比,I/R组心肌梗死面积显著增加(P < 0.05);与I/R组相比,I/R+H组心肌梗死面积显著缩小(P < 0.05);与I/R+H组相比,I/R+H+W组心肌梗死面积显著增大(P < 0.05)。而I/R+W组与I/R组相比心肌梗死面积差异无统计学意义(图 1A)。
|
| 与Sham组比较,aP < 0.05;与I/R组比较,bP < 0.05;与I/R+H组比较,cP < 0.05 图 1 五组大鼠心肌梗死面积、血清LDH活性的比较(n=8) Fig 1 Comparison of the area of myocardial infarction and serum LDH leakage among the five groups (n=8) |
|
|
与Sham组相比,I/R组血清LDH活性明显增高(P < 0.05);与I/R组相比,I/R+H组血清LDH活性显著降低(P < 0.05);与I/R+H组相比,H/R+H+W组组血清LDH活性显著升高(P < 0.05)。而I/R+W组与I/R组相比血清LDH活性差异无统计学意义(图 1B)。
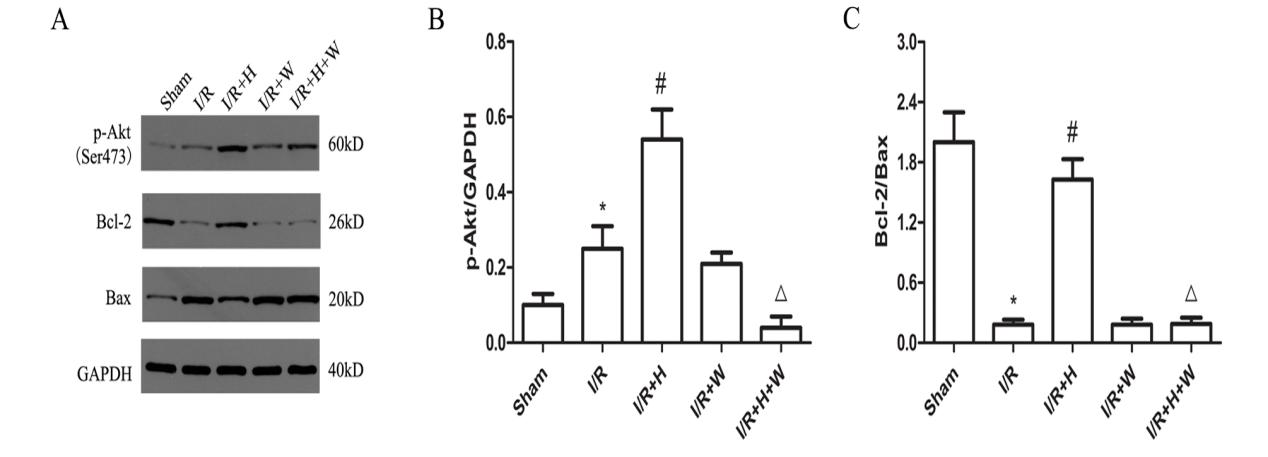
2.3 心肌组织p-Akt(Ser473)、Bcl-2、Bax蛋白的表达与Sham组比较,I/R组p-Akt表达和Bax表达上调,Bcl-2表达下调,Bcl-2/Bax降低(P < 0.05);与I/R组比较,I/R+H组p-Akt及Bcl-2表达上调,Bax表达下调,Bcl-2/Bax升高(P < 0.05);与I/R+H组比较,I/R+H+W组p-Akt表达和Bax表达上调,Bcl-2表达下调,Bcl-2/Bax降低(P < 0.05);而I/R+W组与I/R组相比p-Akt、Bcl-2、Bax表达差异无统计学意义(图 2)。
|
| 与Sham组比较,aP < 0.05;与I/R组比较,bP < 0.05;与I/R+H组比较,cP < 0.05 图 2 五组大鼠心肌p-Akt(Ser473)、Bcl-2、Bax蛋白表达比较(n=8) Fig 2 Comparison of p-Akt (Ser473), Bcl-2 and Bax protein expression in myocardium tissues among the five groups (n=8) |
|
|
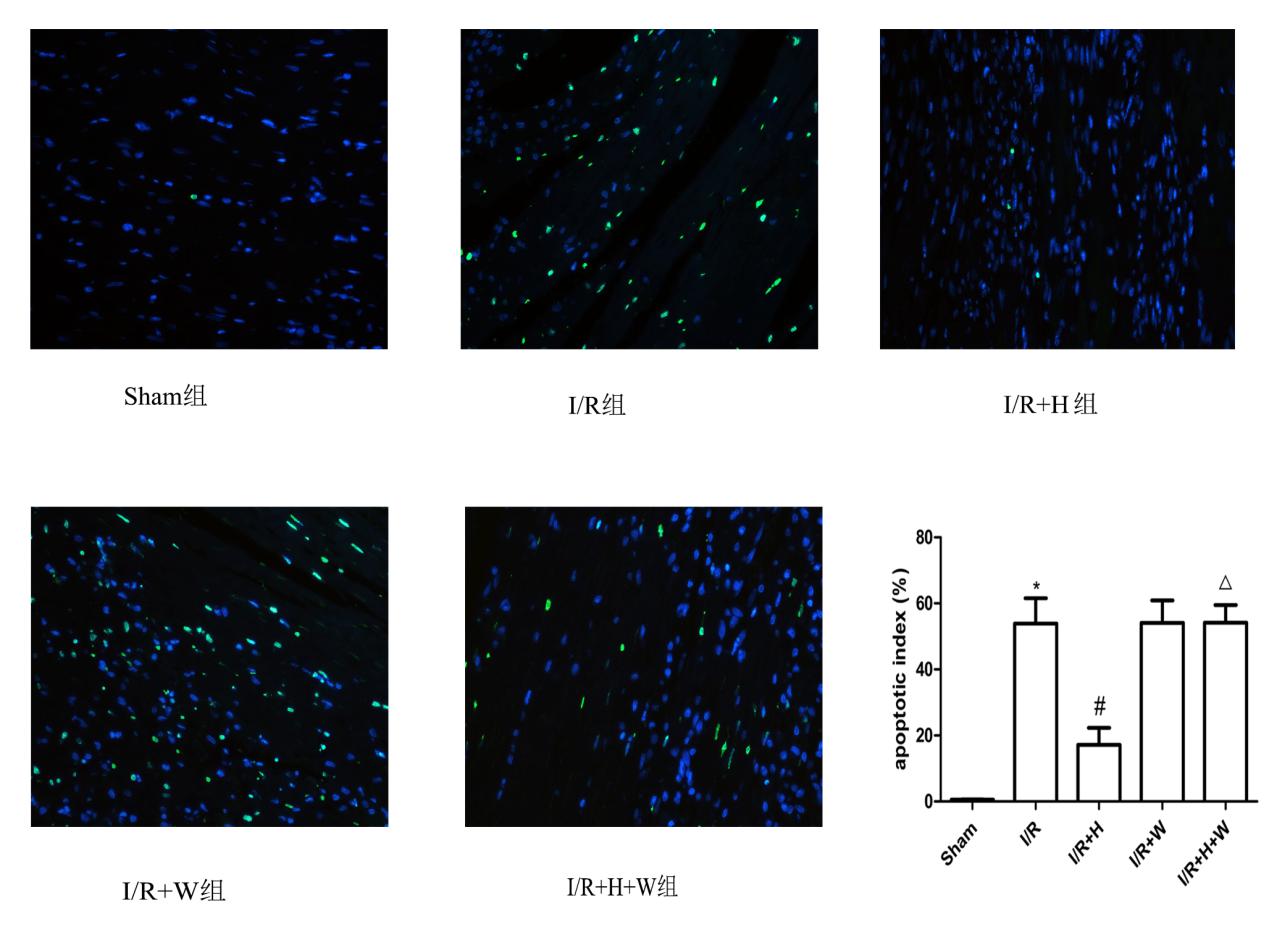
与组相比,I/R组心肌细胞凋亡指数显著增高(P < 0.05);与I/R组相比,I/R+H组心肌细胞凋亡指数显著降低(P < 0.05);与I/R+H组比较,I/R+H+W组心肌细胞凋亡指数显著增高(P < 0.05)。而I/R+W组与I/R组相比心肌细胞凋亡差异无统计学意义(图 3)。
|
| 与Sham组比较,aP < 0.05;与I/R组比较,bP < 0.05;与I/R+H组比较,cP < 0.05 图 3 五组大鼠心肌细胞凋亡指数的比较(×200,n=8) Fig 3 Comparison of cardiomyocyte apoptosis index among the five groups (original magnification×200, n=8) |
|
|
心肌缺血-再灌注损伤是临床常见的病理生理现象。大鼠因其冠状动脉侧枝少,来源广、价格低廉而成为复制心肌缺血-再灌注损伤常用的实验动物。心肌梗死面积是评价心肌损伤严重程度的最直接指标。本研究参照文献[2]中的方法建立心肌缺血-再灌注损伤模型,结果表明,与Sham组比较,I/R组心肌梗死面积增加。心肌酶是反映心肌损伤的血清标准,LDH是常见心肌损伤酶。与Sham组相比,缺血-再灌注组血清LDH的释放明显增多。这些结果提示大鼠心肌缺血-再灌注损伤模型制备成功。
细胞凋亡是心肌缺血-再灌注损伤发病机制中的重要环节之一。心肌细胞凋亡程度决定心肌梗死和心功能障碍程度,而抑制细胞凋亡可明显减轻心肌缺血-再灌注损伤[9]。氢吗啡酮是一种新型μ-阿片受体激动剂,具有起效快、镇痛作用强、不良反应少等优点。既往对氢吗啡酮心肌保护方面的研究表明,氢吗啡酮后处理有助于维持离体心肌缺血-再灌注时的电生理稳定性,抑制心律失常的发生,改善左室功能,其心肌保护机制与抑制再灌注初期线粒体膜转运孔开放有关[5-6]。本研究参照文献[6]及预实验结果选择氢吗啡酮的给药剂量,本研究结果表明,与I/R组比较,I/R+H组心肌梗死面积和心肌细胞凋亡降低,I/R+W组上述指标无差异,提示氢吗啡酮后处理可减轻大鼠心肌缺血-再灌注损伤和凋亡,与上述文献报道一致。
Bcl-2蛋白家族促凋亡蛋白(Bax、Bid和Bak)和抗凋亡蛋白(Bcl-2和Bcl-xL)之间的平衡在启动内源性凋亡通路中起着重要的作用。Bcl-2/Bax比值增高促进细胞存活,Bcl-2/Bax比值降低促进细胞凋亡[9-10]。既往研究表明,阿片类药物后处理可通过调节Bcl-2、Bax蛋白表达发挥抗凋亡作用[3]。在本实验中,缺血-再灌注后,Bcl-2蛋白表达减少,Bax蛋白表达增多,Bcl-2/Bax比率降低,而氢吗啡酮后处理可增加Bcl-2表达,抑制Bax表达,提高Bcl-2/Bax比率,更一步提示氢吗啡酮后处理可减缺血-再灌注引起的心肌细胞凋亡。
PI3K是细胞内重要的信号转导分子,PI3K激活可使膜磷酸肌醇磷酸化生成生成3, 4二磷酸磷脂酰肌醇(PI3, 4P2)、3, 4, 5-三磷脂酰肌醇(PI3, 4, 5P3),它们均可作为第二信使在细胞中传递并介导PI3K的多种细胞功能[7, 11]。Chiari等[12]在兔在体心肌缺血-再灌注实验模型上发现,给予PI3K抑制剂渥曼青霉素后,缺血后处理和异氟烷后处理的心肌保护作用均丧失。Weihrauch等[13]研究发现,吗啡可以通过激活PI3K/Akt信号通路促进异氟烷后处理的抗心肌细胞凋亡作用。Wu等[3]在大鼠心肌缺血/再灌模型中也发现,在再灌注初期应用舒芬太尼可减轻心肌损伤抑制心肌细胞凋亡,而给予渥曼青霉素后,舒芬太尼后处理的心肌保护作用均明显减弱。提示缺血后处理和阿片类药后处理均可通过激活PI3K信号途径发挥保护作用。据报道,活化的PI3K可通过诱导Akt的磷酸化而发挥作用。Akt是一种丝氨酸/苏氨酸蛋白激酶,它是PI3K最主要的靶酶。当PI3K途径中当上游信号刺激细胞膜表面时,在磷脂酰肌醇依赖的蛋白激酶的帮助下,PI3, 4P2和PI3, 4, 5P3可与Akt结合,导致Akt从胞浆转位到质膜,并促进Akt磷酸化,进而激活Akt[14-15]。Akt由N-末端PH结构域、中间区催化结构域、C-末端调节域三部分组成。位于调节域C末端的Ser473位点的磷酸化是使Akt达到完全激活的必要条件。激活的Akt主要通过Bad蛋白(Bcl-2蛋白家族成员之一)、caspase-3、糖原合成酶发挥广泛的生物学效应,包括抗凋亡,促细胞生存等[14-15]。本研究结果显示,与Sham组比较,I/R组p-Akt表达增高,提示机体内在自我保护机制被激活。而且给予氢吗啡酮处理后,心肌组织p-Akt活性进一步增加,抗凋亡蛋白Bcl-2表达增高,促凋亡蛋白Bax表达减少,Bcl-2/Bax比值降低,心肌细胞凋亡减少,提示氢吗啡酮后处理抗凋亡作用与Akt激活有关。然而,预先加入PI3K/Akt特异性抑制剂后,氢吗啡酮后处理的保护作用明显受到抑制,提示氢吗啡酮后处理可通过激活PI3K/Akt信号通路发挥心肌保护作用。
综上所述,氢吗啡酮后处理可减轻心肌缺血-再灌注引起的心肌细胞凋进而减轻心肌损伤,其机制可能是通过激活PI3K/Akt信号通路实现的。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Steppan J, Berkowitz DE, Nyhan D. Ischemic postconditioning and milrinone[J]. J Cardiothorac Vasc Anesth, 2018, 32(5): 2149-2151. DOI:10.1053/j.jvca.2018.01.047 |
| [2] | Chen ZL, Liu RS, Niu QX, et al. Morphine postconditioning alleviates autophage in ischemia-reperfusion induced cardiac injury through up-regulating lncRNAUCA1[J]. Biomedecine Pharmacother, 2018, 108: 1357-1364. DOI:10.1016/j.biopha.2018.09.119 |
| [3] | Wu QL, Shen T, Ma H, et al. Sufentanilpostconditioning protects the myocardium from ischemia-reperfusion via PI3K/Akt-GSK-3β pathway[J]. J Surg Res, 2012, 178(2): 563-570. DOI:10.1016/j.jss.2012.05.081 |
| [4] | Mazer-Amirshahi M, Motov S, Nelson LS. Hydromorphone use for acute pain: Misconceptions, controversies, and risks[J]. J Opioid Manag, 2018, 14(1): 61-71. DOI:10.5055/jom.2018.0430 |
| [5] | 易菁, 高鸿, 段宏伟, 等. 氢吗啡酮后处理对大鼠离体心脏缺血再灌注时电生理稳定性的影响[J]. 中华麻醉学杂志, 2017, 37(9): 1113-1117. DOI:10.3760/cma.j.issn.0254-1416.2017.09.021 |
| [6] | 邱柳基, 麦婧雯, 罗德兴, 等. 氢吗啡酮后处理对大鼠心肌缺血再灌注损伤的保护作用及机制[J]. 中国临床药理学杂志, 2020, 36(6): 621-623. DOI:10.13699/j.cnki.1001-6821.2020.06.008 |
| [7] | Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296(5573): 1655-1657. DOI:10.1126/science.296.5573.1655 |
| [8] | Hausenloy DJ, Yellon DM. New directions for protecting the heart against ischaemia-reperfusion injury: targeting the Reperfusion Injury Salvage Kinase (RISK)-pathway[J]. Cardiovasc Res, 2004, 61(3): 448-460. DOI:10.1016/j.cardiores.2003.09.024 |
| [9] | Han X, Shi H, Liu K, et al. Protective effect of gastrodin on myocardial ischemia-reperfusion injury and the expression of Bax and Bcl-2[J]. ExpTher Med, 2019, 17(6): 4389-4394. DOI:10.3892/etm.2019.7512 |
| [10] | Schenk RL, Strasser A, Dewson G. BCL-2: Long and winding path from discovery to therapeutic target[J]. Biochem Biophys Res Commun, 2017, 482(3): 459-469. DOI:10.1016/j.bbrc.2016.10.100 |
| [11] | Fruman DA, Chiu H, Hopkins BD, et al. The PI3K pathway in human disease[J]. Cell, 2017, 170(4): 605-635. DOI:10.1016/j.cell.2017.07.029 |
| [12] | Chiari PC, Bienengraeber MW, Pagel PS, et al. Isoflurane protects against myocardial infarction during early reperfusion by activation of phosphatidylinositol-3-kinase signal transduction: evidence for anesthetic-induced postconditioning in rabbits[J]. Anesthesiology, 2005, 102(1): 102-109. DOI:10.1097/00000542-200501000-00018 |
| [13] | WeihrauchD, KrolikowskiJG, Bienengraeber M, et al. Morphine enhances isoflurane-induced postconditioning against myocardial infarction: the role of phosphatidylinositol-3-kinase and opioid receptors in rabbits[J]. Anesth Analg, 2005, 101(4): 942-949. DOI:10.1213/01.ane.0000171931.08371.a2 |
| [14] | Thapa N, Chen M, Horn HT, et al. Phosphatidylinositol-3-OH kinase signalling is spatially organized at endosomal compartments by microtubule-associated protein 4[J]. Nat Cell Biol, 2020, 22(11): 1357-1370. DOI:10.1038/s41556-020-00596-4 |
| [15] | Abeyrathna P, Su YC. The critical role of Akt in cardiovascular function[J]. Vascul Pharmacol, 2015, 74: 38-48. DOI:10.1016/j.vph.2015.05.008 |
 2021, Vol. 30
2021, Vol. 30




