2. 武警特色医学中心呼吸与重症医学科,天津 300162
2. Department of Respiratory and Critical Care Medicine, Characteristic Medical Center of Chinese People's Armed Police Force, Tianjin 300162, China
危重病患者只有50%对液体治疗有反应[1-3];而无论是液体复苏不足[4],还是容量过度均可导致患者不良预后[5-6]。因此如何精准实施液体治疗,预测患者液体反应性(fluid responsiveness, FR),是重症医学的研究重点[7-8]。脉搏压力变异度(pulse pressure variation, ΔPP)由于其测量简单,准确性较高,被临床广泛应用于机械通气患者[9-10]。但对于自主呼吸的患者ΔPP的预测价值较低[3, 5, 11],主要是由于自主呼吸时的潮气量(tidal volume, Vt)、胸腔内压力周期性变化(ΔPpl)较低无法产生足够的心脏前负荷改变,因此即使在液体反应者每搏输出量(stroke volume, SV)的周期性变化也较低,从而出现预测的假阴性。有学者提出,如果采用较慢、较深的呼吸模式,通过较大的Vt而使SV的周期性变化增加,从而增加ΔPP预测FR的能力[12];但是临床研究结果显示无论是ΔPP预测FR的受试者工作特征(receiver operating characteristic, ROC)曲线下面积还是最佳截断值均有较大差异[12-14];主要原因是对于深吸气的Vt(Vt during deep inspiration, VtDI)缺乏有效的质量控制,笔者推测:以VtDI对深吸气时的ΔPP(ΔPPDI)进行校正,将进一步提高ΔPPDI预测FR的能力,降低其预测能力在不同人群的变异性。本研究主要目的是研究在完全自主呼吸的脓毒症患者中VtDI对ΔPPDI的影响,并且确定ΔPPDI以及ΔPPDI/VtDI预测FR的能力。
1 资料与方法 1.1 一般资料选择2017年10月至2019年10月收入武警特色医学中心和南京市高淳人民医院ICU的脓毒症和脓毒性休克患者。纳入标准:(1)患者符合脓毒症和脓毒性休克的诊断标准[15];(2)经治医生认为患者需要进行液体治疗;(3)自主呼吸未机械通气患者;(4)需要放置中心静脉导管和股动脉PiCCO导管。排除标准:(1)心律失常(包括房颤或频发性室性期前收缩);(2)经治医生认为液体负荷试验可能加重患者病情;(3)急性哮喘急性发作或者慢性阻塞性肺疾病急性发作或者辅助呼吸肌使用;(4)呼吸频率超过30次/min;(5)无法完成深吸气动作。
本研究获所在医院伦理委员会批准[南京市高淳人民医院伦理委员会,批准号:高人医伦【2019】2019049;武警后勤学院附属医院科研科,批准号:伦审(2017)第81号]。所有入选对象签署知情同意书。
1.2 方法 1.2.1 试验流程本研究系前瞻性观察研究。入选患者在平静呼吸下进行如下参数测量:心率、潮气量(VtTB)、平均动脉压(mean arterial pressure, MAP)、中心静脉压、SV、心输出量(cardiac output, CO)、心指数(cardiac index, CI)、ΔPP(ΔPPTB)。10 min后进入深吸气(deep inspiration, DI)模式:让患者采取缓慢的用力深吸气而后被动呼气(慢肺活量检查程序),呼吸频率8次/min(患者吸气、呼气的开始使用音频信号控制),测量VtDI(L)、ΔPPDI(%),取3次测量的平均数。最后进行液体负荷试验:20 min内静脉输注500 mL生理盐水[16],计算给予负荷试验前后患者SV的变化率(ΔSV),ΔSV=(负荷试验后SV -负荷试验前SV)×100/负荷试验前SV;如果ΔSV≥15%,称为液体反应性阳性(简称反应组),否则为液体反应性阴性(简称无反应组)[3, 16]。
1.2.2 主要参数测量所有患者进行颈内静脉或者锁骨下静脉放置中心静脉导管,桡动脉置管以及股动脉内放置热敏股动脉导管,然后连接到监护仪(IntelliVue MP50, Philips, Boeblingen Germany)进行中心静脉压、MAP的持续监测。CO、SV的数值由热稀释法获得,ΔPP利用动脉脉搏轮廓分析技术由监护仪直接显示;Vt的测量采用便携型肺功能仪(HI-801, CHEST, Tokyo, Japan)。所有参数均取3次测量结果的平均数。整个研究过程中所有患者均接受心电、心率的持续监测。
1.2.3 结果变量以及研究终点的确定结果变量为FR,液体负荷实验后ΔSV≥15%定义为FR阳性,否则为FR阴性。实施液体负荷试验后试验中止。
1.3 统计学方法所有统计学分析采用SPSS 21.0.0及R软件包3.6.1进行。服从正态分布的计量资料使用均数±标准差(Mean±SD)表示,组间比较采用独立样本t检验;偏态分布的计量资料则用中位数(四分位数)表示,并采用秩和检验进行组间比较。计数资料用频数及百分率表示,组间差异检验采用χ2或Fisher确切概率法。ΔPPDI与VtDI参数间进行Pearson相关性分析,并采用多元线性回归分析ΔPPDI的影响因素。通过ROC曲线下面积(AUC)及95%CI评估FR预测准确性,采用DeLong非参数法比较组间AUC,并根据最佳截断值计算灵敏度、特异度、阳性预测值和阴性预测值。使用两步法确定参数灰区范围进一步评估参数预测能力,该法将为每个参数确定两个截断值,参数测量值落入该区间则FR的诊断不确定。第一步是在1 000个bootstrap样本中分别确定预测参数的最佳阈值,这1 000个最佳阈值的95%CI定义为第一个灰区。第二步是确定灵敏度、特异度均 < 90%的参数界值点范围,该范围定义为第二个灰区。两步所确定的灰区范围最大者作为最终的灰区范围。对于不同的患者,参数预测FR的假阳性和假阴性的后果是不同的,本研究基于误分类代价比的概念,使用Cost Ratio(R)来量化,R=假阳性的代价/假阴性的代价,计算不同R值时灰区范围的变化情况。所有检验均为双侧检验,以P < 0.05为差异有统计学意义。
2 结果共38例研究对象,其中武警特色医学中心20例,南京市高淳人民医院18例。7例被排除,原因是辅助呼吸肌的使用(n=4)、呼吸频率超过30次/min或无法完成深吸气(n=3);最终纳入31例,17例(54.8%)为液体反应组,14例(45.2%)为液体无反应组。
2.1 液体反应组和无反应组临床、血流动力学指标的比较液体反应组和无反应组临床、血流动力学指标比较发现,两组年龄、性别、理想体质量、升压药物使用、心率、MAP、CI、呼吸频率、VtTB、ΔPPTB、VtDI差异无统计学意义(均P > 0.05);液体反应组SV显著低于无反应组(P=0.04),而ΔPPDI显著高于无反应组(P=0.001),见表 1。
| 指标 | 液体反应组(n=17) | 液体无反应组(n=14) | t值 | P值 |
| 年龄(岁) | 52.4±17 | 58±12.1 | 0.99 | 0.33 |
| 男性(例,%) | 13 (76.5) | 10 (71.4) | - | 1 |
| 理想体质量(kg) | 66±8 | 68±7 | 0.59 | 0.56 |
| 升压药物使用(例,%) | 6 (35.3) | 8 (57.1) | - | 0.29 |
| 心率(次/min) | 94±19 | 89±12 | -0.80 | 0.43 |
| 平均动脉压(mmHg) | 82±10 | 84±8 | 0.50 | 0.62 |
| 基础心指数[L/(min·m2)] | 3.4±1.1 | 3.9±1.2 | 1.36 | 0.18 |
| 基础每搏输出量(mL) | 65±17 | 81±25 | 2.13 | 0.04 |
| 呼吸频率(次/min) | 19±6 | 18±6 | -0.15 | 0.88 |
| VtTB (mL/kg理想体质量) | 7.2±0.9 | 7.5±0.9 | 0.80 | 0.43 |
| VtDI (mL/kg理想体质量) | 15.6±3.7 | 15.8±3.9 | 0.15 | 0.88 |
| ΔPPTB (%) | 6.0±1.7 | 5.0±1.6 | -0.79 | 0.43 |
| ΔPPDI (%) | 19.1±7.4 | 11.2±4.5 | -3.51 | 0.001 |
| 注:ΔPPTB,平静呼吸脉搏压力变异度;ΔPPDI,深吸气时脉搏压力变异度;VtTB,平静呼吸潮气量;VtDI,深吸气时潮气量,1 mmHg=0.133 kPa | ||||
Pearson相关性分析发现ΔPPDI和VtDI呈正相关,相关系数为0.513(P=0.003);进一步以ΔPPDI为因变量,VtDI和ΔSV为解释变量的多元回归分析发现,构建的多重线性回归模型具有统计学意义(F=52.928,P < 0.01),因变量ΔPPDI变异的78%可由VtDI和ΔSV来解释(校正的R2=78%),VtDI和ΔSV变量的偏回归系数β分别为0.83(95%CI:0.48~1.19,P < 0.01)和0.26(95%CI:0.20~0.33,P < 0.01),见图 1。
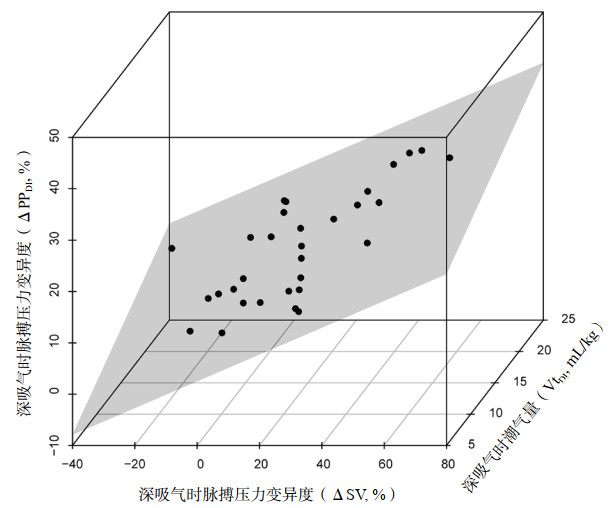
|
| 图 1 深吸气时脉搏压力变异度(ΔPPDI)的多元线性回归模型 Fig 1 The multiple linear regression model for pulse pressure variation during deep inspiration |
|
|
3项参数诊断FR的ROC曲线发现,平静呼吸时ΔPP(ΔPPTB)的AUC值为0.580(95%CI:0.390~0.750),深吸气时ΔPP(ΔPPDI)的AUC为0.832(95%CI:0.660~0.940),而ΔPPDI/VtDI的AUC值最大为0.960(95%CI:0.820~0.990),显著高于ΔPPTB(P < 0.01)和ΔPPDI(P=0.03),见图 2。
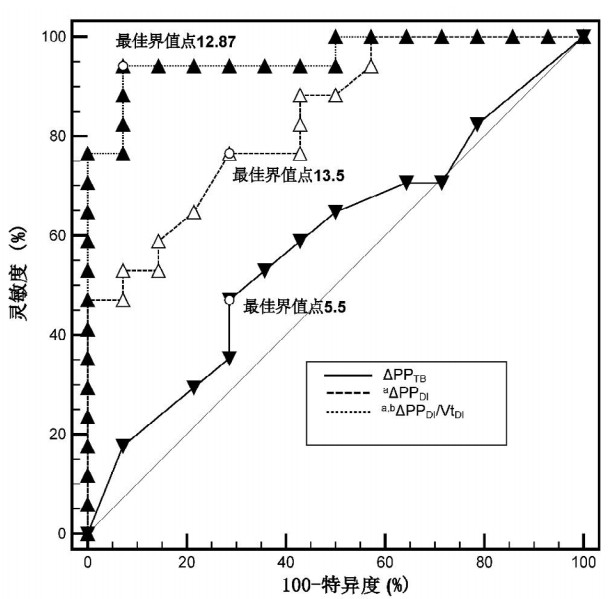
|
| ΔPPTB(平静呼吸时脉搏压力变异度)AUC为0.580(95%CI: 0.390~0.750);ΔPPDI(深吸气时脉搏压力变异度)AUC为0.832(95%CI: 0.660~0.940);经VtDI(深吸气时潮气量)校正的ΔPPDI(ΔPPDI/VtDI)AUC最高为0.960(95%CI: 0.820~0.990)。与ΔPPTB的AUC比较, aP < 0.05, 与ΔPPDI的AUC比较, bP < 0.05 图 2 各参数预测液体反应性受试者工作特征(ROC) 曲线下面积(AUC)比较 Fig 2 The comparison of areas under the receiver operating characteristics curves of 3 indices to detect fluid responsiveness |
|
|
如图 3所示,R=1(假阴性和假阳性的代价相同)时,ΔPPDI的灰区范围为7.8%~19.3%,即ΔPPDI > 19.3%可以确定患者有液体反应性,而ΔPPDI < 7.8%可以确定患者无液体反应性,本研究中17例(54.8%)患者落入此灰区范围。ΔPPDI/VtDI的灰区范围是12.7~14.5,6例(19%)患者落入此灰区范围,见表 2。
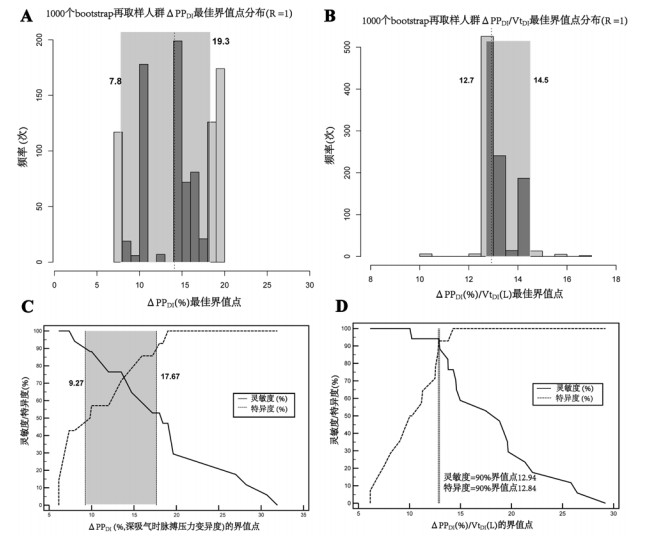
|
| 直方图(A、B)显示在1 000个bootstrap再取样人群中,ΔPPDI和ΔPPDI/VtDI最佳界值点分布,阴影部分表示这1 000个最佳界值点的95%CI (图A、C中的数字),此为第一种方法确定的灰区; 图C、D以灵敏度(或特异度)为纵坐标,以每个参数(ΔPPDI[C]和ΔPPDI/VtDI[D])不同界值点为横坐标,灵敏度和特异度均 < 90%的界值点范围(C图中数字)即为第2种方法确定的灰区(C图阴影部分,D图显示不存在灵敏度和特异度均小于90%的ΔPPDI/VtDI界值点)两种方法所确定的区间最大者作为最终的灰区范围 图 3 在正常液体策略(误分类代价比,R=1),深吸气时测量的脉搏压力变异度(ΔPPDI)以及经深吸气潮气量(VtDI)校正的ΔPPDI(ΔPPDI/VtDI)预测液体反应性灰区范围的确定 Fig 3 Determination of the gray zones for pulse pressure variation during deep inspiration maneuver (ΔPPDI) and ΔPPDI corrected for tidal volume induced by deep inspiration (ΔVtDI) according to a normal fluid policy |
|
|
| 指标 | ΔPPTB (%,平静呼吸时ΔPP) | ΔPPDI (%,深吸气时ΔPP) | ΔPPDI/VtDI (%/L,VtDI校正深吸气时ΔPP) |
| 界值点 | 5.5 | 13.5 | 12.87 |
| 灵敏度(%) | 47.06 | 76.47 | 94.12 |
| 特异度(%) | 71.43 | 71.43 | 92.86 |
| 阳性预测值 | 66.70 | 76.47 | 94.12 |
| 阴性预测值 | 52.63 | 71.43 | 92.86 |
| R=1灰区范围 | 7.8~19.3 | 12.7~14.5 | |
| 包含患者(例,%) | 17 (54.8) | 6 (19)a | |
| R=2灰区范围 | 10.5~19.3 | 12.8~14.5 | |
| 包含患者(例,%) | 13 (41.9) | 2 (6.5)a | |
| R=0.5灰区范围 | 7.8~14.1 | 10.1~14.4 | |
| 包含患者(例,%) | 8 (25.8) | 4 (12.9) | |
| 注:VtDI,深吸气时潮气量;ΔPP,脉搏压力变异度;ΔPPDI/VtDI与ΔPPDI组间卡方检验,aP < 0.01 | |||
如表 2所示,与R=1相比,R=0.5(与临床中的开放性液体策略相对应)时,ΔPPDI和ΔPPDI/VtDI预测FR的灰区从7.8%~19.3%和12.7~14.5下降至7.8%~14.1%和10.1~14.4,分别包含25.8%和12.9%的患者,两组差异无统计学意义(P=0.199);当R=2时(限制性液体策略),ΔPPDI和ΔPPDI/VtDI预测FR的灰区范围是10.5%~19.3%和12.8~14.5,分别包含41.9%和6.5%的患者,两组差异有统计学意义(P=0.001),见图 4。
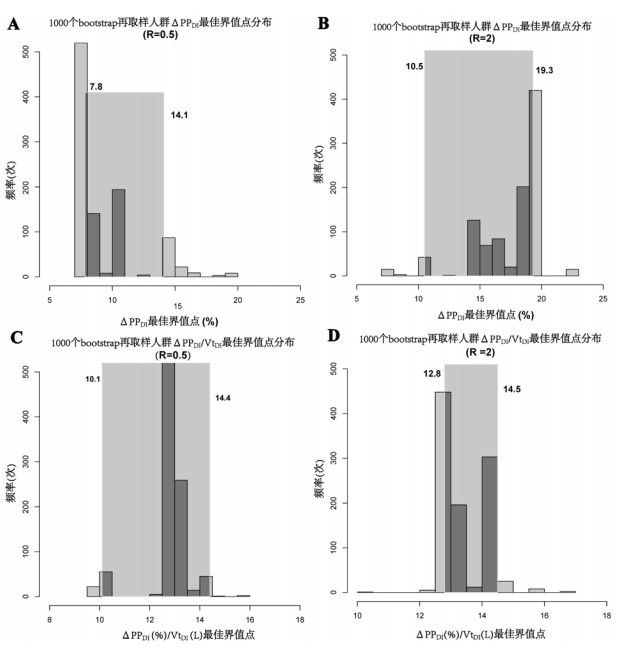
|
| 直方图描述了在1 000个bootstrap再取样人群中ΔPPDI和ΔPPDI/VtDI最佳界值点的分布,阴影部分表示这1 000个界值点的95%CI (图A、B、C、D中的数字),即灰区范围 图 4 在开放性液体策略(误分类代价比,R=0.5)和限制性液体策略(误分类代价比,R = 2)时,深吸气时测量的脉搏压力变异度(ΔPPDI)以及经深吸气潮气量(VtDI)校正的ΔPPDI(ΔPPDI/VtDI)预测液体反应性的灰区范围 Fig 4 Gray zones of pulse pressure variation during deep inspiration maneuver (ΔPPDI) and ΔPPDI corrected for tidal volume induced by deep inspiration (ΔVtDI) for a restrictive fluid policy (R= 2; B and D) or a liberal one (R=0.5; A and C) |
|
|
本研究显示,在31例自主呼吸的脓毒症患者中,ΔPPTB无法可靠地预测FR,具有较高的假阴性,AUC仅为0.58(P > 0.05);与既往研究类似[12, 17]。在自主呼吸患者,Hong等[12]发现ΔPPTB预测FR的AUC为0.618(P=0.11)。此结果可通过心肺交互的基本生理学解释,自主呼吸时较小的Vt导致的胸内压的变化(ΔPpl)也较小,因此即使在液体反应者也难以产生足够的周期性SV变化乃至脉搏压力变化(ΔPP)[3],从而出现预测的假阴性。如表 1所示,在液体反应者中,患者的Vt仅为(7.2±0.9)mL/kg理想体质量。
有学者提出,采用缓慢的深吸气动作,通过提高Vt从而保持足够的ΔPpl,从而降低预测假阴性,提高ΔPP预测FR能力。Hong等[12]选取择期手术自主呼吸的患者,发现ΔPPDI > 13.5%预测FR的灵敏度、特异度、AUC分别为89.7%、86.7%和0.91。Preau等[18]在脓毒症和急性胰腺炎的自主呼吸患者得出与Hong等[12]相似的结论,缓慢呼吸(6次/min)时的ΔPP > 12%预测FR的AUC为0.95。但本研究显示ΔPPDI > 13.5%预测FR的灵敏度、特异度为76.47%和71.43%,AUC仅为0.832,与Zöllei等[14]研究结果类似,他们发现,在正常呼吸(AUC=0.83)与缓慢呼吸(呼吸频率为6次/min,AUC=0.78)间比较,ΔPP预测FR的AUC差异无统计学意义。导致研究结果出现不一致的原因,除了较小的样本量外,主要是由于VtDI在人群中存在较大变异(本研究中VtDI范围是8.8~23.3 mL/kg)。而VtDI是独立于ΔSV影响ΔPPDI水平的因素(图 1),因此VtDI较低的液体反应者其ΔPPDI也较低(假阴性),VtDI较高的液体无反应者由于其较高的ΔPPDI将导致假阳性的发生。本研究结果表明较大的VtDI变异度是ΔPPDI在不同研究中预测能力不同的原因。更为重要的是,经VtDI校正的ΔPPDI可显著提高预测FR的可靠性,降低假阳性、假阴性预测,这进一步支持了上述论点。
另外,以单一截断值将患者简单地分为液体反应者和无反应者,对于临床的指导意义有限[19-20],临床医生无法准确地作出是否需要液体复苏的决定;因为即使某一预测参数(如ΔPPDI/VtDI)灵敏度、特异度都较高,其测量值在液体反应者和无反应者仍有部分是重叠的[21]。为了避免单一界点这种“非黑即白”的判断模式,本研究进一步采用了预测参数的灰区评价体系[2, 22-23],ΔPPDI灰区范围是7.8%~19.3%;意味着如果患者ΔPPDI < 7.8%则可以肯定患者对液体无反应,不应实施液体复苏,而对于ΔPPDI > 19.3%的患者可以肯定对液体有反应,需要实施液体治疗;但是有将近55%的患者落入灰区,其液体反应性无法判断。而ΔPPDI/VtDI的灰区范围是12.7~14.5, 只有19%患者落入此区,显然该参数的灰区在临床中的应用价值更大,可作为临床医生实施个体化液体治疗的有效工具。
上述确定的ΔPPDI/VtDI的灰区,有一个重要的假定,即预测FR假阳性和假阴性的代价是相同的(R=1)。但是在很多临床场景中,这个假定不一定成立。如在脓毒性休克早期,假阴性的代价(对液体反应者未进行液体复苏,即复苏不足)显著高于假阳性的代价(对液体无反应者实施不必要的液体复苏,导致液体负荷过度),因此R < 1(对应开放性的液体策略)[24-25];然而随着对快速液体复苏不良反应的逐渐认识,较多学者倾向于“限制性”液体复苏策略的实施[7, 26],尤其是对于脓毒性休克后期血液动力学基本稳定、休克合并急性呼吸窘迫综合征的患者[27],此时不必要的液体复苏的风险显然高于复苏不足的风险(R > 1)。本研究显示当R=0.5时,ΔPPDI/VtDI预测FR的灰区范围从R=1时的12.7~14.5下降为10.1~14.4,这反映了在实施“开放性液体治疗策略”的临床情境中,需要降低ΔPPDI/VtDI的界值尽力避免假阴性发生。ΔPPDI/VtDI灰区随着R值不同而变化的特点,对于临床液体治疗的实施有着重要的指导意义:对于不同脓毒性休克患者(是否合并ARDS),甚至对于同一患者的不同疾病阶段,应根据所选择的不同液体管理策略(不同的R值);选取不同ΔPPDI/VtDI灰区范围,从而准确做出是否应该补液的决策,为实施个体化的液体治疗提供了可行的临床工具。
本研究有一定局限性,首先,本研究是单中心研究,样本量不大,因此进一步多中心大样本的研究是必要的。其次,很多危重症患者无法完成本研究需要的深吸气动作,因此本研究的结果无法应用于某些自主呼吸的危重患者。
综上所述,本研究表明,对于自主呼吸的患者,ΔPP无法准确预测FR。使用深吸气时测量的ΔPPDI,可以显著提高参数预测FR的能力;但仍有54.8%的患者落入ΔPPDI的灰区而无法确定FR。经VtDI校正的ΔPPDI具有更高的FR预测能力,仅有19%患者落入该参数灰区,可作为临床医生在完全自主呼吸的患者实施个体化液体治疗的有效工具。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Michard F, Teboul JL. Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence[J]. Chest, 2002, 121(6): 2000-2008. DOI:10.1378/chest.121.6.2000 |
| [2] | Cannesson M, Le Manach Y, Hofer CK, et al. Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness: a "gray zone" approach[J]. Anesthesiology, 2011, 115(2): 231-241. DOI:10.1097/ALN.0b013e318225b80a |
| [3] | Liu Y, Wei LQ, Li GQ, et al. Pulse pressure variation adjusted by respiratory changes in pleural pressure, rather than by tidal volume, reliably predicts fluid responsiveness in patients with acute respiratory distress syndrome[J]. Crit Care Med, 2016, 44(2): 342-351. DOI:10.1097/CCM.0000000000001371 |
| [4] | 俞隼, 叶宏伟, 冯玉峰, 等. 江苏省常熟地区脓毒性休克指南依从性及预后的调查[J]. 中华急诊医学杂志, 2020, 29(5): 700-706. DOI:10.3760/cma.j.issn.1671-0282.2020.05.017 |
| [5] | Marik PE, Monnet X, Teboul JL. Hemodynamic parameters to guide fluid therapy[J]. Ann Intensive Care, 2011, 1(1): 1. DOI:10.1186/2110-5820-1-1 |
| [6] | Sakr Y, Rubatto Birri PN, Kotfis K, et al. Higher fluid balance increases the risk of death from sepsis: results from a large international audit[J]. Crit Care Med, 2017, 45(3): 386-394. DOI:10.1097/CCM.0000000000002189 |
| [7] | Self WH, SemLer MW, Bellomo R, et al. Liberal versus restrictive intravenous fluid therapy for early septic shock: rationale for a randomized trial[J]. Ann Emerg Med, 2018, 72(4): 457-466. DOI:10.1016/j.annemergmed.2018.03.039 |
| [8] | Marik PE, Byrne L, van Haren F. Fluid resuscitation in sepsis: the great 30 mL per kg hoax[J]. J Thorac Dis, 2020, 12(Suppl 1): S37-S47. DOI:10.21037/jtd.2019.12.84 |
| [9] | Marik PE, Cavallazzi R, Vasu T, et al. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: a systematic review of the literature[J]. Crit Care Med, 2009, 37(9): 2642-2647. DOI:10.1097/CCM.0b013e3181a590da |
| [10] | Min JJ, Gil NS, Lee JH, et al. Predictor of fluid responsiveness in the 'grey zone': augmented pulse pressure variation through a temporary increase in tidal volume[J]. Br J Anaesth, 2017, 119(1): 50-56. DOI:10.1093/bja/aex074 |
| [11] | Chaves RCF, Correa TD, Neto AS, et al. Assessment of fluid responsiveness in spontaneously breathing patients: a systematic review of literature[J]. Ann Intensive Care, 2018, 8(1): 21. DOI:10.1186/s13613-018-0365-y |
| [12] | Hong DM, Lee JM, Seo JH, et al. Pulse pressure variation to predict fluid responsiveness in spontaneously breathing patients: tidal vs. forced inspiratory breathing[J]. Anaesthesia, 2014, 69(7): 717-722. DOI:10.1111/anae.12678 |
| [13] | Dahl M, Hayes C, Steen Rasmussen B, et al. Can a central blood volume deficit be detected by systolic pressure variation during spontaneous breathing?[J]. BMC Anesthesiol, 2016, 16(1): 58. DOI:10.1186/s12871-016-0224-z |
| [14] | Zollei E, Bertalan V, Nemeth A, et al. Non-invasive detection of hypovolemia or fluid responsiveness in spontaneously breathing subjects[J]. BMC Anesthesiol, 2013, 13(1): 40. DOI:10.1186/1471-2253-13-40 |
| [15] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [16] | Lakhal K, Ehrmann S, Benzekri-Lefevre D, et al. Respiratory pulse pressure variation fails to predict fluid responsiveness in acute respiratory distress syndrome[J]. Crit Care, 2011, 15(2): R85. DOI:10.1186/cc10083 |
| [17] | Bronzwaer AS, Ouweneel DM, Stok WJ, et al. Arterial pressure variation as a biomarker of preload dependency in spontaneously breathing subjects - a proof of principle[J]. PLoS One, 2015, 10(9): e0137364. DOI:10.1371/journal.pone.0137364 |
| [18] | Preau S, Dewavrin F, Soland V, et al. Hemodynamic changes during a deep inspiration maneuver predict fluid responsiveness in spontaneously breathing patients[J]. Cardiol Res Pract, 2012, 2012: 191807. DOI:10.1155/2012/191807 |
| [19] | De Hert SG. Assessment of fluid responsiveness: insights in a "gray zone"[J]. Anesthesiology, 2011, 115(2): 229-230. DOI:10.1097/ALN.0b013e318225b82c |
| [20] | Michard F, ChemLa D, Teboul JL. Applicability of pulse pressure variation: how many shades of grey?[J]. Crit Care, 2015, 19(1): 144. DOI:10.1186/s13054-015-0869-x |
| [21] | Jun JH, Chung RK, Baik HJ, et al. The tidal volume challenge improves the reliability of dynamic preload indices during robot-assisted laparoscopic surgery in the Trendelenburg position with lung-protective ventilation[J]. BMC Anesthesiol, 2019, 19(1): 142. DOI:10.1186/s12871-019-0807-6 |
| [22] | Biais M, Ehrmann S, Mari A, et al. Clinical relevance of pulse pressure variations for predicting fluid responsiveness in mechanically ventilated intensive care unit patients: the grey zone approach[J]. Crit Care, 2014, 18(6): 587. DOI:10.1186/s13054-014-0587-9 |
| [23] | Teboul JL, Monnet X, ChemLa D, et al. Arterial pulse pressure variation with mechanical ventilation[J]. Am J Respir Crit Care Med, 2019, 199(1): 22-31. DOI:10.1164/rccm.201801-0088CI |
| [24] | Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock[J]. N Engl J Med, 2001, 345(19): 1368-1377. DOI:10.1056/NEJMoa010307 |
| [25] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Crit Care Med, 2017, 45(3): 486-552. DOI:10.1097/ccm.0000000000002255 |
| [26] | Marik P, Bellomo R. A rational approach to fluid therapy in sepsis[J]. Br J Anaesth, 2016, 116(3): 339-349. DOI:10.1093/bja/aev349 |
| [27] | Wang YM, Zheng YJ, Chen Y, et al. Effects of fluid balance on prognosis of acute respiratory distress syndrome patients secondary to sepsis[J]. World J Emerg Med, 2020, 11(4): 216-222. DOI:10.5847/wjem.j.1920-8642.2020.04.003 |
 2021, Vol. 30
2021, Vol. 30




