2. 浙江大学医学院附属第二医院肾内科,杭州 310009
Gitelman综合征(Gitelman syndrome,GS)是一种常染色体隐性遗传的失盐性肾小管疾病,由Gitleman等[1]于1966年首次报道。GS的病因是编码位于肾远曲小管的噻嗪类利尿剂敏感的钠氯共同转运(sodium chloride co-transporter,NCCT)蛋白的SLC12A3基因发生功能缺失突变,导致NCCT的结构和/或功能异常,从而引起肾脏远曲小管对钠氯的重吸收障碍导致低血容量、肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system,RAAS)激活、低血钾、低血镁、低钙尿和代谢性碱中毒等临床综合征表现[2]。低镁血症在GS常见,但严重低镁血症罕见,低钠血症在GS中少见,出现重度低钠血症极其罕见。现将本院收治的一例严重低钾低镁低钠血症的患者,最终诊断为合并SIADH和焦磷酸钙沉积的GS病例进行总结分析。
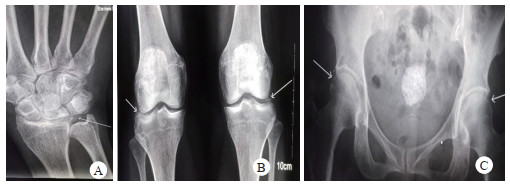
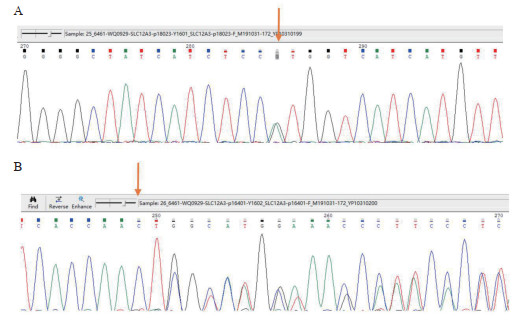
患者,女,61岁。因“阵发性心悸20余年,乏力胸闷1周余”入院。患者20余年前出现阵发性心悸,诊断为“心肌炎”,未予特殊诊治,1周余前无明显诱因出现乏力胸闷,伴头皮麻木,遂来本院就诊,查血电解质:钾2.9 mmol/L,拟“低钾血症”收入本科。既往有糖尿病病史20余年。平时服用二甲双胍及西格列汀片控制血糖,血糖控制尚可。否认服用利尿剂或其他特殊药物史;发育正常,育有1子;父母非近亲结婚,弟弟有“低血钾”病史,但未明确病因,家族其他人无类似疾病史。查体:血压138/69 mmHg,余无殊。完善检查:动脉血气分析:pH 7.48,pCO2 35.9 mmHg,HCO3 27.3 mmol/L,BE 3.3 mmol/L,Ca 0.93 mmol/L,血生化:K 2.3 mmol/L,Na 118 mmol/L,Cl 80 mmol/L,Mg 0.2 mmol/L,Ca 1.72 mmol/L,P 0.78 mmol/L,尿酸101 μmol/L,肌酐52.6 μmol/L,甲状旁腺激素:125 pg/mL(12~65 pg/mL);立位肾素活性:153.8 μIU/mL (4.4~46.1 μIU/mL)立位醛固酮:384 pg/mL (30~353 pg/mL),随机尿钙/尿肌酐:1.19(mmol/mmol)。同步24 h尿电解质:尿量2 000 mL,尿钾120.6 mmol,尿钠259.2 mmol;血渗透压:263 mosm/(kg·H2O),尿渗透压:266 mosm/(kg·H2O)。胸部CT:两肺轻度慢支伴肺气肿。心电图:窦性心律,QTc 483 ms。关节X线:双髋关节、膝关节、右腕关节间隙可见软骨钙化影(图 1),氢氯噻嗪试验结果提示:用药前后,氯离子排泄分数变化为0.951%,说明患者肾小管对氢氯噻嗪无反应,可功能诊断GS。为进一步明确诊断,对患者进行基因检测,结果提示:SLC12A3基因存在复合杂合突变:一个错义突变c.1732G > A(p.Val578Met)和一个移码突变c.1664_1668delCGCCT(p.Ser555fs),第二个突变为新发突变(图 2)。因此,诊断:(1)Gitelman综合征;(2)焦磷酸钙沉积病;(3)抗利尿激素分泌不适当综合征;(4)2型糖尿病;(5)慢性阻塞性肺疾病。入院后予口服氯化钾片每日3.0 g;口服10%氯化钠注射液每日60 mL,螺内酯片每日60 mg,碳酸钙D3片每日0.6 g,骨化三醇胶丸每日0.5 μg,静滴硫酸镁注射液每日5 g等纠正电解质紊乱的治疗。患者乏力、胸闷症状好转,出院前复查血电解质:钾4.76 mmol/L,钠133.1 mmol/L,氯95.7 mmol/L,镁0.65 mmol/L,心电图QTc缩短至407 ms。
|
| 图 1 关节X平片。A.右腕关节间隙(箭头所指),B.双膝关节(箭头所指),C.双髋关节(箭头所指),均可见软骨钙化影 |
|
|
|
| 图 2 患者基因分析结果: A.SLC12A3基因携带一个c.1732G > A(p.Val578Met)杂合突变,为错义突变(箭头);B.SLC12A3基因携带一个变c.1664_1668delCGCCT(p.Ser555fs)杂合突变,为移码突变(箭头) |
|
|
讨论患者为老年女性,既往有阵发性心悸20余年,此次入院以胸闷乏力为主要症状入院,检查提示严重低血钾,低血镁及低血钠,低血氯和代谢性碱中毒,肾性失钾,肾素醛固酮激活但血压正常,临床上高度怀疑GS,同时对氢氯噻嗪无反应,进一步行基因检测发现SLC12A3基因复合杂合突变,GS诊断明确。患者同时伴严重的低血钠,高尿钠,尿渗透压高于血渗透压,影像学提示肺气肿,需考虑慢性阻塞性肺疾病所致抗利尿激素分泌不适当综合征(syndrome of inappropriate antidiuretic hormone secretion SIADH)。经补充浓钠治疗后低钠血症明显缓解。
GS同时合并SIADH和CPPD国内外未见报道。大多数GS患者有不同程度的低镁血症,但极度低镁血症罕见,该患者血镁低至0.2mmol/L。目前认为GS低镁血症机制为肾脏远曲小管顶端侧的瞬时受体电位褪黑素6 (transient receptor potential channel melastatin subtype 6, TRPM6) 蛋白表达减少所致,有研究在GS患者肾活检组织中发现,有低镁血症的肾组织中TRPM6表达较正常的血镁患者显著减少,支持这一理论[3]。TRPM6是介导远曲小管镁离子重吸收的离子通道,其表达减少引起远曲小管镁离子重吸收减少,尿镁丢失,最终引起低镁血症。有文献对GS患者的SLC12A3基因突变位点进行分析,正常血镁患者的突变位点位于胞内段的比例显著高于低血镁患者,提示SLC12A3突变分布可能影响TRPM6损伤程度,从而反映在机体血镁水平上[4]。该患者SLC12A3基因一个突变(p.Val578Met))位于胞内段,另一个突变(p.Ser555fs)为跨膜段,不支持该结论。
镁离子可增加焦磷酸盐溶解度,也是碱性磷酸酶的重要激活物,而碱性磷酸酶可将焦磷酸盐水解成无机磷,因此低镁血症可促进焦磷酸钙结晶在关节沉积,从而导致焦磷酸钙沉积病(calcium pyrophosphate deposition, CPPD[5]。CPPD可表现为假性痛风发作,也可以无症状。该患者X线检查提示双髋、膝关节周围、右腕关节多发钙化,考虑CPPD。本患者无关节痛,考虑为无症状型CPPD。对于有关节痛GS患者,均应行关节X线检查,避免误诊为痛风、自身免疫病所导致的关节病变。该患者有低钙血症,而低钙血症是低镁血症的经典表现,低镁血症引起低钙血症的机制目前认为抑制PTH的释放或者引起骨组织对PTH的抵抗[6]。该患者PTH偏高,考虑存在PTH的抵抗而不是PTH释放减少。
GS出现心律失常,尤其是QT间期延长常见。有研究认为其机制在于低钾低镁血症会延长心肌细胞动作电位时间从而延长QT间期,增加室性心律失常的风险[7]。但也有研究表明在GS中,QT间期延长者与QT间期正常者相比,血钾和血镁水平差异无统计学意义,但QT间期延长者血钠水平低于QT间期正常者[8]。本患者血钾血镁及血钠均低,可能与其QT间期延长均有关,纠正电解质紊乱后,QT间期恢复正常。
低钠血症GS患者少见,合并严重低钠血症病例罕见,因此GS合并严重低钠血症需要考虑其他疾病引起。文献检索显示,仅5例GS并发了低钠血症。第一例考虑由精神性多饮症导致;第二例考虑继发于阻塞性黄疸所致的肾小管损伤[9];第三例考虑肺炎引起的SIADH所致[10];第四及第五例均考虑多种因素相互影响所致,包括失盐性肾病、容量不足导致的ADH过度分泌、远端肾小管尿液稀释功能受损[11-12];该患者严重低血钠、高尿钠、尿渗透压超过血浆渗透压、低尿酸血症,血容量正常,心肝肾、甲状腺功能、肾上腺皮质功能均正常,排除了其他常见低钠血症原因,需考虑SIADH。患者胸部CT提示慢性阻塞性肺疾病,故考虑SIADH由慢性阻塞性肺疾病所致。SIADH主要治疗措施除控制原发病外还需要严格控制水分摄入,但GS患者有脱水倾向,故GS合并SIADH患者治疗不宜限制水分摄入,而是增加钠的摄入,该患者通过口服浓钠,低钠血症得到显著改善,但是长期治疗是个巨大挑战。
低镁血症为Gitelman综合征(GS)的经典表现,GS合并严重低镁血症罕见,可以引起心律失常、CPPD、低钙血症等各种并发症,GS合并严重低钠血症极其罕见,需考虑到合并其他疾病。GS同时合并SIADH和CPPD国内外未见报道。当GS合并SIADH时,不能限水,治疗困难,该患者通过补充浓钠、钾、镁等纠正电解质紊乱的治疗后得到缓解。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Gitelman HJ, Graham JB, Welt LG. A new familial disorder characterized by hypokalemia and hypomagnesemia[J]. Trans Assoc Am Physicians, 1966, 79: 221-235. |
| [2] | Blanchard A, Bockenhauer D, Bolignano D, et al. Gitelman syndrome: consensus and guidance from a kidney disease: improving global outcomes (KDIGO) controversies conference[J]. Kidney Int, 2017, 91(1): 24-33. DOI:10.1016/j.kint.2016.09.046 |
| [3] | 彭晓艳, 蒋兰萍, 陈丽萌. 正常血镁Gitelman综合征的研究进展[J]. 中华肾脏病杂志, 2016, 32(12): 941-944. DOI:10.3760/cma.j.issn.1001-7097.2016.12.012 |
| [4] | Jiang LP, Chen C, Yuan T, et al. Clinical severity of Gitelman syndrome determined by serum magnesium[J]. Am J Nephrol, 2014, 39(4): 357-366. DOI:10.1159/000360773 |
| [5] | Punzi L, Gava A, Galozzi P, et al. Miscellaneous non-inflammatory musculoskeletal conditions. Blau syndrome[J]. Best Pract Res: Clin Rheumatol, 2011, 25(5): 637-648. DOI:10.1016/j.berh.2011.10.013 |
| [6] | Rude RK, Oldham SB, Singer FR. Functional hypoparathyroidism and parathyroid hormone end-organ resistance in human magnesium deficiency[J]. Clin Endocrinol, 1976, 5(3): 209-224. DOI:10.1111/j.1365-2265.1976.tb01947.x |
| [7] | Foglia PE, Bettinelli A, Tosetto C, et al. Cardiac work up in primary renal hypokalaemia-hypomagnesaemia (Gitelman syndrome)[J]. Nephrol Dial Transplant, 2004, 19(6): 1398-1402. DOI:10.1093/ndt/gfh204 |
| [8] | Bettinelli A, Tosetto C, Colussi G, et al. Electrocardiogram with prolonged QT interval in Gitelman disease[J]. Kidney Int, 2002, 62(2): 580-584. DOI:10.1046/j.1523-1755.2002.00467.x |
| [9] | Schepkens H, Stubbe J, Hoeben H, et al. Severe hyponatraemia and hypouricaemia in Gitelman's syndrome[J]. Nephrol Dial Transplant, 2001, 16(11): 2250-2252. DOI:10.1093/ndt/16.11.2250 |
| [10] | Ali A, Masood Q, Yaqub S, et al. A case of Gitelman syndrome with severe hyponatraemia and hypophosphataemia[J]. Singapore Med J, 2013, 54(1): e18-e20. DOI:10.11622/smedj.2013020 |
| [11] | Gopinath B, Chauhan N, Achappa B. Hypocalcaemia and hyponatraemia masquerading the diagnosis of Gitelman syndrome[J]. BMJ Case Rep, 2019, 12(1): bcr-2018-227886. DOI:10.1136/bcr-2018-227886 |
| [12] | Ganguli A, Veis JH. Hyponatremia - A rare complication of Gitelman's syndrome[J]. Indian J Nephrol, 2017, 27(1): 74-77. DOI:10.4103/0971-4065.177208 |
 2021, Vol. 30
2021, Vol. 30




