2. 四川省医学科学院 四川省人民医院重症医学中心,成都 610072;
3. 江油市九O三医院重症医学中心,江油 621700;
4. 四川省医学科学院 四川省人民医院感染控制中心,成都 610072;
5. 西南医科大学临床医学院,泸州 646000
2. Department of CCM, Sichuan Academy of Medical Sciences & Sichuan Provincial People's Hospital, University of Electronic Science and Technology of China, Chengdu 610072, China;
3. Department of ICU, 903 hospital of Jiangyou province, Jiangyou 621700, China;
4. Department of Hospital Sense Control Center, Sichuan Academy of Medical Sciences & Sichuan Provincial People's Hospital, University of Electronic Science and Technology of China, Chengdu 610072, China;
5. School of Clinical Medicine, Southwest Medical University, Luzhou 646000, China
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)于1970年开始试用于临床[1],作为一项对重症肺炎、严重急性呼吸窘迫综合征、急性心肌梗死、爆发性心肌炎等严重心衰、呼衰提供高级生命支持的技术[2],病死率高[3-4]、并发症多。影响ECMO患者死亡的主要原因除了包括疾病自身严重程度、血流动力学不稳定、组织灌注减少、电解质紊乱、血小板减少、红细胞破坏、感染、凝血功能障碍、泵功能或回路故障等[4-5],还包括血液与非生物膜接触所致的炎症级联反应、氧化应激。McDonald等[6]发现氧化应激会加大ECMO患者死亡风险,而Landis等[7]发现减轻ECMO辅助期间氧化应激反应,对其严密评估,可能对提高ECMO患者预后起到积极作用。同时,目前关于ECMO患者死亡风险预测模型的研究较少,包括针对严重急性呼吸窘迫综合征患者VV-ECMO死亡预测评分(PRESERVE-Score6)[8]、甲型流感肺炎的ECMO-Net评分[9]、RESP评分[10]等,且关于评估ECMO患者预后的预测模型仍存在争议,在临床中尚无完善的预测模型用于评估ECMO患者预后,所以探索包含评估氧化应激指标在内的更完善的ECMO死亡预测模型显得十分重要。
ECMO期间氧化应激与活性氮氧化物(reactive nitrogen and oxygen species,RNOS)、脂质过氧化物的释放密切相关[11-12],但因其检测较为复杂,故在临床中少用。目前研究证实红细胞分布宽度(red blood cell distribution width,RDW)与氧化应激密切相关[13-14],是用于描述外周血中红细胞体积大小均度的血常规指标,近年来广泛用于心衰、心梗等疾病预测[15]。Bazick等[16]发现,危重病患者的RDW增高,可能与预后不良相关,而联合评估RDW对创伤患者死亡预测有较高临床价值[17],同时RDW作为预测ICU患者死亡的独立危险因素及新型预测指标被纳入越来越多的研究。
故此,本研究采取回顾性队列研究的方法,探索RDW预测ECMO患者死亡的临床价值,分析ECMO患者死亡相关因素,并尝试建立预警评分,为早期评估ECMO患者的预后提供依据。
1 资料与方法 1.1 一般资料收集2015年1月至2020年1月入住四川省医学科学院-四川省人民医院重症医学科(intensive care unit, ICU)的110例接受ECMO治疗患者资料。
1.1.1 纳入标准接受体外膜氧合治疗患者。
1.1.2 排除标准① 年龄 < 18岁或年龄 > 85岁;②ECMO辅助下行气道手术患者;③3 d内死亡患者;④终末型心肺疾病。
1.1.3 结局定义存活定义为完全康复转出ICU或好转出院,死亡定义为住院期间死亡或因疾病难以控制家属放弃治疗。
1.1.4 伦理学本研究经过四川省人民医院伦理委员会批准,且所有指标均获得患者或其直系亲属的同意及授权(伦理审批号:四川省人民医院伦审(研)2020年第414号)。
1.2 研究方法 1.2.1 ECMO启动标准V-V ECMO: 高条件机械通气(FiO2为1.0, PEEP≥5 cmH2O)下患者PaO2≤50 mmHg超过2 h;V-A ECMO: 持续性低心排(持续性低血压、外周灌注差、心室充盈压上升、无尿或少尿、持续酸中毒)。
1.2.2 ECMO操作流程材料:体外循环套包BE-PLS2050(MAQUET, 德国),静脉插管BE-PVS、PVL系列(MAQUET, 德国),经皮穿刺针PIK150(MAQUET, 德国),动脉插管BE-PVS系列(MAQUET, 德国)。穿刺:静脉-静脉(V-V)为股静脉-颈内静脉,静脉-动脉(V-A)为股静脉-股动脉。ECMO启动初始设置:起始血流量:50~70 mL/(kg·min),起始转速:1 500 r/min。根据平均动脉压和指脉氧饱和度及时调整血流量、氧流量,维持平均动脉压于65 mmHg以上,指脉氧饱和度于88%~92%,同时关注心脏功能。全身抗凝:肝素钠注射液(海通药业,成都)起始剂量为50 U/kg,维持剂量5~15 U//(kg·h),维持活化部分凝血活酶时间(activated partial thromboplastin time,APTT)于40~60 s。
1.2 数据收集收集患者基本信息,APACHE Ⅱ评分,ECMO前机械通气时间,ECMO治疗前、治疗后第24小时和第72小时RDW的血小板数量、APTT、乳酸,是否输血,是否透析,ECMO类型,ECMO上机时间,ECMO后机械通气时间、总ICU住院时间。
1.3 统计学方法采用SPSS 23.0软件进行统计分析。计量资料呈正态分布用均数±标准差(Mean±SD)表示,组间比较采用独立样本t检验;非正态分布用中位数、四分位数间距M(QL, QU)表示,组间比较Mann-Whitney U秩和检验。计数资料采用卡方检验,采用校正卡方检验或Fisher精确检验。采用前进法Logistic回归进行死亡危险因素分析并建立预测模型,采用Hosmer & Lemeshow法行预测模型拟合度检测。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析危险因素截断值,并计算ROC曲线下面积(area under curvea, AUC)评估各危险因素和预测模型对ECMO患者死亡预测的准确性。以P < 0.05为差异有统计学意义。
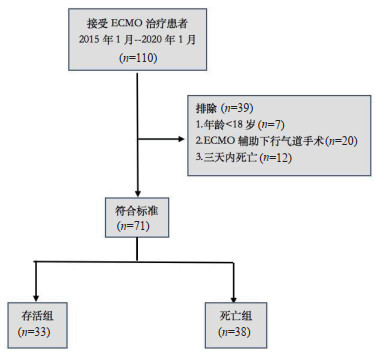
2 结果 2.1 入组筛选流程共入选110例接受ECMO治疗患者,其中排除年龄 < 18岁者7例,行ECMO辅助气道手术者20例,3 d内死亡者12例,最终71例患者纳入分析,见图 1。
|
| 图 1 纳入患者筛选流程 Fig 1 The flow diagram on screening the patients who met the inclusion criteria |
|
|
71例患者中,存活组33例,男性25例,女性8例,年龄(46.55 ± 12.74)岁,APACHE-Ⅱ评分(20.82 ± 6.02)分;死亡组38例,男性21例,女性17例,年龄(53.37 ± 15.11)岁,APACHE-Ⅱ评分(23.32 ± 4.84)分。V-V ECMO 46例,其中存活组21例,死亡组25例;V-A ECMO 25例,其中存活组12例,死亡组13例。V-V ECMO基础疾病包括急性呼吸窘迫综合征、重症肺炎、肺栓塞、肺移植;V-A ECMO基础疾病包括重症心肌炎、心梗、急性心衰、心脏骤停。死亡组患者在年龄、APACHE Ⅱ评分、ECMO上机72 h RDW、72 h APTT均高于存活组,ICU住院时间低于存活组,差异有统计学意义(P < 0.05)。两组在性别、ECMO类型、ECMO上机前RDW、上机后24 h RDW、上机后72 h血小板、乳酸、ECMO上机时间、ECMO前机械通气时间、ECMO后机械通气时间、输血治疗、透析治疗上差异无统计学意义(P > 0.05),见表 1。
| 一般资料 | 存活组(n=33) | 死亡组(n=38) | χ2 / t /Z值 | P值 |
| 性别 男性 女性 |
25 8 |
21 17 |
3.252 |
0.071 |
| 年龄(岁, Mean±SD) | 46.55 ± 12.74 | 53.37 ± 15.11 | -2.039 | 0.045 |
| APACHE Ⅱ评分(分) ECMO类型[例] V-V V-A |
20.82 ± 6.02 21 12 |
23.32 ± 4.84 25 13 |
-2.07 0.036 |
0.043 0.85 |
| ECMO上机前RDW-SD(fl) | 45.32 ± 4.95 | 45.95 ± 5.58 | -0.494 | 0.623 |
| ECMO上机后 24 h RDW-SD[fl, M(QL, QU)] |
44.70(41.60,48.85) |
46.00(42.90, 49.65) |
-1.257 |
0.209 |
| ECMO上机后 72 h RDW-SD(fl) |
45.10(42.60,47.50) |
48.65(45.00,52.25) |
-2.767 |
0.006 |
| 血小板(×109/L) | 103.0(70.00, 140.55) | 76.52(49.50,119.25) | -1.833 | 0.067 |
| APTT(s) | 40.42(35.45,50.00) | 46.25(42.45,54.83) | -2.767 | 0.006 |
| 乳酸(mmol/L) | 1.80(1.30,2.85) | 1.80(1.57,3.07) | -0.756 | 0.45 |
| ECMO上机时间(d) | 7.25(4.20,10.55) | 7.50(3.75,12.25) | -0.711 | 0.477 |
| ECMO前机械通气时间(d) | 1(0,2) | 1(0,4) | -1.545 | 0.122 |
| ECMO后机械通气时间(d) | 6.25(2.25,14.75) | 7.00(3.75,11.25) | -0.665 | 0.506 |
| ICU住院时间(d) | 20.00(11.50,35.50) | 12.50(7.00,19.25) | -2.608 | 0.009 |
| 输血[n] | 24 | 34 | 2.287a | 0.13 |
| 连续肾脏替代治疗[n] | 16 | 25 | 2.168 | 0.141 |
| 注:Mean±SD均数±标准差,M(QL, QU)为中位数、四分位数间距。APACHE Ⅱ为急性生理与慢性健康评分,ECMO为人工膜肺氧合,V-V\V-A为静脉-静脉\静脉-动脉;RDW-SD为红细胞分布宽度标准差;APTT为活化部分凝血活酶时间;ICU为重症监护室;a校正卡方值 | ||||
根据表 1的结果,将具有统计学意义的危险因素绘制ROC曲线并计算曲线下面积,结果显示:APACHE Ⅱ评分、ECMO上机72 h RDW、72 h APTT、ICU住院时间的曲线下面积分别为0.632、0.691、0.691、0.68,且最佳截断值均具有统计学意义(P < 0.05)。其中ECMO上机72 h RDW的曲线下面积最大,当72 h RDW-SD > 46.9(fl)时,预测患者短期预后的敏感度为0.658,特异度为0.727,见表 2。
| 指标 | 截断值 | AUC | 敏感度 | 特异度 | χ2值 | P值 |
| 年龄 | 55.52 | 0.628 | 0.421 | 0.788 | 3.520 | 0.060 |
| APACHE Ⅱ评分 | 19.50 | 0.632 | 0.921 | 0.424 | 9.745 | 0.002 |
| ECMO上机72 h RDW-SD (fl) | 46.90 | 0.691 | 0.658 | 0.727 | 10.552 | 0.001 |
| ECMO上机72 h APTT(s) | 42.55 | 0.691 | 0.761 | 0.661 | 13.265 | 0.000 |
| ICU住院时间(d) | 19.52 | 0.680 | 0.576 | 0.763 | 8.494 | 0.004 |
| 注:AUC为曲线下面积;APACHE Ⅱ为急性生理与慢性健康评分;ECMO为人工膜肺d.RDW-SD为红细胞分布宽度标准差;APTT为活化部分凝血活酶时间;ICU为重症监护室 | ||||||
将ROC曲线分析后具有统计学意义的危险因素纳入Logistic回归,采用前进法分析,结果显示APACHE Ⅱ评分、ECMO上机72 h RDW、72 h APTT为ECMO患者死亡独立危险因素,并建立Logistic回归预测模型,回归方程为: Y=-9.304+0.111×(APACHE Ⅱ)+0.097×(72 h RDW)+0.048×(72 h APTT),经Hosmer-Lemeshow拟合优度检验后,拟合优度0.999,P=0.001,见表 3。
| 指标 | B | SE(b) | Wald χ2 | df | P值 | OR值 | 95% CI |
| APACHE Ⅱ (分) | 0.111 | 0.056 | 3.940 | 1 | 0.047 | 1.117 | 1.001~1.246 |
| ECMO上机72 h RDW-SD(fl) | 0.097 | 0.045 | 4.764 | 1 | 0.029 | 1.102 | 1.010~1.203 |
| ECMO上机72 h APTT(s) | 0.048 | 0.022 | 4.757 | 1 | 0.029 | 1.049 | 1.005~1.096 |
| 常量 | -9.304 | 2.795 | 11.081 | 1 | 0.001 | .000 | |
| 注:B为回归系数, SE(b)为标准误, Waldχ2为Wald检验;df为自由度, OR值为优势比,CI为置信区间 | |||||||
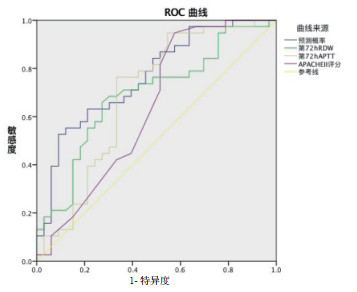
将ECMO上机72 h RDW、72 h APTT、APACHE Ⅱ评分的预测模型进行ROC曲线分析,结果显示:联合ECMO上机72 h RDW的预测模型的曲线下面积为0.764,灵敏度0.526,特异性0.909,均高于各单项指标预测的曲线下面积,表明联合ECMO上机72 h RDW的预测模型对ECMO患者短期预后具有一定预测价值,见图 2。
|
| 图 2 预测模型及各单项指标预测ECMO患者预后的ROC曲线 Fig 2 ROC curve of predictive model and single index in predicting the prognosis of patients with ECMO |
|
|
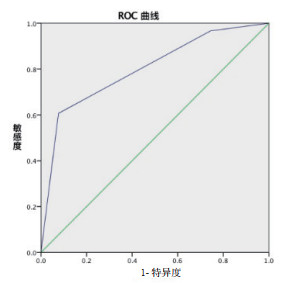
将回归方程中的回归系数取整赋分,分别为1、1、1分,建立简易预警评分[RDW-SD≤46.9(fl)赋0分,RDW-SD(fl) > 46.9赋1分,APTT和APACHE-Ⅱ同理],总分0分~3分,见表 4。预警评分的ROC曲线,曲线下面积为0.8,灵敏度0.607,特异性0.923,截断值为评分2分,故评分 > 2分为ECMO死亡高危组,评分≤2分为ECMO死亡低危组,见图 3。
| 简易预警指标 | 指标分组 | 评分 |
| ECMO上机72 h RDW-SD (fl) | RDW≤46.9 RDW > 46.9 |
0分 1分 |
| ECMO上机72 h APTT(s) | APTT≤42.55 APTT > 42.55 |
0分 1分 |
| 入院24 h APACHE Ⅱ评分 | APACHE Ⅱ评分≤19.5 APACHE Ⅱ评分 > 19.5 |
0分 1分 |
| 总分 | 0~3分 |
|
| 图 3 简易死亡预警评分预测ECMO患者预后的ROC曲线 Fig 3 ROC curve of death warning score in predicting the prognosis of patients with ECMO |
|
|
ECMO随着技术的发展,临床适应证的扩大,目前已广泛用于肺移植、气道肿瘤,在COVID-19治疗中也体现出一定有效性[18],然而其病死率高,预测预后的评分较少,使越来越多的研究探索更完善的预测模型以评估ECMO患者预后。本研究结果显示ECMO上机72 h RDW在预测ECMO患者死亡风险中具有一定临床价值,上机后72 h RDW值高于24 h RDW,且死亡组RDW值均高于存活组,ECMO上机72 h RDW预测ECMO患者死亡的ROC曲线下面积为0.691,最佳截断值为46.9 fl,灵敏度0.658,特异性0.727。RDW为反应红细胞体积异质性的常用血常规指标,是用红细胞体积标准差除以平均红细胞体积,已证明RDW增加与红细胞破坏、网织红细胞释放增加、氧化应激、炎症、大量脂质过氧化物与活化氮氧化合物增加密切相关[16, 19]。本研究中,ECMO运行时,RDW随时间增加可能与血液与非生物膜接触时红细胞生成抑制、凋亡增加、红细胞破坏相关,同时血液与非生物膜接触使氧化应激增加,从而网织红细胞生成增加[16, 20]。RDW既往常用于贫血的诊断,近年来越来越多地应用于各类疾病预后的预测,研究证明可作为急性冠脉综合征、心衰、心梗、社区获得性肺炎、急慢性肝炎[21-22]等疾病的预后预测指标,loveday等[23]发现RDW可以显著改善APACHE Ⅱ评分危险分层,Tsuboi等[24]研究证明RDW可作为独立于C-反应蛋白的成熟生物标志物,Oh等[25]证明RDW增加可以预测连续肾脏替代治疗患者预后,本研究证明RDW可以作为ECMO患者死亡的独立危险因素,对ECMO患者预后具有一定预测价值。
目前对ECMO患者预后评估的预测模型较少,且针对不同病种,检测指标不一且繁杂,所以仍具有争议,本研究发现ECMO上机72 h RDW、72 h APTT,APACHE Ⅱ评分为ECMO患者死亡的独立危险因素,联合72 h RDW、72 h APTT,APACHE Ⅱ评分预测ECMO患者死亡的曲线下面积为0.764,灵敏度0.526,特异性0.909,且模型预测概率均高于各单项预测,证明联合ECMO上机72 h RDW、72 h APTT,APACHE Ⅱ评分可能可以更简便易得、科学、有效地对ECMO死亡风险进行评估,与Sarah等[23, 26]研究联合RDW和其他评分更有效地预测ICU住院病死率的结果相似。我们的研究发现,RDW相较其他预测模型指标更容易获得,更佳简便,预测价值较高。
APTT作为内源性凝血监测指标,在ECMO治疗中增高的原因可能为血液与非生物膜接触后,非生物膜吸附纤维蛋白原及凝血因子Ⅻ, 从而增强内源性凝血途径,从而APTT增高,其与肝素剂量呈相关[27]。而Combes等[28]认为40~55 s能减少出血并发症,减少病死率,Arnouk等[27]认为APTT > 70 s出血风险较大,而在本研究中ECMO上机72 h APTT > 42.55 s联合其他指标预测患者预后不良,结果可能与研究涵盖V-V/V-A ECMO两种不同人群的数据、样本量较小有关,而本次研究缺乏对出血相关并发症的统计,故不能探讨死亡组与存活组出凝血障碍与APTT的关系,所以需要扩大样本量并增加对出凝血并发症的统计进行进一步研究。
APACHE Ⅱ评分已被广泛用于重症患者的预后评估[29],其预测价值被广泛认可,APACHE-Ⅱ评分越高与患者预后不佳相关[36]。将ECMO上机72 h RDW、72 h APTT,APACHE Ⅱ评分建立简易预警评分,72 h RDW-SD > 46.9 fl、72 h APTT > 42.55 s、APACHE Ⅱ评分 > 19.5时ECMO患者死亡风险较高,此评分模型ROC曲线下面积为0.8,灵敏度0.607,特异性0.923。
本研究发现联合ECMO上机72 h RDW、72 h APTT,APACHE Ⅱ评分建立的预警评分能简便、科学、有效地预测ECMO患者预后,所有指标在临床中易获取,较目前已有的评分更简洁,特异性较高,可以值得推荐。同时研究也存在局限性,首先,研究设计为单中心研究,样本量较小;其次,RDW与输血治疗相关,与抗凝相关性较小,在研究中少部分患者经历了输血治疗,可能对研究结果有一定影响,同时,未统计出血并发症与APTT的关系,未验证RDW与RNOS的相关性;最后,由于医院仪器设备限定,检测RDW类型受限,数据为RDW-SD值,精确度较RDW-CV值低。所以还需进一步扩大样本量,在多中心中进行统计,同时在另外一组队列中对模型进行验证。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Hill JD, O'Brien TG, Murray JJ, et al. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung[J]. N Engl J Med, 1972, 286(12): 629-634. DOI:10.1056/NEJM197203232861204 |
| [2] | Muller G, Flecher E, Lebreton G, et al. The ENCOURAGE mortality risk score and analysis of long-term outcomes after VA-ECMO for acute myocardial infarction with cardiogenic shock[J]. Intensive Care Med, 2016, 42(3): 370-378. DOI:10.1007/s00134-016-4223-9 |
| [3] | Karagiannidis C, Brodie D, Strassmann S, et al. Extracorporeal membrane oxygenation: evolving epidemiology and mortality[J]. Intensive Care Med, 2016, 42(5): 889-896. DOI:10.1007/s00134-016-4273-z |
| [4] | Wang GN, Chen XF, Zhang G, et al. A case of thyroid emergency with cardiac arrest supported by extracorporeal membrane oxygenation[J]. World J Emerg Med, 2018, 9(4): 288-290. DOI:10.5847/wjem.j.1920-8642.2018.04.009 |
| [5] | 中华医学会小儿外科学分会心胸外科学组. 体外膜肺氧合支持儿科暴发性心肌炎专家共识[J]. 中华急诊医学杂志, 2020, 29(1): 36-41. DOI:10.3760/cma.j.issn.1671-0282.2020.01.005 |
| [6] | McDonald CI, Fraser JF, Coombes JS, et al. Oxidative stress during extracorporeal circulation[J]. Eur J Cardiothorac Surg, 2014, 46(6): 937-943. DOI:10.1093/ejcts/ezt637 |
| [7] | Landis RC, Brown JR, Fitzgerald D, et al. Attenuating the systemic inflammatory response to adult cardiopulmonary bypass: a critical review of the evidence base[J]. J Extra Corpor Technol, 2014, 46(3): 197-211. |
| [8] | Schmidt M, Zogheib E, Rozé H, et al. The PRESERVE mortality risk score and analysis of long-term outcomes after extracorporeal membrane oxygenation for severe acute respiratory distress syndrome[J]. Intensive Care Med, 2013, 39(10): 1704-1713. DOI:10.1007/s00134-013-3037-2 |
| [9] | Pappalardo F, Pieri M, Greco T, et al. Predicting mortality risk in patients undergoing venovenous ECMO for ARDS due to influenza A (H1N1) pneumonia: the ECMOnet score[J]. Intensive Care Med, 2013, 39(2): 275-281. DOI:10.1007/s00134-012-2747-1 |
| [10] | Schmidt M, Bailey M, Sheldrake J, et al. Predicting survival after extracorporeal membrane oxygenation for severe acute respiratory failure. The Respiratory Extracorporeal Membrane Oxygenation Survival Prediction (RESP) score[J]. Am J Respir Crit Care Med, 2014, 189(11): 1374-1382. DOI:10.1164/rccm.201311-2023OC |
| [11] | Peek GJ, Firmin RK. The inflammatory and coagulative response to prolonged extracorporeal membrane oxygenation[J]. Asaio J, 1999, 45(4): 250-263. DOI:10.1097/00002480-199907000-00003 |
| [12] | Trittenwein G, Rotta AT, Gunnarsson B, et al. Lipid peroxidation during initiation of extracorporeal membrane oxygenation after hypoxia in endotoxemic rabbits[J]. Perfusion, 1999, 14(1): 49-57. DOI:10.1177/026765919901400108 |
| [13] | Friedman JS, Lopez MF, Fleming MD, et al. SOD2-deficiency anemia: protein oxidation and altered protein expression reveal targets of damage, stress response, and antioxidant responsiveness[J]. Blood, 2004, 104(8): 2565-2573. DOI:10.1182/blood-2003-11-3858 |
| [14] | Gülen B, Sonmez E, Yaylaci S, et al. Effect of harmLess acute pancreatitis score, red cell distribution width and neutrophil/lymphocyte ratio on the mortality of patients with nontraumatic acute pancreatitis at the emergency department[J]. World J Emerg Med, 2015, 6(1): 29-33. DOI:10.5847/wjem.j.1920-8642.2015.01.005 |
| [15] | Förhécz Z, Gombos T, Borgulya G, et al. Red cell distribution width in heart failure: prediction of clinical events and relationship with markers of ineffective erythropoiesis, inflammation, renal function, and nutritional state[J]. Am Heart J, 2009, 158(4): 659-666. DOI:10.1016/j.ahj.2009.07.024 |
| [16] | Bazick HS, Chang D, Mahadevappa K, et al. Red cell distribution width and all-cause mortality in critically ill patients[J]. Crit Care Med, 2011, 39(8): 1913-1921. DOI:10.1097/ccm.0b013e31821b85c6 |
| [17] | Liu ZH, Hu H. The RTS plus measurement of the RDW improves the prediction of 28-day mortality in trauma patients[J]. Am J Emerg Med, 2018, 36(6): 1112-1113. DOI:10.1016/j.ajem.2017.10.028 |
| [18] | Cho HJ, Heinsar S, Jeong IS, et al. ECMO use in COVID-19: lessons from past respiratory virus outbreaks-a narrative review[J]. Crit Care, 2020, 24(1): 301. DOI:10.1186/s13054-020-02979-3 |
| [19] | Lippi G, Targher G, Montagnana M, et al. Relation between red blood cell distribution width and inflammatory biomarkers in a large cohort of unselected outpatients[J]. Arch Pathol Lab Med, 2009, 133(4): 628-632. DOI:10.1043/1543-2165-133.4.628 |
| [20] | Kolls JK. Oxidative stress in sepsis: a redox redux[J]. J Clin Invest, 2006, 116(4): 860-863. DOI:10.1172/JCI28111 |
| [21] | Horne BD, May HT, Kfoury AG, et al. The Intermountain Risk Score (including the red cell distribution width) predicts heart failure and other morbidity endpoints[J]. Eur J Heart Fail, 2010, 12(11): 1203-1213. DOI:10.1093/eurjhf/hfq115 |
| [22] | Braun E, Kheir J, Mashiach T, et al. Is elevated red cell distribution width a prognostic predictor in adult patients with community acquired pneumonia?[J]. BMC Infect Dis, 2014, 14: 129. DOI:10.1186/1471-2334-14-129 |
| [23] | Loveday S, Sinclair L, Badrick T. Does the addition of RDW improve current ICU scoring systems?[J]. Clin Biochem, 2015, 48(9): 569-574. DOI:10.1016/j.clinbiochem.2015.04.002 |
| [24] | Tsuboi S, Miyauchi K, Kasai T, et al. Impact of red blood cell distribution width on long-term mortality in diabetic patients after percutaneous coronary intervention[J]. Circ J, 2013, 77(2): 456-461. DOI:10.1253/circj.cj-12-0730 |
| [25] | Oh HJ, Park JT, Kim JK, et al. Red blood cell distribution width is an independent predictor of mortality in acute kidney injury patients treated with continuous renal replacement therapy[J]. Nephrol Dial Transplant, 2012, 27(2): 589-594. DOI:10.1093/ndt/gfr307 |
| [26] | Wang FL, Pan WZ, Pan SM, et al. Red cell distribution width as a novel predictor of mortality in ICU patients[J]. Ann Med, 2011, 43(1): 40-46. DOI:10.3109/07853890.2010.521766. |
| [27] | Arnouk S, Altshuler D, Lewis TC, et al. Evaluation of anti-xa and activated partial thromboplastin time monitoring of heparin in adult patients receiving extracorporeal membrane oxygenation support[J]. ASAIO J, 2020, 66(3): 300-306. DOI:10.1097/MAT.0000000000001004 |
| [28] | Combes A, Hajage D, Capellier G, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome[J]. N Engl J Med, 2018, 378(21): 1965-1975. DOI:10.1056/nejmoa1800385 |
| [29] | 杨静, 司君利, 刘冠群, 等. 肠杆菌血行感染脓毒症患者的预后危险因素分析[J]. 中华急诊医学杂志, 2020, 029(005): 688-93. DOI:10.3760/cma.j.issn.1671-0282.2020.05.015 |
 2021, Vol. 30
2021, Vol. 30




