2. 广东省人民医院,广州 510080
2. Department of Emergency and Critical Care Medicine, Guangdong Provincial People's Hospital, Guangzhou 510080, China
脓毒症是危害全球人类健康的常见疾病之一。根据2016年共识,脓毒症被定义为宿主对感染反应失调导致的危及生命的器官功能障碍[1]。脓毒症导致的高病死率与其造成的急性器官衰竭密切相关,包括心脏、肺脏、肝脏、泌尿道、大脑等重要器官[2]。其中,脓毒症导致的脑损伤将严重影响患者的神经系统功能[3]。
血脑屏障是保护中枢神经系统内环境稳定的重要生理屏障,可以保护大脑免于遭受各种毒性分子的入侵,其结构破坏和功能障碍都将导致脑细胞发生不可逆的损伤[4],但脓毒症后血脑屏障通透性的变化尚不明确。本项研究旨在探讨脓毒症诱导血脑屏障通透性改变的潜在分子机制,为脓毒症患者临床治疗提供科学的理论依据。
1 材料与方法 1.1 试剂荧光素钠(CAS 518-47-8)和三氯乙酸(CAS 76-03-9)购买自美国Sigma公司。Claudin-5(35-2500)、Occludin(71-1500)、ZO-1(40-2200)等一抗抗体和蛋白marker(26616)购买自美国Thermo Fisher Scientific公司。CD31(ab24590)一抗抗体、山羊抗鼠荧光二抗(150116)、山羊抗兔荧光二抗(ab150077)、驴抗鼠荧光二抗(ab150106)、驴抗兔荧光二抗(ab150083)均购买自英国Abcam公司。总蛋白提取试剂盒购买自中国贝博公司。PBS粉末、TBS粉末、甘氨酸、Tris、SDS等购买于中国博士德公司。多聚甲醛购买于中国雷根公司。
1.2 动物与分组实验用动物为清洁级SD雄性大鼠,共36只,体质量250~300 g,鼠龄3个月左右;由南方医科大学动物实验中心提供。根据随机(随机数字法)对照原则分为以下4组:假手术组、脓毒症1 d组、脓毒症4 d组、脓毒症7 d组,每组9只(荧光素钠检测3只,Western blot检测3只,免疫荧光检测3只)。本项实验全程遵守动物实验伦理相关原则。
1.3 建立脓毒症大鼠模型SD大鼠禁食过夜,但不禁饮。称重记录每只大鼠的体质量并编号,按照50 mg/kg体质量腹腔注射3%的戊巴比妥钠麻醉动物。采用盲肠结扎穿孔术(CLP)建立脓毒症大鼠模型。将SD大鼠仰卧位固定于操作台上,腹部备皮后使用安尔碘消毒,沿腹白线分别剪开皮肤和肌肉层,切口长约1.5~2.0 cm。于腹中找到盲肠并轻拉至腹腔外,将盲肠末端与回盲部连线的中点部位结扎,使用18 G的注射针来回贯穿盲肠4次,随后轻按盲肠挤出一粒米粒大小的粪便。将盲肠回纳入腹腔后缝合肌层和皮肤,皮下注射预热的生理盐水5 mL/100 mg进行液体复苏,术后注意保暖。
1.4 血脑屏障通透性检测荧光素钠用于检测大鼠血脑屏障的通透性改变[5]。大鼠安乐死之前30 min从尾静脉注射4%荧光素钠4 mL/kg,实验结束后暴露心脏使用冷的生理盐水进行灌注。取大脑皮层组织并称重,精确至0.1 mg,随后加入70%三氯乙酸沉淀蛋白,使用电动研磨器研磨制备脑组织匀浆。随后于4 ℃ 10 000 ×g离心15 min,取上清液使用荧光分光光度计测量波长为480/538 nm(激发光/发射光波长)时的吸光度,并根据标准曲线计算脑组织中的荧光素钠含量。
1.5 Western blot检测根据总蛋白提取试剂盒说明书提取大鼠皮层组织总蛋白,BCA法检测组织蛋白浓度,并使用RIPA裂解液配平各组蛋白。随后于100 ℃加热变性蛋白10 min。按照分组将各组蛋白样品加入上样孔中,凝胶电泳分离蛋白,随后使用孔径为0.2 μm的PVDF膜将蛋白湿转于膜上。使用5%脱脂牛奶封闭1 h,根据目的蛋白相对分子质量大小进行裁膜,随后将蛋白条带放入Claudin-5(1:500)、Occludin(1:1 000)、ZO-1(1:1 000)的一抗工作液中,4 ℃孵育过夜。次日将蛋白条带放入二抗(1:3 000)室温孵育1h后,放置于超灵敏化学发光成像系统中自动曝光成像,使用Image J软件对蛋白条带进行灰度分析。
1.6 免疫荧光检测制作大鼠脑组织冰冻切片并置于-80 ℃保存。取各组的脑组织冰冻切片恢复至室温,PBS漂洗后使用免疫组织化学笔勾圈,封闭透膜(5%BSA加0.1%Triton X-100)1 h。加入一抗Claudin-5(1:100)、Occludin(1:200)、ZO-1(1:200)、CD31(1:200),4 ℃孵育过夜。次日加入二抗(1:250),室温孵育1 h。使用含DAPI的抗荧光淬灭剂封片,并置于荧光显微镜下观察拍照。
1.7 统计学方法数据采用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(Mean±SD)表示,多组数据间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果采用盲肠结扎穿孔术建立脓毒症大鼠模型后,观察大鼠的状态并且记录各组大鼠体质量变化情况。和假手术组大鼠相比较,脓毒症组的大鼠呼吸急促,精神萎靡、反应迟钝,活动量少、进食饮水少,腹胀明显,排稀便。腹腔解剖可见肠系膜黏连,近端肠管扩张,盲肠结扎部位颜色暗红且表面有脓液渗出,整个腹腔可见血性渗出液。见图 1。
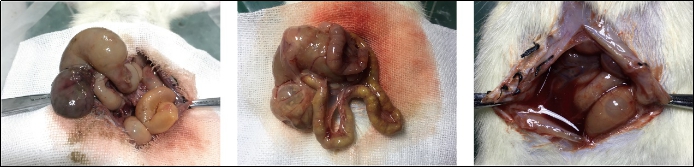
|
| 脓毒症大鼠的腹腔解剖图,可见肠系膜黏连,近端肠管扩张,盲肠结扎部位颜色暗红且表面有脓液渗出,血性渗出液弥漫整个腹腔 图 1 脓毒症大鼠的腹腔解剖图 Fig 1 Anatomy of the abdominal cavity of sepsis rats |
|
|
和假手术组相比较,脓毒症组的大鼠体质量下降,随着脓毒症的病程发展,大鼠体质量持续降低,脓毒症7 d组的大鼠体质量最低,且明显低于脓毒症4 d(P < 0.05)、脓毒症1 d(P < 0.05)以及假手术组(P < 0.05)的大鼠。见表 1。
| 分组 | 体质量(g) |
| 假手术组 | 251±4.2a |
| 脓毒症1 d组 | 240±5.4a |
| 脓毒症4 d组 | 213±7.9a |
| 脓毒症7 d组 | 172±5.8 |
| 注:aP<0.05 | |
荧光素钠定量的结果显示:和假手术组相比,脓毒症1 d组的大鼠脑组织中的荧光素钠含量显著增加(P < 0.05)。随着脓毒症的病程发展,荧光素钠含量持续增加,脓毒症7 d组的荧光素钠含量最高,且明显高于脓毒症4 d(P < 0.05)、脓毒症1 d(P < 0.05)以及假手术组(P < 0.05)的大鼠。见图 2。
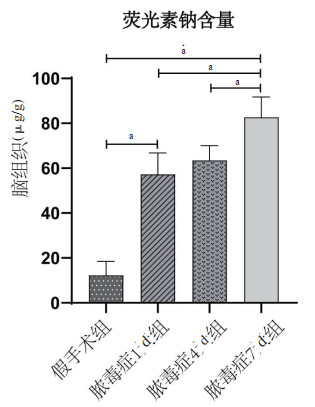
|
| 各组大鼠脑组织中的荧光素钠含量测定,aP < 0.05 图 2 假手术组和脓毒症大鼠脑组织的荧光素钠含量(n=3) Fig 2 The content of fluorescein sodium in sham-operated rats and sepsis rats (n=3) |
|
|
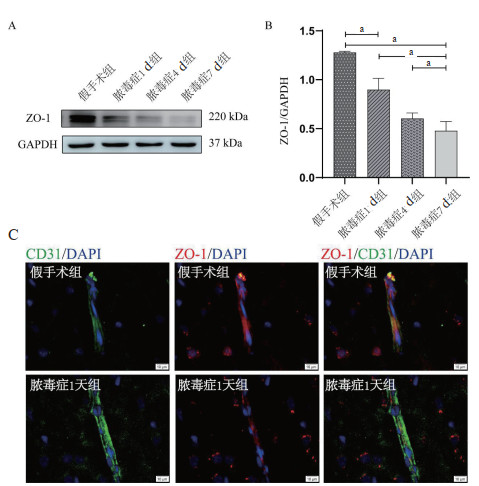
Western blot的结果显示:和假手术组大鼠相比,脓毒症1 d组的大鼠脑组织中的Claudin-5(P < 0.05)、Occludin(P < 0.05)、ZO-1(P < 0.05)的表达量明显下调。随着脓毒症的病程发展,紧密连接蛋白的表达量持续降低。
脓毒症7 d的大鼠脑组织中的紧密连接蛋白Claudin-5、Occludin、ZO-1的表达量最低,并且明显低于脓毒症4 d(Claudin-5:P < 0.05;Occludin:P < 0.05;ZO-1:P < 0.05)、脓毒症1 d(Claudin-5:P < 0.05;Occludin:P < 0.05;ZO-1:P < 0.05)以及假手术组的大鼠(Claudin-5:P < 0.05;Occludin:P < 0.05;ZO-1:P < 0.05)。见图 3A-B,图 4A-B,图 5A-B。
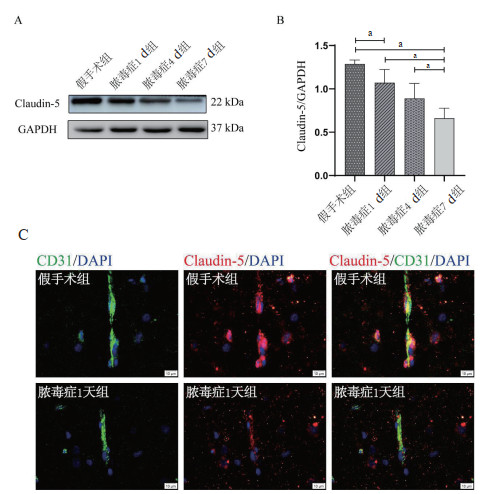
|
| A,B:Western blot检测各组Claudin-5的蛋白表达,aP < 0.05; C:免疫荧光检测各组的CD31+脑微血管内皮细胞(绿色),Claudin-5(红色),Claudin-5和脑微血管内皮细胞的共定位(Merge);水平标尺:10 μm 图 3 脓毒症大鼠下调Claudin-5的表达(n=6) Fig 3 The expression of Claudin-5 decreased in sepsis rats (n=6) |
|
|
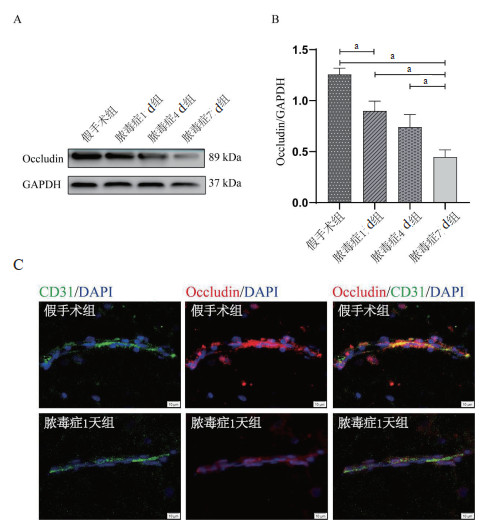
|
| A,B:Western blot检测各组Occludin的蛋白表达,aP < 0.05; C:免疫荧光检测各组的CD31+脑微血管内皮细胞(绿色),Occludin(红色),Occludin和脑微血管内皮细胞的共定位(Merge);水平标尺:10 μm 图 4 脓毒症大鼠下调Occludin的表达(n=6) Fig 4 The expression of Occludin decreased in sepsis rats (n=6) |
|
|
|
| A,B:Western blot检测各组ZO-1的蛋白表达,aP < 0.05; C:免疫荧光检测各组的CD31+脑微血管内皮细胞(绿色),ZO-1(红色),ZO-1和脑微血管内皮细胞的共定位(Merge);水平标尺:10 μm 图 5 脓毒症大鼠下调ZO-1的表达(n=6) Fig 5 The expression of ZO-1 decreased in sepsis rats (n=6) |
|
|
免疫荧光的结果显示:和假手术组相比,脓毒症1 d组的大鼠脑组织中的红色荧光强度(Claudin-5、Occludin、ZO-1的表达)明显降低。见图 3C,图 4C,图 5C。
3 讨论脓毒症是感染引起的全身炎症反应综合征,具有病情发展迅速、病死率高和易发后遗症等临床特点[6]。因此,脓毒症患者的救治相对复杂困难。而脓毒症早期的病理生理特征不明显,当发生发展为全身性改变时,系统性炎症级联反应已经形成,此时的治疗措施更倾向于对症治疗。其中,脓毒症对脑组织造成的损伤多为急性反应,主要是因为循环系统中的毒害成分透过血脑屏障诱导脑组织损伤,表现为弥漫性脑功能障碍[7]。脓毒症幸存者遗留长期的致残性认知功能障碍,或存在记忆力、注意力等功能损害[8]。在本项研究中,在脓毒症1 d的大鼠脑组织中可以检测到荧光素钠的含量升高,是假手术组大鼠荧光素钠的含量的4倍以上,提示荧光素钠的渗漏增加,脓毒症诱导血脑屏障通透性增加。
血脑屏障是保证大脑内环境基本稳定、调节中枢神经系统生理功能的重要结构,由脑微血管内皮细胞及其细胞间的紧密连接、完整的基膜、周细胞以及星形胶质细胞脚板围成的神经胶质膜构成。上述任一组分结构的破坏都可能造成血脑屏障功能障碍[9-10]。
脓毒症破坏血脑屏障的病理生理机制尚未明确,目前多认为是血源性细胞因子和活性氧对脑微血管内皮细胞的破坏导致血脑屏障通透性增加。脑微血管内皮细胞是外周物质进入中枢神经系统的第一道防线,被认为是调控BBB通透性的核心环节。其中,脑微血管内皮细胞之间的紧密连接蛋白复合物可以封闭细胞旁运输途径,是限制BBB两侧的物质转运的物理结构基础,Claudin-5、Occludin以及ZO-1是重要构成部分。在本项研究中,通过建立脓毒症大鼠模型发现,和假手术组相比较,脓毒症大鼠中的血脑屏障紧密连接蛋白(Claudin-5、Occludin和ZO-1)表达量降低、荧光素钠渗漏增加,提示脓毒症可以增加血脑屏障通透性,脓毒症对血脑屏障有损伤作用。这些与其他文献报道一致,但脓毒症是否导致血脑屏障通透性的持续破坏尚未见报道。因此,提取脓毒症1 d、4 d、7 d的大鼠脑组织,检测脑组织荧光素钠的含量以及血脑屏障紧密连接蛋白的表达。
实验结果发现,随着脓毒症的病程发展,紧密连接蛋白(Claudin-5、Occludin和ZO-1)的表达量持续降低、荧光素钠渗漏持续升高。脓毒症7 d的大鼠脑组织中的紧密连接蛋白的表达量最低,并且明显低于脓毒症4 d、脓毒症1 d以及假手术组的大鼠;脓毒症7 d的大鼠脑组织中的荧光素钠含量最高,并且明显高于脓毒症4 d、脓毒症1 d以及假手术组的大鼠。提示脓毒症持续的时间越久,血脑屏障的通透性越高。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for Sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287.[PubMed |
| [2] | Lelubre C, Vincent JL. Mechanisms and treatment of organ failure in Sepsis[J]. Nat Rev Nephrol, 2018, 14(7): 417-427. DOI:10.1038/s41581-018-0005-7 |
| [3] | Meneses G, Cárdenas G, Espinosa A, et al. Sepsis: developing new alternatives to reduce neuroinflammation and attenuate brain injury[J]. Ann N Y Acad Sci, 2019, 1437(1): 43-56. DOI:10.1111/nyas.13985 |
| [4] | Zhao Z, Nelson AR, Betsholtz C, et al. Establishment and dysfunction of the blood-brain barrier[J]. Cell, 2015, 163(5): 1064-1078. DOI:10.1016/j.cell.2015.10.067 |
| [5] | de Oliveira J, Engel DF, de Paula GC, et al. High cholesterol diet exacerbates blood-brain barrier disruption in LDLr-/- mice: impact on cognitive function[J]. J Alzheimers Dis, 2020, 78(1): 97-115. DOI:10.3233/JAD-200541 |
| [6] | Cecconi M, Evans L, Levy M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. DOI:10.1016/s0140-6736(18)30696-2 |
| [7] | Gofton TE, Young GB. Sepsis-associated encephalopathy[J]. Nat Rev Neurol, 2012, 8(10): 557-566. DOI:10.1038/nrneurol.2012.183 |
| [8] | Zanotti-Cavazzoni SL. Long-term cognitive impairment and functional disability among survivors of severe Sepsis[J]. Yearb Crit Care Med, 2011, 2011: 188-190. DOI:10.1016/j.yccm.2010.12.025 |
| [9] | Xiao MJ, Xiao ZJ, Yang BB, et al. Blood-brain barrier: more contributor to disruption of central nervous system homeostasis than victim in neurological disorders[J]. Front Neurosci, 2020, 14: 764. DOI:10.3389/fnins.2020.00764 |
| [10] | Obermeier B, Daneman R, Ransohoff RM. Development, maintenance and disruption of the blood-brain barrier[J]. Nat Med, 2013, 19(12): 1584-1596. DOI:10.1038/nm.3407 |
 2021, Vol. 30
2021, Vol. 30




