新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)的发病率随着早产儿存活率的提高而逐年增加[1]。RDS的发病率与胎龄成负相关,几乎所有在孕22~28周出生的早产儿均会发生RDS,孕34~36周出生的早产儿中约有3%会发生RDS。患RDS的早产儿不仅病死率高达50%,幸存者后期也常会由于发生儿童慢性肺部疾病而影响生命安全和生活质量[2-3]。RDS多发生在肺发育的管状期晚期或囊状期早期,通常归因于周围气道发育不良和肺表面活性物质(pulmonary surfactant,PS)的产生及分泌减少或延迟。PS是一种由肺泡Ⅱ型细胞合成、包装和分泌的磷脂-蛋白质复合物,不仅能降低肺泡气液界面张力,还可在呼气末保持肺泡扩张[4-5]。近年来多项研究表明遗传因素可能增加RDS的发病率[6]。与异卵双胞胎相比,同卵双胞胎中发生RDS的机率更高,表面活性物质相关基因的突变可能会增加新生儿发生RDS的风险[7]。三磷酸腺苷结合盒A3转运体(ATP-binding cassette transporter A3,ABCA3)定位于板层小体的界限膜,是PS细胞内储存的细胞器。国内外研究证明,ABCA3错义突变可能导致ABCA3蛋白的运输受损或功能障碍,ABCA3的纯合子或复合杂合突变、非同义突变与致死性新生儿RDS有关[8-9]。目前非同义ABCA3基因突变增加了新生儿患RDS的风险,但关于不改变氨基酸序列却可能改变内含子-外显子剪接、剪接控制元件、信使RNA稳定性、翻译效率或蛋白质折叠的同义突变知之甚少。因此,本研究拟通过对内蒙古地区蒙汉族RDS患儿进行ABCA3外显子基因测序,以明确ABCA3外显子同义突变位点,进一步了解ABCA3基因同义突变与蒙汉族RDS发生的相关性,从分子遗传学水平探讨RDS的发病机制。
1 资料与方法 1.1 一般资料研究对象来自内蒙古医科大学附属医院新生儿科于2018年01月至2019年06月收治的蒙汉族患儿,RDS组纳入标准:符合欧洲颁布的RDS诊断标准的蒙汉族新生儿。对照组纳入标准:与RDS组同期住院的非RDS患儿。RDS组与对照组蒙汉族患儿均需为直系三代亲属居住在内蒙古地区的蒙汉族,家属均知情同意并签署知情同意书。RDS组与对照组均需符合以下排除标准:(1)先天性心肺畸形、肺发育不良、培养阳性的脓毒症、染色体异常等; (2)生后重度窒息患儿; (3)母亲孕期有明确感染史或患有妊娠期糖尿病。
本研究经内蒙古医科大学附属医院伦理委员会批准(批准号:2021012)。
1.2 方法 1.2.1 基因组DNA提取对纳入的研究对象采集外周静脉血2 mL(2.5%枸椽酸钠溶液抗凝)并封存于EDTA抗凝管中,使用血液基因组DNA提取试剂盒(SK8224)从血液样本中提取基因组DNA,对提取后的DNA进行PCR扩增,利用2%琼脂糖凝胶电泳分离PCR扩增产物,并运用紫外分光光度计分析DNA样本的纯度和浓度。电泳图见图 1。
|
| 图 1 ABCA3基因经PCR扩增后在1%琼脂糖凝胶电泳图 Fig 1 Electrophoretic map of ABCA3 gene amplified by PCR in 1% agarose gel |
|
|
采用第二代高通量测序技术对ABCA3基因所有外显子及相邻内含子区域(约50个碱基对)进行测序:本次实验与中国上海生工有限公司合作,测序环节交由该公司进行。将提取的基因组DNA片段化后进行纯化,PCR扩增后连接上Illumina公司提供的接头,对加上接头的片段进行凝胶电泳,回收条带,将回收的产物用通用引物进行18个循环的扩增及纯化,并按照Illumaina公司的说明完成40个循环的测序。利用Alamut软件评估内含子与外显子交界区碱基改变是否为剪接位点突变及其邻近位点变异对mRNA剪接的影响。若发现某位点确定或可能与临床表型相关,采用Sanger测序或其他检测方法进行验证。
1.2.3 统计学方法以SPSS 20.0软件进行统计学分析。符合正态分布的计量资料采用均数±标准差(Mean±SD)表示,,组间比较采用成组t检验; 计数资料以率或百分比(%)表示,组间比较采用χ2检验。以P < 0.05视为差异有统计学意义。
2 结果 2.1 两组患儿一般情况入选蒙古族患儿82例,包括RDS患儿37例及非RDS患儿45例,入选汉族患儿132例,包括RDS患儿64例及非RDS患儿68例,两组一般情况比较差异无统计学意义(P>0.05),见表 1。
| 蒙古族 | 汉族 | ||||||||
| 指标 | RDS组 (n=37) |
对照组 (n=45) |
χ2/t值 | P值 | RDS组 (n=64) |
对照组 (n=68) |
χ2/t值 | P值 | |
| 性别(n) | |||||||||
| 男 | 21 | 22 | 0.504a | 0.478 | 34 | 32 | 0.485a | 0.486 | |
| 女 | 16 | 23 | 30 | 36 | |||||
| 胎龄(Mean±SD,周) | |||||||||
| <32周 | 30.5±0.7 | 30.6±0.7 | -1.167b | 0.243 | 30.4±0.7 | 30.5±0.8 | -1.894b | 0.058 | |
| 32周≤且<37周 | 32.7±0.6 | 32.6±0.8 | 1.366b | 0.172 | 32.9±0.8 | 32.8±0.8 | 1.649b | 0.099 | |
| ≥37周 | 37.1±0.1 | 37.2±0.2 | -0.957b | 0.339 | 37.2±0.2 | 37.3±0.2 | -0.517b | 0.605 | |
| 出生体质量(g) | 1378±145 | 1376±144 | 1.477b | 0.140 | 1377±142 | 1375±139 | 2.080b | 0.380 | |
| 分娩方式(n) | |||||||||
| 顺产 | 13 | 16 | 0.002a | 0.968 | 23 | 29 | 0.622a | 0.430 | |
| 剖宫产 | 24 | 29 | 41 | 39 | |||||
| 规律促肺成熟(n) | |||||||||
| 是 | 26 | 31 | 0.018a | 0.892 | 43 | 40 | 0.988a | 0.320 | |
| 否 | 11 | 14 | 21 | 28 | |||||
| 注:a以例表示,统计值为χ2值; b以Mean±SD表示,统计值为t值 | |||||||||
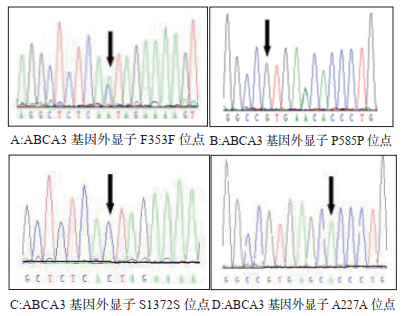
214名患儿基因检测结果提示F353F、P585P、A227A、V150V、L982L、A928A、S1372S、P1653P、E1618E、及A1027A等多个位点均出现同义突变,其中F353F、P585P、A227A和S1372S四个同义变异体较常见,且符合哈代-温伯格平衡。使用Alamut软件,发现没有任何同义变异体被预测破坏内含子-外显子剪接。见图 2。
|
| 图 2 ABCA3碱基序列图 Fig 2 ABCA3 base sequence diagram |
|
|
对所有入组的患儿ABCA3外显子进行基因测序,外里子基因测序结果显示,无论蒙古族与汉族,RDS组患儿ABCA3基因同义突变频率与对照组患儿相比,差异均有统计学意义(蒙古族:χ2=9.402,P=0.002;汉族:χ2=9.348,P=0.002),其中蒙汉族RDS患儿F353F位点及P585P位点突变率高于对照组,差异有统计学意义(蒙古族F353F位点:χ2=5.270,P=0.022;汉族F353F位点:χ2=5.532,P=0.019。蒙古族P585P位点:χ2=4.711,P=0.030;汉族P585P位点:χ2=4.480,P=0.034)。见表 2,3。
| 突变位点 | 蒙古族 | 汉族 | |||||||
| RDS组(n=37) | 对照组(n=45) | χ2值 | P值 | RDS组(n=64) | 对照组(n=68) | χ2值 | P值 | ||
| F353F | 16(21.62) | 8(8.89) | 5.270 | 0.022 | 29(22.66) | 16(11.76) | 5.532 | 0.019 | |
| P585P | 13(17.57) | 6(6.67) | 4.711 | 0.030 | 20(15.63) | 10(7.35) | 4.480 | 0.034 | |
| A227A | 2(2.70) | 4(4.44) | 0.030 | 0.862 | 3(2.34) | 5(3.68) | 0.074 | 0.786 | |
| V150V | 1(1.35) | 0 | 0.010 | 0.922 | 1(0.78) | 1(0.74) | 0.498 | 0.480 | |
| L982L | 0 | 0 | - | - | 1(0.78) | 0 | 0.010 | 0.920 | |
| A928A | 1(1.35) | 0 | 0.010 | 0.922 | 1(0.78) | 1(0.74) | 0.030 | 0.862 | |
| S1372S | 3(4.05) | 5(5.56) | 0.006 | 0.936 | 2(1.56) | 4(2.94) | 0.114 | 0.735 | |
| P1653P | 0 | 0 | - | - | 0 | 1(0.74) | 0.820 | 0.365 | |
| E1618E | 0 | 0 | - | - | 1(0.78) | 0 | 1.790 | 0.181 | |
| A1027A | 0 | 0 | - | - | 1(0.78) | 0(0.00) | 0.000 | 1.000 | |
| 突变总频率 | 36(48.65) | 23(25.56) | 9.402 | 0.002 | 59(46.09) | 38(27.94) | 9.348 | 0.002 | |
| 欧洲婴儿 | 非洲婴儿 | 内蒙古蒙古族婴儿 | 内蒙古汉族婴儿 | ||||||||||||
| 突变位点 | RDS组 (n=109) |
对照组 (n=158) |
P值 | RDS组 (n=44) |
对照组 (n=192) |
P值 | RDS组 (n=37) |
对照组 (n=45) |
P值 | RDS组 (n=64) |
对照组 (n=68) |
P值 | |||
| V150V | 1(0.0046) | 5(0.016) | 0.41 | 13(0.15) | 50(0.13) | 0.61 | 1(0.0135) | 0 | 0.922 | 1(0.0078) | 1(0.0074) | 0.480 | |||
| A227A | 5(0.023) | 8(0.025) | 1.00 | 1(0.011) | 1(0.0026) | 0.33 | 2(0.027) | 4(0.0444) | 0.862 | 3(0.0234) | 5(0.0368) | 0.786 | |||
| F353F | 26(0.12) | 41(0.13) | 0.79 | 4(0.045) | 30(0.077) | 0.37 | 16(0.216) | 8(0.0889) | 0.022 | 29(0.2266) | 16(0.1176) | 0.019 | |||
| P585P | 40(0.18) | 61(0.19) | 0.82 | 7(0.080) | 33(0.084) | 1.00 | 13(0.176) | 6(0.0667) | 0.030 | 20(0.1563) | 10(0.0735) | 0.034 | |||
| A928A | 0 | 1(0.0032) | 1.00 | - | - | - | 1(0.0135) | 0 | 0.922 | 1(0.0078) | 1(0.0074) | 0.862 | |||
| L982L | 1(0.0046) | 0 | 0.41 | - | - | - | - | - | - | 1(0.0078) | 0 | 0.920 | |||
| A1027A | 0 | 1(0.0032) | 1.00 | - | - | - | - | - | - | 1(0.0078) | 0(0.00) | 1.000 | |||
| S1372S | 18(0.083) | 36(0.11) | 0.25 | 21(0.24) | 77(0.20) | 0.38 | 3(0.0405) | 5(0.0556) | 0.936 | 2(0.0156) | 4(0.0294) | 0.735 | |||
| E1618E | 0 | 1(0.0032) | 1.00 | - | - | - | - | - | - | 1(0.0078) | 0 | 0.181 | |||
| V1648V | 0 | 1(0.0032) | 1.00 | - | - | - | - | - | - | - | - | ||||
| P1653P | 0 | 2(0.0063) | 0.52 | - | - | - | - | - | - | 0 | 1(0.074) | 0.365 | |||
| A279A | - | - | - | 1(0.011) | 0 | 0.18 | - | - | - | - | - | - | |||
| I318I | - | - | - | 1(0.011) | 1(0.0026) | 0.33 | - | - | - | - | - | - | |||
| P343P | - | - | - | 0 | 1(0.0026) | 1.00 | - | - | - | - | - | - | |||
| V623V | - | - | - | 1(0.011) | 3(0.0077) | 0.56 | - | - | - | - | - | - | |||
| Y754Y | - | - | - | 0 | 2(0.0051) | 1.00 | - | - | - | - | - | - | |||
| H780H | - | - | - | 1(0.011) | 1(0.0026) | 0.33 | - | - | - | - | - | - | |||
| 突变总频率 | 91(0.42) | 157(0.50) | 0.078 | 41(0.47) | 199(0.51) | 0.50 | 36(0.49) | 23(0.26) | 0.002 | 59(0.46) | 38(0.28) | 0.002 | |||
RDS是新生儿呼吸衰竭和死亡的最重要原因之一[10],其发病率随着胎龄的降低而增加。出生胎龄小于28周的早产儿患RDS的风险最高,发病率约为93%,然而,晚期早产儿同样可发生RDS,一项包括233,844次分娩的研究显示,分别在妊娠34周、35周、36周、37周和≥38周出生的新生儿中有10.5%、6.0%、2.8%、1.0%和0.3%的新生儿诊断RDS[11-12]。近年来随着RDS呼吸管理的不断完善、整体医疗技术的快速发展、PS和机械通气在临床实践中的广泛应用,使RDS的发病率在一定程度上有所下降[13],但持续供氧和机械通气却成为RDS进一步发展为支气管肺发育不良(bronchopulmonary dysplasia,BPD)的危险因素,严重的肺功能损害大大降低了儿童的生活质量和存活率[14-15]。鉴于目前RDS较高的发病率和病死率,明确该病的发病机制及影响因素是我们新生儿科医生的当务之急。随着临床对RDS的日益关注,学者们发现RDS是一种多基因、多因素共同参与的疾病,不仅种族、性别、胎龄、出生体质量、产前是否规律使用激素、母亲是否合并妊娠期糖尿病等会影响RDS的发生风险,遗传因素也是RDS易感的主要原因[16]。国内外研究报道,SCNN1A基因rs4149570和rs7956915位点多态性可能在足月儿RDS易感性中发挥重要作用; SP-A、SP-B基因变异可能增加早产儿RDS的发生风险[17-18],以上研究均提示遗传因素可影响RDS的发生发展。
ABCA3基因共编码33个外显子,由80 000多个核苷酸碱基组成,可转录6500 bp的mRNA。ABCA3对于板层小体的生成、胆固醇及磷脂进入板层小体组装肺表面活性物质的运输是必不可少的[19-20],因此ABCA3基因突变可能导致板层小体生成障碍及PS生成减少,进而引起蛋白质错误折叠,导致功能障碍。自Shulenin等[21]研究者首次报道ABCA3基因突变可导致肺部疾病以来,越来越多的研究发现ABCA3基因突变可能增加了多种疾病的遗传易感性。ABCA3基因是PS相关基因中突变率相对较高的基因,目前已报道ABCA3基因突变约有200多种,包括无义突变、移码突变、错义突变和插入/缺失等。研究发现ABCA3基因内的错义突变可以不同方式影响PS的稳态:如破坏细胞内ABCA3蛋白的定位(c.643C > A,p.Q215K; c.2279T > G,p.M760R)及破坏ABCA3蛋白的脂质转运(c.875A > T,p.E292V; c.4164G > C,p.K1388N)等[22]。大多数ABCA3基因突变均可导致严重的新生儿肺部疾病,且在没有肺移植的情况下,ABCA3的移码或无义突变的纯合子或复合杂合子可导致新生儿呼吸衰竭,并多会在婴儿期死亡[23]。
有研究证实,ABCA3 exon10区域rsl3332514(F353F)位点存在单个碱基点突变C > T,等位基因T可能是RDS的易感基因之一[24],上述研究均证明ABCA3基因突变可能是RDS发生的遗传易感因素。
同义突变是指当碱基置换使某一密码子发生改变时,由于遗传密码子具有兼并性,新旧密码子所编码的氨基酸种类相同,仍可编码同一蛋白质,因此同义突变又被认为是沉默突变,并不产生突变效应。也正是由于其碱基改变并不影响所编码的蛋白质产物,因此对于同义突变是否参与疾病的发生发展仍是目前探索的重点问题。近年研究发现,同义突变可因氨基酸对兼并密码子的翻泽效率不同,或转录水平的差异而使蛋白质表达改变,进而导致疾病的发生,使得同义突变为沉默突变的观点受到挑战。本研究通过对内蒙古地区蒙汉族RDS患儿及对照组进行ABCA3外显子基因测序,结果显示:(1)蒙汉族RDS患儿与对照组患儿多个位点均出现同义突变,如:F353F、P585P、A227A、V150V、L982L、A928A、S1372S、P1653P、E1618E、及A1027A等; (2)p.A227A,p.F353F,p.P585P和p.S1372S四个同义变异体是蒙汉族RDS患儿与对照组患儿常见的同义突变体; (3)无论蒙古族与汉族,RDS组患儿ABCA3基因同义突变频率均高于对照组患儿,差异有统计学意义,提示ABCA3基因的同义变异可能会增加蒙汉族新生儿患RDS的风险; (4)蒙汉族RDS患儿F353F位点及P585P位点突变率高于对照组患儿,差异有统计学意义,提示F353F位点及P585P位点可能是内蒙古地区蒙汉族新生儿患RDS的易感基因之一。本团队前期研究发现,SP-B 1580C等位基因可能是内蒙古地区汉族新生儿患RDS的易感基因之一,而与内蒙古地区蒙古族患儿发生RDS无明显相关。携带SP-C外显子5(S186N)位点A等位基因的蒙古族早产儿患RDS的风险更高,但尚未发现该位点与内蒙古地区汉族RDS的发生有明显相关性。Wambach等[25]对欧洲及非洲RDS患儿与对照组进行ABCA3基因外显子测序,结果提示ABCA3基因同义突变不会增加早产儿患RDS的风险,与本研究结果相反。上述研究均提示地域及种族背景差异可能是分析RDS遗传易感性的重要因素。
ABCA3基因遗传变异的研究有望为新生儿疾病的诊断和治疗开拓新视野,本研究结果表明,ABCA3基因同义突变可能是蒙汉族新生儿患RDS的重要危险因素之一,其中F353F位点及P585P位点可能是内蒙古地区蒙汉族新生儿患RDS的易感基因。本团队致力于新生儿呼吸系统疾病的分子遗传学研究,遗传因素所致的RDS往往症状较重且不可逆,因此笔者团队渴望通过基因检测技术进一步深入了解基因变异与新生儿疾病的相关性,以尽早制定最优化的个体治疗方案。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Qari SA, Alsufyani AA, Muathin SH. Prevalence of respiratory distress syndrome in neonates[J]. Egyp J Hosp Med, 2018, 70(2): 257-264. DOI:10.12816/0043086 |
| [2] | McPherson C, Wambach JA. Prevention and treatment of respiratory distress syndrome in preterm neonates[J]. Neonatal Netw, 2018, 37(3): 169-177. DOI:10.1891/0730-0832.37.3.169 |
| [3] | Xiang JJ, Wang P. Efficacy of pulmonary surfactant combined with high-dose ambroxol hydrochloride in the treatment of neonatal respiratory distress syndrome[J]. Exp Ther Med, 2019, 18(1): 654-658. DOI:10.3892/etm.2019.7615 |
| [4] | Özkan H, Erdeve Ö, Kutman HGK. Turkish Neonatal Society guideline on the management of respiratory distress syndrome and surfactant treatment[J]. Turk Pediatri Ars, 2018, 53: S45-S54. DOI:10.5152/TurkPediatriArs.2018.01806 |
| [5] | Marseglia L, D'Angelo G, Granese R, et al. Role of oxidative stress in neonatal respiratory distress syndrome[J]. Free Radic Biol Med, 2019, 142: 132-137. DOI:10.1016/j.freeradbiomed.2019.04.029 |
| [6] | Tsitoura MI, Stavrou EF, Maraziotis IA, et al. Surfactant protein A and B gene polymorphisms and risk of respiratory distress syndrome in late-preterm neonates[J]. PLoS One, 2016, 11(11): e0166516. DOI:10.1371/journal.pone.0166516 |
| [7] | Shen CL, Zhang QY, Meyer Hudson J, et al. Genetic factors contribute to risk for neonatal respiratory distress syndrome among moderately preterm, late preterm, and term infants[J]. J Pediatr, 2016, 172: 69-74. DOI:10.1016/j.jpeds.2016.01.031 |
| [8] | Schindlbeck U, Wittmann T, Höppner S, et al. ABCA3 missense mutations causing surfactant dysfunction disorders have distinct cellular phenotypes[J]. Hum Mutat, 2018, 39(6): 841-850. DOI:10.1002/humu.23416 |
| [9] | Wambach JA, Wegner DJ, Depass K, et al. Single ABCA3 mutations increase risk for neonatal respiratory distress syndrome[J]. Pediatrics, 2012, 130(6): e1575-e1582. DOI:10.1542/peds.2012-0918 |
| [10] | Donda K, Vijayakanthi N, Dapaah-Siakwan F, et al. Trends in epidemiology and outcomes of respiratory distress syndrome in the United States[J]. Pediatr Pulmonol, 2019, 54(4): 405-414. DOI:10.1002/ppul.24241 |
| [11] | Büke B, Destegül E, Akkaya H, et al. Prediction of neonatal respiratory distress syndrome via pulmonary artery Doppler examination[J]. J Matern Fetal Neonatal Med, 2019, 32(10): 1640-1645. DOI:10.1080/14767058.2017.1413549 |
| [12] | 李秋芳, 邵芳, 俞晓明, 等. 低体质量低孕龄早产儿重度新生儿呼吸窘迫综合征伴严重并发症的抢救[J]. 中华急诊医学杂志, 2010, 19(2): 210-212. DOI:10.3760/cma.j.issn.1671-0282.2010.02.028 |
| [13] | Jeon GW. Surfactant preparations for preterm infants with respiratory distress syndrome: past, present, and future[J]. Korean J Pediatr, 2019, 62(5): 155-161. DOI:10.3345/kjp.2018.07185 |
| [14] | Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of respiratory distress syndrome-2019 update[J]. Neonatology, 2019, 115(4): 432-450. DOI:10.1159/000499361 |
| [15] | Chen F, Huang F, Zhan F. Correlation between serum transforming growth factor β1, interleukin-6 and neonatal respiratory distress syndrome[J]. Exp Ther Med, 2019, 18(1): 671-677. DOI:10.3892/etm.2019.7585 |
| [16] | Li Y, Wang WJ, Zhang DF. Maternal diabetes mellitus and risk of neonatal respiratory distress syndrome: a meta-analysis[J]. Acta Diabetol, 2019, 56(7): 729-740. DOI:10.1007/s00592-019-01327-4 |
| [17] | Tsitoura MI, Stavrou EF, Maraziotis IA, et al. Surfactant protein A and B gene polymorphisms and risk of respiratory distress syndrome in late-preterm neonates[J]. PLoS One, 2016, 11(11): e0166516. |
| [18] | 新春, 梅花, 张钰恒, 等. 蒙古族早产儿呼吸窘迫综合征与SP-A1 rs1059047、rs1136450位点基因多态性相关性研究[J]. 中华急诊医学杂志, 2019, 28(6): 702-706. DOI:10.3760/cma.j.issn.1671-0282.2019.06.009 |
| [19] | Somaschini M, Presi S, Ferrari M, et al. Surfactant proteins gene variants in premature newborn infants with severe respiratory distress syndrome[J]. J Perinatol, 2018, 38(4): 337-344. DOI:10.1038/s41372-017-0018-2 |
| [20] | Kinting S, Li Y, Forstner M, et al. Potentiation of ABCA3 lipid transport function by ivacaftor and genistein[J]. J Cell Mol Med, 2019, 23(8): 5225-5234. DOI:10.1111/jcmm.14397 |
| [21] | Shulenin S, Nogee LM, Annilo T, et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency[J]. N Engl J Med, 2004, 350(13): 1296-1303. DOI:10.1056/NEJMoa032178 |
| [22] | El Boustany P, Epaud R, Grosse C, et al. Unusual long survival despite severe lung disease of a child with biallelic loss of function mutations in ABCA-3[J]. Respir Med Case Rep, 2018, 23: 173-175. DOI:10.1016/j.rmcr.2018.03.004 |
| [23] | Beers MF, Mulugeta S. The biology of the ABCA3 lipid transporter in lung health and disease[J]. Cell Tissue Res, 2017, 367(3): 481-493. DOI:10.1007/s00441-016-2554-z |
| [24] | 梅花, 张钰恒, 张艳波, 等. ABCA3基因突变与蒙汉族新生儿呼吸窘迫综合征的相关性研究[J]. 中华新生儿科杂志, 2018, 33(6): 415-418. DOI:10.3760/cma.j.issn.2096-2932.2018.06.004 |
| [25] | Wambach JA, Wegner DJ, Heins HB, et al. Synonymous ABCA3 variants do not increase risk for neonatal respiratory distress syndrome[J]. J Pediatr, 2014, 164(6): 1316-21.e3. DOI:10.1016/j.jpeds.2014.02.021 |
 2021, Vol. 30
2021, Vol. 30




