食管异物导致的主动脉食管瘘(aortoesophageal fistula, AEF)是一种非常凶险的急症,病情进展迅猛、抢救难度大、病死率很高[1]。回顾2008年12月至2016年4月,浙江大学医学院附属第二医院心脏大血管外科经治了3例食管异物引起的AEF,现报道如下。
1 资料与方法病例1,女,53岁,1周前有鱼刺吞咽史,吞咽有异物感、伴疼痛,无呕血、黑便等情况。CT提示食管周围渗出伴气体影,考虑食管穿孔并发周围脓肿。胃镜示距门齿25 cm食管前壁可见0.5 cm缺损,周边黏膜充血水肿,未见明显异物。血常规提示白细胞及中性粒细胞百分比明显升高。入院后予禁食、广谱抗生素抗感染、营养支持等治疗。1周后患者突发大量呕血,胃镜示距门齿20~25 cm食道前壁一突向食道腔血肿。增强CT示主动脉弓内后方假性动脉瘤形成(图 1A)。考虑发生AEF。因患者有休克表现,急诊行主动脉腔内覆膜支架植入(thoracic endovascular aortic repair, TEVAR)。术后继续抗感染4周,复查CT提示假性动脉瘤消失、纵隔感染控制,随访3年无并发症后失访。
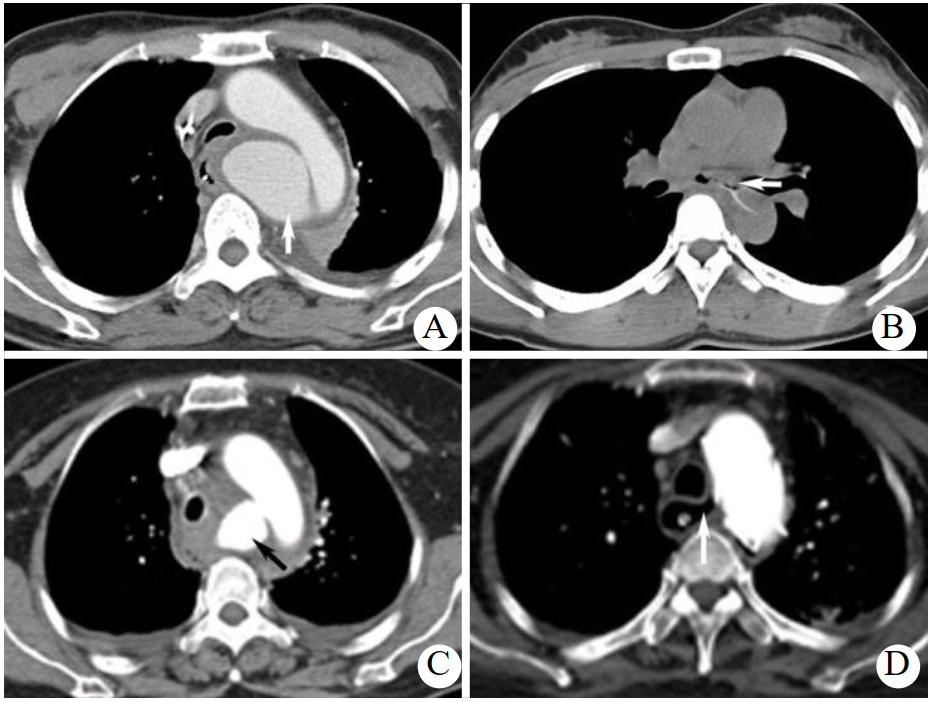
|
| A: 患者1增强CT显示主动脉弓内后方假性动脉瘤形成(箭头示);B: 患者2 CT平扫显示食管内异物刺穿食管壁,向左后刺入胸主动脉(箭头示);C:患者3 CTA显示主动脉弓假性动脉瘤形成(箭头示);D:患者3 CTA可见明显的AEF存在,瘘管非常清晰的与TEVAR术后的主动脉相连(箭头示) 图 1 三例患者增强CT结果 |
|
|
病例2,女,31岁,2 d前进食鱼肉后出现胸骨后吞咽疼痛,无发热、呕血等不适。胃镜示距门齿30 cm处一鱼刺样异物刺入食管壁。CT示气管分叉下方水平见一条状高密度影,向左后刺入胸主动脉,邻近纵隔内少许积气,邻近食道周围渗出改变,结合病史考虑食道内异物(鱼刺)刺入胸主动脉出现AEF(图 1B)。患者行急诊开胸手术,取右侧卧位股动静脉插管建立体外循环,打开纵隔胸膜后发现一枚2 cm左右长的锋利鱼刺刺破隆突下2 cm处食道左侧壁后刺入主动脉,未见明显脓肿形成,组织活力尚好。清除鱼刺、消毒冲洗后直接修补主动脉穿入点,同时以食管周围组织瓣缝合修补食道瘘口。胸腔手术完成后转平卧位行腹腔镜下空肠造瘘。患者术后恢复平稳,随访5年后失访。
病例3,女,56岁,1周前鱼刺伤、3 d前高热39 ℃伴频发呕鲜血入院。断层摄影血管造影(computed tomography angiography,CTA)示食管异物伴穿孔,主动脉弓假性动脉瘤形成(图 1C)。患者大出血后循环不稳定,急诊行TEVAR术控制出血,术毕造影无内漏,胃镜下再取出鱼刺。术后持续广谱抗生素抗感染、禁食、空肠置管营养支持。患者家属始终无法决定行开放手术彻底解决AEF。术后2个月复查CTA提示纵隔感染控制良好。食管造影及胃镜示瘘口愈合,患者恢复进食。术后7个月,患者因突发大量呕血再至本院,出现血压下降、昏迷等休克症状,立即予复苏抢救,胃镜示距门齿22 cm食管壁可见一占位,表面溃疡、糜烂伴出血,结合既往病史考虑原有食管瘘口再次破裂。经积极治疗后患者病情稳定。复查主动脉CTA可见明显的AEF存在,瘘管与TEVAR术后的主动脉明显相连(图 1D)。胃镜见距门齿23 cm处食管瘘口,并见TEVAR支架裸露。此后18个月患者在门诊复查数次CTA及胃镜均无明显变化。患者于术后27个月因发热再次入院,CTA示主动脉弓水平纵隔感染较前明显加重,经抗感染等治疗病情稳定后再次建议患者开放手术治疗未果,患者出院数个月后死亡。
本研究获得医院伦理管理委员会同意,批件号:(2020)伦审研第(371)号。
2 讨论AEF是一种罕见且非常凶险的疾病,病死率高达40%~60%[1-2]。首例AEF报道于1818年,直至1980年才有第1例成功治疗的案例[3]。引起AEF的病因包括主动脉瘤及主动脉术后并发症、食管异物、食管恶性肿瘤等,其中主动脉术后并发症中以TEVAR术后为主,其次为主动脉人工血管置换后,甚至可在距离主动脉术后264个月才发病[1, 4]。
食管异物多见于儿童,成人多以鱼刺、鸡骨、假牙等常见,其中亚洲人以鱼刺居多[5]。食管异物最常见于食管第1狭窄处颈段食管(环咽肌水平),其次是食管第2狭窄处胸段食管(主动脉弓水平),引起AEF的多位于与主动脉相邻的胸段食管。食管异物导致的AEF具有隐蔽性,患者可能拖延数日甚至数周就诊[6-7],纵隔感染严重,此外患者的临床表现往往不以主动脉损伤为首要症状,易与单纯上消化道出血混淆。因食管是开放腔道,食管穿孔后细菌将进入食管周围间隙,引起纵隔感染,主动脉因毗邻关系常受到侵犯腐蚀形成AEF,多以食管周围组织感染坏死、主动脉假性动脉瘤为表现。有部分食管异物逐步刺入主动脉形成AEF,这类患者的感染可能并不严重。还有极少数食管异物直接刺穿主动脉形成AEF,此类患者起病急骤、大出血情况迅速恶化,往往救治不及[8]。
如何准确诊断食管异物引起的AEF非常关键。这类患者多有明确的食管异物病史,可伴有吞咽困难、发热等症状,最典型的是Chiari三联征,包括胸骨后疼痛、前哨性呕血和无症状间歇期后大出血。食管异物引起AEF的Chiari三联征相比较于其他原因引起的AEF更典型[9]。前哨性呕血与后续大出血的间歇期从数小时到数个月不等[9],一旦发生大出血,病死率极高,要争取在黄金时间窗里将患者转运到有经验的救治中心进行抢救。增强CT或造影能发现主动脉周围气体影、血肿形成、造影剂渗出、假性动脉瘤形成等表现。胃镜多能发现位于食管第2狭窄处,食管异物及周围溃疡创面,但也有部分病例异物已经移位到食管外纵隔内或胃肠道,另外如果创面出血很多、胃镜可能难以分辨清楚,同时胃镜本身也有增加出血的风险。一旦确诊AEF应行急诊手术处理,不应尝试取出食管异物,否则会造成类似拔塞子样的主动脉大出血。此外,使用胃镜下止血夹子夹在食管瘘口处,可为后续检查及治疗进行精准定位[10]。
AEF一旦确诊,保守治疗几乎全部死亡[1, 8-9, 11-12],需急诊手术处理[1, 9, 13]。食管异物引起的AEF目前尚无统一理想的治疗方案。外科手术的目标是控制出血并修复主动脉、清除纵隔感染灶、防止食管穿孔的持续污染、修复食管缺损重建消化道。急性大出血的患者使用三腔二囊管能够暂时性地控制出血,为手术赢得时间[6-7, 9-10, 14-15]。
2.1 食管异物术式选择⑴主动脉的处理——TEVAR。食管异物引起的主动脉损伤的处理,是控制出血的关键。食管异物直接刺穿主动脉引起出血的非常少见,出血原因多是由于纵隔炎症腐蚀穿透主动脉壁引起,由于是污染创面,单用TEVAR治疗无法阻断病变进程,存在远期支架移植物感染、需开放手术扩大主动脉切除范围的可能,因此TEVAR能否作为终极治疗手段来治疗AEF是有很大争议的[1, 14, 16]。考虑到开放手术的并发症发生率和病死率,尽管有TEVAR成功治疗AEF的案例报道[7, 12, 17-23],在某些特定的病例中仍然可以采用TEVAR作为一种治疗主动脉的手段。但这些病例多需要附加胸外科食管纵隔的手术,如TEVAR术后行胸腔镜或开放手术下纵隔清创引流、食管修补[20, 22],以及联合食管内支架隔绝瘘口[12]等治疗,取得了很好的效果。但这些案例大多是因为局部感染不严重、纵隔感染已经控制的较满意、再次感染可能性小才获得了成功。针对一些一般状况较差、难以耐受开放手术的患者,TEVAR也是一种姑息性的治疗方法。TEVAR在AEF治疗中应用证据最多的是可作为循环不稳定的患者的首选治疗,以及作为稳定循环、控制出血、向人工血管置换及食管切除的桥接治疗[1, 14, 24]。TEVAR不能改善存活率,如果随访到6~18个月后,因为感染的主动脉、瘘等组织没有切除,植入的支架有再次感染的可能[14],因此建议TEVAR术后一周以内进行开放手术修复主动脉,以避免植入支架造成的感染[24]。目前文献所报道的TEVAR治疗AEF成功的案例随访时间是否足够值得商榷。因此,单纯腔内治疗一定要把握严格的适应证。
⑵主动脉的处理——开放手术。开放手术修复主动脉的效果要优于TEVAR[1]。根据主动脉缺损的范围大小来选择补片修补或者人工血管置换。直接缝合或者补片修补[6, 10, 13]适用于主动脉穿孔很小、基本无感染表现,而人工血管置换适用于污染严重、缺损较大的病变。多数情况下建议左侧开胸、体外循环下进行,如股动静脉转流、左心转流等[11],如主动脉受累范围广、弓上分支受累严重,则需深低温停循环下修复主动脉[15, 22, 25]。探查前应先游离病灶两端正常的主动脉,警惕在没有完全游离出主动脉前打开纵隔胸膜,因为一旦发生大出血将会面临无法阻断主动脉,如果盲目上阻断钳,可能会扩大主动脉破口,导致患者术中大出血死亡。此外,解剖瘘管区时有大出血的可能,发现主动脉破口后要仔细评估主动脉受累范围,瘘口周围感染的主动脉要扩大清创切除,消除潜在的感染灶。右侧开胸处理食管病变是可行的,但很难评估处理主动脉问题。相比较于人工涤纶血管,同种异体血管更具有抗菌性[14, 25-26], 在感染性的主动脉置换中具有一定的优势,缺点是不能够及时获取、长度不一定足够。另外,还可以使用银涂层的人工血管或者将人工血管用利福平等抗生素浸泡后使用[24]。
⑶食管的处理。食管异物导致的食管穿孔基本都需要进行开放手术修补,特别是延误诊断的患者[27]。直接修补还是食管切除目前还没有统一的意见[13]。手术方案取决于穿孔的位置、食管异物的特性、食管本身的问题及纵隔感染的严重程度等情况[27]。直接修补适用于早期发现食管穿孔、食管感染坏死创面很少、纵隔炎症较轻的患者[7-8, 13, 24, 27],其优势是操作简单、术后吞咽功能优于食管重建[28],术中必须彻底清除感染灶、充分引流,否则可能导致食管瘘复发、纵隔感染加重的风险。但很多食管穿孔诊断时间距离发病间隔时间较长、纵隔感染已经很明显,为了防止修补后食管瘘的复发以及彻底去除感染源,更多的术者选择了食管切除,这样能够降低食管、主动脉及纵隔的感染风险,避免感染持续加重、主动脉再次感染大出血[11]。食管切除后,以胃、空肠或结肠进行消化道重建。同期重建消化道能避免二次手术粘连、减少患者痛苦、节约时间和费用,但增加一期手术的复杂性、纵隔脓肿形成、感染难以控制等风险[6]。分期重建消化道,在首次手术后1~2个月甚至半年后进行,能够避免食管分泌物污染纵隔、降低感染风险、防止主动脉再次感染[8, 11, 14, 25],但增加了住院时间、需面对胸腔及胸骨后粘连等问题。总体来讲,同期手术重建与分期手术重建差别不大[1, 6, 10, 14, 25],多数术者倾向于分期进行消化道重建,二期将代食管脏器拉到颈部吻合,使吻合口上移至胸腔外,即使术后出现吻合口瘘也是局限在颈部,能够避免纵隔胸腔的感染。
食管内支架可用来辅助治疗食管穿孔,可应用于食管修补手术后残余瘘的处理[29]、食管恶性肿瘤患者及不能耐受开放手术患者的姑息性治疗[27],也可用于纵隔清创后隔绝食管瘘口、使得食管分泌物不能进入纵隔加重感染[12]。但食管内支架不推荐作为食管穿孔的最终治疗。也有术者尝试使用胃镜下止血夹处理食管的瘘口[18],但这种夹子只适合用于急性食管穿孔、且没有形成纵隔感染的情况下[27]。
此外,以主动脉人工血管置换加食管切除的组合远期预后最佳[1, 11]。而行食管切除加不行人工血管置换的其他主动脉修复,行主动脉人工血管置换加不行食管切除的其他食管修补,这两种组合的远期结果相似。其他不含食管切除或主动脉人工血管置换的方法预后最差[1]。
带蒂大网膜包裹修补后的主动脉或人工血管,或修补后的食管,填充清创后的空腔,在AEF这类感染性疾病处理中具有很大的优势,能隔绝感染灶、显著降低再次感染和病死率[14, 19, 24, 29-31]。带蒂肋间肌瓣[7]和胸锁乳突肌瓣[13]也有类似的作用。
2.2 支持治疗AEF是污染的创面,往往纵隔感染严重,需要给予强力、广谱的抗生素治疗,并结合术中感染组织的培养结果调整抗生素;个别病例合并真菌感染需联合抗真菌治疗[1]。同时抗感染的疗程要足够长,需要达1~2个月甚至半年[7]。
另外,AEF的患者一般需要禁食较长时间,因此需要充足的营养支持来修复创面、抵抗感染,可选择空肠造瘘、鼻肠置管等方式来进行肠内营养支持,其中空肠造瘘具有明显的优势,远期并发症发生率较低。
尽管这几十年来针对AEF的临床处理已经有了长足的进步,但AEF的患者术后病死率仍然很高,术后感染控制不住、主动脉感染后大出血是死亡的主要原因[32]。
回顾本文的3例患者,例1患者接诊后以食管穿孔处理,予广谱抗生素抗感染、禁食后营养支持等治疗,期望感染控制后再行开放手术处理纵隔问题。事后总结反思应急诊行纵隔清创手术,或许能避免进展到AEF。此外,该患者急诊行TEVAR处理AEF后,并没有早期行后续的开放手术处理纵隔感染,尽管患者中期结果尚可,但存在很大的侥幸成分,且患者失访后是否会出现支架植入物感染复发不得而知。例2患者考虑是少见的食管异物直接刺入主动脉引起的AEF,此类的AEF往往纵隔感染较轻,所以针对主动脉和食管的修复都是直接修补,取得了很好的效果,长期随访结果也满意。例3患者以大出血就诊,急诊行TEVAR治疗处理AEF后大出血得到控制,病情稳定,但因患者始终不能决定行开放手术彻底解决根本问题,支架植入物感染不能去除,于是出现了后续的反复感染、大出血,最终患者死亡,需引以为戒。
综上所述,对于食管异物的处理,要警惕AEF的可能。继发于食管异物的AEF,不能仅仅去除食管异物,还需要非常积极地处理感染的主动脉和食管,才能最大程度地改善预后。AEF的处理需要早诊断、早干预,同时需要长疗程抗感染、长期随访。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Takeno S, Ishii H, Nanashima A, et al. Aortoesophageal fistula: review of trends in the last decade[J]. Surg Today, 2020, 50(12): 1551-1559. DOI:10.1007/s00595-019-01937-z |
| [2] | Göbölös L, Miskolczi S, Pousios D, et al. Management options for aorto-oesophageal fistula: case histories and review of the literature[J]. Perfusion, 2013, 28(4): 286-290. DOI:10.1177/0267659113476329 |
| [3] | Ctercteko G, Mok CK. Aorta-esophageal fistula induced by a foreign body: the first recorded survival[J]. J Thorac Cardiovasc Surg, 1980, 80(2): 233-235. |
| [4] | Ochoa Chaar CI, Zafar MA, Velasquez C, et al. Complex two-stage open surgical repair of an aortoesophageal fistula after thoracic endovascular aortic repair[J]. J Vasc Surg Cases Innov Tech, 2019, 5(3): 261-263. DOI:10.1016/j.jvscit.2019.02.011 |
| [5] | Lim CT, Quah RF, Loh LE. A prospective study of ingested foreign bodies in Singapore[J]. Arch Otolaryngol - Head Neck Surg, 1994, 120(1): 96-101. DOI:10.1001/archotol.1994.01880250084012 |
| [6] | Wu MH, Lai WW. Aortoesophageal fistula induced by foreign bodies[J]. Ann Thorac Surg, 1992, 54(1): 155-156. DOI:10.1016/0003-4975(92)91168-9 |
| [7] | Assink J, Vierhout BP, Snellen JP, et al. Emergency endovascular repair of an aortoesophageal fistula caused by a foreign body[J]. J Endovascular Ther, 2005, 12(1): 129-133. DOI:10.1583/04-1401r.1 |
| [8] | Zhang XL, Liu JJ, Li JJ, et al. Diagnosis and treatment of 32 cases with aortoesophageal fistula due to esophageal foreign body[J]. Laryngoscope, 2011, 121(2): 267-272. DOI:10.1002/lary.21366 |
| [9] | Hollander JE, Quick G. Aortoesophageal fistula: a comprehensive review of the literature[J]. Am J Med, 1991, 91(3): 279-287. DOI:10.1016/0002-9343(91)90129-l |
| [10] | Yamada T, Sato H, Seki M, et al. Successful salvage of aortoesophageal fistula caused by a fish bone[J]. Ann Thorac Surg, 1996, 61(6): 1843-1845. DOI:10.1016/0003-4975(96)00001-X |
| [11] | 赖颢, 郑佳予, 李军, 等. 分期手术治疗异物损伤所致主动脉食管瘘四例[J]. 中华创伤杂志, 2012, 28(6): 542-543. DOI:10.3760/cma.j.issn.1001-8050.2012.06.016 |
| [12] | Chen XD, Li JW, Chen J, et al. A combined minimally invasive approach for the treatment of aortoesophageal fistula caused by the ingestion of a chicken bone: case report and literature review[J]. Clinics (Sao Paulo), 2012, 67(2): 195-197. DOI:10.6061/clinics/2012(02)19 |
| [13] | Venara A, Hamdi S, Desolneux G, et al. Long-term successful management of an aortoesophageal fistula secondary to the ingestion of a bone[J]. Presse Med, 2012, 41(5): 543-546. DOI:10.1016/j.lpm.2011.09.013 |
| [14] | Kelly SL, Peters P, Ogg MJ, et al. Successful management of an aortoesophageal fistula caused by a fish bone: case report and review of literature[J]. J Cardiothorac Surg, 2009, 4: 21. DOI:10.1186/1749-8090-4-21 |
| [15] | Ohta N, Koshiji T, Imamura M, et al. Aortoesophageal fistula caused by foreign body[J]. Jpn J Thorac Cardiovasc Surg, 2000, 48(3): 184-185. DOI:10.1007/BF03218118 |
| [16] | 黄磊, 张雷, 冯翔, 等. 主动脉—食管瘘的急诊腔内治疗[J]. 中华胸心血管外科杂志, 2017, 33(11): 658-662. DOI:10.3760/cma.j.issn.1001-4497.2017.11.003 |
| [17] | Zamora CA, Sugimoto K, Tsuji Y, et al. Stent-grafting of an infected aortoesophageal fistula following ingestion of a fish bone[J]. J Endovasc Ther, 2005, 12(4): 522-523. DOI:10.1583/05-1556.1 |
| [18] | Mezzetto L, Treppiedi E, Scorsone L, et al. Thoracic aortic pseudoaneurysm after esophageal perforation and mediastinitis caused by accidental ingestion of a mutton bone: a case report on staged endoscopic and endovascular treatments[J]. Ann Vasc Surg, 2016, 30: 307.e15-307.e19. DOI:10.1016/j.avsg.2015.07.025 |
| [19] | Shen JY, Zhang HW, Fan KJ, et al. Aortoesophageal fistula and arch pseudoaneurysm after removing of a swallowed chicken bone: a case report of one-stage hybrid treatment[J]. BMC Surg, 2018, 18(1): 3. DOI:10.1186/s12893-018-0335-1 |
| [20] | Wei YP, Chen LR, Wang YM, et al. Proposed management protocol for ingested esophageal foreign body and aortoesophageal fistula: a single-center experience[J]. Int J Clin Exp Med, 2015, 8(1): 607-615. |
| [21] | Hanif MZ, Li DC, Jabeen S, et al. Endovascular repair in penetrating aortoesophageal foreign body injury[J]. Ann Thorac Surg, 2013, 96(4): 1457-1459. DOI:10.1016/j.athoracsur.2012.12.046 |
| [22] | Xi EP, Zhu J, Zhu SB, et al. Surgical treatment of aortoesophageal fistula induced by a foreign body in the esophagus: 40 years of experience at a single hospital[J]. Surg Endosc, 2013, 27(9): 3412-3416. DOI:10.1007/s00464-013-2926-3 |
| [23] | Kato N, Tadanori H, Tanaka K, et al. Aortoesophageal fistula-relief of massive hematemesis with an endovascular stent-graft[J]. Eur J Radiol, 2000, 34(1): 63-66. DOI:10.1016/s0720-048x(99)00107-2 |
| [24] | Hwang SH, Cho JW, Bae CH, et al. Staged surgical treatment of primary aortoesophageal fistula[J]. Korean J Thorac Cardiovasc Surg, 2019, 52(3): 182-185. DOI:10.5090/kjtcs.2019.52.3.182 |
| [25] | Sica GS, Djapardy V, Westaby S, et al. Diagnosis and management of aortoesophageal fistula caused by a foreign body[J]. Ann Thorac Surg, 2004, 77(6): 2217-2218. DOI:10.1016/j.athoracsur.2003.06.031 |
| [26] | Coselli JS, Köksoy C, LeMaire SA. Management of thoracic aortic graft infections[J]. Ann Thorac Surg, 1999, 67(6): 1990-1993. DOI:10.1016/s0003-4975(99)00355-0 |
| [27] | Triadafilopoulos G, Roorda A, Akiyama J. Update on foreign bodies in the esophagus: diagnosis and management[J]. Curr Gastroenterol Rep, 2013, 15(4): 1-6. DOI:10.1007/s11894-013-0317-5 |
| [28] | Reardon MJ, Brewer RJ, LeMaire SA, et al. Surgical management of primary aortoesophageal fistula secondary to thoracic aneurysm[J]. Ann Thorac Surg, 2000, 69(3): 967-970. DOI:10.1016/s0003-4975(99)01087-5 |
| [29] | Zhu YJ, MacArthur JW, Lui NS, et al. Surgical management for aortoesophageal fistula after endovascular aortic repair[J]. Ann Thorac Surg, 2020, 109(5): 1611-1613. DOI:10.1016/j.athoracsur.2019.08.076 |
| [30] | Kunishige H, Myojin K, Ishibashi Y, et al. Perforation of the esophagus by a fish bone leading to an infected pseudoaneurysm of the thoracic aorta[J]. Gen Thorac Cardiovasc Surg, 2008, 56(8): 427-429. DOI:10.1007/s11748-008-0266-3 |
| [31] | LeMaire SA, Coselli JS. Options for managing infected ascending aortic grafts[J]. J Thorac Cardiovasc Surg, 2007, 134(4): 839-843. DOI:10.1016/j.jtcvs.2007.05.059 |
| [32] | Jin T, Yu GW, Ma L. Secondary rupture of aorta following the surgical management of aortoesophageal fistula[J]. Asian Cardiovasc Thorac Ann, 2005, 13(4): 374-376. DOI:10.1177/021849230501300418 |
 2021, Vol. 30
2021, Vol. 30




