爆震伤是由爆炸产生的冲击波超压直接作用于机体后因释放的能量而产生的各种损伤[1]。近年来,爆炸伤害事件屡见不鲜,对全球各地区均有巨大影响[2-4]。肺爆震伤病死率较高,损伤机制尚未完全明确,临床上至今仍无特异性治疗方法。因此,本实验利用自主研发的精确爆震装置建立小鼠肺爆震伤模型,通过基于质谱技术(mass spectrometry, MS)的蛋白质组学方法对胸部爆震后不同时间点的小鼠肺蛋白质组学进行分析,探究肺爆震伤后的肺组织损伤机制。
1 材料与方法 1.1 实验动物健康雄性C57BL/6小鼠60只,体质量20~25 g,鼠龄6~8周,购自辽宁长生生物技术有限公司[SCXK(辽)2015-0001],于实验室动物房内可自由饮食、饮水,适应性饲养1周后开始实验。称质量、编号后随机(随机数字法)分成6组(n=10):对照组、单次低强度胸部爆震后12 h组、24 h组、48 h组、72 h组及1周组。实验设计和对动物的处置符合动物伦理学标准,并经北部战区总医院伦理委员会审核通过[BZ.No20190120a0480130(196)]。
1.2 模型建立采用自主研发精准爆震装置(专利号:201620222422.8)建立小鼠肺爆震伤模型,用10%水合氯醛(青岛捷世康科技有限公司,中国)(0.3 mL/100 g)腹腔注射将小鼠麻醉后固定在橡皮胶垫上,使其胸部充分暴露,其他部位进行遮挡保护,并在上方罩一软编织袋,避免二次撞击损伤。本实验共放置5层18 μm厚的铝膜,冲击波瞬时超压达(69±8)psi(1 psi=6.895 kPa)。对照组仅予腹腔麻醉,不进行冲击波暴露。建模成功后将各组小鼠放回动物房继续饲养,环境与条件不变,自由进食水。
1.3 HE染色在建模后相应时间点处死小鼠,取肺组织。浸泡在4%甲醛(北京索莱宝科技有限公司,中国)缓冲液中的左肺组织,先后经梯度酒精和二甲苯脱水、透明后浸蜡,之后再包埋、修块,制成4 μm厚连续切片,再将切片置于蒸馏水中脱蜡。标本经苏木精染液(北京索莱宝科技有限公司,中国)染色5 min,冲洗5 min后浸入1%醋酸乙醇中30 s,再次用自来水冲洗,随后用0.5%伊红染液(北京索莱宝科技有限公司,中国)染色1~3 min,经梯度酒精脱水后在蒸馏水中冲洗30 s,最后用中性树脂封固,于显微镜下观察、拍照。
1.4 蛋白质组学测定 1.4.1 蛋白提取将已采集的小鼠右肺充分研磨至粉末状后置于5 mL离心管中,加入4倍体积的裂解缓冲液(8 mol/L尿素,Sigma,美国)和1%蛋白酶抑制剂混合液(Calbiochem公司,德国)超声(Fisher Scientific,美国)下充分裂解,4 ℃,12 000 r/min,离心10 min提取上清液,最后按厂家说明书用BCA试剂盒(杭州弗德生物科技有限公司,中国)进行蛋白浓度测定。
1.4.2 胰酶酶解将5 mmol/L二硫苏糖醇5 mL(Sigma,美国)加入蛋白溶液中,在56 ℃下还原30 min;然后加入11 mmol/L碘代乙酰胺5 mL(Sigma,美国),于室温、避光孵育15 min;再向样品中加入100 mmol/L溴化四乙铵5 mL,使尿素浓度稀释至2 mol/L以下;最后,先以1∶50(胰酶∶蛋白)的比例加入胰酶,于37 ℃酶解过夜;再按1∶100(胰酶∶蛋白)的比例,第二次加入胰酶,继续酶解4 h。
1.4.3 TMT标记将酶解后获得的肽段用Strata X C18萃取柱(Phenomenex,美国)除盐后置于真空干燥冷冻。提取0.5 mmol/L TEAB 5 mL(Sigma,美国)溶解肽段,严格按照串联质量标签(tandem mass tag, TMT)试剂盒操作说明来标记肽段。操作如下:将标记试剂解冻,再用乙腈溶解,充分混合,于室温孵育2 h。混合已被标记的肽段,再予除盐后于真空干燥冷冻。
1.4.4 HPLC分级已标记肽段采用高pH反向高效液相色谱(high performance liquid chromatography, HPLC)分级,色谱柱为Agilent 300 Extend C18(粒径5 μm,内径4.6 mm,长250 mm)(Agilent公司,美国)。操作如下:肽段分级梯度为8%~32%乙腈(Fisher Chemical,美国)、pH 9.0,在60 min内分离为60个组分,随后肽段合并为18个组分,再经真空干燥冷冻后以备后续操作。
1.4.5 液相色谱-串联质谱联用分析(liquid chromatography-tandem mass spectrometry, LC-MS/MS)将肽段用液相色谱流动相A相(0.1%甲酸)溶解,再注入反相色谱柱(15 cm,75 μm)。液相梯度设置:0~20 min,6%~20% B;20~33 min,20%~35% B;33~37 min,35%~80% B;37~40 min,80% B,流速维持在320 nL/min;流动相B为含0.1%甲酸和98%乙腈的水溶液。以上步骤均在EASY-nLC 1000UPLC系统上以400 nL/min的恒定流速进行。分离后的肽段被注入NSI离子源(电压2.0 kV)中,经电离后进入Q ExactiveTM Plus质谱仪(Thermo公司,美国)进行分析。肽段母离子和其二级碎片均采用高分辨的Orbitrap予以检测和分析。设置一级质谱扫描范围350~1 800 m/z,分辨率70 000;二级质谱扫描范围则固定起点为100 m/z,分辨率17 500。数据采集模式使用数据依赖型扫描(DDA)程序。设置自动增益控制(AGC)为5×104,信号阈值为1×104,最大注入时间为200 ms,串联质谱扫描的动态排除时间为15 s,避免母离子的重复扫描。
1.5 数据库检索二级质谱数据使用Maxquant(v 1.5.2.8)进行检索。设置检索参数:数据库为SwissProtMouse(16 992条序列),并加入反库和常见污染库,以计算随机匹配造成的假阳性率(FDR),及消除鉴定结果中污染蛋白的影响;设置酶切方式为Trypsin/P、漏切位点数为2、肽段最小长度为7个氨基酸残基、肽段最大修饰数为5;设置First search和Main search的一级母离子质量误差容忍度分别为20×10-6和5×10-6,二级碎片离子的质量误差容忍度为0.02 Da;设置半胱氨酸烷基化为固定修饰,可变修饰为甲硫氨酸的氧化。设置定量方法为FDR < 1%。至少有一条特异性肽段被鉴定到,才能被判定肽段对应的蛋白被鉴定到。通过特异性肽段的鉴定判定蛋白鉴定的数量。
1.6 生物信息学分析对定量的差异表达蛋白应用Bioinformatics & Evolutionary Genomics软件(http://bioinformatics.psb.ugent.Be/webtools/Venn/)进行维恩图绘制;应用DAVID数据库(https://david.ncifcrf.gov/)和KEGG数据库(http://www.genome.jp/kegg/kegg2.htmL)作进一步功能注释和富集分析。
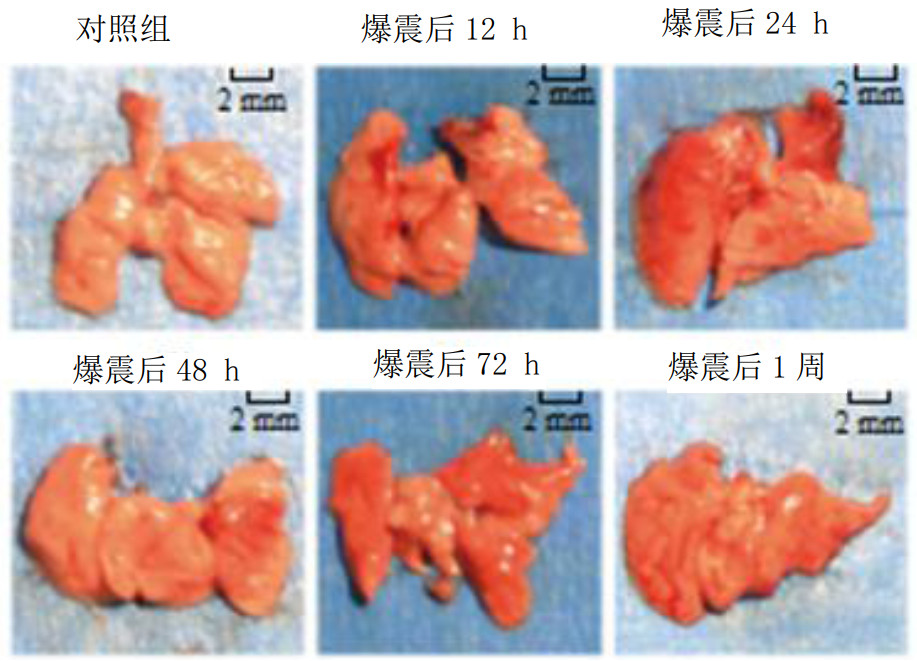
2 结果 2.1 肺组织大体观察肺爆震伤模型建立后,如图 1所示在12 h可观察到小鼠肺的大体外观有肿胀,表面有散在出血点,而对照组外观结构完整,未见明显变化;而后,肺组织表面出血点增多,呈片状分布,其中以24 h最为严重;在72 h肺肿胀、出血情况均有所减轻;在1周时肺大体外观基本恢复同对照组。
|
| 图 1 各组小鼠肺组织病理大体观察 Fig 1 The pathological observation of lung tissue in each group |
|
|
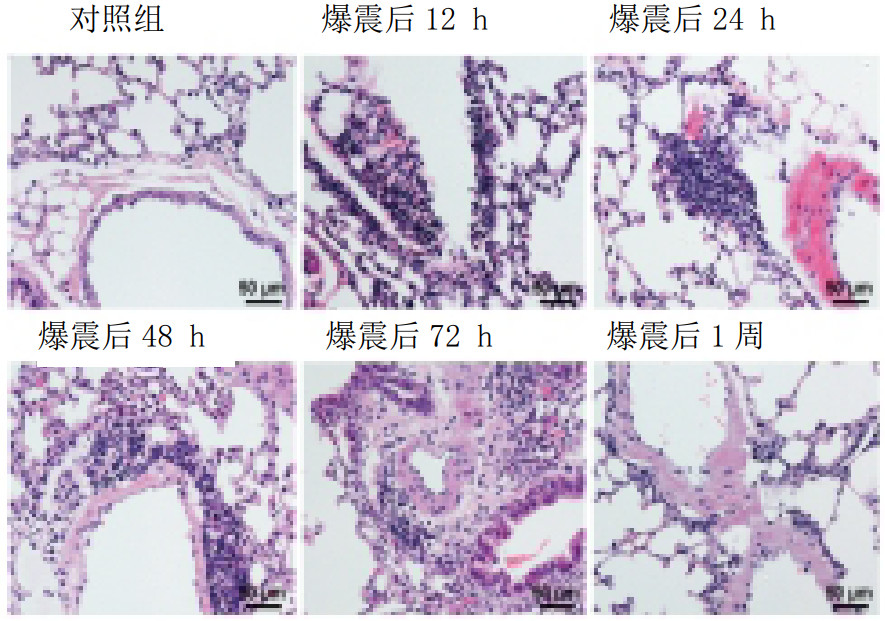
光镜下可见(图 2),对照组小鼠肺组织结构完整,肺泡壁较均匀一致,在肺泡腔内有少量渗液,肺组织内无红细胞及炎症细胞渗出;而在胸部爆震后12 h和24 h,肺泡正常组织结构消失,肺泡腔内弥漫性出血,大量炎细胞浸润,肺间质渗出液增多,肺泡壁增厚,肺泡腔萎陷融合;48 h后上述情况逐渐改善;1周时肺组织结构与对照组相似。
|
| 图 2 各组小鼠肺组织光镜下观察(HE× 400) Fig 2 Lung tissue of mice in each group under light microscope (HE× 400) |
|
|
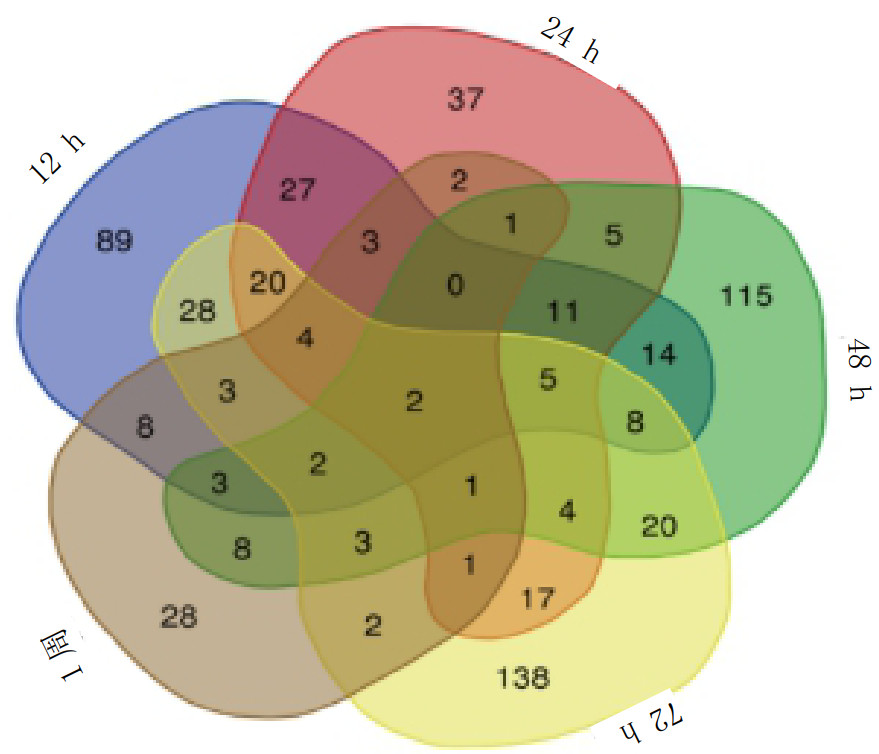
LC-MS/MS对胸部爆震后的小鼠肺组织标本共鉴定到6 861个蛋白质,与对照组比较,共定量到608个差异表达蛋白,其中于爆震后12 h、24 h、48 h、72 h及1周分别定量到227个、140个、202个、258个和71个差异蛋白(图 3)。
|
| 蓝色代表爆震后12 h组,红色代表 24 h组,绿色代表 48 h组,黄色代表 72 h,褐色代表 1周组;图中数字代表该组差异表达蛋白数量;重叠部分颜色不同,其中数字代表不同时间点共存差异表达蛋白数量 图 3 胸部爆震后不同时间点小鼠肺组织差异表达蛋白数量 Fig 3 The number of differentially expressed proteins in the lung tissues of mice at different time points after thorax blast |
|
|
经基因本体论(gene ontology, GO)分析,得到608个差异表达蛋白主要富集在细胞粘附、细胞外基质组织、胶原原纤维组织及凝血功能等130个生物学过程子类;外泌体、细胞外基质、细胞质及基底膜等66个细胞组分子类;以及细胞外基质结构组成、肌动蛋白结合及抗氧化活性等43个分子功能子类。每项注释结果排名前十的子类如表 1所示。
| 类别 | GO Term | 结果 | 差异蛋白数量 |
| BPa | GO: 0030155 | regulation of cell adhesion/细胞粘附调节 | 8 |
| GO: 0007596 | blood coagulation/凝血 | 11 | |
| GO: 0034097 | response to cytokine/对细胞因子反应 | 11 | |
| GO: 0007160 | cell-matrix adhesion/细胞基质粘连 | 11 | |
| GO: 0008360 | regulation of cell shape/细胞形态调节 | 15 | |
| GO: 0019433 | triglyceride catabolic process/甘油三酯分解过程 | 7 | |
| GO: 0030199 | collagen fibril organization/胶原原纤维组织 | 9 | |
| GO: 0010466 | negative regulation of peptidase activity/肽酶活性的负调控 | 15 | |
| GO: 0030198 | extracellular matrix organization/细胞外基质组织 | 18 | |
| GO: 0007155 | cell adhesion/细胞粘附 | 40 | |
| CCb | GO: 0072562 | blood microparticle/血液微粒 | 19 |
| GO: 0034361 | very-low-density lipoprotein particle/极低密度脂蛋白 | 9 | |
| GO: 0042627 | chylomicron/乳糜微粒 | 8 | |
| GO: 0005737 | cytoplasm/细胞质 | 261 | |
| GO: 0005604 | basement membrane/基底膜 | 21 | |
| GO: 0005578 | proteinaceous extracellular matrix/蛋白细胞外基质 | 37 | |
| GO: 0005615 | extracellular space/细胞外间隙 | 103 | |
| GO: 0031012 | extracellular matrix/细胞外基质 | 43 | |
| GO: 0005576 | extracellular region/胞外区 | 116 | |
| GO: 0070062 | extracellular exosome/外泌体 | 199 | |
| MFc | GO: 0030414 | peptidase inhibitor activity/肽酶抑制剂活性 | 14 |
| GO: 0016209 | antioxidant activity/抗氧化活性 | 7 | |
| GO: 0005543 | phospholipid binding/磷脂结合 | 12 | |
| GO: 0042802 | identical protein binding/相同蛋白质结合 | 38 | |
| GO: 0005178 | integrin binding/整合素结合 | 13 | |
| GO: 0004867 | serine-type endopeptidase inhibitor activity/丝氨酸型内肽酶抑制剂的活性 | 15 | |
| GO: 0008289 | lipid binding/脂类结合 | 25 | |
| GO: 0003779 | actin binding/肌动蛋白结合 | 29 | |
| GO: 0048407 | platelet-derived growth factor binding/血小板衍生生长因子结合 | 7 | |
| GO: 0005201 | extracellular matrix structural constituent/细胞外基质结构组成 | 11 | |
| 注:a biological process,生物学过程;b cellular component,细胞组分;c molecular function,分子功能 | |||
KEGG富集分析共得到24个子类,其中包括细胞外基质受体相互作用、黏着斑、补体途径、PI3K-Akt信号通路、白细胞跨内皮迁移及血小板激活等,如表 2所示。
| KEGG mmua | 结果 | 差异蛋白数量 |
| mmu05200 | pathways in cancer/癌症通路 | 22 |
| mmu04611 | platelet activation/血小板激活 | 10 |
| mmu04520 | adherens junction/黏着连接 | 7 |
| mmu04977 | vitamin digestion and absorption/维生素消化吸收 | 4 |
| mmu05322 | systemic lupus erythematosus/系统性红斑狼疮 | 11 |
| mmu05414 | dilated cardiomyopathy/扩张型心肌病 | 8 |
| mmu05140 | leishmaniasis/利什曼病 | 7 |
| mmu05152 | tuberculosis/肺结核 | 13 |
| mmu00860 | porphyrin and chlorophyll metabolism/卟啉和叶绿素代谢 | 6 |
| mmu05205 | proteoglycans in cancer/癌症蛋白聚糖 | 15 |
| mmu04810 | regulation of actin cytoskeleton/肌动蛋白细胞骨架调节 | 16 |
| mmu04670 | leukocyte transendothelial migration/白细胞跨内皮迁移 | 11 |
| mmu03320 | PPAR signaling pathway/过氧化物酶体增殖因子活化受体信号通路 | 9 |
| mmu04141 | protein processing in endoplasmic reticulum/内质网蛋白加工 | 14 |
| mmu04151 | PI3K-Akt signaling pathway/PI3K-Akt信号通路 | 25 |
| mmu05145 | toxoplasmosis/弓形虫病 | 12 |
| mmu05222 | small cell lung cancer/小细胞肺癌 | 11 |
| mmu04610 | complement and coagulation cascades/补体途径 | 12 |
| mmu03030 | DNA replication/DNA复制 | 9 |
| mmu04974 | protein digestion and absorption/蛋白质消化吸收 | 15 |
| mmu03010 | ribosome/核糖体 | 20 |
| mmu04510 | focal adhesion/黏着斑 | 30 |
| mmu05146 | amoebiasis/阿米巴病 | 23 |
| mmu04512 | ECM-receptor interaction/细胞外基质受体相互作用 | 23 |
| 注:a Mus musculus小鼠 | ||
本研究采用自主研发的精准爆震装置对小鼠进行胸部爆震,与其他常规装置相比,其具有操作简单、可重复作用部位较准确及过程可控等优点,能较好地模拟临床患者的损伤特点[5-7]。在前期研究中,笔者明确了不同程度小鼠肺损伤所需冲击波强度范围,成功率高达90%以上[8]。因此在本实验中,为保持爆震组小鼠存活率,便于后续研究观察,选择了单次低强度爆震。建模后,爆震组小鼠出现肺泡正常组织结构消失、肺泡腔内出血、炎细胞浸润、肺间质渗出液增多、肺泡壁增厚及肺泡腔萎陷融合等典型急性肺损伤病理改变[9]。因此,可以确定小鼠肺爆震伤模型建立成功。
通过TMT联合LC-MS/MS,对胸部爆震后的小鼠肺组织标本共鉴定到6 861个蛋白质,其中差异表达蛋白608个,并观察到不同时间点蛋白表达组合亦不同。说明单次低强度的胸部爆震也会在1周内不同时间点对小鼠肺组织蛋白的表达产生显著影响。另外,Ahmed等[10]证实,颅脑受一次低水平爆炸的大鼠,也会存在持续的氧化应激、血管异常以及神经元和胶质细胞丢失等改变。所以,即使在开阔场地,单次暴露于低强度爆炸冲击波下,也会对机体造成损伤,应尽早明确诊断及治疗。
本研究采用GO和KEGG做进一步注释,得到608个差异表达蛋白,主要富集在细胞粘附、细胞外基质组织、凝血功能、抗氧化活性、PI3K-Akt信号通路以及白细胞跨内皮迁移等功能通路上。这些结果可能说明,小鼠胸部爆震后肺损伤主要与粘附、氧化应激、凝血功能紊乱和炎症反应等有关。有文献报道,各种原因导致的炎症是急性肺损伤的本质[11]。另外,已有研究报道了类似的结果,他们发现炎症对肺的影响可从爆震后24 h发展到48 h,并在48 h达到高峰[12]。由此可见,肺爆震伤的损伤机制虽较复杂,但早期炎症反应显著,可能与其他反应机制密切相关。另外,炎症因子的积聚和爆发级联反应也是肺爆震伤高病死率的主要原因[13-14]。
其他研究中也观察到了相似的结果。比如Li等[15]证实,冲击波超压暴露明显增加SD大鼠全身促炎和抗炎细胞因子的产生,肺组织出现明显的水肿、炎症、内皮损伤和出血等病理改变,早期给予衰变加速因子可通过调控补体系统,有效抑制炎症反应。另有实验观察到,爆炸损伤可导致体外培养的A549细胞间粘附减少,细胞形态改变,促进炎症反应、凋亡及氧化损伤。全氟碳化合物能介导NF-κB、MAPK通路抑制炎症、活性氧簇(reactive oxygen species,ROS)产生,及通过Bcl-2/Bax和caspase-3的信号通路抑制细胞凋亡[16]。由此可进一步说明,炎症反应在急性肺损伤复杂机制中的“串联”作用。
综上所述,本研究应用基于LC-MS/MS的蛋白质组学技术鉴定到608个与肺爆震伤相关的差异表达蛋白,不同时间点差异蛋白组合亦不同,更能充分说明肺爆震伤早期炎症反应显著,且变化复杂。但这些差异蛋白之间如何相互作用,以及具体关系,仍有待后续研究。
作者个人贡献声明 解晓荟参与设计实验,实施研究,采集数据,分析解释数据及文章撰写;佟昌慈参与实施研究,采集数据及分析解释数据;丛培芳参与实施研究,采集数据及分析解释数据;刘颖参与实施研究,采集数据及分析解释数据;柳云恩参与设计实验,分析解释数据,对文章的知识性内容作批判性审阅及指导;金红旭参与设计实验,对文章的知识性内容作批判性审阅及指导,获取研究经费
利益冲突 所有作者均声明不存在利益冲突
| [1] | DePalma RG, Burris DG, Champion HR, et al. Blast injuries[J]. N Engl J Med, 2005, 352(13): 1335-1342. DOI:10.1056/NEJMra042083 |
| [2] | 杨策, 蒋建新, 王正国, 等. 肺冲击伤转化研究: 历史、现状与挑战[J]. 实用医药杂志, 2019, 36(1): 1-5, 8. DOI:10.14172/j.issn1671-4008.2019.01.001 |
| [3] | 张连阳. 灾难爆炸伤医学救援进展[J]. 解放军医学杂志, 2015, 40(9): 689-692. DOI:10.11855/j.issn.0577-7402.2015.09.01 |
| [4] | Powers M, Monson MJE, Zimmerman FS, et al. Anthropogenic disasters[J]. Crit Care Clin, 2019, 35(4): 647-658. DOI:10.1016/j.ccc.2019.06.002 |
| [5] | Liu YE, Tong CC, Zhang YB, et al. Chitosan oligosaccharide ameliorates acute lung injury induced by blast injury through the DDAH1/ADMA pathway[J]. PLoS One, 2018, 13(2): e0192135. DOI:10.1371/journal.pone.0192135 |
| [6] | 佟昌慈, 柳云恩, 张玉彪, 等. 新型小鼠脑爆震伤模型的建立及研究[J]. 中华急诊医学杂志, 2019, 28(1): 44-49. DOI:10.3760/cma.j.issn.1671-0282.2019.01.009 |
| [7] | Liu Y, Liu YE, Tong CC, et al. CD28 deficiency attenuates primary blast-induced renal injury in mice via the PI3K/Akt signalling pathway[J]. BMJ Mil Health, 2020, 166(E): e66-e69. DOI:10.1136/jramc-2019-001181 |
| [8] | Tong CC, Liu YN, Zhang YB, et al. Shock waves increase pulmonary vascular leakage, inflammation, oxidative stress, and apoptosis in a mouse model[J]. Exp Biol Med (Maywood), 2018, 243(11): 934-944. DOI:10.1177/1535370218784539 |
| [9] | Sziklavari Z, Molnar TF. Blast injures to the thorax[J]. J Thorac Dis, 2019, 11(Suppl 2): S167-S171. DOI:10.21037/jtd.2018.11.106 |
| [10] | Ahmed FA, Kamnaksh A, Kovesdi E, et al. Long-term consequences of single and multiple mild blast exposure on select physiological parameters and blood-based biomarkers[J]. Electrophoresis, 2013, 34(15): 2229-2233. DOI:10.1002/elps.201300077 |
| [11] | Kaku S, Nguyen CD, Htet NN, et al. Acute respiratory distress syndrome: etiology, pathogenesis, and summary on management[J]. J Intensive Care Med, 2020, 35(8): 723-737. DOI:10.1177/0885066619855021 |
| [12] | Smith JE, Garner J. Pathophysiology of primary blast injury[J]. J R Army Med Corps, 2019, 165(1): 57-62. DOI:10.1136/jramc-2018-001058 |
| [13] | Smith JE. The epidemiology of blast lung injury during recent military conflicts: a retrospective database review of cases presenting to deployed military hospitals, 2003-2009[J]. Philos Trans R Soc Lond B Biol Sci, 2011, 366(1562): 291-294. DOI:10.1098/rstb.2010.0251 |
| [14] | Chen KH, Yang J, Xiao F, et al. Early peritoneal dialysis ameliorates blast lung injury by alleviating pulmonary edema and inflammation[J]. Shock, 2020, 53(1): 95-102. DOI:10.1097/SHK.0000000000001325 |
| [15] | Li YS, Yang ZS, Chavko M, et al. Complement inhibition ameliorates blast-induced acute lung injury in rats: potential role of complement in intracellular HMGB1-mediated inflammation[J]. PLoS One, 2018, 13(8): e0202594. DOI:10.1371/journal.pone.0202594 |
| [16] | Zhang ZR, Liang ZX, Li HD, et al. Perfluorocarbon reduces cell damage from blast injury by inhibiting signal paths of NF-κB, MAPK and Bcl-2/Bax signaling pathway in A549 cells[J]. PLoS One, 2017, 12(3): e0173884. DOI:10.1371/journal.pone.0173884 |
 2021, Vol. 30
2021, Vol. 30




