内科危重患者,常合并多种基础疾病,存在营养不良高风险,并出现胃肠功能障碍。重症患者的肠内营养(enteral nutrition,EN)治疗有促进肠道功能恢复、纠正肠道内菌群失调等作用; 但部分患者也存在EN治疗不耐受情况。急性胃肠损伤分级评分(the classification score of acute gastrointestinal injury,AGI)标准以临床症状为主,不完全适用危重患者; 近年来胃肠道超声逐渐流行; 目前没有将两者联合检查评估肠内营养对危重患者胃肠功能恢复价值的相关研究。本研究将腹腔内压、胃窦超声横截面积、超声测量左/右侧结肠直径、结肠蠕动频率、EN开始时间、EN剂量、前白蛋白(PA)及EN并发症等指标进行追踪,动态监测开启肠内营养、滋养性喂养、目标性喂养等过程,评估肠内营养对胃肠功能的恢复价值。
1 资料与方法本实验经福建医科大学附属漳州市医院伦理委员会批准执行(伦理审批编号:20180212D,所有研究对象均签署知情同意书)。
1.1 一般资料 1.1.1 纳入标准年龄 > 18岁,由于内科疾病导致胃肠功能损伤,存在营养不良高风险,住院时间大于120 h的住院患者。
1.1.2 排除标准① 腹部开放性创伤; ②腹腔肿瘤、大量腹腔积液; ③急性胃肠功能损伤Ⅲ级以上; ④妊娠; ⑤肝功能Child分级2级以上。
1.1.3 资料收集入选在2019年1月到2020年1月在本院MICU新收治的52例因病情导致AGI评分Ⅰ~Ⅱ级的成年患者,NRS2002评分≥3分的患者进行研究。循环稳定至少4 h后开始给予肠内营养制剂百普力(短肽类,1 kcal/mL),启动EN后24~48 h内给予滋养性喂养20 mL/h; 若无出现肠内营养不耐受,则给予目标性喂养40 mL/h。肠内喂养途径均采用床旁超声引导下鼻空肠置管。
收集所有的临床基本情况156组,包括腹腔内压(IAP,由膀胱内压获得)胃肠超声检查,包括胃窦超声横截面积(CSA)、超声测量左/右侧结肠直径(D)、结肠蠕动频率(f)、EN开始时间、EN剂量、前白蛋白(PA)及EN并发症等。EN治疗后肠功能恢复为成功组; 出现严重并发症如大量胃潴留、呕吐、吸入性肺炎、肠扩张等判断为肠内营养不耐受,考虑肠功能未能恢复,为失败组。
1.2 床旁超声检查在超声科专业医师指导下,由具有重症超声培训合格证的熟练的研究人员对研究对象行床旁胃窦超声、结肠超声检查。检查中及检查后,注意患者伤口污染及探头消毒。
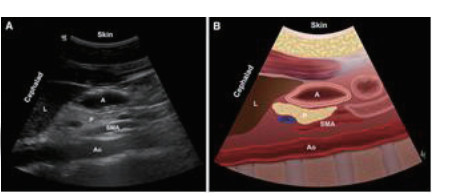
1.2.1 ①胃窦超声评估利用床旁超声机Sonosite M-Tube进行检测,利用2~5 MHz凸阵探头,患者取仰卧位或右侧卧位(因病情危重无法右侧卧位者取仰卧位),床头抬高30~45°,探头方向与身体纵轴平行,在剑突下于正中矢状线右侧获取清晰胃窦部超声[1],见图 1。
|
| 图 1A 胃窦超声检查部位 |
|
|
|
| 图 1B 胃窦超声切面及示意 |
|
|
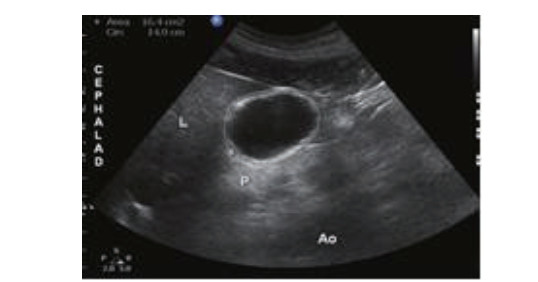
② 利用超声数据包对胃窦部面积进行描计计算,应用公式[2]:GV(ml)=27.0+14.6×right-lateral CSA-1.28×age,进行评估胃内容物容积,见图 2。
|
| 图 2 胃窦超声横截面描计 |
|
|
选用上述2~5 MHz凸阵超声探头。左/右半结肠超声:凸阵探头置于左/右侧腹,沿降结肠走向,由上至下纵向滑动扫查,必要时可旋转探头90°,增加横向滑动扫查[3]。详见图 3。

|
| 图 3 结肠超声检查 |
|
|
采用SPSS 20统计软件对所有数据进行处理和统计,计量资料以均数±标准差(Mean±SD)表示,两组之间连续变量的计量资料的比较采用独立样本t检验,计数资料采用率或构成比进行描述,组间的差异比较采用检验。GraphPad Prism 5绘制组间变量散点图及折线图。
2 结果 2.1 临床特征分析本实验总52例研究对象,收集数据156组。包括男性患者28例,女性24例; 年龄在46到90岁,年龄(71.6±8.9)岁。根据肠功能结局,EN成功组34例,失败组18例,对患者的临床特征做单因素分析,提示两组在性别、年龄、启动EN时(ENst)IAP、APACHEⅡ评分、PA、疾病构成等差异无统计学意义,见表 1。
| 项目 | 成功组(n=34) | 失败组(n=18) | t值 | P值 |
| 年龄(岁) | 70.41±9.4 | 70.5±5.9 | -0.41 | 0.967 |
| APACHEⅡ评分 | 27.5±1.89 | 27.5±1.29 | 0.0 | 1.000 |
| ENst IAP | 16.30±1.89 | 16.34±2.49 | -0.177 | 0.907 |
| 疾病构成: | ||||
| 肺部感染 | 6 | 1 | ||
| 心衰 | 14 | 3 | ||
| 脓毒性休克 | 8 | 7 | ||
| 腹腔感染 | 1 | 5 | ||
| 胰腺炎 | 4 | 2 | ||
| MODS | 1 | 0 |
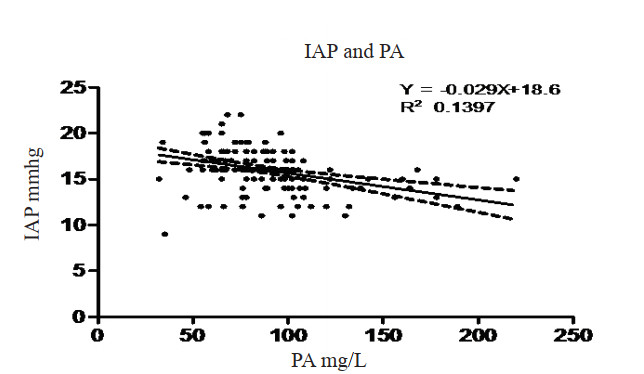
IAP与PA的相关性分析,R2为0.139,传统指标IAP与PA相关性小,见图 4。
|
| 图 4 IAP与PA的相关性分析 |
|
|
两组间分析显示,两组在启动肠内营养时间差异有统计学意义。两组之间启动EN时,CSA、D、f差异具有统计学意义,IAP、PA差异无统计学意义。见表 2。
| 项目 | EN St | t值 | P值 | |
| 1组 | 2组 | |||
| EN St | 12.18±7.63 | 32±7.63 | -6.644 | < 0.05* |
| IAP | 17.85±1.54 | 17.94±2.01 | 3.513 | 0.91 |
| CSA | 9.62±1.37 | 10.72±1.56 | -2.526 | < 0.05* |
| D | 3.0±0.25 | 3.39±0.50 | -3.098 | < 0.05* |
| f | 3.15±0.82 | 1.89±0.42 | 7.013 | < 0.05* |
| PA | 73.09±11.5 | 73.06±8.4 | 0.012 | 2.799 |
| 注:1组为EN成功组; 2组为EN失败组。EN st:启动肠内营养时间; IAP:腹腔内压,mmHg; CSA:胃窦横截面积cm2; D:结肠直径,cm; f:结肠蠕动频率,bpm; PA:前白蛋白,mg/L | ||||
EN 72 h、120 h后,成功组与失败组,在CSA、D、f等肠功能指标差异有统计学意义; 且PA亦差异有统计学意义; IAP随着肠功能恢复逐渐下降,差异有统计学意义。见表 3。
| 项目 | EN st | t值 | P值 | |
| 1组 | 2组 | |||
| EN st | 12.18±7.63 | 32±7.63 | 2.502 | 0.32 |
| IAP | 17.85±1.54 | 17.94±2.01 | 4.340 | 0.506 |
| CSA | 9.62±1.37 | 10.72±1.56 | 2.501 | 0.105 |
| D | 3.0±0.25 | 3.39±0.50 | 6.203 | 0.705 |
| f | 3.15±0.82 | 1.89±0.42 | 4.09 | 0.25 |
| PA | 73.09±11.5 | 73.06±8.4 | 6.102 | 0.705 |
将成功组内EN 20 mL/H的滋养性喂养、与40 mL/H的目标性喂养进行多因素比较分析,在CSA、D、f等肠功能指标差异有统计学意义; IAP、PA亦差异有统计学意义。见表 4、图 5。
| 指标 | EN 72 h | t值 | P值 | |
| 1组 | 2组 | |||
| IAP | 15.53±2.79 | 16.94±1.45 | -2.394 | .020* |
| CSA | 8.15±1.02 | 10.28±1.41 | -5.687 | < 0.05* |
| D | 2.79±0.42 | 3.28±0.58 | -3.169 | < 0.05* |
| f | 3.91±0.79 | 2.28±0.83 | 6.879 | < 0.05* |
| PA | 93.35±10.4 | 72.94±8.5 | 7.602 | 0.05 |

|
| 图 5 成功组内单因素趋势图 |
|
|
| 指标 | EN 120 h | t值 | P值 | |
| 1组 | 2组 | |||
| IAP | 15.03±1.19 | 15.78±1.7 | -1.664 | 0.108 |
| CSA | 7.88±1.04 | 9.56±1.24 | -4.869 | < 0.05* |
| D | 2.85±0.36 | 3.11±0.58 | -1.714 | < 0.05* |
| f | 4.06±0.6 | 2.89±0.83 | 5.281 | < 0.05* |
| PA | 125.5±33.2 | 86.17±10.2 | 6.371 | < 0.05* |
EN成功组内PA在EN st、EN 72 h、EN 120 h三个时间点进行两两比较,差异有统计学意义,见表 6。
| 指标 | EN | t值 | P值 | |
| 20 mL/H | 40 mL/H | |||
| IAP | 17.69±1.636 | 15.29±2.175 | 6.298 | < 0.01 |
| CSA | 9.44±1.52 | 8.06±1.006 | 4.907 | < 0.01 |
| D | 2.97±0.291 | 2.83±0.376 | 2.071 | 0.041 |
| f | 3.19±0.822 | 3.98±0.712 | -4.86 | < 0.01 |
| PA | 74.94±13.5 | 109.5±29.7 | -8.03 | < 0.01 |
| PA | 检验统计量 | 标准误 | 秩次 | P值 |
| 1-2 | -32.412 | 7.17 | -4.52 | < 0.001 |
| 1-3 | -58.426 | 7.17 | -8.148 | < 0.001 |
| 2-3 | -26.015 | 7.17 | -3.628 | < 0.001 |
| 注:1:EN启动时; 2:EN 72 h; 3:EN 120 h | ||||
重症患者病因复杂,其全身炎症反应与代偿性抗炎反应失衡程度不一,胃肠道黏膜经常是最敏感、最先受累的部位[4],约62%的患者存在胃肠功能损伤[5]。与肠外营养相比,EN支持可抑制患者骨骼肌质量的减少[6]。早期EN可以保留肠上皮功能[7],可以促进胃肠黏膜修复、促进胃肠功能恢复,减少内源性感染,缩短ICU患者的机械通气时间[8]。根据成人住院营养治疗指南[9],循环稳定后可以开启肠内营养治疗。
目前肠内营养治疗的方式有间断喂养及持续输注。间歇喂养可以建立胃肠道激素间歇分泌的模式,减少夜间胃里的细菌数量,但胃管脱位、胃残余容积、腹泻和误吸发生率高[10]。持续输注能够改善患者的营养状况,减少胃肠道功能障碍的发生率, 维持脏器功能稳定, 提高临床治疗有效率[11-12]。间断喂养和连续输注喂养在不增加不良反应率的情况下实现营养目标方面是相似的[13],所以本研究采用持续性输注肠内营养的喂养方式。
若12 h胃潴留量(gastric residual volume,GRV)1 200 ml,以及出现呕吐、腹泻、腹痛腹胀等[14]胃肠道症状,则称为喂养不耐受。因而,有效全面的评估肠内营养治疗后胃肠功能的恢复情况极其重要。目前采用多急性胃肠损伤(acute gastrointestinal injury, AGI)[15]进行分级评估,但评估内容以患者主观感受及膀胱压为主,缺乏更丰富的客观检查; 很多危重患者存在有创机械通气、镇痛镇静,无法表达主观感受,更阻止了胃肠道功能的评估; 故本试验的AGI评估采用可测量的IAP作为参考,同时联合胃肠道超声提供胃窦部横截面、结肠直径、蠕动频率等客观指标,弥补AGI评分的不足。
有关危重患者胃肠系统检查的文献综述中,肠功能恢复的检查重点是胃肠道声音和腹胀[16],本试验在此基础上增胃窦横截面积、结肠直径、结肠蠕动率以评价EN后肠功能恢复标志; 若出现喂养不耐受,则考虑EN后肠功能无明显恢复。
本试验将无创的床旁胃肠超声的应用于肠内营养治疗的患者,监测其在喂养过程中的IAP、CSA、结肠直径、蠕动频率及PA,观察肠内营养治疗对肠功能恢复的价值。本研究发现,在腹腔内压不能反应肠功能的吸收功能状态,与前白蛋白相关性差(已除外肝脏合成功能障碍),R2为0.139。在启动肠内营养时,肠内营养治疗成功组与失败组在性别、年龄、启动EN时IAP、APACHEⅡ评分、PA、疾病构成等基础状态的指标差异无统计学意义,在胃窦部横截面积、结肠直径、蠕动频率等胃肠功能指标差异有统计学意义,说明在IAP类似状态下,通过胃肠道超声,能更好的评估胃肠功能的损伤状态,且可以更早的进行肠内营养治疗[17]。
喂养过程中,在喂养72 h、120 h的时间点监测IAP、CSA、D等客观指标,提示随EN治疗的进行,成功组较失败组肠功能恢复更好,出现喂养并发症少,腹腔内压下降,胃窦部横截面积、结肠直径缩小,肠蠕动频率增加,进而促进前白蛋白合成增加,差异有统计学意义。喂养成功组内分析,提示EN 20 mL/h的滋养性喂养[18]、与40 mL/h的目标性喂养进行单因素比较分析,在CSA、D、f等肠功能指标差异有统计学意义,提示肠功能恢复顺利; 而失败组在临床特征差异无统计学意义情况下,启动EN时机较晚,且出现喂养不耐受情况增加,提示延迟启动EN对肠功能恢复无明显帮助。同样,IAP、PA亦差异有统计学意义,提示肠吸收功能改善、腹腔内压下降。肠内营养治疗成功组内PA在EN st、EN 72 h、EN 120 h三个时间点进行两两比较差异有统计学意义,符合肠道吸收功能恢复的临床意义。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Cubillos J, Tse C, Chan VW, et al. Bedside ultrasound assessment of gastric content: an observational study[J]. J Can D'anesthesie, 2012, 59(4): 416-423. DOI:10.1007/s12630-011-9661-9 |
| [2] | Bouvet L, Chassard D. Ultrasound assessment of gastric volume: what is the best threshold?[J]. Anesth Analg, 2013, 117(6): 1508-1509. DOI:10.1213/ANE.0b013e3182a9666b |
| [3] | 尹万红, 王小亭, 刘大为, 等. 重症超声临床应用技术规范[J]. 中华内科杂志, 2018, 57(6): 397-417. DOI:10.3760/cma.j.issn.0578-1426.2018.06.004 |
| [4] | 王小亭, 刘大为, 于凯江, 等. 中国重症超声专家共识[J]. 中华内科杂志, 2016, 55(11): 900-912. DOI:10.3760/cma.j.issn.0578-1426.2016.11.020 |
| [5] | McClave SA, DiBaise JK, Mullin GE, et al. ACG clinical guideline: nutrition therapy in the adult hospitalized patient[J]. Am J Gastroenterol, 2016, 111(3): 315-334. DOI:10.1038/ajg.2016.28 |
| [6] | Kita R, Miyata H, Sugimura K, et al. Clinical effect of enteral nutrition support during neoadjuvant chemotherapy on the preservation of skeletal muscle mass in patients with esophageal cancer[J]. Clin Nutr, 2021, S0261-S5614(21): 00017-0. DOI:10.1016/j.clnu.2021.01.007 |
| [7] | Shukla A, Chapman M, Patel JJ. Enteral nutrition in circulatory shock: friend or foe?[J]. Curr Opin Clin Nutr Metab Care, 2020, 24(2): 159-164. DOI:10.1097/mco.0000000000000731 |
| [8] | 姚梅琪, 封秀琴, 郭芝廷, 等. 危重患者早期肠内营养支持剂量选择的Meta分析[J]. 中华急诊医学杂志, 2018, 27(8): 866-871. DOI:10.3760/cma.j.issn.1671-0282.2018.08.010 |
| [9] | Ritz MA, Fraser R, Edwards N, et al. Delayed gastric emptying in ventilated critically ill patients: measurement by 13 C-octanoic acid breath test[J]. Crit Care Med, 2001, 29(9): 1744-1749. DOI:10.1097/00003246-200109000-00015 |
| [10] | Li YL, Yang J, Sun SX, et al. Effects of intermittent feeding versus continuous feeding on enteral nutrition tolerance in critically ill patients: a protocol for systematic review and meta-analysis[J]. Medicine (Baltimore), 2020, 99(50): e23528. DOI:10.1097/MD.0000000000023528 |
| [11] | 孙宏, 李珂, 杨倩, 等. 不同肠内营养供给方式对老年重症肺炎的疗效研究[J]. 中华急诊医学杂志, 2020, 29(1): 92-98. DOI:10.3760/cma.j.issn.1671-0282.2020.01.015 |
| [12] | Jiang YP, Hu BC, Zhang S, et al. Effects of early enteral nutrition on the prognosis of patients with sepsis: secondary analysis of acute gastrointestinal injury study[J]. Ann Palliat Med, 2020, 9(6): 3793-3801. DOI:10.21037/apm-20-1650 |
| [13] | Hrdy O, Vrbica K, Strazevska E, et al. Comparison of continuous versus intermittent enteral nutrition in critically ill patients (COINN): study protocol for a randomized comparative effectiveness trial[J]. Trials, 2020, 21(1): 955. DOI:10.1186/s13063-020-04866-2 |
| [14] | Jones NE, Dhaliwal R, Day AG, et al. Factors predicting adherence to the Canadian Clinical Practice Guidelines for nutrition support in mechanically ventilated, critically ill adult patients[J]. J Crit Care, 2008, 23(3): 301-307. DOI:10.1016/j.jcrc.2007.08.004 |
| [15] | Reintam Blaser A, Malbrain ML, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394. DOI:10.1007/s00134-011-2459-y |
| [16] | Deane AM, Ali Abdelhamid Y, Plummer MP, et al. Are classic bedside exam findings required to initiate enteral nutrition in critically ill patients: emphasis on bowel sounds and abdominal distension[J]. Nutr Clin Pract, 2021, 36(1): 67-75. DOI:10.1002/ncp.10610 |
| [17] | Gungabissoon U, Hacquoil K, Bains C, et al. Prevalence, risk factors, clinical consequences, and treatment of enteral feed intolerance during critical illness[J]. JPEN J Parenter Enteral Nutr, 2015, 39(4): 441-448. DOI:10.1177/0148607114526450 |
| [18] | van de Putte P, Perlas A. Ultrasound assessment of gastric content and volume[J]. Br J Anaesth, 2014, 113(1): 12-22. DOI:10.1093/bja/aeu151 |
 2021, Vol. 30
2021, Vol. 30



