2. 宁波市第一医院急诊科 315010
硝苯地平为二氢吡啶类钙拮抗剂,临床主要用于抗高血压与治疗心绞痛,该药常见不良反应包括低血压、头痛、头晕等,因血管扩张引起的水肿也十分常见,但主要表现为脚踝水肿。2020年3月23日至4月2日期间,宁波市第一医院成功救治一例硝苯地平中毒致胸腔和腹腔积液患者,现将诊治经过报道如下。
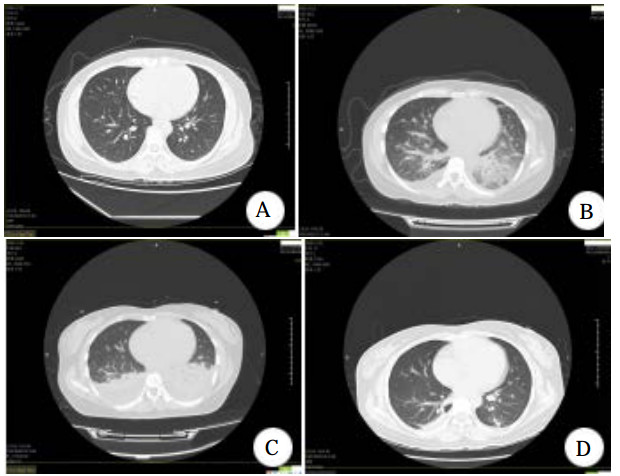
1 资料与方法患者女,33岁,因情绪低落自服硝苯地平片(规格10 mg)七八十片,约半小时后出现呕吐,呕吐物为内容物,15 h后出现胸闷,伴少许咳嗽,无胸痛,无呼吸困难,无咳痰,家属送至当地基层医院就诊,急诊测血压92/48 mmHg(1 mmHg=0.133 kPa),予补液升压等治疗后转入本院,查体一般情况良好,意识清楚,体温38℃,呼吸26次/min,血压87/61 mmHg,心率110次/min,心律齐,未闻及病理性杂音,两肺呼吸音清,未闻及啰音,口唇无发绀,颈静脉无怒张,腹平软,肝脾无肿大,双下肢无水肿。实验室检查:超敏C反应蛋白 < 0.50 mg/L,白细胞数10.49×109/L,中性粒细胞百分数88.7%,血红蛋白109.0 g/L;肌酐106 μmol/L,血气分析、凝血功能、D-二聚体、肌钙蛋白、肝功能等均无明显异常。胸部CT示两肺下叶少许慢性炎症性改变(图 1A)。
|
| 图 1 患者胸部CT(A:入院前;B:入院第1天;C:入院第4天;D:入院第7天) |
|
|
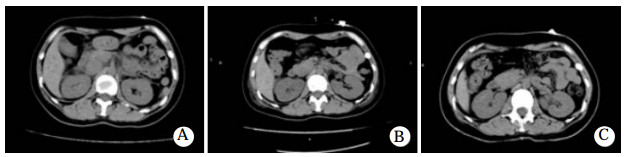
患者入院后,予心电监护,测血压并积极补液、导泻、利尿等对症治疗,但患者拒绝血液灌流治疗。入院10余个小时后,患者出现了胸闷咳嗽,氧饱和度下降至90%,予鼻导管吸氧后经皮氧分压维持在95%左右,入院1 d后氧饱和度降至88.4%,查肌钙蛋白0.136 ng/mL,B型脑钠肽为575.9 pg/mL,均为轻度升高。复查胸部CT出现两肺肺水肿和双侧少量积液(图 1B),查腹部CT亦发现胆囊窝区、胰周渗出改变,腹腔积液(图 2A)。血压进一步降至58/42 mmHg,予多巴胺10μg/(kg·min)收缩血管升压,持续输注葡萄糖酸钙(10 mL/12 h)对抗硝苯地平的钙拮抗剂作用,人血白蛋白(10 g/12 h)补充胶体渗透压,葡萄糖生理盐水(500 mL qd)补液,甲泼尼龙(40 mg/d)抗炎,还原型谷胱甘肽(2.4 g/d)护肝,托拉塞米(20 mg/d)利尿等治疗处理。多巴胺升压使用2 d后转用去甲肾上腺素(8 mg为泵注射)继续使用2 d,药物维持下血压可达(102~122)/(52~68)mmHg。入院4 d,撤去升血压药物后,收缩压能够维持在90 mmHg以上并动态监护未再出现低血压。入院第四天复查胸部CT提示两侧胸腔积液增多(图 1C),腹部CT提示胰周渗出减少(图 2B),继续当前治疗。入院第七天胸腔积液、肺水肿以及腹腔积液几乎完全吸收(图 1D、图 2C)。经过12 d的治疗后患者胸闷气促、咳嗽咳痰完全好转。出院一个月后随访患者未再服用硝苯地平,也未出现上述不良症状。
|
| 图 2 患者腹部CT(A:入院第1天;B:入院第4天;C:入院第7天) |
|
|
硝苯地平与血浆蛋白(白蛋白)的结合率大约是95%,普通的血液透析无法清除过量的硝苯地平,有效的排出方式为血液灌流。硝苯地平片口服后10 min即可测出其血药浓度,约30 min后达血药峰浓度,1~2 h作用达高峰,小剂量服用时其药代动力学的终末消除半衰期为1.7~3.4 h。有临床研究表明,当过量服用后10.5~72 h内浓度时间曲线呈线性,半衰期长至7.5 h[1]。
硝苯地平作为二氢吡啶类钙拮抗剂的抗高血压药物,过量服用必然造成低血压反应,其主要作用机制是可选择性抑制钙离子心肌或血管平滑肌细胞内的转运,减少钙离子经过慢钙通道进入细胞,从而起到松弛血管平滑肌,扩张冠状动脉和小动脉,降低外周血管阻力等作用。持续钙离子输注理论上能够反转硝苯地平过量的钙拮抗剂的毒性作用,但是临床效果表达不一[2-3],而且大剂量钙剂补充同样也会造成不良反应的发生,关于钙剂的使用剂量及疗程也没有确切的数据,所以在治疗过程中密切关注血钙变化是十分重要的。本案例中每间隔一日监测一次血钙,患者入院治疗后将血钙浓度维持在2.22~2.32 mmol/L。有文献指出,将钙离子浓度控制于略高于上限是十分理想的,既能有效起到治疗作用又可控制不良反应发生[4]。
事实上,硝苯地平因能扩张血管,降低肺动脉高压作用而被用于预防高原肺水肿[5]。过量服用硝苯地平中毒引起胸腔积液合并腹腔积液十分罕见。患者入院第2天曾行心脏超声,显示EF值为60%,室壁收缩活动未见明显异常,可以排除硝苯地平因负性肌力作用,心脏代偿失调引起心源性肺水肿。引起胸腔积液合并腹腔积液的原因可能是毛细血管渗漏症等非心源性因素。微循环结构中引流微静脉有完整的平滑肌细胞,硝苯地平通过减少钙离子进入细胞起到松弛平滑肌扩张血管作用,但是微静脉的弹性有限,所以首先出现细胞连接分离,间距增大甚至断裂,使本不能透过毛细血管的白蛋白等胶体物质漏出毛细血管。而伴随组织间的胶体升高,血管内的水分迅速进入组织间隙从而引起胸腔积液与腹腔积液。本例患者治疗过程中,首次尝试使用白蛋白治疗胸腔积液与腹腔积液,7 d内总计140 g,患者积液得到快速吸收,因为没有对照试验,所以无法明确白蛋白是否对减缓疾病程度或积液吸收有促进作用。
休克按病因分为:低血容量性休克、心源性休克、过敏性休克、脓毒性休克和神经源性休克。不同原因引起的休克在血管活性药物中的选择有所区别[6-8]。本例患者病程早期,由于大剂量服用硝苯地平,一方面抑制钙离子心肌转运导致心脏泵血功能障碍;另一方面也松弛血管平滑肌,扩张冠状动脉和小动脉,导致局部血容量下降组织缺血,所以该患者引起休克的病因可能兼并心源性与低血容量性。多巴胺是一种内源性中枢神经递质,是去甲肾上腺素的前体药物,不同受体发挥作用与剂量有关,小剂量主要作用与多巴胺受体,使肾及肠系膜血管扩张;中等剂量能激动β1受体,使心肌收缩力增强和心排血量增加,亦可作用与α1受体,轻微收缩周围血管;当大剂量则以α1受体的收缩血管为主。去甲肾上腺素主要作用于α受体而刺激心脏β1受体轻微,其收缩血管作用突出而正性肌力效应较弱。同时小剂量的多巴胺具有增加肾血流量及肾小球滤过率的作用,有助于药物的排泄,适用于血压尚可维持在80~90 mmHg的患者,而去甲肾上腺素收缩血管不利药物排泄,其仅对于出现低血压(收缩压 < 80 mmHg或平均动脉压 < 60 mmHg)的患者首选[9]。但是因为多巴胺的心脏毒性等不良反应较为显著,长期使用可增加病死率[10],如果需要长时间使用时,应考虑使用去甲肾上腺素代替,若收缩压恢复至90 mmHg,则可选用多巴酚丁胺,因为其能够增加心排出量而不易引起血压大幅波动。对于低血容量性休克,去甲肾上腺素也仅用于难治性休克,其收缩冠状动脉的效果可能进一步加重心肌缺血,不作首选[11]。因此,本例患者出现休克症状后首先选用了多巴胺治疗,使用2 d后继而转用去甲肾上腺素继续升压治疗2 d,收缩压恢复至90 mmHg以上停药并动态监护未再出现低血压。
综上所述,一旦发现患者过量服用硝苯地平,需要第一时间进行催吐、洗胃,甚至可以药用炭、蒙脱石等吸附性药物,减少硝苯地平吸收。治疗该药中毒,需根据临床表现,主要针对低血压、心力衰竭、肺水肿、腹腔积液等症状,进行升压、利尿、护肝、补液、抗炎、补充胶体渗透压等处理,必要时进行血液灌流。患者一般预后良好,且无后遗症。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Ferner RE, Monkman S Riley J. Pharmacokinetics and toxic effects of nifedipine in massive overdose[J]. Hum Exp Toxicol, 1990, 9(5): 309-311. DOI:10.1177/096032719000900507 |
| [2] | Crump BJ, Holt DW, Vale JA. Lack of response to intrave-nous calcium in severe verapamil poisoning[J]. Lancet, 1982, 2(8304): 939-940. DOI:10.1016/s0140-6736(82)90912-6 |
| [3] | Luscher TF, Noll G, Sturmer T, et al. Calcium gluconate insevere verapamil intoxication[J]. N Engl J Med, 1994, 330(10): 718-719. DOI:10.1056/NEJM199403103301019 |
| [4] | Zhou H, Liu Y, Li GQ. A novel dosing regimen for calcium infusion in a patient of massive overdose of sustained-release nifedipine[J]. Am J Med Sci, 2013, 345(3): 248-251. DOI:10.1097/MAJ.0b013e31826ce66f |
| [5] | Bartsh P, Maggiorini M, Ritter M, et al. Prevention of high altitude pulmonary edema by nifedipine[J]. N Engl J Med, 1991, 325(18): 1284. DOI:10.1056/NEJM199110313251805 |
| [6] | 周飞虎, 宋青. 去甲肾上腺素与多巴胺对脓毒性休克应用疗效的Meta分析[J]. 中华危重病急救医学, 2013, 25(8): 449-454. DOI:103.370/cma.j.issn.2095-4352.2013.08.001 |
| [7] | 熊日成, 俞宙, 孙杰, 等. 多巴胺与去甲肾上腺素在心源性休克患者中的疗效探讨[J]. 中华老年多器官疾病杂志, 2016, 15(12): 919-922. DOI:10.11915/j.issn.1671-5403.2016.12.219 |
| [8] | 李茂琴, 史载祥, 许继元, 等. 去甲肾上腺素联合多巴酚丁胺对感染性休克患者胃黏膜灌注的作用[J]. 中华急诊医学杂志, 2003, 12(4): 249-251. DOI:10.3760/j.issn:1671-0282.2003.04.011 |
| [9] | 中华医学会心血管病分会心血管急重症学组. 心原性休克诊断和治疗中国专家共识2018[J]. 中华心血管病杂志, 2019, 47(4): 265-277. DOI:10.3760/cma.j.jssn.0253-3758.2019.04.003 |
| [10] | De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and norepinephrine in the treatment of shock[J]. N Engl J Med, 2010, 362(24): 779. DOI:10.1056/NEJMc1003900 |
| [11] | 中华医学会重症医学分会. 低血容量休克复苏指南2007[J]. 中国危重病急救医学, 2008, 20(3): 129-134. DOI:10.3321/j.issn:1003-0603.2008.03.002 |
 2021, Vol. 30
2021, Vol. 30




