2. 浙江大学医学院附属第二医院心血管内科,杭州 310009
经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)正成为中高危主动脉瓣疾病患者的重要治疗手段。TAVR术后心功能不全时需要动静脉体外膜肺氧合(veno-arterial extracorporeal membrane oxygenation, V-A ECMO)等机械循环支持(mechanical circulatory support,MCS)。文献提示,目前V-A ECMO与心室辅助装置Impella先后或联合使用可见于国外个别单中心研究,国内尚未见相关报道。本文报道1例患者,TAVR术后ECMO辅助3 d,改Impella(型号Impella 2.5, 流量2.5 L/min)再辅助9 d,顺利出院。
1 资料与方法患者, 女,71岁,30 kg,因“反复心悸胸闷13年余,加重1个月余”于2019年8月20日入院。体格检查:颈静脉怒张, 两肺呼吸音粗,两下肺可闻及明显湿啰音,心界向左扩大,胸骨右缘第二肋间可闻及4/6级舒张期叹气样杂音。实验室及辅助检查:心脏彩超(图 1)示主动脉瓣关闭不全伴重度反流,二尖瓣少中量反流,中度肺动脉高压;左室射血分数(left ventricular ejection fraction,LVEF)25%,左室舒张末容积(left ventricular end-diastolic volume,LVEDV)216 mL,左心房(left atrium,LA)4.81 cm。脑钠肽 > 5 000 pg/mL,肌钙蛋白I 0.13 ng/mL。Euroscore Ⅱ29.2%。入院诊断:主动脉瓣关闭不全伴重度反流,NYHA Ⅳ级;冠心病;短阵性室性心动过速。患者有主动脉瓣置换指征,鉴于外科手术高危,心脏团队经讨论后拟行TAVR术。
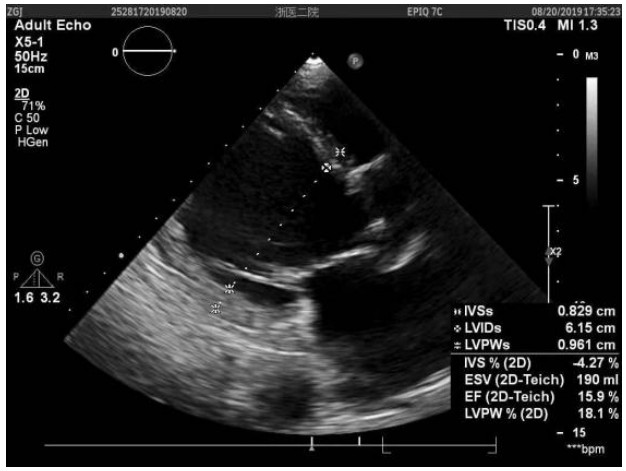
|
| 图 1 患者入院时心脏超声结果 |
|
|
患者入院后第7天行TAVR术。术中在人工瓣膜释放时,心脏骤停,立刻行心肺复苏及紧急股动静脉体外循环(cardiopulmonary bypass,CPB)。CPB辅助下完成TAVR术,术中食道超声示主瓣无反流,但左室收缩功能差,LVEF < 30%。患者经较大剂量血管活性药物治疗,仍无法脱离CPB,遂转为V-A ECMO(MAQUET BE-PLS 2050,Germany)支持。ECMO流量2.5~3 L/min [80~100 mL/(kg•min)],少量血管活性药维持。入监护室时血压108/68 mmHg(1 mmHg=0.133 kPa),心率98次/min,中心静脉压5 mmHg,呼气末正压3 cm/H2O(1 cmH2O=0.098 kPa),脉搏氧饱和度100%。
患者V-A ECMO辅助3 d。期间,维持血压60 mmHg以上,同时予抗感染,行连续肾脏替代治疗,输红细胞,输血浆等对症治疗,患者内环境好转,然而血管活性药量持续增加。第3天,多巴酚丁胺5 μg/(kg•min),肾上腺素0.16 μg/(kg•min),去甲肾上腺素0.1 μg/(kg•min),BP 65/60 mmHg, HR 149次/min,CVP 25 mmHg,PEEP 5 cmH2O, SpO2 93%,乳酸2.8 mmol/L。床边心超提示左心功能差,左室扩张,LVEF < 30%。胸片提示两肺散在炎性渗出,胸腔积液几乎无变化。考虑ECMO下左室后负荷过重,拟行左心减压。当日入导管室,置入Impella(Abiomed, Danvers, MA),型号Impella 2.5, 流量2.5 L/min,肝素抗凝,维持活化凝血时间160~180 s。
Impella植入后联合ECMO应用,血压上升至110/85 mmH,HR 98次/min,血管活性药减少,心超较前对比提示右室收缩可,左室减压明显。ECMO流量逐渐减低,30 min后,停止ECMO。去甲肾上腺素0.1 μg/(kg•min),BP 100~110/60~70 mmHg,生命体减停征稳定,HR 98次/min,CVP 14 mmHg。动脉氧分压200 mmHg, 乳酸2.2 mmol/L。心超示LVEF 20%。
患者行Impella支持期间每日心超提示:左心功能逐步恢复。至辅助第5天时,LVEF达到39%。第9天,血管活性药减停,患者生命指征平稳,心脏基础瓣膜疾病以及ICU机械通气时间较长导致的肺部感染已基本控制。心超示EF约为35%~40%。达到撤机指征,撤除Impella。41 d后,患者于2019年10月18日康复出院,心超(图 2)示LVEF 35.8%,LVEDV 110 mL,LA 3.37 cm。出院后2个月心超(图 3)随访,LVEF 41.1%,LVEDV 85.7 mL。
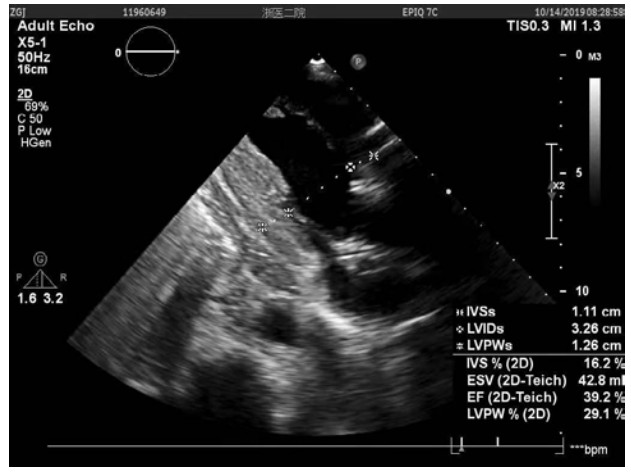
|
| 图 2 患者康复出院日心脏超声结果 |
|
|
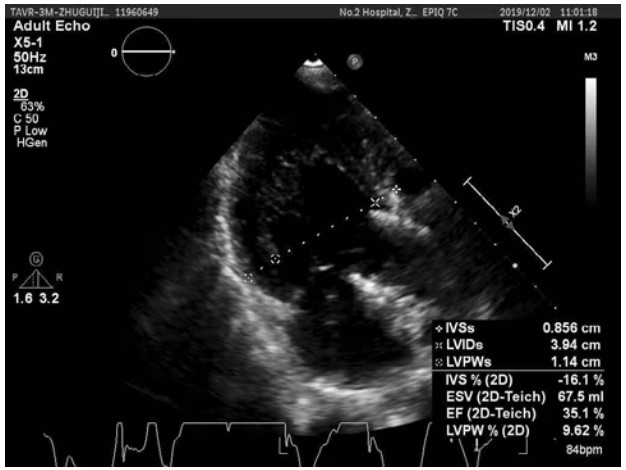
|
| 图 3 患者出院后2个月随访心脏超声结果 |
|
|
本研究经医院伦理委员会审批通过,审批编号(2020)伦审研第(311)号。
2 讨论通过文献复习,TAVR术前与术中因预防性或紧急应用Impella短期辅助,可见于个案报道且效果良好[1-7]。TAVR术后多见于ECMO辅助心功能,尚未见Impella辅助相关报道。虽然ECMO已被广泛用于支持心源性休克或心脏骤停患者,在V-A ECMO支持期间,左室过载的发生率估计高达70%,并可能对患者生存率产生显著影响[8],长期使用与不良结局和高并发症发生率相关[9]。
目前的指南将Impella植入用于高危的经皮冠状动脉介入治疗或作为心源性休克的短期机械循环支持[10]。基于将血液从心室泵出,经过主动脉瓣进入升主动脉并流向全身,同时通过冠状动脉入口供应心肌循环的原理,为血流动力学提供支持和心肌保护。Impella以其提供的流量大小和心室支持方式分为2.5,Cardiac Power,Right Percutaneous,5四种型号。Donker等[11]通过仿真实验表明Impella可最大减少肺动脉楔压(pulmonary artery wedge pressure,PAWP)10 mmHg和20%左室容积。一些学者认为Impella能通过卸载左室压力,减少左室做功和心肌耗氧,向主动脉输送大量血液增加平均动脉压和心输出量,进而改善全身灌注和增加冠状动脉流量,降低PAWP和右室后负荷[12-14]。Tschöpe等[15]通过一例暴发性心肌炎运用Impella Cardiac Power支持39 d顺利脱机的成功实践提出PROPELLA概念,即长时间Impella左室辅助支持,认为当右室功能足够时,单独使用Impella是可行的,随着时间推移,通过心肌炎症的减轻、心脏重建的调节和代谢机制的恢复使心脏结构与功能得到恢复,治疗效果超出了其作为血流动力学正常化的机械支持的主要用途。另一方面,由于Impella的抗凝特点,其5%~10%溶血发生率以及其他血液系统并发症仍需临床工作者进一步探索[16]。
综上所述,本例冠心病患者TAVR术后,ECMO辅助3 d,未见心功能改善,考虑左心过载,转为Impella支持,行左室减压同时提高心输出量,辅助9 d,心功能明显恢复,顺利脱机。Impella在本例中长时间辅助的运用,为心源性休克患者的机械循环支持装置的选择和应用提供新思路,同时有待于进一步多中心、大样本的临床研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] | Dallan LAP, Young A, Bansal E, et al. Predicted coronary occlusion and impella salvage during valve-in-valve transcatheter aortic valve replacement[J]. Cardiovasc Revasc Med, 2020, 21(11s): 28-32. DOI:10.1016/j.carrev.2019.03.019 |
| [2] | Panoulas VF, Montorfano M, Contri R, et al. Acute heart failure management in a young patient requiring complex left main percutaneous coronary intervention, Impella 2.5 and transcatheter aortic valve implantation[J]. Int J Cardiol, 2015, 180: 199-202. DOI:10.1016/j.ijcard.2014.11.155 |
| [3] | Khan A, Patel B, Shehadeh A, et al. Impella as a bridge to emergent valve-in-valve transcatheter aortic valve replacement in severe prosthetic aortic valve Stenosis[J]. J Am Coll Cardiol, 2019, 73(9): 2985. DOI:10.1016/s0735-1097(19)33591-0 |
| [4] | Johnson DW, ErwinⅢ JP. Use of impella 5.0 prior to transcatheter aortic valve replacement in a patient with severe aortic Stenosis and cardiogenic shock[J]. J Heart Valve Dis, 2017, 26(4): 485-487. |
| [5] | Arora S, Bahekar AA. Staged high-risk percutaneous coronary intervention with impella support after on-pump transcatheter aortic valve replacement[J]. Tex Heart Inst J, 2016, 43(5): 423-427. DOI:10.14503/thij-16-5770 |
| [6] | Singh V, Mendirichaga R, Inglessis-Azuaje I, et al. The role of impella for hemodynamic support in patients with aortic Stenosis[J]. Curr Treat Options Cardiovasc Med, 2018, 20(6): 395-403. DOI:10.1007/s11936-018-0644-9 |
| [7] | Martinez CA, Singh V, Heldman AW, et al. Emergent use of retrograde left ventricular support in patients after transcatheter aortic valve replacement[J]. Catheter Cardiovasc Interv, 2013, 82(2): E128-E132. DOI:10.1002/ccd.24583 |
| [8] | Donker DW, Brodie D, Henriques JPS, et al. Left ventricular unloading during veno-arterial ECMO: a review of percutaneous and surgical unloading interventions[J]. Perfusion, 2019, 34(2): 98-105. DOI:10.1177/0267659118794112 |
| [9] | Cheng R, Hachamovitch R, Kittleson M, et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1, 866 adult patients[J]. Ann Thorac Surg, 2014, 97(2): 610-616. DOI:10.1016/j.athoracsur.2013.09.008 |
| [10] | Chieffo A, Ancona MB, Burzotta F, et al. Observational multicentre registry of patients treated with IMPella mechanical circulatory support device in ITaly: the IMP-IT registry[J]. EuroIntervention, 2020, 15(15): e1343-e1350. DOI:10.4244/eij-d-19-00428 |
| [11] | Donker DW, Brodie D, Henriques JPS, et al. Left ventricular unloading during veno-arterial ECMO: a simulation study[J]. ASAIO J Am Soc Artif Intern Organs, 2019, 65(1): 11-20. DOI:10.1097/MAT.0000000000000755 |
| [12] | Koeckert MS, Jorde UP, Naka Y, et al. Impella LP 2.5 for left ventricular unloading during venoarterial extracorporeal membrane oxygenation support[J]. J Card Surg, 2011, 26(6): 666-668. DOI:10.1111/j.1540-8191.2011.01338.x |
| [13] | Pappalardo F, Schulte C, Pieri M, et al. Concomitant implantation of Impella® on top of veno-arterial extracorporeal membrane oxygenation may improve survival of patients with cardiogenic shock[J]. Eur J Heart Fail, 2017, 19(3): 404-412. DOI:10.1002/ejhf.668 |
| [14] | Lim HS. The effect of impella CP on cardiopulmonary physiology during venoarterial extracorporeal membrane oxygenation support[J]. Artif Organs, 2017, 41(12): 1109-1112. DOI:10.1111/aor.12923 |
| [15] | Tschöpe C, Van Linthout S, Klein O, et al. Mechanical unloading by fulminant myocarditis: LV-IMPELLA, ECMELLA, BI-PELLA, and PROPELLA concepts[J]. J Cardiovasc Transl Res, 2019, 12(2): 116-123. DOI:10.1007/s12265-018-9820-2 |
| [16] | Miller PE, Solomon MA, McAreavey D. Advanced percutaneous mechanical circulatory support devices for cardiogenic shock[J]. Crit Care Med, 2017, 45(11): 1922-1929. DOI:10.1097/ccm.0000000000002676 |
 2021, Vol. 30
2021, Vol. 30




